Первый опыт транскатетерной имплантации аортального клапана в многопрофильном лечебном учреждении
Автор: Крюков Е.В., Чернецов В.А., Кранин Д.Л., Гайдуков А.В., Назаров Д.А., Федоров А.Ю., Варочкин К.А., Дунаев Э.П., Замский К.С.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.12, 2017 года.
Бесплатный доступ
Пациенты пожилого и старческого возраста с выраженным аортальным стенозом относятся к крайне тяжелой категории кардиохирургических больных. Ежегодно около 30% пациентам отказывают в хирургическом лечении. Транскатетерная имплантация аортального клапана (ТИАК) является методом выбора для таких больных. С 2014г. по 2016г. в Центре сердечно-сосудистой хирургии Главного военного клинического госпиталя им. Н.Н. Бурденко выполнено 19 операций транскатетерной имплантации аортального клапана. ТИАК является эффективным и безопасным методом выбора при лечении пожилых пациентов с тяжелым аортальным стенозом, имеющих противопоказания или высокий хирургический риск к выполнению операции в условиях искусственного кровоснабжения.
Аортальный стеноз, транскатетерная имплантация аортального клапана, протезирование клапана
Короткий адрес: https://sciup.org/140188630
IDR: 140188630 | УДК: 616.126.52-089.819.843
Текст научной статьи Первый опыт транскатетерной имплантации аортального клапана в многопрофильном лечебном учреждении
Пороки клапанов сердца в структуре сердечно-сосудистых заболеваний занимают третье место после артериальной гипертензии (АГ) и ишемической болезни сердца (ИБС). Из них аортальный стеноз (АС) является наиболее частой патологией клапанного аппарата сердца. Распространенность АС в популяции существенно увеличивается с возрастом. Это болезнь пожилого и старческого возраста. В европейских странах умеренный АС встречается у 5% населения, критический – в 3%, при этом более чем у 50% отсутствует выраженная клиническая картина. АС – это наиболее частая клапанная патология у кардиохирургических больных, так операции по коррекции стеноза аортального клапана (АК) составляют от 10 до 22% от всех операций на сердце. В США ежегодно проводится более 50 тысяч операций по поводу АС [1, 2, 3].
По современным данным наиболее частой причиной возникновения АС является дегенеративный кальциноз створок и кольца АК. Значительно меньшую роль в развитии АС играет врожденная патология АК, такая как наличие двустворчатого АК. Ревматическое поражение АК в настоящее время встречается крайне редко. Этиология сенильного АС неизвестна. Фактором риска является гиперхолистеринэмия, так при уровне липопротеинов выше 50 мг\дцл прогрессирование АС происходит вдвое быстрее [4, 5]. Ряд исследований доказали взаимосвязь АГ и скорости развития АС, связывая это как с механической нагрузкой на створки, так и с активацией ренин-ан-гиотензиновой системы [6, 7]. Глубокое секвестрирование генетического кода и современные иммуногистохимические реакции установили взаимосвязь между более быстрым развитием кальциноза у больных в частности с двустворчатым АК. Так, у больных с двустворчатым АК выявлены белки NOTCH1 и GATA-5, присутствие которых в настоящее время ассоциируют с активацией неоостеогенеза в АК [8, 9, 10, 11]. Наличие аллели rs10455872 увеличивает риск развития АС в 1,5–2,0 раза [12, 13, 14]. Так же, у больных с АС выявлены различные специфические варианты строения рецепторов к витамину D (VDR), APOE, APOB и др. [15].
Пациенты с выраженным АС относятся к крайне тяжелой категории кардиохирургических больных. Операции среди пациентов старших возрастных групп с выраженной сопутствующей патологией сопряжена с достаточно высоким уровнем госпитальной летальности, которая, по данным разных авторов, достигает 11–15%. Протезирование АК различными типами механических или биологических протезов до сих пор остается «золотым стандартом» в лечение этой категории больных [16, 17]. Однако, в ряде случаев, тяжесть состояния больного и наличие сопутствующей патологии не позволяют выполнить операцию в условиях искусственного кровообращения. Ежегодно около 30% пациентам отказывают в хирургическом лечении [18, 19]. Это обстоятельство было решающим для разработки и применения альтернативных методов хирургической коррекции патологии АК.
Впервые в клинике транскатетерная имплантация баллон-расширяемого АК после серии экспериментальных операций на моделях животных была выполнена 16 апреля 2012 г. французскими хирургами во главе с A. Cribier 57-летнему пациенту, находящемуся в состоянии кардиогенного шока. Ввиду большого хирургического риска больному не представлялось возможным выполнить

открытое протезирование АК. ТИАК была проведена антеградным транссептальным доступом и завершилась успешно. В раннем послеоперационном периоде была отмечена стабилизация гемодинамических показателей. Впоследствии при патологоанатомическом исследовании была констатирована безопасность установки клапана у данного пациента: устья коронарных отверстий не были перекрыты протезом, не было повреждения митрального клапана и восходящей аорты [20, 21]. Это явилось толчком к разработке новых устройств и методик транскатетерной имплантации АК и широкому внедрению данной техники в практику. Так уже к 2011 г. было выполнено более 15 000 операций ТИАК в 43 странах мира [22]. В РФ первая транскатетерная имплантация АК была выполнена в НЦССХ им. А.Н. Бакулева в 2009 г. [23]. ТИАК является методом выбора для больных, которым было отказано в традиционном хирургическом лечении, а в последнее время, в связи с расширением показаний, рекомендована в качестве альтернативы для пациентов высокого риска хирургического вмешательства [24].
Материалы и методы
За период с ноября 2014 г. по июль 2016г. в Центре сердечно-сосудистой хирургии ГВКГ им. Н.Н. Бурденко выполнено 19 операций ТИАК. Средний возраст пациентов составил 81,7 ± 1,75 лет; из них 15 мужчин и 4 женщины. Большинство больных находилось в III–IV функциональном классе по NYHA. Оценка риска хирургического вмешательства проводилась с помощью шкал EuroSCORE и STS, в среднем составила 22,4 ± 8,6 и 10,2 ± 3,1. У всех больных диагностировался АС тяжелой степени. По данным ЭхоКГ: максимальная скорость стенотической струи через АК в систолу составила 5,15 ± 0,2 м/с, средний градиент систолического давления на АК составил 53,4 ± 13,03 мм рт.ст., максимальный – 113 ± 6,8 мм рт.ст., площадь поперечного сечения отверстия АК – 0,81 ± 0,25 кв.см; коэффициенты DVI – 0,18 ± 0,03, VTI – 0,19 ± 0,02. Клиническая характеристика больных представлена в таблице 1.
Пациенты прошли обследование по программе подготовки к катетерной имплантации АК (рис. 1), включающую в себя: трансторакальную и чреспищеводную ЭхоКГ, мультиспиральную компьютерную томографию с контрастированием аорты и ее ветвей, коронарографию, аортографию с ангиографией подвздошно-бедренного сегмента.
Результаты и обсуждение
ТИАК была выполнена у всех больных пункционно, применялся правосторонний чрезбедренный доступ. Левосторонний доступ использовался для контроля места пункции и для установки катетера в некоронарный синус. Всем больным имплантирован клапан CoreValve Transcatheter Aortic Valve (Medtronic, США) – это само-раскрывающийся нитиноловый протез со встроенным трехстворчатым клапанном из свиного перикарда
Табл. 1. Клиническая характеристика оперированных пациентов
|
Характеристика |
(n = 19) |
|
Мужчины/женщины |
15/4 |
|
Средний возраст (годы) |
81,7 ± 3 ,6 |
|
Индекс массы тела |
24,9 ± 2,45 |
|
EuroSCORE |
22,4 ± 8,6 |
|
STS |
10,2 ± 3,1 |
|
Проявления ХСН на момент проведения операции |
|
|
(ФК по NYHA): |
|
|
– II |
26,3% |
|
– III |
57,9% |
|
– IV |
15,8% |
|
Показатели ЭхоКГ: |
|
|
• КДР ЛЖ (см) |
5,53 ± 0,54 |
|
• КСР ЛЖ (см) |
3,67±0,71 |
|
• ФВ (%) |
60,3 ± 10,03 |
|
• Площадь отверстия АК (см2) |
0,81 ± 0,25 |
|
• Средний систолический градиент на АК (мм рт.ст.) |
53,4 ± 13,03 |
|
• Максимальная скорость стенотической струи |
|
|
через АК (м\с) |
5,15 ± 0,2 |
|
• DVI |
0,18 ± 0,03 |
|
• VTI |
0,19 ± 0,02 |
|
• Систолическое давление в ЛА (мм рт.ст.) |
36,7 ± 11,6 |
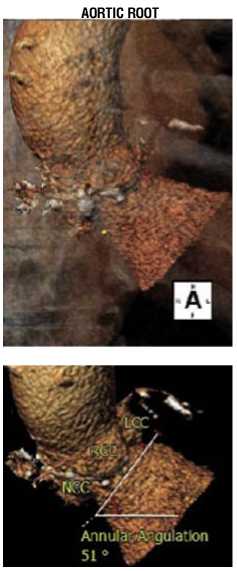
AORTIC ROOT
IMPLANTER/S VIEW
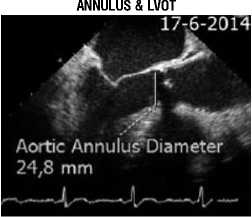
Рис. 1. Протокол подготовки к ТИАК
(рис. 2). Использовали следующие размеры: 23 (двум больным), 26 (пять больных), 29 (десяти больным) и 31 (двум больным). Имплантация выполнена с выведением клапана в полость левого желудочка на 4–12 мм. В одном случае выведение на 12 мм было связано с выраженной ангуляцией аорты. Контроль за позиционированием протеза, значимостью регургитационных потоков
Крюков Е.В., Чернецов В.А., Кранин Д.Л., Гайдуков А.В., Назаров Д.А., и др.
ПЕРВЫЙ ОПЫТ ТРАНСКАТЕТЕРНОЙ ИМПЛАНТАЦИИ АОРТАЛЬНОГО КЛАПАНА В МНОГОПРОФИЛЬНОМ ЛЕЧЕБНОМ УЧРЕЖДЕНИИ

Рис. 2. Клапан CoreValve
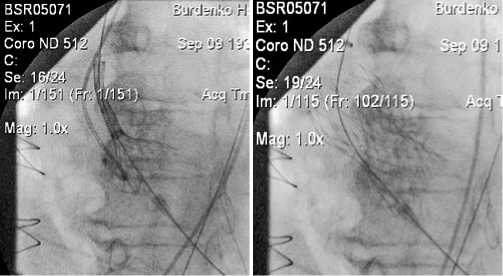
Рис. 3. Процесс имплантации АК. Пациент Д., 78 лет. Диагноз: Врожденный порок сердца, двустворчатый АК. АС тяжелой степени. ХСН IV ФК. Аортокоронарное шунтирование в анамнезе
и развитием осложнений осуществлялось с помощью чреспищеводной ЭхоКГ в режиме on-line. У всех больных место пункции было ушито аппаратно: Pro Glide – левая нога, Pro Star – правая нога. Средняя продолжительность операции составила 150,1 ± 20,6 мин., время скопии 21,4 ± 4,8 мин. Двум больным, в связи с наличием сопутствующего стенозирующего атеросклероза коронарных артерий, оперативное пособие было разделено на два этапа: первым этапом – ангиопластика и стентирование пораженных коронарных артерий, вторым этапом – коррекция клапанного порока. Одному больному одновременно было выполнено ЧТКА со стентированием ПКА и ТИАК.
Средняя длительность наблюдения больных, подвергнутых ТИАК, составила 13,4 ± 5,6 месяца. Интра-опреационной, 30-дневной и отдаленной летальности не отмечено. В двух случаях (11,7%) потребовалась имплантация постоянной системы ЭКС из-за развития полной АВ-блокады. Большинство пациентов (58,7%) после операции перешли во II функциональный класс по NYHA (рис. 4). По данным контрольной ЭхоКГ отмечена выраженная положительная динамика: максимальная скорость стенотической струи через АК в систолу составила 2,3 ± 0,2 м/с, пиковый градиент систолического давления на АК снизился до 13 ± 2 мм рт.ст., средний до 10,3 ± 1,5 мм рт.ст., коэффициент DVI увеличился до 0,62 ± 0,09, VTI до 0,66 ± 0,11 (рис. 5). У всех больных отмечалась трансклапанная и парапротезная регургитация, у большинства (88,2%) она имела легкую степень. Продолжительность госпитализации в среднем составила 7 дней.
Выводы
ТИАК аорты является эффективным и безопасным методом выбора при лечении пожилых пациентов с тяжелым АС, имеющих противопоказания или высокий хирургический риск к выполнению операции в условиях искусственного кровоснабжения. Полученный нами ближайший результат позволяет расширить показания к ТИАК.
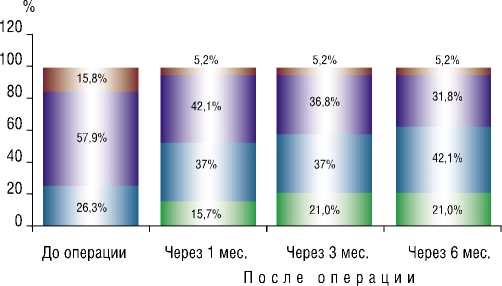
I I I ФК XCH no NYHA ■ I III ФК XCH no NYHA
■ I II ФКХСН no NYHA I I IV ФК XCH no NYHA
Рис. 4. Динамика течения ХСН
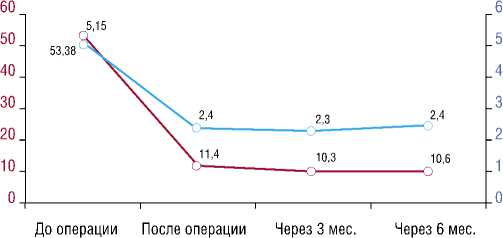
Средний градиент систолического давления на АК (мм рт.ст.)
Скорость струи через АК (м\с)
Рис. 5. Показатели среднего градиента систолического давления на АК и скорость струи через АК при динамическом наблюдении
2006; 368(9540): 1005–11.
-
2. Faggiano P., Antonini-Canterin F., Erlicher A., Romeo C., Cervesato E., Pavan D., Piazza R., Huang G., Nicolosi G. Progression of aortic valve sclerosis to aortic stenosis. Am J Cardiol. 2003; 91(1): 99–101.
-
3. Iung B., Baron G., Butchart E.G. et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on Valvular Heart Disease. Eur Heart J 2003; 24: 1231-43.
-
4. Freeman R.V., Otto C.M. Spectrum of calcific aortic valve disease: pathogenesis, disease progression, and treatment strategies. Circulation 111, 3316–3326 (2005).
-
5. Rajamannan N.M., Bonow R.O., Rahimtoola S.H. Calcific aortic stenosis: an update. Nat. Clin. Pract. Cardiovasc. Med. 4, 254–262 (2007).
-
6. Helske S. et al. Induction of local angiotensin II-producing systems in stenotic aortic valves. J. Am. Coll. Cardiol. 44, 1859–1866 (2004).
-
7. O’Brien K.D. et al. Association of angiotensinconverting enzyme with low-density lipoprotein in aortic valvular lesions and in human plasma. Circulation 106, 2224– 2230 (2002).
-
8. Garg V. et al. Mutations in NOTCH1 cause aortic valve disease. Nature 437, 270–274 (2005). This is the first study to report that mutations in NOTCH1 cause both development of bicuspid aorticvalve and calcification of aortic valve.
-
9. Theodoris C.V. et al. Human disease modeling reveals integrated transcriptional and epigenetic mechanisms of NOTCH1 haploinsufficiency. Cell 160, 1072–1086 (2015).
-
10. Laforest B., Andelfinger G., Nemer M. Loss of Gata5 in mice leads to bicuspid aortic valve. J. Clin. Invest. 121, 2876–2887 (2011).
-
11. Shi L.M. et al. GATA5 loss-of-function mutations associated with congenital bicuspid aortic valve. Int. J. Mol. Med. 33, 1219–1226 (2014).
-
12. Thanassoulis G. et al. Genetic associations with valvular calcification and aortic stenosis. N. Engl. J. Med. 368, 503–512 (2013).
-
13. Kamstrup P.R., Tybjaerg-Hansen A., Nordestgaard B.G. Elevated lipoprotei-n(a) and risk of aortic valve stenosis in the general population. J. Am. Coll. Cardiol. 63, 470–477 (2014).
-
14. Arsenault B.J. et al. Lipoprotein(a) levels, genotype and incident aortic valve stenosis: a prospective Mendelian randomization study and replication in a case–control cohort. Circ. Cardiovasc. Genet. 7, 304–310 (2014).
-
15. Bosse Y., Mathieu P., Pibarot P. Genomics: the next step to elucidate the etiology of calcific aortic valve stenosis. J. Am. Coll. Cardiol. 51, 1327–1336 (2008).
-
16. O’Brien S.M., Shahian D.M., Filardo G. The society of thoracic surgeons 2008 cardiac risk models: part 2 – isolated valve surgery. Ann Thorac. Surg. 2009; 88: S23–42.
-
17. Никитина Т.Г., Акишбая М.О., Скопин И.И., Бокерия Л.А. Непосредственные и отдаленные результаты хирургической коррекции аортального стеноза. Грудная и сердечно-сосудистая хирургия. 2007; 3: 12–8.
-
18. Van Geldorp M.W.A., van Gameren M., Kappetein A.P., Arabkhani B., de Groot-de Laat L.E., Takkenberg J.J. et al. Therapeutic decisions for patients with symptomatic severe aortic stenosis: room for improvement? Eur. J. Cardiothorac. Surg. 2009; 35: 953–7.
-
19. Bouma B.J., van den Brink R.B.A., van der Meulen J.H.P. et al. To operate or not on elderly patients with aortic stenosis: the decision and its consequences. Heart. 1999; 82: 143–8.
-
20. Cribier A., Eltchaninoff H., Bash A. et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002; 106: 3006–8.
-
21. Cribier A. Historical perspective: 10th year anniversary of TAVI. EuroIntervention. 2012; 8: Q15-Q17.
-
22. Taylor J. Clinical trials on transcatheter aortic valve implantation cannot be compared because of inconsistent endpoints. Eur Heart J. 2011; 32: 125–6.
-
23. Бокерия Л.А., Алекян Б.Г., Пурсанов М.Г. Эндоваскулярная хирургия пороков сердца. Грудная и сердечно-сосудистая хирургия. 2010; 4: 42–4.
-
24. Алекян Б.Г., Пурсанов М.Г., Шахбазян К.Р. Современные медицинские технологии в лечении критического кальцинированного аортального стеноза у пожилых пациентов с высоким хирургическим риском. Грудная и сердечно-сосудистая хирургия. 2015; 4: 4–7.
Список литературы Первый опыт транскатетерной имплантации аортального клапана в многопрофильном лечебном учреждении
- Nkomo V.T., Gardin J.M., Skelton T.N., Gottdiener J.S., Scott C.G., Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. Lancet. 2006; 368(9540): 1005-11.
- Faggiano P., Antonini-Canterin F., Erlicher A., Romeo C., Cervesato E., Pavan D., Piazza R., Huang G., Nicolosi G. Progression of aortic valve sclerosis to aortic stenosis. Am J Cardiol. 2003; 91(1): 99-101.
- lung B., Baron G., Butchart E.G. et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on Valvular Heart Disease. Eur Heart J 2003; 24: 1231-43.
- Freeman R.V., Otto C.M. Spectrum of calcific aortic valve disease: pathogenesis, disease progression, and treatment strategies. Circulation 111, 3316-3326 (2005).
- Rajamannan N.M., Bonow R.O., Rahimtoola S.H. Calcific aortic stenosis: an update. Nat. Clin. Pract. Cardiovasc. Med. 4, 254-262 (2007).
- Helske S. et al. Induction of local angiotensin II-producing systems in stenotic aortic valves. J. Am. Coll. Cardiol. 44, 1859-1866 (2004).
- O’Brien K.D. et al. Association of angiotensinconverting enzyme with low-density lipoprotein in aortic valvular lesions and in human plasma. Circulation 106, 22242230 (2002).
- Garg V. et al. Mutations in NOTCH1 cause aortic valve disease. Nature 437, 270-274 (2005). This is the first study to report that mutations in NOTCH1 cause both development of bicuspid aorticvalve and calcification of aortic valve.
- Theodoris C.V. et al. Human disease modeling reveals integrated transcriptional and epigenetic mechanisms of NOTCH1 haploinsufficiency. Cell 160, 1072-1086 (2015).
- Laforest B., Andelfinger G., Nemer M. Loss of Gata5 in mice leads to bicuspid aortic valve. J. Clin. Invest. 121, 2876-2887 (2011).
- Shi L.M. et al. GATA5 loss-of-function mutations associated with congenital bicuspid aortic valve. Int. J. Mol. Med. 33, 1219-1226 (2014).
- Thanassoulis G. et al. Genetic associations with valvular calcification and aortic stenosis. N. Engl. J. Med. 368, 503-512 (2013).
- Kamstrup P.R., Tybjaerg-Hansen A., Nordestgaard B.G. Elevated lipoprotei-n(a) and risk of aortic valve stenosis in the general population. J. Am. Coll. Cardiol. 63, 470-477 (2014).
- Arsenault B.J. et al. Lipoprotein(a) levels, genotype and incident aortic valve stenosis: a prospective Mendelian randomization study and replication in a case-control cohort. Circ. Cardiovasc. Genet. 7, 304-310 (2014).
- Bosse Y., Mathieu P., Pibarot P. Genomics: the next step to elucidate the etiology of calcific aortic valve stenosis. J. Am. Coll. Cardiol. 51, 1327-1336 (2008).
- O’Brien S.M., Shahian D.M., Filardo G. The society of thoracic surgeons 2008 cardiac risk models: part 2 -isolated valve surgery. Ann Thorac. Surg. 2009; 88: S23-42.
- Никитина Т.Г., Акишбая М.О., Скопин И.И., Бокерия Л.А. Непосредственные и отдаленные результаты хирургической коррекции аортального стеноза. Грудная и сердечно-сосудистая хирургия. 2007; 3: 12-8.
- Van Geldorp M.W.A., van Gameren M., Kappetein A.P., Arabkhani B., de Groot-de Laat L.E., Takkenberg J.J. et al. Therapeutic decisions for patients with symptomatic severe aortic stenosis: room for improvement? Eur. J. Cardiothorac. Surg. 2009; 35: 953-7.
- Bouma B.J., van den Brink R.B.A., van der Meulen J.H.P. et al. To operate or not on elderly patients with aortic stenosis: the decision and its consequences. Heart. 1999; 82: 143-8.
- Cribier A., Eltchaninoff H., Bash A. et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002; 106: 3006-8.
- Cribier A. Historical perspective: 10th year anniversary of TAVI. EuroIntervention. 2012; 8: Q15-Q17.
- Taylor J. Clinical trials on transcatheter aortic valve implantation cannot be compared because of inconsistent endpoints. Eur Heart J. 2011; 32: 125-6.
- Бокерия Л.А., Алекян Б.Г., Пурсанов М.Г. Эндоваскулярная хирургия пороков сердца. Грудная и сердечно-сосудистая хирургия. 2010; 4: 42-4.
- Алекян Б.Г., Пурсанов М.Г., Шахбазян К.Р. Современные медицинские технологии в лечении критического кальцинированного аортального стеноза у пожилых пациентов с высоким хирургическим риском. Грудная и сердечно-сосудистая хирургия. 2015; 4: 4-7.


