Питательная основа для культивирования штамма Bifidobacterium infantis 2008
Автор: Бояринева И.В., Хамагаева И.С., Замбалова Н.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (96) т.85, 2023 года.
Бесплатный доступ
Бифидобактерии, как представители микробиоценоза кишечника, играют важную роль в механизме резистентности макроорганизма к различным заболеваниям, являются продуцентами биологически активных веществ, обладающих иммунокоррегирующим действием. Разработка технологий поликомпонентных бифидумпрепаратов, содержащих физиологически активные клетки бифидобактерий с высоким коэффициентом адгезии к слизистой кишечника и продуцируемые ими биологически активные вещества - ферменты, полисахариды, гликопротеины, органические кислоты и др., направлена на расширение ассортимента лечебно-профилактических средств. Многочисленные исследовательские работы подтверждают положительный эффект от комбинирования животных и растительных компонентов в продуктах питания и их обогащение пробиотическими культурами. Соевое молоко характеризуется полным отсутствием лактозы и является незаменимым продуктом детского питания в случае возникновения аллергических реакций, связанных с непереносимостью молочного сахара, вызванные отсутствием или снижением активности лактазы в слизистой кишечника. Лактазная недостаточность сопровождается возникновением аллергических реакций, связанных с непереносимостью молочного сахара, также дисбактериозом, препятствующим формированию нормального биоценоза в кишечнике, и тем самым требуют адекватной профилактики и коррекции препаратами пробиотической направленности. В настоящей работе изучено влияние соевой сыворотки на рост штамма Bifidobacterium infantis 20088. Подобрана доза глюкозы, обеспечивающая максимальную скорость роста клеток бифидобактерий. Наибольшее количество жизнеспособных клеток бифидобактерий наблюдается при внесении 1% глюкозы. В ходе проведенных исследований определен состав питательной среды для производства бактериального концентрата на основе соевой сыворотки. Данный набор жизненно необходимых микроэлементов и витаминов в среде активизирует рост штаммов Bifidobacterium infantis 20088, количество жизнеспособных клеток составляет 1012 к.о.е./см3.
Питательная основа, соевая сыворотка, бифидобактерии, биомасса, бактериальный концентрат
Короткий адрес: https://sciup.org/140303198
IDR: 140303198 | УДК: 637.1 | DOI: 10.20914/2310-1202-2023-2-130-135
Текст научной статьи Питательная основа для культивирования штамма Bifidobacterium infantis 2008
Нормальная микробиота человека оказывает влияние практически на все жизненно важные процессы и функции организма Поддержание функциональной активности микрофлоры, постоянства кишечного гомеостаза является прерогативой нормального физиологического состояния организма [1]. Большое количество исследований, опубликованных в последние годы, демонстрирует положительную роль пробиотиков в комплексной терапии многих заболеваний ЖКТ, а также заболеваний, не связанных напрямую с органами пищеварения [2].
Пробиотическим штаммам лактобацилл и бифидобактерий отводится существенная роль в нормализации функционирования всей иммунной системы [3]. Нормализация микробиоты с использованием бифидобактерий снижает риск возникновения разнообразных нарушений нервнопсихической деятельности и стресса. Так, назначение B. infantis безмикробным мышам в раннем возрасте ослабляло до нормального уровня их реакцию на стресс [4]. Вид B. infantis является психобиотиком, который облегчает болевые ощущения у больных синдромом раздраженного кишечника, у которых нормализовались сывороточные концентрации провоспалитель-ных цитокинов [5]. Психобиотическая комбинация штаммов L. helveticus и B. longum смягчала симптомы депрессии в периоде после инфаркта миокарда [6].
У каждого человека в кишечнике находятся свои индивидуальные штаммы (аутоштаммы) лакто-, бифидобактерий, кишечной палочки и т. д. Пробиотики изготавливают на основе «универсальных» производственных штаммов микробов. Дошедшие живыми до толстой кишки пробиотические клетки, более чем в 70% случаев вступают в антагонистические взаимоотношения с аутоштаммами микроорганизмов пациента, проще говоря, обладают бионесовместимостью [7, 8]. Пробиотические клетки к тому же чувствительны к большинству антибиотиков даже в тех небольших концентрациях, которые создаются антибиотиками в крови, а в кишечнике концентрации антибиотиков создаются в десятки-сотни раз выше. В последние десять лет появились доказательства, что пробиотические бактерии участвуют в горизонтальном переносе генов антибиотико-резистентности [9]. Имеются данные, подтверждающие аэротолерантность многих штаммов Bifidobacterium , обладающих способностью образовывать колонии на поверхности желудочнокишечного тракта в аэробных условиях, что открывает новые стратегии отбора и включения кишечных штаммов пробиотиков в функциональные пищевые продукты [10].
Пробиотики характеризуются антиаллер-гическим, антидиабетическим и противовоспалительным действием. Введение в организм пробиотических бифидо- и лактобактерий приводит к облегчению синдрома раздраженной толстой кишки [11].
В настоящее время наиболее остро затрагивается проблема аллергических реакций. Известно, что воздействия внешней среды вызывают изменения в организме, способствующие развитию аллергии. Считают, что в основе развития аллергии в первую очередь лежит нарушение специфической и неспецифической иммунобиологической реактивности организма.
Среди наиболее значимых неспецифических неинфекционных аллергенов особо выделяют белки коровьего молока. Аллергия на коровье молоко является заболеванием, при котором иммунная система реагирует на один или несколько молочных белков, вызывая воспалительную реакцию. Коровье молоко является наиболее распространенным аллергеном у детей, но у 80–90% пациентов наблюдается устойчивость уже к пяти годам. Действительная распространенность аллергии на коровье молоко составляет 2–6% у детей и 0,1–0,5% у взрослых [12].
В настоящее время для взрослых и детей с недостаточной активностью лактозы или её полного отсутствия в организме всё более востребованными на рынке специализированных продуктов питания становятся низколактозные и безлактозные молочные биопродукты.
Для производства таких продуктов используются различные технологии, наиболее распространённая из которых – ферментативное расщепление лактозы. Ферментативный гидролиз лактозы применяется при производстве широкого ассортимента безлактозных и низколактозных молочных продуктов: молока, йогуртов, сыров, мороженого [13]. В некоторых случаях детей с аллергией на коровье молоко следует кормить гипоаллергенными смесями на основе интенсивно гидролизованной сыворотки или казеина или же немолочными заменителями молока на растительной основе [14].
Наиболее используемые растительным заменителем молока является соевое молоко. При сравнении растительных заменителей молока становится очевидно, что только соевое молоко сопоставимо с коровьим по содержанию белка (от 2,9 до 3,7%).
По количеству липидов соевое молоко сопоставимо с полужирным коровьим. Основная их часть – ненасыщенные жирные кислоты, необходимые для здоровья человека. По содер- жанию витамина РР, железа и калия соевое молоко превосходит молоко животного происхождения. За счет наличия таких веществ как лецитин и изофлавоны, которые несут немало пользы для здоровья человека, употребление этого напитка благоприятным образом сказывается на общем состоянии человека.
Углеводы в сое представлены растворимыми сахарами – глюкозой, фруктозой, сахарозой, гидролизуемыми полисахаридами – крахмалом и нерастворимыми структурными полисахаридами – гемициллюлозой, пектиновыми веществами. Особый интерес представляют олигосахара сои – рафиноза и стахиоза, так как являются необходимым субстратом для полноценного функционирования микрофлоры кишечника [15].
Ферментирование соевых продуктов является актуальным направлением развития пищевой промышленности. Спектр бактерий, которые могут быть использованы в качестве пробиотиков для производства ферментированного соевого напитка разнообразен [16–18]. Так, например, ферментация бактериальным штаммом Lactobacillus casei Shirota улучшает вкус и функциональность соевого напитка. Укрепляющие здоровье эффекты, приписываемые определенным штаммам бифидобактерий, включают усиление иммунной функции, улучшение целостности толстой кишки, снижение частоты и продолжительности кишечных инфекций, подавление аллергических реакций и стимуляцию пищеварения и элиминации. Эти положительные свойства привели к их включению в состав функциональных продуктов питания [19, 20].
Цель работы – изучение возможности применения соевой сыворотки при приготовлении питательной среды для получения гипоаллергенного бактериального концентрата бифидобактерий.
Материалы и методы
Экспериментальные исследования проводились на кафедре «Технология молочных продуктов. Товароведение и экспертиза товаров», проблемной научно-исследовательской лаборатории Восточно-Сибирского государственного университета технологий и управления.
В работе использовали штаммы бифидобактерий Bifidobacterium infantis 20088 . Применены реактивы химически чистые для получения питательной основы на основе соевой сыворотки. Для получения соевой сыворотки 90 г. соевой муки растворяли в 1 л воды, смесь кипятили в течение 10 мин. После охлаждения в соевое молоко вносили хлористый магний и отделяли сыворотку от образовавшегося сгустка. На основе полученной сыворотки готовили три образца
Для определения кинетических параметров анализировали кривые роста бактерии в координатах А490 – τ, где А490 – определение параметров культуральной жидкости при длине волны 490 нм; τ – продолжительность культивирования. Удельную скорость роста µ находили как тангенс угла наклона прямой в координатах ln А490 – τ. Измерения оптической плотности проводили на спектрофотометре KF-77 при длине волны 490 нм.
Количество клеток бифидобактерий находили методом предельных разведений на среде ГМК по ТУ 10–02–02–789–192–95.
Результаты и обсуждение
В качестве контроля использовали бактериальный концентрат бифидокультур на основе творожной сыворотки.
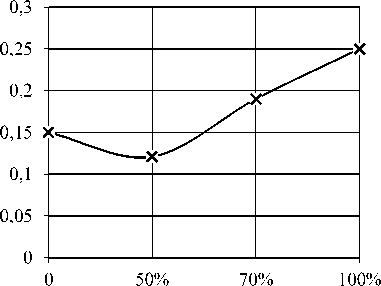
Оценку роста бифидокультур на соевой основе наблюдали по средним значениям удельной скорости роста клеток µ ср. на отрезке фаз экспоненциального роста бактерий. Температура культивирования бифидобактерий составила 37 °C (рисунок 1).
Количество соевой сыворотки, % Amount of soy whey, %
Рисунок 1. Скорость роста бифидокультур на различных соевых средах
Figure 1. The growth rate of bifidocultures on various soy media
Результаты, представленные на рисунке 1 показывают, что увеличение концентрации соевой сыворотки в среде приводит к повышению удельной скорости роста бифидокультур. Максимальная скорость роста бифидокультур отмечена в соевой питательной среде без разбавления водой.
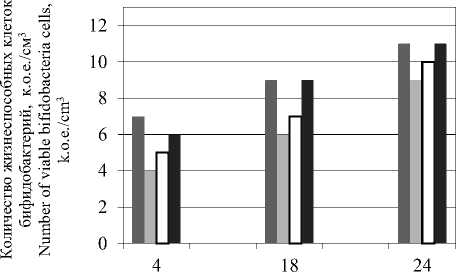
В ходе эксперимента наблюдали рост клеточных культур бифидобактерий на различных питательных соевых основах (рисунок 2).
Из данных, представленных на рисунке 2, видно, что максимальный рост клеток бифи-докультур 2×1011 к.о.е./см3 отмечен в соевой среде без добавления воды. В соевых питательных средах с концентрацией сыворотки 70 и 50% количество жизнеспособных клеток соответствует титру бифидоклеток в контроле.
Время, ч
■ контроль / control Time, h
■ 50% соевой сыворотки / 50% soy whey
□ 70% соевой сыворотки / 70% soy whey
■ 100% соевой сыворотки / 100% soy whey
Рисунок 2. Количество клеток бифидокультур на соевых основах
-
Figure 2. The number of cells of bifidocultures on soy bases
Из представленных данных можно сделать вывод о том, что максимальная скорость роста и титр клеток бифидокультур отмечены на соевой среде без добавления воды.
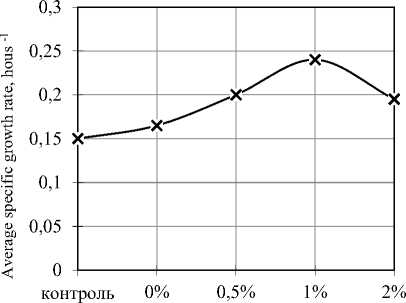
На следующем этапе проводили подбор оптимальной дозы глюкозы, обеспечивающей рост клеток бифидобактерий (рисунок 3).
Количество глюкозы, % Amount of glucose, %
Рисунок 3. Влияние глюкозы на рост клеток бифидобактерий
-
Figure 3. The effect of glucose on the growth of bifidobacteria cells
На основании представленных на рисунке 3 данных можно сделать вывод, что внесение 1% глюкозы обеспечивает максимальную скорость роста клеток бифидокультур. Титр жизнеспособных клеток бифидокультур при этом составляет 4×1011 к.о.е./см3. При увеличении концентрации глюкозы в среде удельная скорость роста бифидокультур снижается.
Проведенные исследования позволили оптимизировать состав питательной среды для приготовления бактериального концентрата бифидокультур Bifidobacterium infantis 20088 на соевой основе (таблица 1).
Таблица 1.
Состав соевой питательной среды
Table 1.
Composition of soy nutrient medium
|
Компоненты |
Количество, г |
|
Соевая сыворотка | Soy whey |
987,3 |
|
Глюкоза | Glucose |
10 |
|
Магний хлористый | Magnesium chloride |
0,3 |
|
Натрий лимоннокислый трехзамещенный Tri-substituted sodium citric acid |
1,0 |
|
Калий фосфорнокислый однозамещенный Single-substituted potassium phosphoric acid |
0,5 |
|
Аскорбиновая кислота | Ascorbic acid |
0,1 |
|
Агар микробиологический Microbiological agar |
0,8 |
В результате проведенных исследований разработан состав питательной среды на основе соевой сыворотки для дальнейшего использования в производстве бактериального концентрата бифидокультур B. infantis 20088
Заключение
Полученный в ходе проведенных исследований компонентный состав питательной среды для культивирования B. infantis 20088 содержит все необходимые источники питания, факторы роста и обладает оптимальными физико-химическими показателями. Титр жизнеспособных клеток бифидобактерий при культивировании на соевой питательной среде составляет 1012 к.о.е./см3. Предположительно, что олигосахариды соевой сыворотки стимулируют рост бифидобактерий и повышают их удельную скорость роста.
Список литературы Питательная основа для культивирования штамма Bifidobacterium infantis 2008
- Mishkin S. Dairy sensitivity, lactose malabsorption, and elimination diets in inflammatory bowel disease // Am J Clin Nutr. 1997. V. 65. № 2. Р. 564-567.
- Новик Г.И. Бифидобактерии: научные основы практического применения // Проблемы здоровья и экологии. 2006. С. 144-151.
- Ардатская М.Д. Пробиотики, пребиотики и метабиотики в коррекции микроэкологических нарушений кишечника // Медицинский Совет. 2015. V. 13. P. 94-99.
- Ардатская М.Д., Столярова Л.Г., Архипова Е.В., Филимонова О.Ю. Метабиотики как естественное развитие пробиотической концепции // Трудный пациент. Гастроэнтерология. 2017. Т. 15. № 6-7. С. 35-39.
- Akinsemolu A.A. Th e role of microorganisms in achieving the sustainable development goals // J Clean Prod. 2018. V. 182. Р. 139-155. https://doi.org/10.1016/j.jclepro.2018.02.081
- Clarke G., Stilling R.M., Kennedy P.J. et al. Gut microbiota: the neglected endocrine organ // Mol Endocrinol. 2014. V. 28. Р. 1221-1238. https://doi.org/10.1210/me.2014-1108
- Somit A., Peterson S.A. Research in biopolitics. Vol. 9. Biology and politics. The cutting edge. Bingley, UK: Emerald Group Publ. Ltd., 2011. 255 p. https://doi.org/10.1108/ S2042-9940(2011)0000009005
- Parashar A., Udayabanu M. Gut microbiota regulates key modulators of social behavior // Eur Neuropsychopharmocol. 2016. V. 26. Р. 78-91. https://doi.org/10.1016/j.euroneuro.2015.11.002
- Дармов И.В., Чичерин И.Ю., Погорельский И.П., Лундовских И.А. Выживаемость микроорганизмов пробиотиков в условиях in vitro, имитирующих процесс пищеварения у человека // Кишечная микробиота: тезисы инновационных научных статей. 2013. V. 2. С. 4-15.
- Токарева Н. Коррекция и профилактика дисбактериоза // Эффективная фармакотерапия. Гастроэнтерология. 2011. №. 3. С. 77-84.
- Bourdichon F., Berger, B., Casaregola, S., Farrokh, C. et al. Safety demonstration of microbial food cultures (MFC) in fermented food products // Safety Demonstration of Microbial Food Cultures (MFC) in Fermented Food Products. 2012. V. 455. P. 2.
- Marcos-Fernández R., Blanco-Míguez A., Ruiz L., Margolles A.et al. Towards the isolation of more robust next generation probiotics: The first aerotolerant Bifidobacterium bifidum strain // Food Research International. 2023. V. 165. P. 112481. https://doi.org/10.1016/j.foodres.2023.112481
- Mazzoli R, Pessione E. The neuro-endocrinological role of microbial glutamate and GABA signaling // Front Microbiol. 2016. V. 7. Р. 1934. https://doi.org/10.3389/fmicb.2016.01934
- Crittenden R.G., Bennett L.E. Cow's milk allergy: a complex disorder // J Am Coll Nutr. 2005. V. 24. P. 582S591S.
- Добриян Е.И., Ильина А.М., Горлова А.Г. Производство низколактозных продуктов // Пищевая промышленность. 2019. № 4. С. 40-42.
- Kneepkens C.M., Meijer Y. Clinical practice. Diagnosis and treatment of cow's milk allergy // Eur J Pediatr. 2009. V. 168. P. 891-896. https://doi.org/10.1007/s00431-009-0955-7
- Шепельская Н.Р., Проданчук Н.Г. Изофлавоноиды сои как ксеноэстрогены для человека // Фундаментальные исследования. 2011. № 9. С. 593-598.
- Ледина А.В., Прилепская В.Н. Фитоэстрогены и изофлавоноиды сои в лечении климактерического синдрома // Фарматека. 2012. № 12 (245). С. 86-89.
- Хабибулина Н.В. Изучение процесса получения и очистки фракций соевых изофлавоноидов совместно с изолятом белка сои // Успехи в химии и химической технологии. 2010. Т. 24. № 11 (116). С. 46-50.
- Решетник Е.И., Фролова Н.А., Бабий Т.В. Влияние употребления изофлавонов сои на профилактику развития онкологических заболеваний // XXI век: итоги прошлого и проблемы настоящего плюс. Food Technology. 2022. Т. 11. № 2 (58). С. 88-91. https://doi.org/10.46548/21vek2022-1158-0015


