Пневмонит как осложнение иммунотерапии онкологических заболеваний: сложности диагностики и лечения
Автор: Чижова Ю.С., Федотов В.Д., Захарова Е.М.
Журнал: Клиническая практика @clinpractice
Рубрика: Научные обзоры
Статья в выпуске: 2 т.16, 2025 года.
Бесплатный доступ
Пневмонит — одно из жизнеугрожающих осложнений иммунотерапии онкологических заболеваний. Несмотря на низкую встречаемость, пневмонит оказывает значительное влияние не только на качество жизни пациентов, но и на смертность, в том числе заставляя менять схему лечения основного заболевания. Терапия ингибиторами контрольных точек иммунного ответа является относительно новым, но хорошо зарекомендовавшим себя видом лечения злокачественных новообразований. Ожидается, что с расширением списка показаний к иммунотерапии будет расти и количество осложнений, в связи с чем становится очевидной необходимость информирования об этом врачей разного (не только онкологического) профиля. Важно поддерживать у них высокий индекс подозрительности, чтобы на ранних этапах выявлять жизнеугрожающее осложнение и назначать адекватное лечение. Известные в настоящее время исследования отечественных и зарубежных авторов по выявлению и лечению пневмонита в большинстве своём носят узконаправленный характер, рассматривая конкретный препарат иммунотерапии или конкретную локализацию опухоли. В представленной статье мы объединили и систематизировали данные разных источников, делая акцент на диагностике и терапии этого опасного осложнения.
Иммунотерапия, ингибиторы контрольных точек, пневмонит, компьютерная томография
Короткий адрес: https://sciup.org/143184561
IDR: 143184561 | DOI: 10.17816/clinpract655829
Текст научной статьи Пневмонит как осложнение иммунотерапии онкологических заболеваний: сложности диагностики и лечения
Пневмонит (pneumonitis, пульмонит) — это общий термин, обозначающий воспаление лёгочной ткани, которое в случае бактериальной или вирусной этиологии носит название пневмонии, а при неинфекционном характере заболевания (например, вследствие воздействия аллергических агентов, облучения или лекарственных средств) используется термин «пневмонит».
В настоящее время терапия ингибиторами контрольных точек иммунного ответа становится всё более востребованной, при этом иммунотерапия, как и любая другая, обладает побочными эффектами. Частота встречаемости такого жизнеугрожающего осложнения, как пневмонит, невелика и составляет 3–5% при монотерапии ингибиторами PD-1 (programmed cell death protein 1 — белок запрограммированной клеточной гибели-1) и PD-L1 (programmed death-ligand 1 — лиганд рецептора программируемой клеточной гибели-1), до 10% — при комбинированной терапии, однако, согласно Американскому торакальному обществу, показатели смертности от пневмонита составляют до 35% общего количества летальных исходов [1].
ПАТОГЕНЕЗ ПНЕВМОНИТА
Клетки опухоли, по сути своей, являются чужеродным агентом, пусть и возникающим из собственных клеток [2], который иммунная система должна распознать и уничтожить. Однако, чтобы избежать гибели, опухолевые клетки выработали различные механизмы защиты. Первый путь — экспрессия на поверхности цитотоксического CTLA-4 (cytotoxic T-lymphocyte associated protein 4 — Т-лимфоцитассоциированный протеин 4), что приводит к торможению иммунного ответа [3]. Второй путь — продуцирование лигандов PD-L1 и PD-L2, которые связываются с рецепторами PD-1 на Т-клетках, тем самым блокируя их и ограничивая иммунные реакции.
REVIEW
Pneumonitis as a Complication of Immunotherapy of Oncological Diseases: Difficulties in Diagnosis and Treatment
Yu.S. Chizhova1, V.D. Fedotov2, E.M. Zakharova1
-
1 Research Institute of Clinical Oncology «Nizhny Novgorod Regional Clinical Oncological Dispensary», Nizhny Novgorod, Russia;
-
2 Privolzhsky Research Medical University, Nizhny Novgorod, Russia
Pneumonitis is one of the life-threatening complications of immunotherapy of oncological diseases. Despite the low occurrence rate, pneumonitis significantly affects not only the quality of life in the patients, but also the mortality, forcing to change the treatment scheme of the main disease. Therapy with immune checkpoint blockers is a relatively new, but well established type of oncology therapy. It is expected that, with the extension of the list of indications to immunotherapy, some growth would be observed in the number of complications, due to which it becomes necessary to inform the physicians of various (not only oncological) specialties about it. It is important for them to maintain high index of suspicion to be able to detect this life-threatening complication at the early stages and to prescribe adequate treatment. The currently known research works by national and foreign authors on the detection and treatment of pneumonitis in their majority have a strictly specialized type due to studying a specific immunotherapy medicine or a specific location of the tumor. In the present article, we have summarized and systematized the data from various sources, emphasizing on the diagnostics and therapy of this dangerous complication.
Submitted 12.02.2025 Accepted 21.05.2025 Published online 22.06.2025
Иммунотерапия направлена на отключение вышеописанных механизмов торможения иммунной системы. Прикрепляясь на раковых клетках или лимфоцитах, моноклональные антитела против иммунных контрольных точек блокируют взаимодействие между рецепторами, восстанавливая нормальную иммунную реакцию. В настоящее время для клинического использования одобрены ингибиторы PD-1 ниволумаб и пембролизумаб, ингибиторы PD-L1 атезолизумаб, авелумаб и дурвалумаб, антитело к CTLA-4 ипилимумаб.
Патогенез самого пневмонита до конца пока не изучен. Согласно одной из версий, на наш взгляд, наиболее состоятельной, иммунные контрольные точки участвуют не только в активации иммунного ответа, но и в предотвращении его чрезмерной активности по отношению к собственным клеткам. При иммунотерапии происходит отключение данного механизма и развитие аутоиммунных процессов.
ФАКТОРЫ РИСКА РАЗВИТИЯ ПНЕВМОНИТА
Пневмонит как осложнение иммунотерапии развивается относительно редко, а значит, существуют обстоятельства, повышающие эту вероятность. Из различных источников литературы нами были выделены основные факторы риска: так, наиболее часто упоминаются хронические заболевания лёгких у пациентов до лечения, такие как интерстициальные заболевания лёгких, хроническая обструктивная болезнь лёгких, курение, сочетание иммунотерапии и других методов лечения [4], пожилой возраст [5], лучевая терапия в анамнезе [6]. Существует зависимость и от типа опухоли [7]: в частности, при почечно-клеточном раке и немелкоклеточном раке лёгкого частота пневмонита выше, чем при меланоме (4,4% и 1,4% соответственно). Имеет значение и сам препарат иммунотерапии: так, ингибиторы PD-1 дают более высокую частоту пневмонита по сравнению с ингибиторами PD-L1 и более высокую частоту пневмонита III или IV степени. Частота возник-


новения пневмонита не является дозозависимой [7], однако отмечается её кумулятивный характер, т.е. частота выше при длительном лечении.
КЛИНИЧЕСКАЯ КАРТИНА ПНЕВМОНИТА
В ходе анализа литературных источников установлено, что для пневмонита отсутствуют характерные клинические симптомы, при этом основными жалобами являются одышка, кашель, лихорадка и боль в груди; сложность добавляют также ранее существовавшие хронические болезни лёгких, обострения которых обладают схожей картиной.
Пневмонит определяется по следующим диаг- ностическим параметрам, основанным на критериях, предложенных сетью клинических исследований идиопатического лёгочного фиброза (Idiopathic Pulmonary Fibrosis Clinical Research Network, IPFnet) [5]:
-
1) необъяснимое усиление одышки в течение последних 30 дней;
-
2) данные компьютерной томографии с новыми двусторонними участками уплотнения лёгочной ткани по типу консолидации или матового стекла;
-
3) отсутствие признаков лёгочной инфекции в результате диагностического введения бронхоальвеолярного лаважа, эндотрахеальной аспирации или посева мокроты в сочетании с отрицательными анализами крови на другие потенциально инфекционные патогены;
-
4) отсутствие признаков злокачественных клеток в жидкости бронхоальвеолярного лаважа для исключения лимфангитического распространения рака;
-
5) исключение левосторонней сердечной недостаточности и других возможных причин острой дыхательной недостаточности;
-
6) интервал между последним введением системной противоопухолевой терапии и появлением клинических и рентгенологических признаков менее 4 недель.
Согласно общим критериям токсичности Национального института рака США (National Cancer Institute Common Toxicity Criteria for Adverse Events, NCI СТСАЕ, version 5.0) [8], выделяют несколько степеней тяжести пневмонита:
-
• I степень — бессимптомная с отсутствием клинической картины и жалоб пациента: изменения выявляются только по результатам компьютерной томографии (КТ); показано только клиническое и диагностическое наблюдение;
-
• II степень — симптомы, незначительно влияющие на качество жизни пациента, требующие ограниченного медицинского вмешательства (медикаментозная терапия);
-
• III степень — выраженные симптомы, ограничивающие повседневные действия пациента, требуется медикаментозная и оксигенотерапия;
-
• IV степень — опасная для жизни дыхательная недостаточность, показано срочное медицинское вмешательство (например, трахеотомия или интубация);
-
• V степень — выраженная дыхательная недостаточность, смерть.
ДИАГНОСТИКА ПНЕВМОНИТА
Исследование функции лёгких является одним из ранних и чувствительных диагностических ме- тодов пневмонита, на что указывают относительное снижение функциональной жизненной ёмкости лёгких ≥10% от исходного уровня, снижение диффузионной способности лёгких по монооксиду углерода (diffusing capacity of the lungs for carbon monoxide, DLCO) <60% от должного, снижение пройденного расстояния до <300 м и десатурация <85% к концу теста 6-минутной ходьбы.
Бронхоскопия с бронхоальвеолярным лаважем выполняется на ранних этапах обследования, чтобы исключить альтернативные диагнозы, такие как пневмония [3]; содержание лимфоцитов >60% может указывать на пневмонит.
Компьютерная томография высокого разрешения — золотой стандарт выявления пневмонита, оценки его прогрессирования или разрешения. Как следует из вышеуказанной классификации NCI СТСАЕ, v. 5.0, на I стадии заболевания рентгенологические изменения предшествуют появлению жалоб пациентов, в связи с чем важно разобраться, как выглядят изменения на КТ. К сожалению, специфичных рентгенологических признаков пневмонита нет. Суммируя данные изученных нами источников, мы определили основные, наиболее часто встречающиеся паттерны, которые были классифицированы в соответствии с международной мультидисциплинарной классификацией интерстициальных пневмоний Американского торакального общества / Европейского респираторного общества (American Thoracic Society / European Respiratory Society, ATS/ERS) [9]:
-
• паттерн криптогенной организующей пневмонии [3] визуализируется как очаговая консолидация с субплевральным и/или пери-бронхиальным распределением и воздушными бронхограммами. Специфическим считается признак обратного ореола (симптом атолла) — участки помутнения по типу матового стекла в центре и консолидацией по периферии (рис. 1);
-
• паттерн неспецифической интерстициальной пневмонии [10] визуализируется как сливающи-
- еся двусторонние помутнения по типу матового стекла и ретикулярные изменения преимущественно в периферических и нижних отделах лёгких нижних долей с выраженными тракционными бронхоэктазами и потерей объёма нижней доли. Отмечается перибронховаскулярное распределение с субплевральным сохранением нормальной лёгочной ткани (рис. 2);
-
• паттерн гиперчувствительного пневмонита [11] визуализируется как диффузно распространённое уплотнение лёгочной ткани по типу матового стекла с центрилобулярными узелками с «воздушными ловушками» на выдохе (рис. 3);
-
• паттерн острого респираторного дистресс-синдрома [10] визуализируется как диффузное или мультифокальное повышение плотности лёгочной ткани по типу матового стекла и консолидации, преимущественно с переднезадним градиентом распределения, а также как снижение объёма лёгких, дилатация бронхов и тракционные бронхоэктазы (рис. 4).
Особую сложность представляет диагностика пневмонита у пациентов с лучевой терапией органов грудной клетки в анамнезе, поскольку у них возникает другая разновидность пневмонита — лучевая. Рентгенологические признаки лучевого пневмонита: очаговая консолидация лёгочной ткани примерно в области поля высокой дозы облучения, чаще бывает односторонней, поражает меньше долей лёгкого и имеет острую границу, не соответствующую нормальной анатомии доли, в то время как лекарственно-индуцированный пневмонит имеет тенденцию быть двусторонним, поражать больше долей и реже иметь острую границу [6].
Учитывая сложности диагностики и оценки пневмонита, связанного с иммунотерапией, возникает необходимость поиска новых подходов к анализу КТ-изображений. Нами были найдены данные о работах с использованием программ искусственного интеллекта. Во время эпидемии пневмонии, ассоциированной с коронавирусной инфекцией (COVID-19), разработчики обучали искусственный
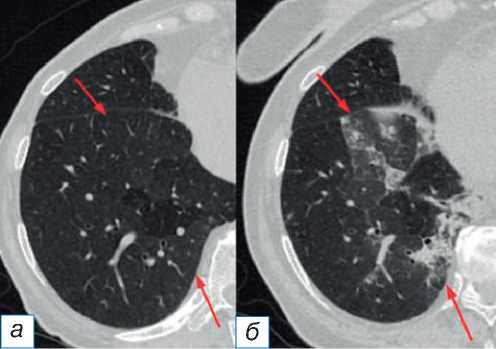
Рис. 1. Паттерн криптогенной организующей пневмонии: до ( а ) и после ( б ) иммунотерапии (стрелки).
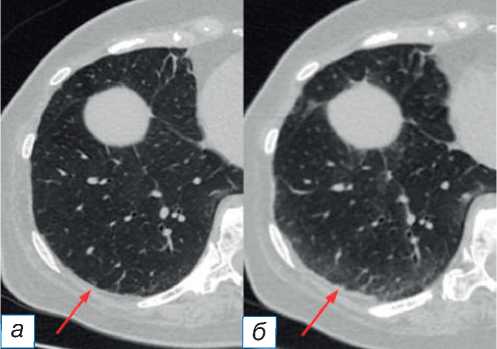
Рис. 2. Паттерн неспецифической интерстициальной пневмонии: до ( а ) и после ( б ) иммунотерапии (стрелки).
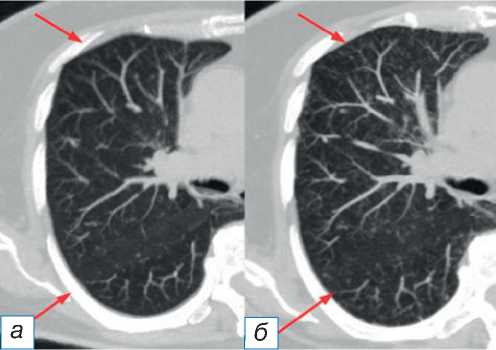
Рис. 3. Паттерн гиперчувствительного пневмонита: до ( а ) и после ( б ) иммунотерапии (стрелки).
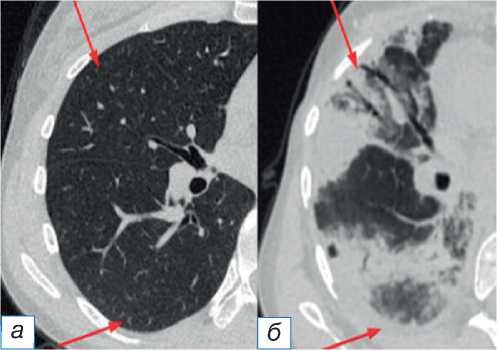
Рис. 4. Паттерн острого респираторного дистресс-синдрома: до ( а ) и после ( б ) иммунотерапии (стрелки).
интеллект распознаванию и оценке характерных изменений лёгочной ткани. Учитывая, что в основе рентгенологической картины COVID-19 лежат интерстициальные изменения, то становится возможным и распознавание пневмонита [12]. Особую ценность использования искусственного интеллекта представляет количественная оценка объёма поражённой лёгочной ткани, что позволяет отслеживать динамику заболевания. На наш взгляд, исследования в данном направлении представляют значительный интерес.
ЛЕЧЕНИЕ ПНЕВМОНИТА
Тактика лечения пневмонита во многих источниках носит общий характер. Мы объединили данные из отечественных и зарубежных источников и систематизировали в зависимости от степени тяжести.
При I степени лечение не показано, и иммунотерапия может продолжаться непрерывно. Рекомендовано регулярное наблюдение с повторными КТ грудной клетки и исследованиями функции лёгких через 3–4 недели. Если развиваются симптомы или рентгенологические изменения, которые предвещают прогрессирование заболевания, тактика лечения меняется и будет соответствовать пневмониту более высокой стадии.
При II степени рекомендуется воздержаться от иммунотерапии и начать приём пероральных глюкокортикоидов. В настоящее время нет рандомизированных клинических исследований, в которых были бы показаны однозначные подходы к дозам системных глюкокортикоидов и длительность их приёма. Так, в небольшом количестве опубликованных статей [13] фигурируют дозы глюкокортикоидов 1–2 мг/кг массы тела, длительность терапии в течение 6–8 недель, максимально до 12 недель. В отечественных руководствах рекомендуется преднизолон в дозировке 1–2 мг/кг в сутки или метилпреднизолон в дозе 0,5–1 мг/кг в сутки перорально [14]. Лечение продолжается в течение 4–6 недель. Пациенты, как правило, наблюдаются амбулаторно с оценкой динамики клинической картины в течение 48 часов от начала стероидной терапии и 1–2 раза в неделю после этого. Приём глюкокортикоидов следует продолжать в начальной дозе, пока симптомы не вернутся к степени I или к исходному уровню, после чего дозировка медленно снижается в течение 6-недельного периода.
При пневмоните III и IV степени требуется госпитализация и немедленное прекращение иммунотерапии. Перед началом терапии следует выполнить бронхоскопию и анализ бронхоальвеолярного лаважа для исключения инфекционной этиологии поражения. Большинство торакальных сообществ рекомендуют внутривенное введение метилпреднизолона или его эквивалента в высоких дозах (метилпреднизолон от 1 до 2–4 мг/кг в сутки) [15]. Показанием к оксигенотерапии является снижение сатурации до 88%.
Стоит особо отметить, что достижение клинического улучшения при терапии глюкокортикоидами служит сигналом к медленному, по крайней мере в течение 6 недель, снижению дозы препарата. В случае быстрого снижения дозы возникает рикошетный пневмонит, течение которого может быть более тяжёлым, чем при первоначальном проявлении.
Особую сложность в лечении представляет стероидрефрактерный пневмонит, который, по данным публикаций, развивается у 20–40% больных [13]. В случае развития рефрактерного пневмонита можно рассмотреть дополнительную иммуносупрессивную терапию микофенолата мофетилом, циклофосфамидом или инфликсимабом (5 мг/кг однократно) [14, 15]. Внутривенная терапия иммуноглобулином предлагается как более безопасная и эффективная, чем терапия инфликсимабом или его комбинацией с иммуноглобулином [13].
Ещё один вариант терапии — ингибитор рецепторов интерлейкина 6 тоцилизумаб, который показал хорошую эффективность в одном исследовании. Другие иммуносупрессоры, такие как микофенолата мофетил или циклофосфамид, считаются медленно действующими, в связи с чем их эффективность сомнительна.
По данным исследования [4], улучшение/раз-решение пневмонита в ходе лечения достигается в 88–90% случаев: при I степени — примерно в 100%, при II степени — в 93%, при III степени и выше — в 64%. Такая статистика свидетельствует о важности выявления пневмонита на ранних стадиях. Однако, даже в случае полного излечения, общая выживаемость пациентов, перенёсших пневмонит, ниже, чем у пациентов без этого осложнения [5].
В некоторых исследованиях было обнаружено, что у пациентов, у которых появились побочные реакции, ответ на лечение был лучше, чем у пациентов без осложнений. Так, пациенты с пневмонитом достигли более высоких показателей общей частоты ответа, чем те, у кого его не было (37% против 18% соответственно) [16]. Таким образом, возобновление иммунотерапии может быть желательным, хотя общая частота побочных явлений при повторном назначении препарата выше. Согласно мнению Общества иммунотерапии рака (Society for Immunotherapy of Cancer, SITC) [17], повторный приём препарата возможен у пациентов с полно- стью излеченным пневмонитом II степени, а также у отдельных пациентов с полностью купированным пневмонитом III степени, у которых преимущества иммунотерапии перевешивают риск рецидива осложнений. Пациенты с пневмонитом IV степени не должны проходить повторную иммунотерапию. В отечественных рекомендациях [14] допускается возобновление терапии при I и II степенях, при III и IV степенях — постоянная отмена терапии.
ЗАКЛЮЧЕНИЕ
Анализ большого числа литературных источников помог выявить сложности диагностики пневмонита. Использование искусственного интеллекта для анализа КТ-исследований является, на наш взгляд, перспективным методом диагностики этого потенциально смертельного заболевания. Особую ценность представляет возможность количественной оценки поражённой лёгочной ткани для более точного отслеживания динамики заболевания.
Терапия ингибиторами контрольных точек иммунного ответа является хорошо зарекомендовавшим себя видом лечения онкологических болезней. Ввиду того, что иммунотерапия становится всё более востребованной, в настоящее время расширяется и список показаний к ней, что, несомненно, приведёт к росту числа осложнений, а поскольку пациенты наблюдаются не только в учреждениях онкологического профиля, возникает необходимость в информировании врачей разных специализаций о данной угрозе. Важно поддерживать у них высокий индекс подозрительности, поскольку пневмонит является жизнеугрожающим осложнением, тем не менее выявленный на ранних стадиях и при соответствующей терапии он хорошо поддаётся лечению, что способствует выживаемости онкопациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. Ю.С. Чижова — обзор публикаций по теме статьи, написание текста рукописи; В.Д. Федотов — обзор публикаций по теме статьи, редактирование рукописи; Е.М. Захарова — обзор публикаций по теме статьи. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы одобрили рукопись, а также согласились нести ответственность за все аспекты работы, гарантируя надлежащее рассмотрение и решение вопросов, связанных с точностью и добросовестностью любой её части).
Этическая экспертиза. Все пациенты, данные которых включены в исследование, при поступле- нии в стационар подписывали информированное добровольное согласие на использование результатов обследования и лечения в научных целях.
Источники финансирования. Отсутствуют.
Раскрытие интересов. Авторы заявляют об отсутствии отношений, деятельности и интересов за последние три года, связанных с третьими лицами (коммерческими и некоммерческими), интересы которых могут быть затронуты содержанием статьи.
Оригинальность. При проведении исследования и создании настоящей работы авторы не использовали ранее опубликованные сведения (текст, иллюстрации, данные).
Доступ к данным. Редакционная политика в отношении совместного использования данных к настоящей работе неприменима, данные могут быть опубликованы в открытом доступе.
Генеративный искусственный интеллект. При создании настоящей статьи технологии генеративного искусственного интеллекта не использовали.
Рассмотрение и рецензирование. Настоящая работа подана в журнал в инициативном порядке и рассмотрена по обычной процедуре. В рецензировании участвовали два внешних рецензента и научный редактор издания.
ADDITIONAL INFORMATION
Author contributions. Yu.S. Chizhova: review of publications on the topic of the article, writing the text of the manuscript; V.D. Fedotov: review of publications on the topic of the article, editing the manuscript; E.M. Zakharova: review of publications on the topic of the article. The authors confirm that their authorship complies with the international ICMJE criteria (all authors have approved the manuscript and also agreed to be accountable for all aspects of the work, ensuring that questions related to the accuracy and integrity of any part of it are appropriately reviewed and resolved).
Ethics approval. All patients whose images were included in the study signed an informed voluntary consent upon admission to the hospital to use the results of the examination and treatment for scientific purposes.
Funding sources. No funding.
Disclosure of interests. The authors declare that they have no relationships, activities or interests over the past three years related to third parties (commercial and non-commercial) whose interests may be affected by the content of the article.
Statement of originality. The authors did not utilize previously published information (text, illustrations, data) in conducting the research and creating this paper.
ГАТАТАТА' ltatatat FATAT кТ ГА
Data availability statement. The editorial policy regarding data sharing does not apply to this work, data can be published as open access.
Generative AI. Generative AI technologies were not used for this article creation.
Provenance and peer-review. This paper was submitted to the journal on an initiative basis and reviewed according to the usual procedure. Two external reviewers and the scientific editor of the publication participated in the review.


