Побочные эффекты длительной антиаритмической терапии амиодароном
Автор: Дорофеева Наталья Петровна, Иванченко Дарья Николаевна, Машталова Ольга Георгиевна, Куликова Ирина Евгеньевна, Чибинева Светлана Анатольевна, Тер-Акопян Александра Ованесовна, Скляров Федор Викторович, Кияшко Екатерина Евгеньевна
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 1 (29), 2017 года.
Бесплатный доступ
Распространенность фибрилляции предсердий подразумевает широкое применение антиаритмических препаратов, в частности, амиодарона. В качестве побочных эффектов применения данного препарата наиболее часто упоминается поражение щитовидной железы. В статье рассмотрен клинический случай развития у пациента с фибрилляцией предсердий фотосенсибилизации, которую редко можно наблюдать в клинической практике.
Фибрилляция предсердий, амиодарон, побочные эффекты, фотосенсибилизация, клинический случай
Короткий адрес: https://sciup.org/143164630
IDR: 143164630
Текст научной статьи Побочные эффекты длительной антиаритмической терапии амиодароном
Фибрилляция предсердий представляет собой наиболее часто встречаемое нарушение ритма сердца. Частота ее выявления в общей популяции составляет 1-2%. Распространенность фибрилляции предсердий предопределяет широкое назначение пациентам анти-аритмических препаратов. Одним из наиболее широко испольуемых антиаритмических препаратов является амиодарон, который назначается для профилактики и лечения желудочковых и наджелудочковых аритмий. Предпосылками применения амиодарона являются его способность оказывать влияние как на суправентрикулярные, так и на желудочковые тахиаритмии, а также тот факт, что он эффективен как при нормальной, так и при сниженной систолической функции ЛЖ [1, 2]. Амиодарон был открыт в 1961 году и первоначально был представлен как антиангинальный препарат. Лишь в 1970 году были открыты его антиаритмический и антифи-брилляторный эффекты.
Амиодарон относится к III классу анти-аритмических препаратов по классификации Vaughan Williams. Его уникальность обусловлена также способностью неконкурентно ингибировать альфа- и бета-адренорецепторы, инактивировать калиевые каналы, быстрые натриевые каналы в мембране кардиомиоцитов. Он обладает свойствами антагонистов кальция и периферических вазодилататоров. Особенностью фармакокинетики препарата является его кумуляция в жировой ткани и продолжительный период полувыведения, который также может варьировать в широких пределах и составлять от 25 до 110 суток. Следует отметить, что пациенты с нарушениями ритма сердца постоянно принимают несколько лекарственных препаратов. В связи с этим весьма актуаль- ной представляется проблема лекарственных взаимодействий. Так, известно, что повышение концентрации амиодарона в крови может быть вызвано приемом препаратов из группы статинов, дигоксина, варфарина, некоторых антагонистов кальция и ряда других, что обусловлено взаимодействием через систему цитохрома Р450. Среди побочных эффектов терапии амиодароном можно выделить поражение щитовидной железы (<35%), пневмопатию (1-17%), неврологические расстройства (3-35%), фото-токсические и аллергические кожные реакции.
Преимущественное поражение щитовидной железы обусловлено химической структурой препарата, содержащим 37% йода (в одной таблетке 200 мг содержится 75 мг йода), кроме того имеющего существенное структурное сходство с гормонами щитовидной железы. В процессе метаболической трансформации из каждых 200 мг амиодарона высвобождается примерно 6-9 мг неорганического йода, что в 50–100 раз превышает суточную потребность в элементе. Именно поэтому вероятность развития нежелательных реакций прогрессивно возрастает с увеличением дозы и продолжительности приема. Примерно 30% больных вынуждены прекращать прием антиаритмических препаратов из-за выраженных побочных эффектов. Это является особенно актуальным среди пациентов, получающих амиодарон с целью восстановления синусового ритма, а через годы вызывающее появление тяжелого тиреотоксикоза. И решение о дальнейшем восстановлении ритма откладывается до нормализации показателей гормонов щитовидной железы.
Под фототоксичностью понимают изменение цвета кожных покровов от серо-голубого до свинцового оттенка. Встречается она в 1% случаев применения терапии препаратом. Патоморфологически характеризуется отложением липофусцина в лизосомах дермы [3]. Может сохраняться продолжительное время [4].
В качестве иллюстрации представляем клинический случай, который демонстрируют описанные нежелательные эффекты амиодарона, а именно – изменение цвета кожных покровов с нормальных физиологических до сероголубого цвета и возникновение амиодарон-индуцированного тиреоидита.
Пациент Г. поступил в кардиологическое отделение Ростовской клинической больницы с основными жалобами на перебои в работе сердца, боли ноющего характера без четкой вза- имосвязи с физической нагрузкой. Кроме того, пациент обращал внимание на повышение артериального давления до 150/90 мм рт. ст., снижение массы тела на 6 кг в течение 3 месяцев.
Из анамнеза заболевания известно, что у больного в 2002 году впервые был зарегистрирован пароксизм фибрилляции предсердий (ФП). По данному факту он был госпитализирован в центральную районную больницу, где синусовый ритм удалось восстановить с использованием амиодарона в суточной дозе 600 мг, что соответствует среднетерапевтической дозировке. При выписке из стационара пациенту были даны рекомендации о последующем приеме амиодарона в дозе 200 мг по 1 таблетке 2 раза в день в течение 5 дней с последующим двухдневным перерывом и дальнейшим переходом на поддерживающую дозу 200 мг в сутки.
Однако полученные при выписке рекомендации пациент не выполнял и самостоятельно повысил дозу амиодарона до 8 таблеток в сутки (с достижением суточной дозы 1600 мг), которую принимал на протяжении последующих девяти лет. Впоследствии, к 2005 году появилось изменение окраски кожных покровов в местах контакта с солнечными лучами, начала уменьшаться масса тела. В 2011 году отметил ухудшение состояния, а именно – увеличились частота и интенсивность эпизодов сердцебиений, перебоев в работе сердца, болей за грудиной. На электрокардиограмме была снова зарегистрирована фибрилляция предсердий. Пациент продолжал прием амиодарона в той же дозе.
С октября 2015 года больной отменил препарат самостоятельно и начал принимать соталол в дозировке 40 мг в день. Помимо антиаритми-ческой терапии, регулярно принимал стандартную комбинацию кандесартана и гидрохлорти-азида в дозе 16/12,5 мг в сутки, варфарин 5 мг в сутки.
При поступлении объективно было выявлено, что кожные покровы лица, ушных раковин, верхней части шеи были серо-голубого цвета, окраска кожных покровов остальной поверхности тела без особенностей (рис. 1).
В легких дыхание везикулярное, хрипов, крепитаций не выслушивалось, частота дыхания составляла 18 в минуту. Со стороны сердечно-сосудистой системы было выявлено, что пульс на лучевой артерии слабого наполнения, аритмичен с частотой сердечных сокращений порядка 78 ударов в минуту, пульс – 72 удара в минуту. Дефицит пульса составил 6 уда-
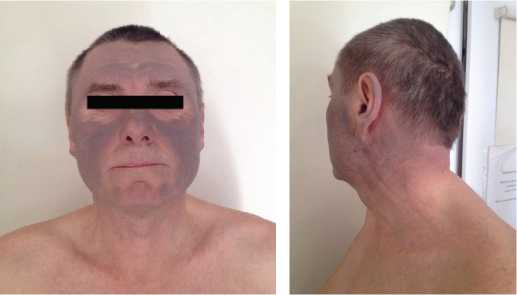
Рис. 1. Фотосенсибилизация кожных покровов у пациента Г. на фоне терапии амиодароном.
ров в минуту. Перкуторно границы сердца расширены влево на 1 см. Аускультативно тоны сердца аритмичны, приглушены. Артериальное давление было на уровне 125/80 мм рт. ст.
Лабораторно общий анализ крови без особенностей, рутинные биохимические показатели – в пределах нормальных значений. По данным коагулограммы дозировка принимаемого варфарина была адекватной, Международное нормализованное отношение было на уровне 2,3. Обращали на себя внимание лабораторные признаки нарушения функции щитовидной железы: уровень тиреотропного гормона составил 0,01 ММЕ/мл, свободного тироксина – 57,12 пмоль/л. Инструментально на электрокардиограмме определялись фибрилляция предсердий с частотой сердечных сокращений (ЧСС) 110-62 удара в минуту, нарушение внутрижелудочковой проводимости. В динамике было достигнуто снижение ЧСС до 92-50 ударов в минуту.
На эхокардиограмме были выявлены дилатация левого предсердия до 42 мм., повышение давления в легочной артерии до 37 мм рт. ст. с сохранной фракцией выброса левого желудочка (72%). При проведении УЗИ щитовидной железы обнаружены мелко-узловые образования обеих долей (максимально 7х6 мм).
На фоне проведенной в стационаре терапии состояние пациента улучшилось: уменьшились перебои в работе сердца, повысилась толерантность к физической нагрузке, гемодинамика стабилизировалась, пациент был выписан с рекомендациями по приему бисопролола 5 мг, инда-памида + периндоприла 2,5/0,625 мг, варфарина 5 мг, аторвастатина 20 мг.
При выписке из стационара пациенту была рекомендована терапия тиреостатиками (тиама-зол) в дозе 30 мг в сутки. Через 1 месяц амбула- торной тиреостатической терапии наблюдалась положительная динамика гормонов щитовидной железы: уровень свободного тироксина составил 23 пмоль/л, уровень тиреотропного гормона оставался 0,014 ММЕ/мл, свободный трийодти-ронин был на уровне 4,64 пмоль/л. Была уменьшена доза тиамазола до 20 мг/сутки. Проведен контроль гормонов щитовидной железы через 1 месяц: нормализация уровня тиреотропного гормона до 0,37 ММЕ/мл, общего тироксина до 106 нмоль/л, что соответствует нормативным значениям.
После стабилизации функции щитовидной железы пациент был госпитализирован в отделение сердечно-сосудистой хирургии Ростовской клинической больницы ЮОМЦ ФМБА России с целью проведения изоляции устьев легочных вен методом криодеструкции. При поступлении на электрокардиограмме определялись фибрилляция предсердий с ЧСС 75-85 ударов в минуту, нарушение внутрижелудочковой проводимости. На эхокардиограмме выявлялись дилатация левого предсердия до 45 мм, давление в легочной артерии 23 мм рт.ст. с сохранной фракцией выброса левого желудочка (59%). Повторное ультразвуковое исследование щитовидной железы не проводилось.
По данным мультиспиральной компьютерной томографии легочных вен и левого предсердия было выявлено увеличение размеров левого предсердия до 74х50х77 мм. Объем левого предсердия с учетом ушка превышал в 2 раза нормальные значения, составляя 180 мл. Правые верхняя и нижняя, а также левая верхняя легочные вены незначительной увеличены (до 19-20 мм).
Криовоздействие проводилось под общей анестезией. После выполнения двух криовоздействий в устье каждой легочной вены на электрокардиограмме был зарегистрирован синусовый ритм.
Учитывая, что интоксикация амиодароном у пациента происходила в течение девяти лет, а первые изменения со стороны кожных покровов появились уже спустя три года от начала использования антиаритмика, токсичный дозозависимый эффект в данном случае наступил при применении 1600 мг препарата на протяжении трех лет. Обращает также внимание тот факт, что, даже несмотря на имевшийся перерыв в приеме препарата в течение шести месяцев, предшествовавших первой госпитализации, интенсивность серого оттенка кожи сохранялась, что свидетельствовало о длительных фар- макодинамическом эффекте и периоде полувыведения.
Клинический интерес описанного нами случая состоит в том, что акцентирует внимание клинициста на риск фотосенсибилизации кожных покровов пациента и поиск амиодарон- индуцированных состояний. В данном случае они развилась вследствие отсутствия комплаент-ности к назначаемой антиаритмической терапии. Кроме того, наличие йода в составе амиодарона повышает вероятность поражения щитовидной железы, что также отмечалось у нашего больного.
Список литературы Побочные эффекты длительной антиаритмической терапии амиодароном
- Singh, B.N. Amiodarone as paradigm for developing new drugs for atrial fibrillation. J Cardiovasc Pharmacol 2008; 52: 300-305.
- Vassallo P. and Trohman R.G. Prescribing amiodarone: An evidence-based review of clinical indications. JAMA 2007; 298: 1312-1322.
- Harris L., McKenna W.J., Rowland E. et al. Side effects of long-term amiodarone therapy. Circulation 1983; 67:45-51.
- Blackshear J.L. Randle H.W. Reversibility of blue-gray cutaneous discoloration from amiodarone. Mayo Clin Proc 1991; 66:721-726.


