Почвенные микроорганизмы, разлагающие ароматические углеводороды и карбоновые кислоты
Автор: Рыбкина Д.О., Гусев В.А., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 6, 2005 года.
Бесплатный доступ
Проведен анализ образцов почв, подверженных интенсивному техногенному воздействию и определен спектр основных загрязняющих органических соединений. Из образцов почв выделены бактериальные штаммы, способные использовать в качестве ростового субстрата MOHO-, полиароматические углеводороды и галогензамещенные ароматические карбоновые кислоты. Изолированные бактерии-деструкторы отнесены к родам Deinococcus, Cellulomoncts, Micrococcus, Planococcus и Pseudomonas.
Короткий адрес: https://sciup.org/147204357
IDR: 147204357 | УДК: 58.051:579.222.2:57.083.18
Текст научной статьи Почвенные микроорганизмы, разлагающие ароматические углеводороды и карбоновые кислоты
“Институт экологии и генетики микроорганизмов, 614081, Пермь, ул. Голева, 13
ь Пермский государственный университет, 614990, Пермь, ул. Букирева, 15
Проведен анализ образцов почв, подверженных интенсивному техногенному воздействию и определен спектр основных загрязняющих органических соединений. Из образцов почв выделены бактериальные штаммы, способные использовать в качестве ростового субстрата моно-, полиароматические углеводороды и галогензамещенные ароматические карбоновые кислоты. Изолированные бактерии-деструкторы отнесены к родам Deinococcus, Cellulo-monas, Micrococcus, Pianococcus и Pseudomonas.
В настоящее время в окружающую среду выбрасывается большое количество чужеродных для природы органических соединений. К числу наиболее распространенных среди этой группы веществ относятся галогенированные производные бензола, бензойной и салициловой кислот, фенола и бифенила, а также их незамещенные формы. Промышленное производство таких веществ составляет сотни тысяч тонн в год. Они широко используются при изготовлении пластификаторов, смазочных средств, пестицидов, гербицидов, красок, лаков, клеев (Федоров, 1993; Ревелль, Ревелль, 1995). Следует отметить, что галогензамещенные синтетические ароматические вещества обладают уникальными физическими и химическими свойствами (устойчивость к действию высоких температур, кислот, щелочей и т.д.), обусловливающими их высокую стабильность и сопротивляемость действию естественных деструктивных факторов. Характерной особенностью соединений ароматического ряда является способность к биоаккумуляции и увеличению их концентрации в организме животных при продвижении по трофическим цепям (Пурмаль, 1998; Воронов, Сидоров, 1999). Накопление таких соединений в органах и тканях животных и человека приводит к развитию онкологических и других заболеваний (Воронов, Сидоров, 1999; Кулинский, 1999; Parkinson, Safe, 1987). В связи с этим проблема очистки территорий, загрязненных синтетическими ароматическими веществами и их галогенпроизводными, приобрела в настоящее время особую актуальность.
В результате многолетних исследований, проводившихся учеными разных стран, становится очевидным, что наиболее эффективным для детоксикации соединений данного класса является биологическое разрушение с использованием микроорга- низмов-деструкторов. Разработка методов биоремедиации загрязненных территорий с использованием природных микроорганизмов позволяет решать проблему санации таких районов без энергоемких и высокозатратных операций, включающих механические, физические и химические методы (Звягинцев, 1995; Alexander, 1999; Margesin, Schinner, 2001; Dua et al., 2002).
В настоящее время ведется активный поиск новых штаммов микроорганизмов, способных без дополнительной селекции и генетической модификации разрушать синтетические ароматические соединения и их галогенпроизводные. Следует отметить, что использование микроорганизмов с подобными свойствами перспективно в районах складирования отходов различных химических производств. В нашей работе для поиска микроорганизмов, обладающих деструктивной активностью в отношении ряда ароматических соединений, была выбрана территория, на которой размещаются отходы производства ОАО “Галоген” (г. Пермь). Основной продукцией предприятия являются фторированные, хлорированные и бронированные органические и неорганические соединения.
Цель настоящей работы - поиск и изучение микроорганизмов, способных разлагать ароматические углеводороды и их галогенпроизводные.
Материалы и методы исследования
Почвенные образцы
Образцы почвы были отобраны на территории химического производства: 1 - в районе действующего отстойника (склад № 1), 2 - на территории с захоронениями 10-летнего возраста (склад № 2), 3 -
на территории с захоронениями отходов 20-летнего возраста (склад № 3), 4 - в котловане с двухгодичными захоронениями отходов йодобромного производства (склад № 4). Почвенные образцы отбирали в летний период 2004 г. с глубины 5-10 см и помещали в стерильные плотно закрывающиеся емкости.
Анализ химического загрязнения почв
Почвенные образцы были проанализированы на содержание химических примесей. 10 г почвы помещали в колбу с плотно притертой крышкой и вносили 5 мл стерильной дистиллированной воды. Экстракцию проводили дважды смесью концентрированной H2SO4 : 12.5% SDS : гексан в соотношении 1:10:25 при 37°С в течение 60 мин на шейкере при 100 об/мин с последующим отбором и объединением гексановой фракции. Остаточную воду удаляли внесением безводного сульфата натрия.
Анализ почвенных экстрактов проводили на газовом хроматографе (Agilent Technology, GC6890N) с масс-селективным детектором (Agilent Technology, MSD5973N) и кварцевой капиллярной колонкой HP-5MS SN US15189741-1 (длинна 30 м, диаметр 0.25 мм) при программировании температуры от 150 (1 мин) до 165°С со скоростью 1.5°С/мин и далее до 225°С со скоростью подъема температуры 3°С/мин (Hernandez et al., 1997). Газ-носитель - гелий (1 мл/мин), температура испарителя 230°С. Величина пробы 0.2 мкл.
Накопительные культуры
Микроорганизмы, исследуемые в настоящей работе, были получены методом накопительных культур. Для этого образцы почвы (10 г) помещали во флаконы с 50 мл минеральной среды KI (Zaitsev et al, 1991). Накопительные культуры различались источниками углерода. В качестве единственного источника углерода и энергии использовали бифенил, 2-хлорбензоат (2ХБК), 3-фторбензоат (ЗФБК), 2,6-дифторбензоат (2,6ФБК) или 3,5-дибром-салицилат (3,5-БрСал) в концентрации 1 г/л. Инкубацию проводили в течение 2 месяцев при 28°С.
Отбор чистых культур бактерий
Из полученных накопительных культур путем высева на агаризованную среду К1 с соответствующим субстратом выделяли чистые культуры бактерий. Чистоту культур контролировали высевом на агаризованную полноценную среду (10 г/л NaCI, 10 г/л триптона и 5 г/л дрожжевого экстракта, pH 7.0). Изолированные бактериальные штаммы получили обозначение “G” (табл. 1).
Определение таксономического положения . изолированных штаммов
Морфологические, физиологические и биохимические признаки микроорганизмов изучали по общепринятым методикам (Методы общей бакте риологии, 1983; Методы почвенной микробиологии и биохимии, 1991). Хемотаксономические признаки изучали по описанным ранее методикам (Chemical methods in bacterial systematic, 1985; Evtushenko et al., 2000). Идентификацию бактериальных штаммов-деструкторов проводили по «Определителю бактерий Берджи» (1997).
Определение субстратной специфичности
Субстратную специфичность выделенных штаммов изучали путем культивирования на агари-зованной и в жидкой минеральной среде К1 при 28’С. В качестве единственного источника углерода и энергии использовали бензол, бифенил, нафталин, фенол, толуол и ряд карбоновых кислот: бензойную, салициловую, иорп-оксибензойную, протока-теховую, 2,4-дихлорфеноксиуксусную (2,4-Д), ор- mo-фталевую, 2ХБК, 3-хлорбензойную (ЗХБК), ЗФБК, 4-хлорбензойную (4ХБК), 2,4-дихлор-бензойную (2,4ХБК), 2,6ФБК и 3,5-БрСал. Концентрация субстратов в жидкой ростовой среде составляла 1 г/л. При выращивании микроорганизмов на агаризованных средах нафталин, бифенил, фенол, бензол, толуол добавляли на крышку чашки Петри. Появление роста бактерий свидетельствовало об использовании субстрата.
Статистическая обработка результатов
Все эксперименты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel, SigmaPlot 7.0.
Результаты и обсуждение
Образцы почвы и их характеристика
На территории размещения отходов производства было отобрано 16 образцов почв. Для отбора проб было выбрано четыре склада: в трёх из них в разное время были захоронены фторированные и хлорированные органические и неорганические соединения, а на складе № 4 размещались отходы производства йодированных и бромированных органических веществ.
В образцах почв, отобранных на территории склада № 1, обнаружено присутствие различных органических соединений, как-то: алифатические, циклические, галогенароматические и ароматические углеводороды, алифатические спирты и эфиры (рис. 1). Доминирующими по уровню загрязнения являются циклические и галогенароматические углеводороды (62.14% и 24.08% соответственно). В образцах почв, отобранных на территории склада № 2, галогенароматические углеводороды не обнаружены (рис. 1). Основную часть среди выявленных веществ составляют циклические и алифатические углеводороды (74.92% и 17.03% соответственно).
Анализ образцов почв со склада № 3 показал наличие четырех классов органических соединений (рис. 1). Доминирующими также являются циклические углеводороды (87.13%), при этом ароматические и галогенароматические соединения отсутствуют. Таким образом, несмотря на одинаковый начальный спектр загрязнения всех описанных проб почвы, химический анализ показал исчезновение органических загрязнителей отдельных классов с течением времени.
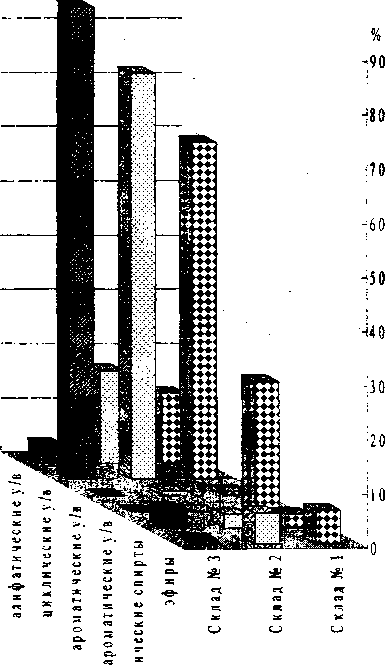
Рис. 1. Содержание органических загрязнителей в почвенных пробах с территории складирования отходов химического производства
Образцы почв, отобранные с территории склада № 4, по составу химических веществ отличались от вышеописанных проб почв (рис. 2). Наряду с алифатическими, ароматическими и галогена-роматическими углеводородами, обнаруженными в почвенных пробах действующего отстойника отходов (склад № 1), масс-спектрометрический анализ показал присутствие галогеналифатических углеводородов, алифатических спиртов и карбоновых кислот. Основная доля загрязнения приходится на циклические и галогенароматические углеводороды (38.08% и 37.06% соответственно).
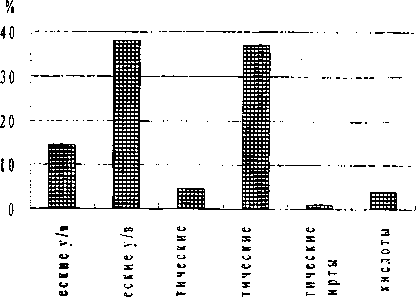
Рис. 2. Содержание органических загрязнителей в почвенных пробах со склада отходов йодобромного производства
Анализ полученных результатов показал, что во всех пробах почв среди загрязняющих веществ преобладают циклические углеводороды, а в образцах, отобранных в месте размещения отходов йодобромного производства и на территории действующего склада отходов производства фторированных и хлорированных соединений, значительную долю составляют галогенароматические углеводороды.
Накопительные и индивидуальные культуры бактерий
На минеральной среде К1 были поставлены накопительные культуры. В качестве селективного фактора использовали соединение, являющееся основным источником углерода и энергии (табл. 1).
Микробный рост в большинстве случаев был характерен для накопительных культур, содержащих образцы почв “свежих” захоронений промышленных отходов (склад № 1 и № 4), и отсутствовал в накопительных культурах с почвами, отобранными на территории склада № 3 (возраст размещения отходов 20 лет). Для дальнейшего изучения и выделения чистых культур бактерий-деструкторов отобрано 9 накопительных культур.
В результате проведенных исследований выделено 37 чистых бактериальных культур, способных использовать в качестве единственного источника углерода и энергии 2ХБК, ЗФБК, 2,6ФБК, 3,5БрСал и бифенил (табл. 1). Следует отметить, что наблюдалась зависимость количества выделенных бактериальных штаммов от возраста складирования отходов химического производства в месте отбора образцов почвы. Наибольшее количество штаммов изолировано из накопительных культур с почвенными образцами со склада № 1 (действующий склад), тогда как из накопительных культур, содержащих образцы почвы со склада № 2
(размещение отходов прекращено десять лет назад), изолировано лишь три штамма-деструктора. На основании полученных данных можно предположить, что удаление из почв отдельных классов загрязняющих веществ приводит в дальнейшем к элиминации из микробного сообщества почв штаммов-деструкторов данных соединений. Интересно отметить, что бактерии, способные использовать 3,5БрСал в качестве ростового субстрата, были селектированы только из накопительных культур, содержащих почвы, загрязненные отходами йодо/бромного производства.
Таблица 1
|
Штаммы бактерий, выделенные из накопительных культур |
|||
|
Пробы почвы |
Субстрат выделения |
Штаммы |
|
|
грамотрицательные |
грамполо-жительные |
||
|
о |
2ХБК |
G112, G113 |
0111 |
|
ЗФБК |
G120 |
0121,0122, 0123, 0124, 0125,0126 |
|
|
2,6ФБК |
G106, G107 |
0101,0102, 0103,0105, |
|
|
3,5БрСал |
— |
||
|
бифенил |
G127, G128, 0129, G132, G133,G134 |
—• |
|
|
§ и |
2ХБК |
— |
|
|
ЗФБК |
— |
— |
|
|
2,6ФБК |
— |
0104 |
|
|
3,5БрСал |
— |
||
|
бифенил |
G130, G131 |
— |
|
|
£ о |
2ХБК |
— |
— |
|
ЗФБК |
— |
||
|
2,6ФБК |
— |
||
|
3,5БрСал |
— |
— |
|
|
бифенил |
— |
||
|
м- 5 о |
2ХБК |
— |
0108,0109, ОНО |
|
ЗФБК |
— |
— |
|
|
2,6ФБК |
— |
— |
|
|
3,5БрСал |
G114, G117, 0119 |
G115,6116, 0118 |
|
|
бифенил |
G135,G137 |
0136 |
|
Примечание. “—” - штаммы на данном субстрате не выделены.
Для дальнейшего исследования было отобрано 14 чистых бактериальных культур, наиболее активно растущих на субстратах выделения, среди которых пять (штаммы G101, G104, 0105, G106, G107) изолированы из накопительных культур с 2,6ФБК, пять (штаммы G108, G109, G110, 0112, 0113)- с 2ХБК, три (штаммы G120, G125, G126) -с ЗФБК и один (штамм G118) - с 3,5БрСал.
Идентификация бактерий-деструкторов
Установлено, что из отобранных штаммов бактерий большинство (10 штаммов) является грам-положительными, а к грамотрицательным микроорганизмам относятся только 4 штамма.
Грамотрицательные штаммы G106, G107, 0112 и G113 имеют круглые, палевые, выпуклые, блестящие колонии. Клетки имеют форму прямых палочек с закругленными концами. Для всех штаммов характерно образование желто-зеленого флюоресцирующего пигмента. Штаммы обладают метаболизмом чисто дыхательного типа, оксидазо-и каталазоположительные, уреазо- и амилазоотрицательные, хемоорганотрофы, в органических факторах роста не нуждаются. Индол и сероводород не образуют, денитрификацию не осуществляют. На основании морфологических и физиолого-биохимических особенностей штаммы отнесены к роду Pseudomonas. Штаммы G106, 0112 и G113 осуществляют разжижение желатины и восстанавливают нитрат до нитрита, что позволяет отнести их к виду Р. fluorescens. Штамм G107 идентифицирован как Р. putida, так как не разжижает желатину и не восстанавливает нитрат.
Четыре грамположительных штамма (G101, G104, G108, G125) отнесены к роду Deinococcus. Клетки штаммов сферические, расположены в парах или тетрадах; неподвижные, неспорообразующие. Колонии от оранжевых до красных, круглые, выпуклые, не прозрачные. Аэробы, хемоорганотрофы, метаболизм чисто дыхательного типа, углеводы не используют. Каталазо- и оксидазоположительные, уреазо- и амилазоотрицательные. Индол и сероводород не образуют, желатину не разжижают, денитрификацию не осуществляют. Штаммы G101, G108 и G125, в отличие от штамма 0104, не восстанавливают нитрат до нитрита.
Клетки штаммов G105, G109, G120 и G126 окрашиваются по Граму положительно и представлены кокками, расположенными в парах, тетрадах или скоплениях неправильной формы, но не в цепочках. На полноценной среде формируют круглые колонии желтого цвета. Аэробы, метаболизм дыхательного типа. Каталазо- и оксидазоположительные. Растут в присутствии 5% NaCl. Анализ полученных данных дает основание предварительно отнести штаммы к роду Micrococcus.
Грамвариабельный штамм G110 представлен сферическими клетками, одиночными или в парах. Формирует круглые выпуклые колонии желтооранжевого цвета. Аэроб, хемоорганотроф, метаболизм дыхательного типа. Каталазоположительный, оксидазоотрицательный. Нитрат до нитрита не восстанавливает, желатину не гидролизует. Глюкозу не использует, индол и сероводород не образует. Активно растет на полноценной среде с 5% NaCl и плохо - на среде с содержанием NaCl менее 1%. На основании изученных признаков штамм может быть отнесен к роду Pianococcus.
Грамположительный штамм G118 идентифицирован как Cellulomonas sp. ■ Молодая культура состоит из тонких палочек, иногда сгруппированных в пары V-образной конфигурации. Мицелий не образует. На полноценной среде формирует желтые, выпуклые, блестящие, непрозрачные колонии. Аэроб, хемоорганотроф, обладает дыхательным и бродильным типами метаболизма. Ка-талазо- и оксидазоположительный. Целлюлолитический, восстанавливает нитрат до нитрита. Физиологические, биохимические и хемотаксономи-ческие признаки штамма соответствуют признакам рода Cellulomonas.
Таким образом, изолированные и отобранные для дальнейшего изучения штаммы-деструкторы по результатам предварительной идентификации являются представителями родов: Deinococcus, Cellulomonas, Micrococcus, Pianococcus и Pseudomonas. Работа по уточнению родовой и видовой принадлежности штаммов будет продолжена.
Анализ субстратной специфичности изолированных штаммов бактерий
Выделенные и идентифицированные бактериальные штаммы были проверены на способность использовать в качестве ростового субстрата ряд ароматических и полиароматических соединений (табл. 2).
Таблица 2
Рост штаммов на ароматических углеводородах
|
2 i 3 |
Субстрат |
||||
|
о 01 Я |
§ Я ID |
я св Я |
п о я |
о о |
|
|
G 126 |
++++ |
++++ |
++++ |
++++ |
++++ |
|
G 110 |
++++ |
++++ |
++++ |
++++ |
++++ |
|
G 104 |
++++ |
++++ |
++++ |
++ |
++++ |
|
G 120 |
++++ |
++++ |
++++ |
++ |
++++ |
|
G 109 |
++++ |
+++ |
+++ |
+ |
++++ |
|
G 118 |
++++ |
++ . |
++ |
++ |
++++ |
|
G 125 |
++++ |
+ |
++ |
++++ |
+++ |
|
G 108 |
++ |
+ |
+ |
+++ |
++ |
|
G 105 |
+4- |
+ |
+ |
+ |
++ |
|
G 107 |
++ |
+ |
— |
++ |
++++ |
|
G 101 |
++ |
+ |
— |
+ |
+ |
|
G 106 |
+ |
+ |
— |
+ |
|
|
G 112 |
— |
— |
— |
+ |
++ |
|
G 113 |
— |
— |
— |
+ |
+ |
Примечание. “+ - ++++” - активность роста штаммов, ” - роста нет.
Установлено, что штаммы Deinococcus sp. G104, G125, G108, Micrococcus sp. G126, G120, G109, G105, Cellulomonas sp. G118. и Pianococcus sp. G110 используют в качестве ростового субстрата бензол, бифенил, нафталин, фенол и толуол. Наиболее ак тивно на всех вышеперечисленных соединениях растут штаммы Micrococcus sp. G126 и Pianococcus sp. G110. В то же время некоторые из исследуемых штаммов оказались не способны расти на одном или нескольких ароматических субстратах (табл. 2). Так, штаммы Deinococcus sp. G101 и Р. putida G107 не используют в качестве источника углерода и энергии нафталин, штамм P.fluorescens G106 - фенол и нафталин, а штаммы P.fluorescens G112 и G113 - бензол, бифенил и нафталин.
Полученные результаты позволяют предположить, что исследуемые бактериальные штаммы обладают ферментативными системами, обеспечивающими разложение моно- и полиароматических соединений. Способность девяти штаммов расти на бифениле, нафталине, бензоле и толуоле, вероятно, обусловлена широкой субстратной специфичностью ферментов диоксигеназной атаки ароматического кольца, в частности бифенил диоксигеназы (Barriault, Sylvestre, 1999; Baldwin et al., 2000). Ферментативной активностью бифенил диоксигеназы может быть обусловлена и способность штаммов Р. putida G107, Deinococcus sp. G101 и P. fluorescens G106 использовать как ростовой субстрат бензол, толуол и бифенил, но не нафталин (Suenaga et al., 2001). Диоксигеназные ферментативные системы штаммов Р. fluorescens G112 и СИЗ не проявляют активности к незамещенным ароматическим соединениям, но способны окислять толуол. Рост изучаемых штаммов, за исключением P.fluorescens G106, на феноле позволяет сделать предположение о функционировании у данных штаммов фенол гидроксилазы, осуществляющей окисление фенола до катехола (Shingler et al., 1993).
В таблице 3 приведены результаты изучения способности выделенных штаммов использовать в качестве единственного источника углерода и энергии ряд ароматических карбоновых кислот. Показано, что шесть штаммов способны расти на всех предложенных кислотах.
Анализ полученных результатов позволяет сказать, что среди изолированных штаммов-деструкторов наиболее распространены ферментативные системы разложения бензойной и орто фталевой кислот (табл. 3). Напротив, катаболитные системы, специфичные к салициловой кислоте, встречаются значительно реже, поскольку семь из четырнадцати исследуемых бактериальных штаммов не используют данную кислоту в качестве ростового субстрата (табл. 3). Выделенные штаммы, за исключением Deinococcus sp. G101, Micrococcus sp. G105, P. fluorescens G112 и G113, растут на бензойной, иа/ш-оксибензойной и про-токатеховой кислотах, что позволяет предположить наличие в описываемых штаммах ферментативных систем, обеспечивающих разложение не только бензойной кислоты, но и ее галогенпроиз-водных (Карасевич, 1982; Уткин и др., 1991).
Таблица 3
Рост штаммов на ароматических кислотах
|
1 3 |
Субстрат, кислота |
||||
|
3 О Д ю |
5 « о S EI S |
>3 о в S О & § X |
5 № О о о |
5 И • 1 6 S §;..... |
|
|
G 104 |
-н-н- |
++++ |
++++ |
++++ |
++++ |
|
G 118 |
44 |
++++ |
++++ |
++++ |
4444 |
|
G 109 |
+++ |
444 |
444 |
44 |
++ |
|
G 126 |
++ |
44 |
++ |
+++ |
+++ |
|
G 120 |
++ |
+4- |
+++ |
+ |
++ |
|
G ПО |
++ |
4 |
++ |
+++ |
++++ |
|
G 107 |
++++ |
++++ |
++++ |
+ |
+ |
|
G 125 |
+++ |
— |
++ |
+ |
++ |
|
G 108 |
44 |
+ |
+ |
+ |
|
|
G 106 |
++++ |
— |
+ |
+ |
++ |
|
G 101 |
++++ |
— |
— |
+ |
|
|
G 105 |
++++ |
— |
— |
— |
+ |
|
G 113 |
+ |
— |
— |
— |
+ |
|
G 112 |
+ |
— |
— |
— |
— |
Примечание. “+ - ++++” - активность роста штаммов, “—” - роста нет.
На полученных данных о спектре загрязнения образцов почв, послуживших источником выделения штаммов-деструкторов (рис. 1, 2), и результатах культивирования бактерий на ароматических соединениях (табл. 1, 2, 3) была изучена способность отобранных штаммов расти на фторированных и хлорированных бензойных кислотах, а также на бромзамещенной салициловой и дихлорза-мещенной феноксиуксусной кислотах (табл. 4).
Установлено, что штаммы Micrococcus sp. G120, G126, Pianococcus sp. G110 и Deinococcus sp. G104 наиболее эффективно используют в качестве ростового субстрата орто-, мета-, пара-, моно- и дизамещенные бензоаты и салицилат. Штаммы Deinococcus sp. G101 и Micrococcus sp. G109 проявляют более низкую активность, но также способны расти на использованных в работе галогенпроизводных бензоата и салицилата. Девять штаммов оказались не способны использовать в качестве источника углерода и энергии одну или несколько галогензамещенных ароматических кислот (табл. 4). Интересно отметить, что среди мо-нозамещенных бензоатов наиболее труднодоступным субстратом для выделенных бактерий являются .мета-производные (ЗХБК, ЗФБК), а среди дизамещенных галогенированных кислот - 2,4-Д. Четких закономерностей между расположением заместителей в молекулах бензойной, салициловой и феноксиуксусной кислот и деструктивной активностью исследуемых штаммов не выявлено.
Таблица 4
Рост штаммов на галогензамещенных ароматических кислотах
|
S 2 св § G 120 |
Субстрат |
|||
|
2ХБК +++ |
ЗХБК +++ |
4ХБК ++++ |
2,4ХБК +++ |
|
|
G ПО |
+++ |
++ |
++++ |
++++ |
|
G 126 |
+++ |
4444 |
++++ |
|
|
G 104 |
44 |
+++ |
++ |
++ |
|
G 125 |
+ |
++ |
+ |
++ |
|
G 101 |
++ |
+ |
++ |
+ ■ |
|
G 109 |
44 |
+ |
++ |
— |
|
G 107 |
+ |
+ |
++++ |
44 |
|
G 108 |
+ |
— |
++ |
+ |
|
G 106 |
— |
+ |
+ |
—. |
|
G 118 |
— |
+++ |
— |
|
|
G 105 |
— |
+ |
+ |
— |
|
G 113 |
+ |
—. |
— |
— |
|
G 112 |
+ ЗФБК |
2,6ФБК |
3,5БрСал |
2,4-Д |
|
G 120 |
++++ |
++++ |
++++ |
+++ |
|
G ПО |
++++ |
++++ |
++++ |
44 |
|
G 126 |
++++ |
++++ |
4444 |
444 |
|
G 104 |
++++ |
4444 |
++++ |
++++ |
|
G 118 |
++++ |
++++ |
++++ |
++++ |
|
G 125 |
++ |
++ |
++++ |
44 |
|
G 109 |
444 |
444 |
444 |
+++ |
|
G 101 |
444 |
+ |
+++ |
— |
|
G 107 |
— |
+ |
—— |
— |
|
G 108 |
+ |
— |
+ |
— |
|
G 106 |
+ |
+ |
444 |
— |
|
G 105 |
— |
+ |
— |
|
|
G ИЗ |
—•• |
— |
||
|
G 112 |
— |
— |
— |
|
Примечание. “+ - ++++” - активность роста штаммов, “—” - роста нет.
Таким образом, среди выделенных и описанных в настоящей работе бактериальных штаммов наиболее широкой субстратной специфичностью по отношению к различным ароматическим углеводородам обладают штаммы Deinococcus sp. G104, G125, Micrococcus sp. G120, G125, G126, Pianococcus sp. G110, Cellulomonas sp. G118. Напротив, штаммы P. fluorescens G112 и G113, выделенные на 2ХБК, используют в качестве ростового субстрата узкий спектр моноароматических соединений (четыре и пять, соответственно, из восемнадцати исследованных в работе веществ).
Заключение
Известно, что на техногенных территориях процесс селекции организмов с новыми признаками идет значительно активнее, чем в естественных условиях. Следовательно, для поиска новых бак- териальных штаммов-деструкторов целесообразнее использовать почвы, подверженные загрязнению отходами химических производств.
В настоящей работе исследованы образцы почв, отобранные на территориях размещения отходов производств галогенированных органических и неорганических соединений. Установлено, что в почвенных образцах присутствуют загрязняющие вещества различных классов органических соединений, при этом с увеличением возраста складирования промышленных отходов количественный и качественный состав чужеродных химических веществ в почвах значительно изменяется и происходит снижение уровня поллютантов. Полученные результаты позволили предположить наличие в данных почвах микрофлоры, участвующей в процессах разложения соединений техногенного происхождения.
Методом накопительных культур из образцов почв выделены штаммы бактерий-деструкторов, предварительно отнесенные к родам Deinococcus, Cellulomonas, Micrococcus, Pianococcus и Pseudomonas. Большинство выделенных штаммов проявляют деструктивную активность по отношению к широкому спектру галогенированных и незамещенных моно- и полиароматических соединений. Наиболее интересными в плане субстратной специфичности являются грамположительные штаммы Deinococcus sp. G104, G125, Micrococcus sp. G120, G125, G126, Pianococcus sp. G110. Установлено, что большинство активных штаммов изолировано из почв действующих складов производственных отходов. По-видимому, микрофлора данных почв испытывает наибольшее влияние техногенных факторов и отбор действует в пользу штаммов бактерий с новыми деградативными свойствами.
Таким образом, выделенные и описанные нами бактериальные штаммы являются перспективными для использования в технологиях биоремедиации районов, загрязненных комплексом галогензаме-щенных и незамещенных синтетических ароматических соединений.
Работа поддержана грантом РФФИ-Урал № 04-04-96042.
Список литературы Почвенные микроорганизмы, разлагающие ароматические углеводороды и карбоновые кислоты
- Воронов В. В., Сидоров Р. А. Мутагенные контаминанты окружающей среды//Вести, новых мед. технологий. 1999. Т. 6, Ш 2. С. 134-142.
- Звягинцев Д. Г. Конференция "Интродукция микроорганизмов в окружающую среду"//Микробиология. 1995. Т. 64. С. 141-142.
- Карасевич Ю. Н. Основы селекции микроорганизмов, утилизирующих синтетические органические соединения. М.: Наука, 1982. 144 с.
- Кулинский В. И. Обезвреживание ксенобиотиков//Сорос, образоват. журн. 1999. № 1. С. 8-12.
- Методы общей бактериологии/Под ред. Ф. Гер-хардт и др. М.; Мир, 1983. Т. 1-3.
- Методы почвенной микробиологии и биохимии: Учеб. пособие/Под ред. Звягинцева Д. Г. М.: Изд-воМГУ, 1991.304 с.
- Определитель бактерий Берджи: Пер. с англ./Под. ред. Дж. Хоулта, Н. Крита, П. Снита, Дж. Стейли, С. Уильямса. М.: Мир, 1997. Т. 1-2.
- Пурмаль А. П. Антропогенная токсикация планеты//Сорос, образоват. журн. 1998. № 9. С. 46-51.
- Ревелль П., Ревелль Ч. Среда нашего обитания: В 4-х кн.: Пер. с англ. М.: Мир, 1995.
- Рыбкина ДО., Плотникова Е.Г. Характеристика штамма Р25 -деструктора полихлорированных бифенилов//Биология -наука XXI века: Материалы 6-й Пущинской школы-конф. мол. ученых. Пушино, 2002. С. 56.
- Рыбкина Д. О., Плотникова Е.Г., Дорофеева Л.В., Мироненко Ю.Л., Демаков В.А. Новый аэробный грамположительный микроорганизм с уникальными свойствами деструкции орто-и пара-хлорированных бифенилов//Микробиология. 2003. Т. 72, №. 6. С. 759-765.
- Уткин И. Б., Якимов М. М., Козляк Е. И., Рогожин И. С. Деструкция токсичных органических соединений микроорганизмами//Итоги науки и техники ВИНИТИ. Сер. Биол. химия. 1991. Т. 43. С. 1-100.
- Федоров Л. А. Диоксины как экологическая опасность: ретроспектива и перспективы. М.: Наука, 1993.266 с.
- Alexander М. Biodegradation and bioremediation, 2"'' edn. London: Academic Press, 1999.
- Baldwin B. R., Mesarch M. В., Nies L. Broad substrate specificity of naphthalene and biphenyl-utilizing bacteria//Appl. Microbiol. Biotechnol. 2000. Vol. 53. P. 748-753.
- Barriault D., Sylvestre M. Functionality of biphenyl 2,3-dioxygenase components in naphthalene 1,2-dioxygenase II Appl. Microbiol. Biotechnol. 1999. Vol. 51. P. 592-597.
- Chemical Methods in Bacterial Systematic. M. Goodfellow & D.E. Minnikin (eds). London: Academic Press. 1985.412 р.
- DuaM. Singh A., Ssethunathan N. Johri A.K. Biotechnology and bioremediation: successes and Umitations II Appl. Microbiol. Biothechnol. 2002. Vol. 59. P. 143-152.
- Evtushenko L. I., Dorofeeva L. V., Subbotin S. A., Cole J. R., Tiedje J. M. Leifsonia poae gen. nov., sp. nov., isolated from nematode galls on Poa annua and reclassification of 'Corynebacterium aquaticum' Leifson 1962 as Leifsonia aquatica (ex Leifson 1962) gen. nov., nom. rev., comb. nov. and Clavibacter xyli Davis et al. 1984 with two subspecies as Leifsonia xyli (Davis et al. 1984) gen. nov., comb. nov. II Int. J. Syst. Evol. Microbiol. 2000. Vol. 50. P. 371-380.
- Hernandez B. S, Koh S.-C, Chial M.. Focht D. D. Teфene-utiИzing isolates and there relevance to phenyls in soil//Biodegradation. 1997. Vol. 8. P. 153-158.
- Margesin R., Schinner F. Biodegradation and bioremediation of hydrocarbons in extreme environments II Appl. Microbiol. Biotechnol. 2001. Vol. 56. P. 650-663.
- Parkinson A., Safe S. Mammalian biologic and toxic effects of PCBs II Environ. Toxin Series. 1987. Vol. 1 P. 49-60.
- Shingler v., Bartilson M., Moor T. Cloning and nucleotide sequence of the gene encoding the positive regulator (DmpR) of the fenol catabolic pathway encoded by pV 1150 and identification of DmpR as a member of the NtrC family of transcriptional activators II J. Bacteriol. 1993. Vol. 175. P. 1596-1604.
- Suenaga H., Mitsuoka M., lira Y., Watanabe Т., Furukawa K. Directed evolution of biphenyl dioxygenase: emergence of enhanced degradation capacity for benzene, toluene, and alkylbenzenes II J. Bacteriol. 2001. Vol. 183. P. 5441-5444.
- Zaitsev G.M., Tsoi T.V., Grischenkov V.G., Plotnibva E.G., Boronin A.M. Genetic control of degradation of chlorinated benzoic acids in Arthrobacter globiformis, Corynebacterium sepedonicum and Pseudomonas cepacia strains II FEMS Microbiol. Lett. 1991. Vol. 81. P. 171-176.


