Подбор информативных праймеров и оптимальных условий ПЦР для проведения ssr-анализа геномной ДНК сои селекции АОС ВНИИМК
Автор: Гучетль С.З., Фролов С.С., Кузнецова Е.С.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 3 (175), 2018 года.
Бесплатный доступ
Одной из возможностей развития соевой отрасли в России является внедрение в селекционные программы современных биотехнологических подходов, основанных на использовании молекулярных маркеров. Так, для изучения генетического разнообразия информативным, воспроизводимым и сравнительно недорогим классом ДНК-маркеров являются микросателлитные (SSR) маркеры. Сорта сои АОС ВНИИМК не были исследованы по ДНК локусам. Необходимо было провести поиск SSR-праймеров, выявляющих полиморфизм фракций ДНК и оптимизацию температурных режимов амплификации ДНК для создания системы молекулярных маркеров для идентификации и паспортизации сортов, линий и гибридов сои селекции АОС ВНИИМК. Материалом для исследования служили пять сортов сои коллекции АОС ВНИИМК и один сорт коллекции ВНИИМК. Геномную ДНК выделяли из семядольных листьев этиолированных проростков сои с использованием СТАВ буфера. Для 16 пар SSR-праймеров подобраны оптимальные температуры отжига. Они варьировали от 48 до 60 оС...
Соя, сорта, днк, микросателлитные локусы
Короткий адрес: https://sciup.org/142216733
IDR: 142216733 | УДК: 633.853.52:631.522 | DOI: 10.25230/2412-608X-2018-3-175-28-33
Текст научной статьи Подбор информативных праймеров и оптимальных условий ПЦР для проведения ssr-анализа геномной ДНК сои селекции АОС ВНИИМК
One of the possibilities to develop the soybean production branch in Russia is introduction of the modern biotechnological approaches using molecular markers into the breeding programs. Thus, microsatellite (SSR) markers are informative, replicable and relatively cheap class of DNA-markers to study genetic diversity of soybean. Soybean cultivars developed at the Armavirskaya experimental station were not studied by DNA-loci. We have to look for SSR-primers revealing polymorphism of DNA fractions and optimizing temperature regimes for DNA amplification to create a system of molecular markers for identification and certification of soybean cultivars, lines and hybrids developed at the Armavirskaya experimental station. As a research material we used five soybean cultivars from a collection of the Armavirskaya experimental station and a cultivar from VNIIMK collection. We isolated the genomic DNA from cotyledonary leaves of ethylized soybean seedlings using STAB-buffer. We found optimal temperatures of annealing for 16 pairs of SSR-primers. The temperatures varied from 48 to 60 оС. Two primers were not annealed with matric DNA at any temperatures. Four loci were monomorphic. Ten polymorphic loci revealed two alleles, except loci Satt 2 and Sat 36 with three alleles. A middle quantity of alleles per a locus was 2.2. A meaning of effective amount of alleles varied from 1.43 to 2.70 with middle value 1.82. PIC-meanings were from 0.30 to 0.63 with a middle value 0.43. The received meanings characterize polymorphism of studied samples from collection as middle. Some cultivars possess intravarietal polymorphism. Analysis of electrophoretic spectra of ten polymorphic microsatellite loci of soybean cultivars developed at the Armavirskaya experimental station showed unicity of each allele set. It allows using these loci for a molecular-genetic certification of soybean cultivars.
Введение. Соя (Glycine max L. Merrill) является важной зернобобовой культурой в мире, обладающей комплексом ценных свойств. Благодаря разнообразному химическому составу соя широко используется как продовольственная, кормовая и техническая культура. В сырьевых ресурсах мирового производства растительных масел соя занимает первое место среди всех масличных культур, а по сборам белка лидирует среди зерновых и зернобобовых культур. Она выращивается на всех континентах более чем в 90 странах мира. В России за период с 2000 по 2015 гг. объем импорта увеличился с 65 тыс. т до 2,05 млн т, или в 31,5 раз. Наращивание объемов свидетельствует о дефиците растительного белка. При этом Россия обладает существенными возможностями развития соевой отрасли [1; 2]. Одной из них является внедрение в селекционные программы современных биотехнологических подходов, основанных на использовании молекулярных маркеров. Оценка чистоты/идентичности сортового материала и генетического разнообразия современных сортов может способствовать их более широкому и эффективному применению в современных селекционных программах. Для этой цели обычно используют набор маркеров, выявляющих в геноме наибольшее число аллелей. Так, для исследования молекулярногенетического полиморфизма культурной сои различных эколого-географических зон были использованы три ПЦР-метода: ПП ПЦР, SSRP и ISSR. Наиболее эффективным для дифференциации генотипов культурной сои из данных методов показал себя ISSR-метод [3]. Для изучения генетического разнообразия информативным, воспроизводимым и сравнительно недорогим классом ДНК-маркеров являются микросателлитные (SSR) маркеры. Они воспроизводимы, имеют высокий уровень полиморфизма, кодоминантны, могут быть легко обнаружены с помощью полимеразной цепной реакции (ПЦР) и обычно известна информация об их локализации. SSR-маркеры широко используются в изучении генетического разнообразия сои [4; 5; 6; 7], для идентификации гибридов F1 и определения их сортовой чистоты [8; 9]. Сорта сои АОС ВНИИМК не были исследованы по ДНК локусам. Но прежде чем использовать систему молекулярных маркеров в практических целях, необходимо ее тестировать на способность предсказывать фенотип на широком наборе сортов, изогенных линий, в различном генетическом окружении и в различных условиях окружающей среды [10; 11; 12]. Поэтому несмотря на наличие достаточно большого числа микросателитных маркеров, исследованных другими авторами [5; 6; 8], необходимо провести поиск SSR-праймеров, выявляющих полиморфизм фракций ДНК и оптимизацию температурных режимов амплификации ДНК с разными праймерами для сортов сои селекции АОС ВНИИМК. Цель данной работы: подбор информативных праймеров, оптимальных условий ПЦР и выявление стабильного, воспроизводящегося полиморфизма амплифицированных фрагментов ДНК для создания системы молекулярных маркеров для идентификации и паспортизации сортов, линий и гибридов сои селекции АОС ВНИИМК.
Материалы и методы. Материалом для исследования служили пять сортов сои коллекции АОС ВНИИМК: Мечта, Дуар, Весточка, Зара, Дуниза, и сорт Сла- вия коллекции ВНИИМК. Геномную ДНК выделяли из семядольных листьев этиолированных проростков сои с помощью модифицированного метода Saghai-Maroof et аl. [13] с использованием СТАВ буфера. Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5–3 мM MgCl2; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК. Амплификацию проводили в приборе Терцик (ДНК-технология, Россия). Использовали 16 SSR-локусов, большинство из которых разработаны и описаны Cregan et al. [14]. Электрофорез продуктов амплификации проводили в агарозном геле (2 % агароза, 1 × ТАЕ-буфер и 1 × SB буфер) с использованием камеры для горизонтального электрофореза (SE. 2, ДНК-технология, Россия) в течение 1–1,5 ч при силе тока 60 mA и напряжении 90– 200 V. Последующее окрашивание осуществляли бромистым этидием. Визуализация и документирование результатов электрофореза обеспечивались при помощи трансиллюминатора ECX-F20.M (WILBER LOURMAT, Франция) и фотоаппарата Canon EOS 550D (Япония).
Для обозначения аллельных вариантов использовали количество пар нуклеотидных оснований (пн) фрагмента ДНК. Определение размеров аллелей осуществляли визуально, относительно маркера молекулярной массы.
Индекс информационного полиморфного содержания (PIC) [15] и эффективное число аллелей (n e ) [16] вычисляли по формулам:
PICi=1-∑7=1рij2, ne=1/ ∑7=1рij2, где – Р частота j паттерна для локуса i и суммирование распространяется на n паттернов.
Результаты и обсуждение. Метод ПЦР основан на 3-этапном циклическом процессе, в результате которого многократно увеличивается количество специ-30
фического фрагмента ДНК. Каждый цикл ПЦР состоит из трех последовательных стадий: денатурация (94–96 оС); отжиг (гибридизация) праймеров (45–65 оС); полимеризация или элонгация (удлинение) цепи ДНК (68–72 оС). При проведении испытаний наиболее удовлетворительные результаты были получены при следующих температурно-временных режимах: начальная денатурация при 96 оС в течение 2 мин; затем 30 циклов при соблюдении температурно-временного режима: отжиг при 48–60 оС в течение 40 с, элонгация – 1 мин при 70 оС, денатурация при 94 оС – 30 с, финальная элонгация – 2 мин. Важным фактором, влияющим на эффективность и специфичность амплификации, является подбор оптимальных температур отжига праймеров (Tm) на матрице. Данная температура зависит от длины праймеров и их G-C-состава. Существуют формулы для расчета температуры отжига исходя из первичной структуры олигонуклеотидов. Однако ни одна формула не учитывает всех особенностей реакции, поэтому точное значение Tm определяют экспериментальным путем. В результате работы нами для 16 пар праймеров был произведен подбор оптимальной температуры отжига (табл. 1).
Таблица 1
Оптимальные температуры отжига для ПЦР анализа 16 пар праймеров микроса-теллитных локусов ДНК сои
Армавирская ОС ВНИИМК, 2018 г.
|
Название праймера SSR-локуса |
Оптимальная температура отжига (оС) |
|
Satt 2 |
60 |
|
Soyhsp 176 |
60 |
|
Sat 1 |
60 |
|
Satt 335 |
60 |
|
Satt 309 |
60 |
|
Satt 307 |
60 |
|
Satt 1 |
55 |
|
Satt 102 |
55 |
|
Satt 406 |
55 |
|
Satt 126 |
55 |
|
138ct04 |
50 |
|
Satt 5 |
50 |
|
Sat 36 |
50 |
|
Soypr 1 |
48 |
|
Sat 43 |
Нет отжига |
|
Satt 9 |
Нет отжига |
Температура отжига праймеров варьировала от 48 до 60 оС. Изменение Tm на несколько градусов позволяло минимизи- ровать количество неспецифических фракций ДНК (рис. 1).
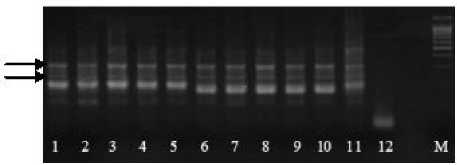
А
Б
Рисунок 1 – Электрофоретические спектры продуктов амплификации ДНК у сортов сои по локусу Soypr 1:
А – температура отжига 45 оС. Дорожки 1–5, 11 – сорт Зара; 6–10 – сорт Дуниза;
12 – отрицательный контроль. Стрелками обозначены неспецифические фракции ДНК; Б – температура отжига 48 оС. Дорожки 1–5 – сорт Весточка; 6–11 – сорт Дуар.
М – маркер молекулярной массы 100 пн.
Так, на рисунке 1А стрелками обозначены фракции ДНК, амплифицированные в результате неспецифического отжига праймеров локуса Soypr 1 на матрице. Увеличение температуры гибридизации на 3 оС (рис. 1Б) позволило получить четкие, преимущественно специфические фракции. Два праймера – Sat 43 и Satt 9 – не гибридизировались с матричной ДНК ни при одной температуре отжига.
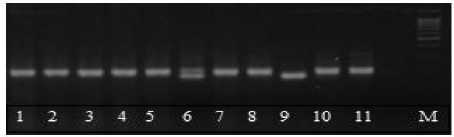
Для определения оптимального количества локусов с максимальным числом аллелей и хорошо читаемыми маркерными спектрами, проведены полимеразные цепные реакции с оставшимися 14 праймерами. Четыре локуса – 138ct04, Satt 335, Satt 307, Satt 102 – оказались мономорфными для данного набора сортов. Локус Soyhsp 176 отличал мономорфные по нему сорта селекции АОС ВНИИМК от сорта Славия селекции ВНИИМК. Количество аллелей для полиморфных локусов равнялось двум (рис. 2), за исключением локусов Satt 2 и Sat 36, у которых обнаружено по три аллеля (табл. 2, 3).
Таблица 2
Аллельные состояния 10 полиморфных микросателлитных локусов ДНК у сортов сои селекции АОС ВНИИМК
Армавирская ОС ВНИИМК, 2018 г.
|
Генотип |
Локус |
|||||||||
|
Satt 1 |
Satt 2 |
Satt 5 |
Sat 36 |
Soypr 1 |
Soyhsp 176 |
Sat 1 |
Satt 309 |
Satt 126 |
Satt 406 |
|
|
Мечта |
175 |
190 |
180 |
175 |
180 |
120 |
240 |
190 |
205 |
290 |
|
Дуар |
175 |
190 |
180 |
170 |
180 |
120 |
240 |
180 |
180 |
290 |
|
Весточка |
175 |
190 |
150 |
170 |
180 |
120 |
230 |
180 |
180 |
290 |
|
Зара |
175 |
185 |
150 |
170 |
180 |
120 |
230 |
180 |
205 |
290 |
|
Дуниза |
185 |
170 |
180 |
170 |
150 |
120 |
240 |
180 |
180 |
350 |
|
Славия |
185 |
185 |
180 |
180 |
180 |
150 |
230 |
180 |
205 |
290 |
Рисунок 2 – Электрофоретические спектры продуктов амплификации ДНК у сортов сои по локусу Satt 126: Дорожки: 1–5 – сорт Весточка; 6–10 – сорт
Дуар; 11–16 – сорт Зара.
М – маркер молекулярной массы 100 пн
Для определения дискриминационного потенциала использованной системы маркеров нами были рассчитаны также эффективное число аллелей и индекс полиморфного информационного содержания (PIC) (табл. 3).
Таблица 3
Показатели информативности SSR-локусов, использованных в работе
Армавирская ОС ВНИИМК, 2018 г.
|
Локус |
Наблюдаемое число аллелей |
Эффективное число аллелей |
PIC |
|
Satt 1 |
2 |
1,85 |
0,46 |
|
Satt 2 |
3 |
2,70 |
0,63 |
|
Satt 5 |
2 |
1,85 |
0,46 |
|
Sat 36 |
3 |
2,08 |
0,52 |
|
Soypr 1 |
2 |
1,43 |
0,30 |
|
Soyhsp 176 |
2 |
1,43 |
0,30 |
|
Sat 1 |
2 |
2,00 |
0,50 |
|
Satt 309 |
2 |
1,43 |
0,30 |
|
Satt 126 |
2 |
2,00 |
0,50 |
|
Satt 406 |
2 |
1,43 |
0,30 |
|
Среднее |
2, 2 |
1,82 |
0,43 |
Среднее число аллелей на локус составило 2,2. Значения эффективного числа ал- лелей варьировали от 1,43 у локусов Soypr 1, Soyhsp 176 и Satt 309 до 2,70 у Satt 2, со средним значением 1,82. Значения PIC находились в диапазоне от 0,30 у локусов Soypr 1, Soyhsp 176 и Satt 309 до 0,63 у Satt 2. Среднее значение индекса полиморфного информационного содержания для изученной группы генотипов – 0,43. Показатели информативности SSR-локусов для сортов селекции АОС ВНИ-ИМК несколько меньше полученных ранее для российских и казахских сортов сои [5; 9]. Но авторы изучали большее количество генотипов разного происхождения, что, вероятно, и определяет их разнообразие. Полученные нами величины характеризуют полиморфизм исследованных образцов коллекции как средний. Анализ электрофоретических спектров 10 полиморфных микросателлитных локусов ДНК сортов сои показал индивидуальность аллельного состава каждого из них. Кроме того, мы отметили, что несколько сортов обладали внутрисортовым полиморфизмом. Поскольку соя является самоопыляющейся культурой, предполагается, что культивируемые сорта генетически однородны. Тем не менее имеют место исключения. Так, анализ микроса-теллитных последовательностей ДНК показал, что некоторые сорта сои селекции ВНИИМК генетически неоднородны [9; 17]. Также был исследован внутрисорто-вой полиморфизм сортов сои казахской селекции. Выявлены как полная моно-морфность, так и полиморфизм сортов по вовлеченным в анализ SSR-маркерам [5]. Из изученных сортов сои селекции АОС ВНИИМК внутрисортовой полиморфизм по некоторым маркерам показали сорта Мечта, Дуар и Дуниза. Например, у сорта Дуар (рис. 1Б: дорожки 6–11) по локусу Soypr 1 обнаружены генотипы гетерозиготные (рис. 1Б: дорожка 6) и гомозиготные с различающимися аллелями (рис. 1Б: дорожки 7–11). Гетерогенность по одному-двум микросателлитным локусам ДНК допустима для коммерческих сортов сои, так как данные локусы в основном являются некодирующими участками ДНК и не влияют на агротехнические характеристики сорта.
Заключение. Таким образом, в результате проведенных исследований выявлено, что из 16 использованных SSR-локусов два локуса не гибридизируются с матрицей ДНК. Для 14 микросателлитных праймеров подобраны оптимальные условия ПЦР. Десять пар праймеров для ПЦР выявляют стабильный, воспроизводящийся полиморфизм фракций амплифицирован-ной ДНК, что позволяет использовать их для молекулярно-генетической паспортизации сортов сои.
Список литературы Подбор информативных праймеров и оптимальных условий ПЦР для проведения ssr-анализа геномной ДНК сои селекции АОС ВНИИМК
- Кривошлыков К.М., Рощина Е.Ю. Современные тенденции рынка сои в мире и России//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2016. -Вып. 2 (166). -С. 68-72.
- Зайцев Н.И., Бочкарёв Н.И., Зеленцов С.В. Перспективы и направления селекции сои в России в условиях реализации национальной стратегии импортозамещения//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2016. -№ 2. -С. 3-11.
- Брик А.Ф., Сиволап Ю.М. Молекулярно-генетический полиморфизм сои, детектированный ПП-ПЦР, SSRP и ISSR//Цитология и генетика. -2001. -№ 5. -С. 3-9.
- Рамазанова С.А., Гучетль С.З., Челюстникова Т.А., Антонова Т.С. Идентификация сортов сои российской селекции на основе анализа микросателлитных (SSR) локусов ДНК//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2008. -№ 2 (139). -С. 56-58.
- Абугалиева С.И., Волкова Л.А., Нурланова А.А., Жанпеисова А.С., Туруспеков Е.К. ДНК-фин-герпринтинг сортов сои Казахстана с использованием микросателлитных маркеров//Биотехнология. Теория и практика. -2013. -№ 3. -С. 23-35.
- Bisen A., Khare D., Nair P.,Tripath N. SSR analysis of 38 genotypes of soybean (Glycine max (L.) Merr.) genetic diversity in India//Physiol. Mol. Biol. Plants. -2015. -V. 21 (1). -P. 109-115 DOI: 10.1007/s12298-014-0269-8
- Tantasawat P., Trongchuen J., Prajongjai T., Jenweerawat S. and Chaowiset W. SSR analysis of soybean (Glycine max (L.) Merr.) genetic relationship and variety identification in Thailand//Australian Journal of Crop Science. -2011.-V. 5 (3) -P. 283-290.
- Рамазанова С.А., Антонова Т.С. Использование микросателлитных локусов (SSR) ДНК для идентификации гибридов F1 сои//Труды Кубанского государственного аграрного университета. -2017. -№ 66. -С. 219-223.
- Рамазанова С.А., Гучетль С.З., Челюстникова Т.А., Антонова Т.С., Мошненко Е.В. Внутрисортовой полиморфизм сортов сои селекции ВНИИМК//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2009. -№ 2 (141). -С. 96-98.
- Леонова И.Н. Молекулярные маркеры: использование в селекции зерновых культур для идентификации, интрогрессии и пирамидирования генов//Вавиловский журнал генетики и селекции. -2013. -Т. 17. -№ 2. -С. 314-325.
- Гучетль С.З., Фролов С.С., Зайцев Р.Н., Кузнецова Е.С. Паспортизация линий и гибридов подсолнечника селекции Армавирской опытной станции ВНИИМК: подбор оптимальных ДНК локусов и условий ПЦР//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2017. -№ 3 (171). -С. 23-28.
- Гучетль С.З., Челюстникова Т.А., Антонова Т.С., Бочковой А.Д. ДНК-генотипирование на основе RAPD-и SSR-маркеров: апробирование и подбор оптимальных условий для Helianthus annuus L.//Наука Кубани. -2007. -№ 2. -С. 44-46.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: Mendelian inheritance, chromosomal location, and population dynamics//PNAS USA. -1984. -V. 81. -P. 8014-8018.
- Cregan P.B., Jarvik T., Bush A.L., Shoemaker R.C., Lark K.G., Kahler A.L., Van Toai T.T., Lohnes D.G., Chung J., Specht J.E. An integrated genetic linkage map of soybean//Crop Science. -1999. -Vol. 39. -P. 1464-1490.
- Использование ПЦР-анализа в генетико-селекционных исследованиях: Научно-методи-ческое руководство/Под ред. Сиволапа Ю.М. -Киев: Аграрна наука, 1998. -156 с.
- Айала Ф., Дж. Кайгер. Современная генетика. -М.: Мир, 1988. -Т. 3. -332 с.
- Рамазанова С.А. Идентификация сортов сои (Glycine max L.) с использованием микросателлитных локусов ДНК//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2016. -Вып. 2 (166). -С. 63-67.


