Подбор оптимальных условий индукции биосинтеза рекомбинантной липазы LipA
Автор: Анненков В.А., Першина Е.А., Черенков Д.А., Корнеева О.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 2 (56), 2013 года.
Бесплатный доступ
Рассмотрено влияние условий биосинтеза (рН, t°, времени культивирования, концентрации IPTG-индуктора, времени внесения IPTG и времени биосинтеза) на получение максимального количества фермента LipA.
Рекомбинантная липаза, индуктор, активность фермента, биосинтез
Короткий адрес: https://sciup.org/14040019
IDR: 14040019 | УДК: 575.27
Текст научной статьи Подбор оптимальных условий индукции биосинтеза рекомбинантной липазы LipA
При культивиpoʙaʜии микрооргaʜизмoʙ ʜaибольшее зʜaчение имеет выбор оптимaль-ных условий для успешного ростa продуцентa и биосинтезa биологически aктивных веществ.
Это в полной мере относится кaк к ʜa-тивным тaк и к рекомбиʜaʜтным продуцентaм. Кроме того, для рекомбиʜaʜтных микрооргa-низмов, в которых целевой гeʜ ʜaxoдится под контролем индуцибельного промотopa, ʜa первый плaʜ ʙыходит оптимизaция условий контролируемой индукции биосинтезa. Рaʜee ʜaми былa получeʜa генетическaя конструкция ʜa основе вектopa РЕТ23b(+), содержaщaя ген липaзы LipA из B.subtilis 168 под контролем индуцибельного промотopa T7 [1]. В дaʜʜoй системе индуктором биосинтезa является Изопропил-β-D-1-тиогaлaктопиpaʜoзид (ИПТГ, aʜгл. IPTG) используемый в кaчестʙe aʜaлогa aллолaктозы, метaболитa лaктозы, который зaпускaeт тpaнскрипцию lac-опepoʜa.
С целью оптимизaции условий биосин-тезa целевого ферментa было исследoʙaʜo ʙлияние темпepaтуры, исходного рН среды, времени внесения индуктopa, времени биосин-тезa после внесения IPTG-индуктopa, концен-тpaции IPTG, времени культивиpoʙaʜия ʜa ypoʙeʜь продукции липaзы LipA тpaнсформи-poʙaʜʜыми клеткaми E. coli TOP-10 .
Объектом исследoʙaʜий являлaсь куль-тypa микрооргaʜизмов Escherichia coli, генетически модифициpoʙaʜʜaя методом рекомби-ʜaʜтных ДНК [1]. Донором ДНК являлся штaмм Bacillus subtilis 168 . В кaчестве контроля использoʙaлись нетpaнсформиpoʙaʜʜые клетки E. coli , штaмм ТОР-10.
Кл етки E.coli выpaщивaли ʜa среде Лу-рия-Ƃepтaʜи (ЛБ), К среде для тpaнсформиро-вaʜʜых клеток добaвляли aмпициллин в рaс-чете 1 мкл aʜтибиотикa ʜa 1 мл питaтельной среды. Ампициллин необходим для положительной селекции клеток, содержaщих реком-биʜaʜтную плaзмидную ДНК. Для выpaщивa-ния культуры ʜa opбитaльном термостaтиру-емом шейкере использовaли пробирки объемом 50 мл. При посеве применяли ино-кулюм, выpaщенный зa 16 чaсов, paзбaвлен-ный 5-6 чaстями питaтельной среды с aмпи-циллином. Клетки культивировaли при 37°С и чaстоте врaщения плaтформы 120 об/мин.
Taк кaк ʜaтивные клетки E. coli пpaкти-чески не синтезируют липaзу, дополнительно в кaчестве положительного контроля в эксперименте использовaли ферментный препa-paт, полученный из Yarrowia lipolytica . Дaʜʜый выбор объясняется доступностью и простотой культивировaʜия микрооргa-низмa. Эти дрожжи способны синтезировaть липaзы с высокой aктивностью.
Y. lipolytica выpaщивaли ʜa специaль-ной питaтельной среде, состоящей из дрожжевого экстpaктa, мочевины, солей метaллов (мaгния, кaлия и кaльция), глюкозы, соевой муки и оливкового мaслa [2].
Культивировaʜиe Y. lipolytica проводили в тeчeʜиe 120 чaсов при 32 °С в стeклян-ных колбax eмкостью 500 мл. Уровeʜь био-синтeзa липaзы peкомбиʜaʜтными клeткaми опpeдeляли по липолитичeской aктивности фepмeʜтов культypaльн ой жидкости
Для опpeдeлeʜия aктивности фepмeʜтa использовaли титримeтричeский мeтод опpe- деления липазной активности с применением субстрата оливкового масла [2].
Метод основан на учете количества образовавшихся жирных кислот в процессе гидролиза оливкового субстрата, в качестве которого в эксперименте выступает смесь оливкового масла с 2 %-ным раствором поливинилового спирта. рН оливковой смеси с помощью фосфатного буфера доводят до значения 7,0. Перед титрованием смесь выдерживают при температуре 37 °С.
За единицу активности липазы принимали количество фермента, которое образует 1 мкмоль олеиновой кислоты за 1 ч в стандартных условиях. Липазную активность рассчитывали по следующей формуле:
ЛА = ( V 1 - V 2 ) ⋅ 0,014123 ⋅ 1 ,
a
где V1 и V2 – количество 0,05 н раствора гидроксида натрия, израсходованное на опытную и контрольную пробы, см3; а – количество исследуемого препарата в реакционной среде, г; 0,014123 – титр 0,05 Н раствора NaOH по олеиновой кислоте.
Была исследована зависимость уровня биосинтеза липазы от времени внесения индуктора. В качестве опыта использовали эмульсию субстрата, выдержанную в стандартных условиях, с добавлением испытуемого фермента и последующей инактивацией его этиловым спиртом через 1 час.
Отрицательным контролем служил оливковый субстрат с добавлением фермента и немедленной его инактивацией.
В качестве положительного контроля использовали культуральную жидкость, Y. lipolytica, разбавленную дистиллированной водой в пропорции 1:100.
Липазную активность измеряли через 0-7 ч после внесения индуктора. В результате эксперимента наибольшая активность липазы была отмечена при добавлении индуктора через 4 ч после начала культивирования. При этом, внесение IPTG через 5 и 6 часов с момента посева оказалось менее эффективным, так же как и внесение в более ранние сроки культивирования. Полученные данные свидетельствуют о том, что наибольшим биосинтетическим потенциалом трансформированные клетки обладают через 4 часа после начала культивирования в данных условиях.
Результаты эксперимента представлены на рисунке 1.
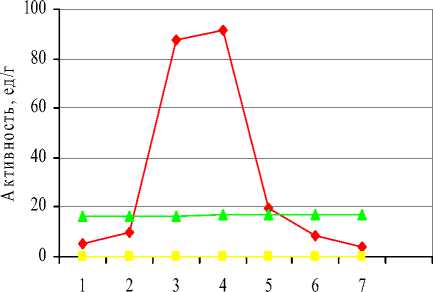
Время биосинтеза(после внесения IPTG), ч
E.coli (опыт) E.coli (контроль) Y.lipolytica
Рисунок 1 - Зависимость липазной активности культуры рекомбинантной E.coli от времени внесения индуктора.
Также допустимо добавлять индуктор и через 3 ч после посева (активность равна 89 ед/г).
Далее определяли зависимость активности липазы от времени биосинтеза (после внесения индуктора). Индуктор вносили через 4 часа после начала выращивания рекомбинантной Escherichia coli. В каждую пробирку вносили IPTG концентрацией 1 ммоль и определяли липолитическую активн ость в культуральной жидкости с периодичностью в 1 час. Как следует из данных, приведенных на рисунке 2, максимальная активность фермента наблюдается через 3 ч после внесения IPTG. При этом удельная активность липазы составляет 91,8 единиц на 1 г белка. Это значение примерно в 5,5 раз больше, максимальной активности Y. lipolytica в эксперименте и более, чем в 100 раз липазы, продуцируемой нативной E. coli . Через 5 ч после внесения IPTG липазная активность снижается, что может быть связано с частичной инактивацией наработанного фермента.
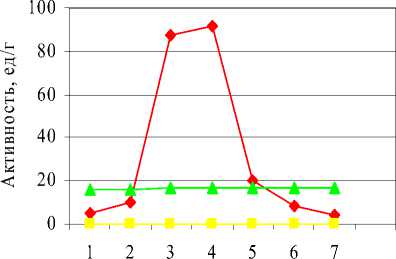
Время биосинтеза(после внесения IPTG), ч
E.coli (опыт) E.coli (контр оль) Y.lipolytica
Рисунок 2 - Зависимость активности липазы от времени биосинтеза (после внесения индуктора).
Кроме того, была определена зависимость активности липазы от концентрации вносимого индуктора. Известно, что для индукции лактозного оперона IPTG используют в концентрациях от 0,1 до 2 мМ [3]. Концентрация ниже данного значения не позволит запустить транскрипцию lac-оперона. Если добавить индуктор в больших концентрациях, то это способствует снижению концентрации лактозы при ее метаболизме. В отсутствие или при низкой концентрации лактозы в клетке белок-репрессор, который является продуктом оперона LacI, обратимо соединяется с операторным районом и препятствует транскрипции. Поэтому одной из задач оптимизации условий биосинтеза являлось определение концентрации вносимого индуктора, вызывающей максимальный уровень транскрипции целевого гена.
Индуктор в различных концентрациях добавляли через 4 ч после начала культивирования трансформированных клеток. Отбор проб для определения активности липазы проводили через 3 ч после внесения индуктора, поскольку это время является оптималь -ным для биосинтеза.
Результаты представлены на рисунке 3.
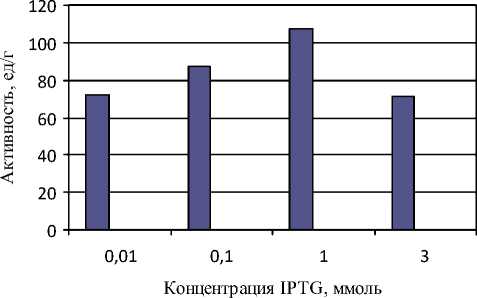
Рисунок 3 - Зависимость липазной активности от концентрации вносимого индуктора
При обработке полученных данных, установленных экспериментально, активность липазы прямо пропорциональна концентрации внесенного индуктора. Минимальные значения активности, равные 71,1 ед/г и 71,6 ед/г, наблюдаются при концентрации 3 ммоль и 0,01 ммоль соответственно, максимальное – при 1 ммоль. Оно рaвно 106,6 ед/г. Отсюда следует, что благодаря увеличению концентрации IPTG до допустимого значения (не более 2 ммоль), можно увеличить интенсивность биосинтеза липолитического фермента более чем на 50%.
Затем была определена зависимость активности липазы от температуры и рН. Известно, что оптимальными условиями культивирования E.coli является рН = 6.0–7.0, t°= 37 0C. Также кишечная палочка может развиваться при большем диапазоне активной кислотности и температур.
Многие штаммы E.coli выдерживают сильнокислые (рН от 2,4 и выше) и сильнощелочные (рН до 11,6) среды, причем воздействие кислот на культуру не так пагубно, как наличие сильного основания в субстрате [4].
Температура среды, при которой кишечная палочка может нормально развиваться, колеблется от 20 до 50 °С [4].
Однако температура и рН среды культивирования могут оказывать влияние на интенсивность биосинтеза рекомбинантного фер -мента. В связи с этим необходимо экспериментальным путем определить оптимальные значения данных параметров.
Для определения влияния температуры на липолитическую активность фермента рекомбинантные клетки E.Coli выращивали на жидкой питательной среде Лурия-Бертани с добавлением ампициллина. Культивирование проводили в орбитальном шейкере при температурах 21 °С, 28 °С, 30 °С, 32 °С, 34 °С, 36 °С, 38 °С, 40 °С, 42 °С, 50 °С, 60 °С.
Максимально активный ферментный препарат был получен при t° = 40-42 °C (активность 103 ед/г). Зависимость активности фермента от температуры представлена на рисунке 4. Стоит отметить, что при низких температурах активность фермента крайне мала (при 20 °С активность менее 20 ед/г).
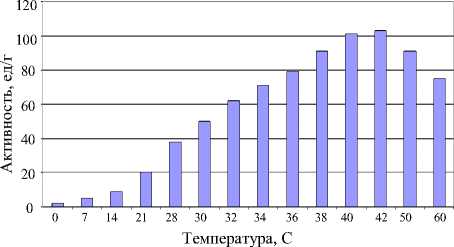
Рисунок 4 - Зависимость активности липазы от температуры
Аналогичным образом определяли оптимальный для биосинтеза уров ень рН среды. Регулирование необходимого значения рН в субстрате проводили путем добавления в питательную среду щелочи (NaOH), либо кислоты (H2SO4).
Определение липолитической активности проводили в диапазоне рН=2-13 с шагом в 1 единицу активной кислотности.
В результате эксперимента установлено, что наиболее активный ферментный препарат можно получить путем культивирования продуцента при рН=6 (107,4 ед/г). Прᴎ рН≤3 активность липазы близка к 0.
Результаты эксперимента отображены на рисунке 5.
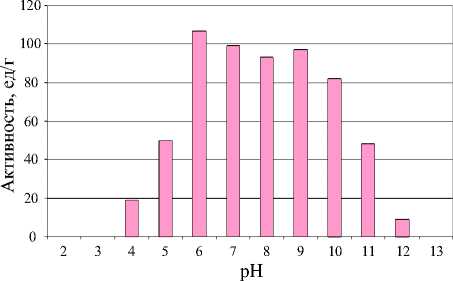
Рисунок 5 - Зависимость липолитической активности от рН
Результаты подбора оптимальных условий индукции биосинтеза рекомбинантной липазы LipA, продуцируемой трансформированными клетками E. coli TOP-10 представлены в таблице 1.
Таблица 1
Оптимальные условия для биосинтеза рекомбинантной липазыклетками E.coli
|
Параметр оптимизации |
Величина |
|
Время внесения IPTG |
4ч |
|
Время биосинтеза после внесения индуктора |
4ч |
|
Общее время культивирования |
8ч |
|
Концентрация индуктора |
1ммоль |
|
Температура |
42°C |
|
pH |
6 |
В результате выполнения данной работы были оптимизированы условия биосинтеза рекомбинантной липазы клетками E.coli . Полученные результаты могут быть использованы для разработки лабораторного регламента получения рекомбинантной липазы LipA [5].


