Подбор праймеров и зонда для амплификации участка гена В646L вируса АЧС
Автор: Фролов Г.С., Канашкина Е.В., Равилов Р.Х., Галимзянов И.Г., Ефимова М.А., Закиров Т.М., Хамидуллина А.И.
Статья в выпуске: 3 т.255, 2023 года.
Бесплатный доступ
Африканская чума свиней (АЧС) - заразное вирусное заболевание свиней, характеризующееся лихорадкой, гиперемией кожи, множественными кровоизлияниями во внутренние органы, атаксией, тяжелой депрессией и высокой смертностью в острых случаях. Совершенствование методов диагностики вируса АЧС является одним из важнейших этапов в борьбе и профилактике этого заболевания. Наряду с рутинными методами диагностики, такими как выделение, РГАД, РИФ, разработанная в последние годы ПЦР в реальном времени, широко используется для диагностики в лабораториях различного уровня, благодаря ее эффективности, высокой чувствительности и специфичности. В связи с тем, что новые вирусные изоляты демонстрируют новые генетические модели, необходим редизайн праймеров, чтобы иметь возможность обнаруживать распространенные, в настоящее время, генотипы вируса АЧС. Разработаны праймеры и зонд для гена B646L вируса АЧС, кодирующего р72 мажорный белок капсида. Праймеры оптимизированы на основе термодинамических параметров и вторичной структуры для высокой эффективности амплификации. Результаты проверки специфичности разработанных праймеров в базе данных GenBank показали, что сконструированные олигонуклеотиды в подавляющем большинстве случаев были комплементарны гену B646L вируса АЧС.
Вирус африканской чумы свиней, олигонуклеотидные праймеры
Короткий адрес: https://sciup.org/142238551
IDR: 142238551 | УДК: 619:616.98:578.842.1:616-078 | DOI: 10.31588/2413_4201_1883_2_255_350
Текст научной статьи Подбор праймеров и зонда для амплификации участка гена В646L вируса АЧС
Африканская чума свиней (АЧС) в настоящее время вызывает серьезные опасения в мировой свиноводческой отрасли, ввиду высокой контагиозности и значительной летальности. Стратегии борьбы с АЧС в первую очередь сосредоточены на раннем обнаружении, ограничении передвижения домашнего скота и уничтожении стада, пораженного или потенциально подверженного воздействию вируса [1, 2, 3].
Учитывая отсутствие эффективных средств профилактики, сходство клинических симптомов АЧС и других болезней свиней, потенциальное появление неспецифических клинических симптомов, быстрая и надежная диагностика имеет важное значение для своевременного проведения мер контроля и предотвращения распространения этой разрушительной болезни [3].
По правилам ВОЗЖ (МЭБ) методы лабораторной диагностики вируса АЧС включают выделение вируса, идентификация его в реакции гемадсорбции (РГАД), непрямой иммунофлуоресценции, полимеразной цепной реакции (ПЦР), петлевой изотермической амплификации (LAMP), методами ИФА и иммуноблоттинга [4].
Выделение вируса и РГАД с использованием клеток свиных макрофагов, РИФ являются классическими методами диагностики вируса АЧС, но требуют лабораторных навыков и более 6
дней для получения результата. Методы ПЦР в реальном времени, разработанные в последние годы, широко используются для рутинной диагностики в лабораториях различного уровня благодаря их эффективности, высокой чувствительности и специфичности [5, 6]. Большинство из них были разработаны на основе VP72-кодирующей области, высококонсервативного гена, кодирующего основной белок вирусной структуры [7, 8]. Анализ генетической изменчивости вируса выявил несоответствия между рекомендованными МЭБ праймерами и новыми изолятами данного возбудителя АЧС. Высокая частота мутаций в последовательностях вирусных нуклеиновых кислот может привести к широким изменениям и даже небольшое количество несовпадений в областях связывания праймеров может привести к значительной ошибке количественного определения, достигающей до 63,12 % [9, 10].
В связи с тем, что новые вирусные изоляты демонстрируют новые генетические модели, необходим редизайн праймеров, чтобы иметь возможность обнаруживать распространенные, в настоящее время, генотипы вируса АЧС.
Материал и методы исследований.
Работа выполнена на базе межкафедральной лаборатории иммунологии и биотехнологии ФГБОУ ВО Казанская ГАВМ. Поиск нуклеотидных последовательностей для разработки специфичных праймеров, фланкирующих ген B646L вируса АЧС осуществлялся по базам Национального Центра Биотехнологической Информатизации (NCBI). Для выравнивания нуклеотидных последовательностей и поиска консервативных участков была использована программа VectorNTI 10 (https://catalog.invitrogen.com).
Последовательности олигонуклеотидов подбирались вручную. Для анализа свойств праймеров использовалась программа OligoAnalyzer 3.1 (http://eu.idtdna.com/analyzer/Applications/O ligoAnalyzer/default.aspx) .
Комплементарность праймеров соответствующим генам оценивали с помощью программы Primer-BLAST (http://www.ncbi.nlm.nih.gov/tools/pr imer-blast) .
Результат исследований.
Филогенетический анализ показал, что все обнаруженные вирулентные изоляты вируса АЧС на территории РФ и в соседних европейских странах, депонированные в международной базе данных GenBank, имеют одинаковый генотип II по гену В646L. Ген В646L мажорного капсидного белка p72 вируса АЧС, является геном видовой специфичности и предпочтительным маркером для обнаружения вируса АЧС.
Поскольку гены вируса АЧС имеют существенные отличия подбор праймеров проводился на основе известных нуклеотидных последовательностей гена В646L вирулентных изолятов вируса АЧС выявленных на территории РФ и в соседних европейских странах депонированных в международной базе данных GenBank штаммов: AF159503- штамм 98/ASF/NG (Нигерия), KT795357 – изолят ETH/3a (Эфиопия), MW296945 – изолят Armenia/07
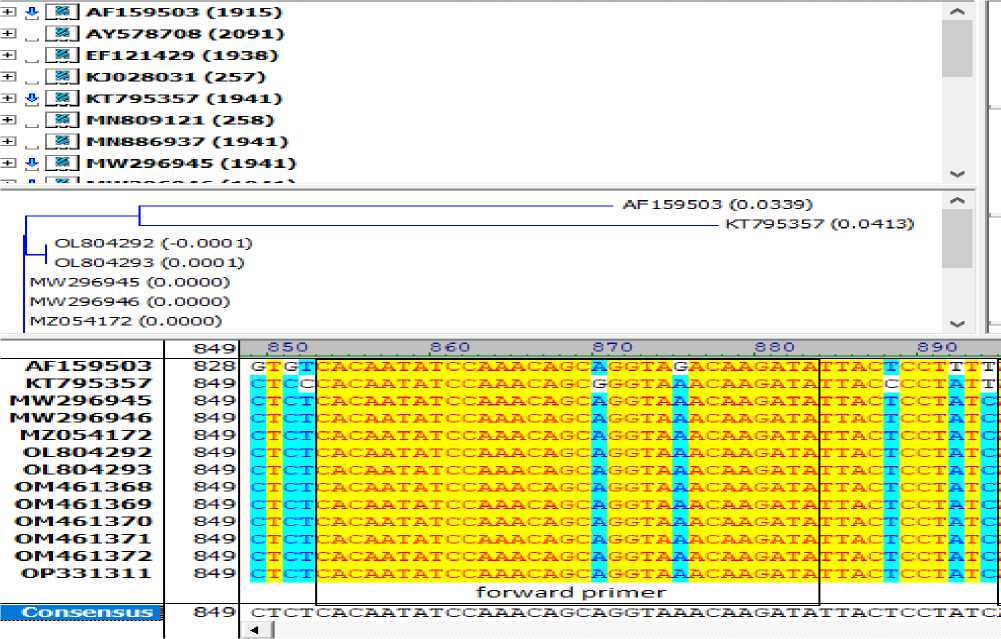
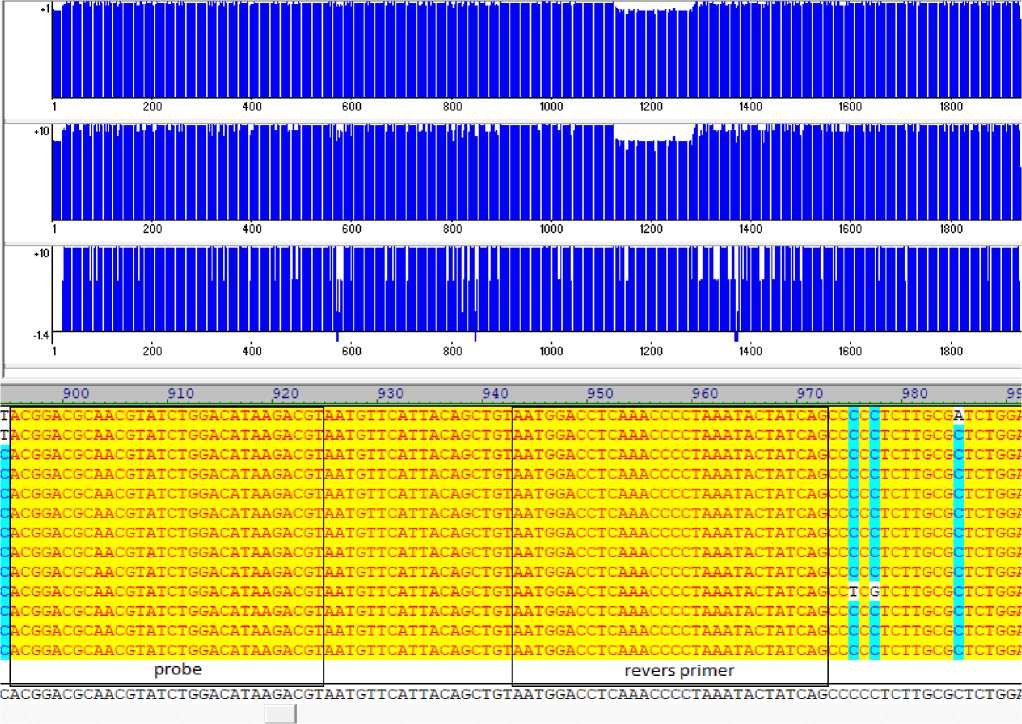
(Армения), MW296946 – изолят Estonia (Эстония), MZ054172 – изолят LA9_Nigeria/2020 (Нигерия), OL804292 – штамм China/2018/AnhuiXCGQ (Китай), OL804293 – Синтетическая конструкция гена белка p72, OM461368 – изолят A9_21_1 (Таиланд: Чианграй), OM461369 – изолят A9_21_2 (Таиланд: Чианграй), OM461370 – изолят A9_21_3 (Таиланд: Чианграй), OM461371 – изолят A9_21_4 (Таиланд: Чианграй), OM461372 – изолят A9_21_5 (Таиланд: Чианграй), OP331311 – изолят JS2018-1 (Китай: Цзянсу) (рис. 1). В целях подбора праймеров для ПЦР мы провели множественное сравнение последовательностей всех штаммов и выявили несколько консервативных областей без делеций, длиной от 26 до 53 п.н. нуклеотидов, достаточной для подбора праймера (рис. 1 а, б). На основании BLASTn анализа определена 100% принадлежность анализируемых последовательностей к возбудителям АЧС.
При подборе праймеров мы руководствовались общепринятыми рекомендациями и старались минимизировать вырожденность праймеров и подобрать их таким образом, чтобы 3'-конец праймера не содержал нуклеотидных замен, т.е. максимально соответствовал участку, на который он будет отжигаться. На 5'-конце допускали несоответствия матрице. Учитывая поставленные задачи и соблюдая эти условия, нам удалось подобрать прямой и обратный праймеры и зонд (Таблица 1).
Далее мы провели анализ термодинамических параметров и вторичной структуры подобранных олигонуклеотидов с целью предсказания их эффективности в амплификации фрагмента гена В646L и оптимизации условий ПЦР (Таблица 2).
Таблица 1 – Нуклеотидные последовательности праймеров, детектирующих фрагменты целевых генов
|
Ген (белок) |
Нуклеотидная последовательность (5′ → 3′) |
Размер ампликона,bp |
|
B646L (P72)F |
cacaatatccaaacagcaggtaaacaagata |
120 |
|
B646L (P72)P |
(ROX)acggacgcaacgtatctggacataagacgt(BHQ2) |
|
|
B646L (P72)R |
ctgatagtatttaggggtttgaggtccatt |
а
б
Рисунок 1 - Фрагменты выравнивания нуклеотидных последовательностей гена B646L ( а, б ,)
Таблица 2 – Характеристика и структура подобранных праймеров для амплификации фрагмента гена В646L
|
Параметры |
В646LF849 |
В646LR940 |
|
Длина, п.н. |
31 |
30 |
|
Содержание GC,% |
35,5 % |
40 % |
|
Tm (макс. – мин.) средн. ,ºC |
57,3 - 63,6 60,45 |
57,8 –63,8 60,8 |
|
Разница между мин. и макс. Tm, ΔTm, ºC |
6,3 |
6 |
|
Шпильки (шп.): количество вариантов, ΔG (kcal.mole-1) |
- |
2шп., ΔG–-0,3 - -0,48 |
|
Гомодимеры (д.), количество вариантов, ΔG (kcal.mole-1), кол-во спаренных оснований (сп.осн.) |
2 д.: ΔG – - 3,91 - - 4,01;4сп.осн.; 13 д.: ΔG–-0,96 - -3,07;2сп. осн.; |
1 д.: ΔG –2,44;3сп. осн.; 21 д.: ΔG– -0,96 - -3,07;2сп. осн.; |
|
Гетеродимеры количество вариантов, ΔG (kcal.mole-1), кол-во спаренных оснований (сп.осн.) |
8 д.: ΔG – -2.44– -3.9; 3сп. осн.; 24 д.: ΔG–-1.94 – -1.95; 2сп. осн. |
1 д.: ΔG –-53.38;30сп. осн.; 12 д.: ΔG – -3.42 - -4.67;3 сп. осн.; 18 д.: ΔG–-0.96 – -3.07; 2сп. осн. |
Как видно из данных таблицы пара праймеров имеет допустимую разницу в содержании GC-пар 4,5 %. Отличие между минимальными и максимальными значениями температур плавления праймеров составило 6,3 и 6 0С, соответственно. Праймеры не образуют тугоплавких шпилек (ΔG меньше –7 kcal.mole-1), однако для каждого из сконструированных праймеров имеются индивидуальные варианты, образующие тугоплавкие гомо- или гетеродимеры.
В целом, можно предположить, что структуры, образующиеся при гомодимеризации праймеров, достаточно стабильны при условиях эксперимента, так как их значения ΔG отрицательны. Это означает, что энергия, необходимая для разрушения структуры и образования двух отдельных одноцепочечных праймеров, меньше нуля, что говорит о том, что эти структуры достаточно устойчивы. Кроме того, значения температуры плавления (Tm) находятся в пределах типичных значений для большинства ПЦР-протоколов, что свидетельствует о возможности эффективной амплификации праймеров в реакции ПЦР.
Результаты проверки специфичности разработанных праймеров в базе данных GenBank показали, что сконструированные олигонуклеотиды в подавляющем большинстве случаев были комплементарны гену В646L вируса АЧС.
Заключение. Разработаны праймеры и зонд для участка гена В646L, кодирующего р72 мажорный белок капсида вируса АЧС. Основываясь на термодинамических параметрах и вторичной структуре олигонуклеотидов, мы уверены в высокой эффективности амплификации этого фрагмента. В дальнейшем, планируется экспериментальная проверка разработанных праймеров.
Исследования проведены при поддержке гранта Министерства сельского хозяйства и продовольствия РТ Рег. № 122120500061-0 от 05.12.22 г.
FrontiersinVeterinaryScience. – 2022. – Т. 9. – P. 830244.
Список литературы Подбор праймеров и зонда для амплификации участка гена В646L вируса АЧС
- Ефимова, М. А. Анализ иммунодоминантных пептидов вируса африканской чумы свиней для конструирования кандидатных вакцин / М. А. Ефимова, А. Г. Галеева, А. И. Хамидуллина, Р. Х. Равилов // Аграрная наука. - 2023. - № 3. - С. 40-45.
- Колбасов, Д. В. Африканская чума свиней: создание вакцины актуально / Д. В. Колбасов // Животноводство России. - 2020. - № 7. - С. 29-33.
- Нефедьева, М. В. Анализ иммуномодулирующих белков вируса африканской чумы свиней / М. В. Нефедьева, И. А. Титов, К. А. Мима, А. С. Малоголовкин // Молекулярная генетика, микробиология и вирусология. -2019. - № 1. - С. 42-48.
- Хисамутдинов, А. Г. Эпизоотическая ситуация по туберкулезу крупного рогатого скота в Республике Татарстан / А. Г. Хисамутдинов, Д. Н. Мингалеев, Р. Х. Равилов [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. - 2018. - Т. 234. - № 2. - С. 2112 1 7.
- Flannery, J. Identification of novel testing matrices for African swine fever surveillance /j. Flannery, M. Ashby, R. Moore, S. Wells, P. Rajko-Nenow, C. L.Netherton [et al.] //j. Vet. Diagn.Invest. - 2020. - V. 32(6). - P. 961-963.
- Hwang, H. J. Development and validation of a fast quantitative real-time PCR assay for the detection of African swine fever viru s / H. J. Hwang, Y.S. Choi, K. Song, M. Frant, J.H. Kim // Front. Vet. Sci. - 2023. -V. 4. -P. 9:1037728.
- Luo, Y. Development of an updated PCR assay for detection of African swine fever virus / Y. Luo, S. A. Atim, L. Shao, C. Ayebazibwe, Y. Sun, Y. Liu [et al.] // Arch Virol. - 2017. - V. 162(1). - P. 191-199.
- Ravilov, R. K. Viralvectorvac ci n esagainstASF: problemsandprospectives / R. K. Ravilov, A. A. Rizvanov, D. N. Mingaleev, E. Y. Zakirova [et al.] // FrontiersinVeterinaryScience. - 2022. - Т. 9. -P. 830244.
- Yin, D. Development of RealTime PCR Based on A137R Gene for the Detection of African Swine Fever Virus. / D. Yin, R. Geng, H. Lv, C. Bao, H. Shao, J. Ye, K. Qian and A. Qin // Front. Vet. Sci. - 2021. - V. 8. - P. 753-967.


