Поддерживающая терапия при множественной миеломе
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 4 т.19, 2023 года.
Бесплатный доступ
Постиндукционная поддерживающая терапия как у молодых, так и пожилых пациентов с впервые диагностированной множественной миеломой не вызывает сомнений. В статье представлены результаты клинических исследований по оценке эффективности ингибиторов протеасом и иммуномодулирующих препаратов в постиндукционной поддерживающей терапии пациентов с множественной миеломой разного возраста. Представлен анализ эффективности бортезомиба, иксазомиба, леналидомида и талидомида. Показано, что поддерживающая терапия существенно увеличивает выживаемость больных множественной миеломой, в том числе при высоком риске. Статья представляет особый интерес для врачей-гематологов, терапевтов, клинических ординаторов и студентов медицинских вузов.
Множественная миелома, иксазомиб, бортезомиб, леналидомид, беспрогрессивная выживаемость, высокий риск, стандартный риск
Короткий адрес: https://sciup.org/170199869
IDR: 170199869
Текст научной статьи Поддерживающая терапия при множественной миеломе
живающей терапии после аутоТГСК. Талидомид и леналидомид признаны эффективным средством лечения ММ в индукционной и поддерживающей терапии. Эффективность их при множественной миеломе связана со способом действия. Эти препараты нацелены на специфический белок цереблон, выполняющий в клетках функцию Е3-убиквитинлигазы, что приводит как к онкогенным эффектам на ранней стадии, так и к иммуномодулирующим эффектам, благоприятным для долгосрочного контроля опухоли.
В нескольких исследованиях фазы III обнаружено существенное улучшение качества ответа, увеличение беспрогрессивной выживаемости больных, получавших иммуномодулирующий препарат талидомид в качестве консолидации или поддерживающей терапии после аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) [4-7]. Сходные данные выявлены и по результатам крупных мета-анализов [4,8]. Было обращено внимание на отчетливое увеличение времени до прогрессирования ММ в посттрансплантационном периоде у больных, получавших поддерживающую терапию талидомидом. Так, по результатам клинического исследования III фазы HOVON-50, талидомид пролонгировал выживаемость без событий с 22 мес. до 34 мес. (р <0,001) и беспрогрессивную выживаемость (PFS) с 25 мес. до 34 мес. (р <0,001) [7]. Мета-анализ, представленный Международной рабочей группой по миеломе (IMWG), продемонстрировал снижение риска прогрессирования или смерти на 35% [8]. Однако у пациентов с цитогенетическими аномалиями высокого риска результаты были хуже. Что касается общей выживаемости (OS), то в большинстве исследований не было обнаружено существенных различий в сравнении с группой больных, не получавших талидомид. Между тем, значительное улучшение общей выживаемости выявлено в мета-анализах IMWG (отношение рисков – HR= 0,84) [8] и MRC Myeloma IX (HR=0,75) [4]. В то же время увеличение общей выживаемости было отмечено только у пациентов с благоприятным прогнозом [гипердиплои-дия, t(6;14), t(11;14)] при отсутствии таких цитогенетических аномалий, как t(4;14), t(14;16), t(14;20) и del(17p) [4]. Кроме того, плохая переносимость талидомида, частое развитие периферической нейропатии 3-4 ст. ограничивало продолжительность лечения, при этом частота досрочного прекращения поддерживающей терапии достигала 84%. Кроме токсичности талидомида выделено еще одно важное обстоятельство: его длительное использование может привести к развитию более резистентного рецидива. По этой причине талидомид рекомендуется использовать в качестве поддерживающей терапии не более 1 года.
Поддерживающее лечение леналидомидом считается стандартом лечения всех пациентов с ММ после аутоТГСК (I, A по версии ESMO 2021) [9]. В исследовании Intergroupe Francophone du Myélome 2005-02 медиана PFS составила 41 мес. в группе пациентов, получавших поддерживающую терапию леналидомидом до прогрессирования заболевания, по сравнению с 23 мес. у пациентов, получавших плацебо.
Леналидомид имеет меньше побочных эффектов, чем талидомид, что позволяет проводить длительное лечение и успешнее контролировать заболевание. Мета-анализ, включивший более 1200 пациентов с медианой наблюдения 79,5 мес., показал, что поддерживающая терапия леналидомидом обеспечивает более чем 2-кратное увеличение PFS (52,8 мес. по сравнению с 23,5 мес.), а преимущество OS по сравнению с плацебо составило 2,5 года. Однако не было никакой пользы у пациентов с ММ ISS-III или цитогенетическими аномалиями высокого риска [10]. Между тем, в исследовании MRC-XI, в котором 1137 пациентов получали поддерживающую терапию леналидомидом и 834 пациента находились под наблюдением, результаты иные. Медиана выживаемости без прогрессирования составила 39 мес. (95%CI: 36–42) в группе больных с леналидомидом и 20 мес. (95%CI: 18-22) – находящихся под наблюдением (HR=0,46 [95%CI: 0,41–0,53]; p <0,0001) [11]. Медиана общей выживаемости не была достигнута (95%CI: 66–не достигнута) среди больных с леналидомидом и в группе наблюдения (95%CI: 61–не достигнута). Сходными оказались и показатели 3-летней выживаемости. Так, общая выживаемость за 3 года в группе пациентов, получавших леналидомид, составила 78,6%, и 75,8% – в группе наблюдения (HR=0,87 [95% CI: 0,73–1,05]; p=0,15). В то же время у пациентов с высоким цитогенетическим риском 3-летняя OS составила 75% в группе леналидомида по сравнению с 64% в группе наблюдения, а у пациентов сверхвысокого риска – 63% против 43,5% соответственно. Правда, к этим результатам следует относиться с осторожностью, поскольку пациенты, участвующие в исследовании MRC-XI и получавшие поддерживающую терапию леналидомидом, ранее находились на иммуномодулирующих препаратах и были чувствительны к ним. Кроме того, определение пациентов с высоким риском было различным в мета-анализе [10] и в исследовании MRC-XI [11]; в метаанализе цитогенетика высокого риска включала только пациентов с t(4;14) и del17p, в то время как в исследовании MRC-XI пациенты были классифицированы на три группы цитогенетического риска: стандартный риск, высокий риск или сверхвысокий риск (неблагоприятные цитогенетические аномалии были определены как амплификация 1q, t(4;14), t(14;16), t(14;20), или del(17p)] [10,11]. Следует также отметить, что данные Myeloma XI показали преимущество PFS при поддерживающей терапии леналидомидом независимо от статуса минимальной остаточной болезни и продемонстрировали повышенную скорость конверсии из МОБ-положительного к МОБ-отрицательному статусу с леналидомидом (32%) по сравнению с наблюдением (4%).
Подтверждение эффективности поддерживающей терапии леналидомидом получено и в исследовании CALGB 100104, в котором пациенты были рандомизированы в группы, получающие поддерживающую терапию леналидомидом (n=231) или плацебо (n=229) после выполнения аутоТГСК [12]. При медиане наблюдения 34 мес. у 37% пациентов, получавших леналидомид, по сравнению с 58%, получавших плацебо, наблюдалось прогрессирование заболевания или они умерли. Медиана времени до прогрессии в группе больных с леналидомидом составила 46 мес. по сравнению с 27 мес. в группе больных с плацебо (р <0,001). Вторые первичные злокачественные опухоли возникли у 18 пациентов, получавших леналидомид (8%), и у 6 пациентов, получавших плацебо (3%). Анализ выживаемости после 91-месячного периода наблюдения показал, что медиана времени до прогрессирования ММ составила 57,3 мес. (95%CI: 44,2-73,3) при приеме леналидомида и 28,9 мес. (95%CI: 23,0–36,3) – плацебо
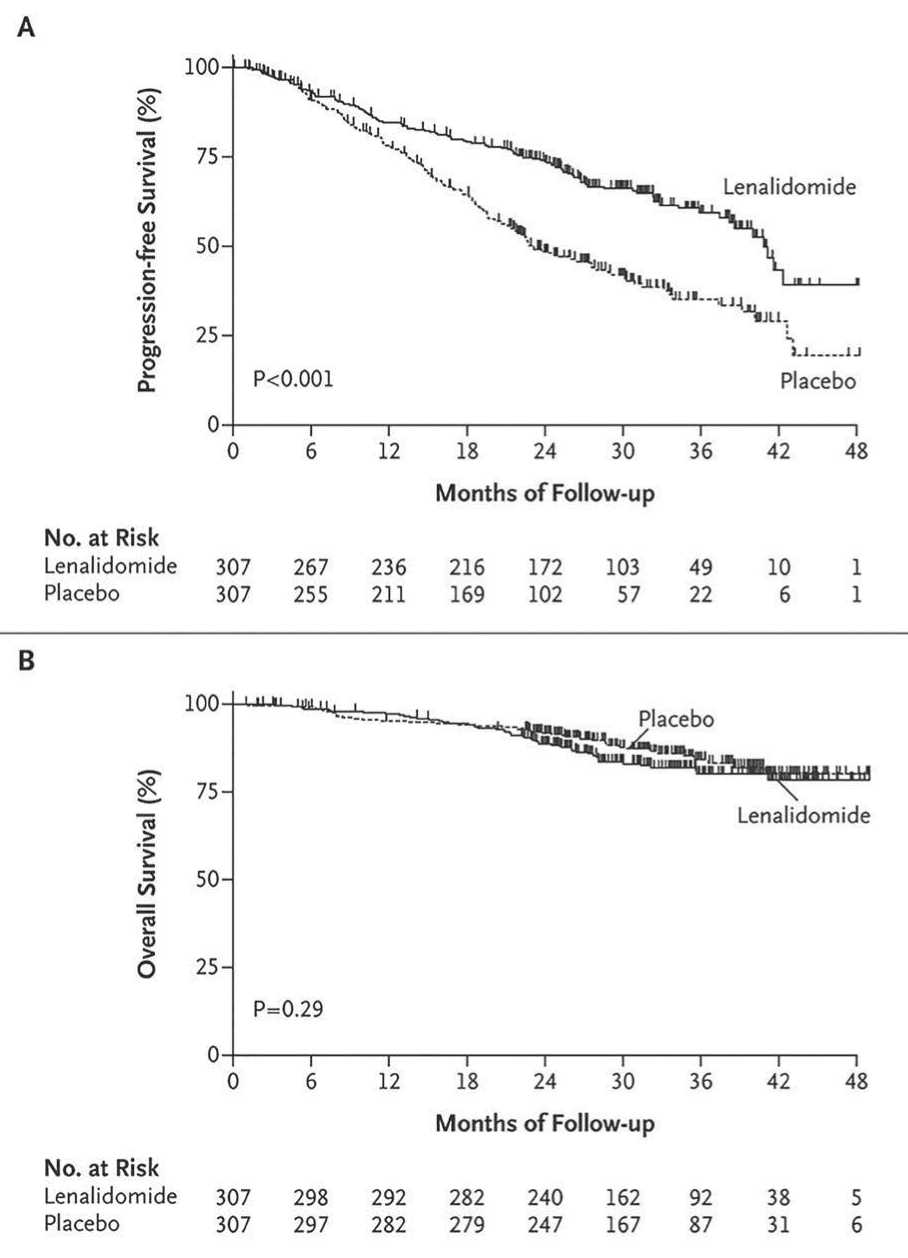
Рисунок 1. Кривые выживаемости без прогрессии (Progression-free Survival) и общей выживаемости (Overall Survival) больных ММ, получавших поддерживающую терапию леналидомидом (Lenalidomide), и в группе плацебо (Placebo) [14].
(HR=0,57; 95% CI 0,46–0,71; р <0,0001) [13]. Наиболее частыми нежелательными явлениями (НЯ) 3-4 степени тяжести при поддержке леналидомидом, по сравнению с плацебо, были нейтропения (50% против 18%) и тромбоцитопения (15% против 5%). Увеличилась частота вторых первичных злокачественных новообразований (гематологические плюс солидные опухоли): на фоне леналидомида – 14%, плацебо – 4%.
Данные международного рандомизированного двойного слепого исследования III фазы IFM 200502 (n=614) показали, что у пациентов, получавших леналидомид в качестве консолидирующей терапии после аутоТГСК с последующим приемом леналидомида в качестве поддерживающей терапии, улучшились частота и качество ответов [14]. После медианы наблюдения в 30 мес. у 264 пациентов наблюдалось прогрессирование заболевания (104 в группе леналидомида и 160 в группе плацебо). При этом медиана PFS составила 41 мес. в группе леналидомида и 23 мес. в группе плацебо (HR=0,50; р <0,001). Вероятность выживания без прогрессирования в течение 3 лет после рандомизации составила 59% у тех, кто получал леналидомид, и 35% у тех, кто получал плацебо. В то же время общая выживаемость через 3 года после рандомизации была аналогичной в двух исследуемых группах (80% в группе с леналидомидом и 84% в группе плацебо; HR=1,25; р=0,29) (рис. 1). Медиана выживаемости не была достигнута ни в одной из групп. Повышенная частота вторых первичных злокачественных заболеваний наблюдалась в обеих группах (у 32 пациентов из группы леналидомида и у 12 пациентов из группы плацебо) [14].
Данные исследования MM-015 III фазы показывают, что поддерживающая терапия леналидомидом после первичной терапии по схеме МPL (мелфалан/ преднизон/леналидомид) значительно снижала риск прогрессирования заболевания и увеличивала PFS у больных в возрасте ≥65 лет [15]. Однако беспрогрессивная выживаемость пациентов, получавших MPL с последующим поддерживающим приемом леналидомида (MPL-L), была значительно длительнее (медиана 31 мес.) по сравнению с двумя другими группами больных, не получавшими поддерживающей терапии: MPL – медиана 14 мес.; HR=0,49 (р <0,001), MP – медиана 13 месяцев; HR=0,40 (р <0,001); в группах MPL и MP различий не выявлено. Причем, установлено, что поддерживающая терапия леналидомидом улучшала PFS на 66% по сравнению с плацебо, независимо от возраста [15]. 3-летняя OS составила 70% в группе MPL-L, 62% – MPL и 66% – MP. Среди нежелательных явлений авторы обращают внимание на гематологическую токсичность. Нейтропения 4 степени развилась у 35% больных из группы MPL-L, 32% – MPL и 8% – MP; тромбоцитопения 4 степени – у 11, 12 и 4% пациентов соответственно. Тромбозы глубоких вен 3 или 4 степени тяжести наблюдались у 3% боль- ных, получавших леналидомид и у 1% – MP. Во всех группах наблюдалось развитие вторичных гематологических опухолей: острого миелоидного лейкоза (4 больных из группы MPL-L и 2 – MPL), миелоди-спластического синдрома (1 – из группы MPL-L, 3 – MPL, 1 – MP), T-клеточного острого лимфобластного лейкоза (1 – из группы MPL-L), хронического мие-ломоноцитарного лейкоза (1 – из группы MPL-L). В целом частота вторых опухолей за 3-летний период наблюдения при лечении MPL-L составила 7%. Различные солидные опухоли возникли с одинаковой частой (5 – в группе MPL-L, 4 – MPL, 3 – MP).
В мета-анализ 4 рандомизированных контролируемых исследований вошли пациенты, получавшие поддерживающую терапию леналидомидом или плацебо, или находившиеся только под наблюдением, как после трансплантации, так и без нее [16]. Анализ показал, что у пациентов, получавших поддерживающую терапию леналидомидом, значительно улучшилась PFS (HR=0,49; р <0,001) и наблюдалась тенденция к пролонгированию OS (HR=0,77; р=0,071) по сравнению с отсутствием поддерживающей терапии или плацебо. Однако, как и в предыдущем исследовании [15], обращается внимание на частоту тяжелой (3-я и 4-я степени тяжести) нейтропении (HR=4,9, p <0,001), тромбоцитопении (HR=2,7, p <0,001), утомляемости (HR=2,3, p <0,01), тромбозов глубоких вен и/или эмболии легочной артерии (HR=3,2, p <0,02), а также повышенный риск вторичных злокачественных неоплазий. Поэтому вопрос о том, следует ли регулярно предлагать пациентам поддерживающую терапию леналидомидом, является спорным. По мнению некоторых экспертов, на данный момент поддерживающую терапию леналидомидом следует считать стандартной для пациентов с высоким риском. Для пациентов с заболеванием низкого риска следует обсудить соотношение риска и пользы от поддерживающей терапии леналидомидом в сравнении с осторожным ожиданием, пока у нас не будет больше данных о преимуществах общей выживаемости.
Наряду с иммуномодуляторами в качестве поддерживающей терапии применяют ингибиторы протеасом. В одном из крупных рандомизированных исследований поддерживающая терапия борте-зомибом показала преимущество PFS по сравнению с поддерживающей терапией талидомидом. При медиане наблюдения 41 мес. медиана PFS была больше в группе пациентов, получавших в индукции программу PAD + бортезомиб, чем VAD + талидомид (медиана 35 vs 28 мес.; р=0,002). Улучшены показатели PFS и OS у больных с делецией 17p13 (медиана PFS в группе с поддержкой бортезомибом составила 22 мес., талидомидом – 12 мес.; р=0,01. Медиана общей выживаемости при наблюдении в течение 54 мес. не достигнута при поддержке бортезомибом и составила 24 мес. при поддержке талидомидом (р=0,003). Однако следует отметить, что индукционная те- рапия в этом исследовании не была одинаковой в двух группах лечения [PAD по сравнению с VAD соответственно] [17]. Тем не менее, это исследование привлекает к себе внимание тем, что долгосрочное лечение бортезомибом, по-видимому, преодолело неблагоприятное воздействие del(17p). Так, 8-летняя общая выживаемость при поддерживающей терапии бортезомибом в этой подгруппе больных составила 52% против 54% у пациентов без этой цитогенетической аномалии. Правда, совершенно иная ситуация наблюдалась в случае выявления других цитогенетических аномалий высокого риска – t(4;14) и амплификация 1q21 [17]. Возможно, это было ассоциировано с дополнительной субклональной гетерогенностью, что свидетельствует о необходимости комбинированных стратегий непрерывной терапии у пациентов с высоким риском. В то же время, при назначении бортезомиба в индукционной терапии пациентов с ВДММ, выживаемость больных промежуточного риска оказалась сходной с таковой у больных стандартного риска [18]. Jagannaty A. et al. в своих исследованиях указывают на преодоление бортезомибом негативного влияния на прогноз транслокации t(4;14) и del(13q) [19,20].
По результатам исследования UPFRONT III фазы, поддерживающая терапия бортезомибом после лечения первичной терапией на основе бортезомиба в целом переносится удовлетворительно. В это исследование были включены пациенты с ВДММ, не являющиеся кандидатами на аутоТГСК. Пациенты были рандомизированы 1:1:1 для получения в течение 24 недель восьми 21-дневных циклов индукции VD, VTD или VMP (VD: внутривенное введение бортезомиба 1,3 мг/м2, дни 1, 4, 8 и 11 плюс пероральный дексаметазон 20 мг, дни 1, 2, 4, 5, 8, 9, 11 и 12 [циклы 1-4] и дни 1, 2, 4 и 5 [циклы 5-8]; VTD: бортезомиб и дексаметазон также плюс талидомид перорально по 100 мг, дни с 1 по 21; VMP: бортезо-миб, как и прежде, плюс перорально мелфалан 9 мг/м2 и преднизолон 60 мг/м2 с 1 по 4 дни, каждый второй цикл). В течение следующих 25 недель (пять 35-дневных циклов) проводилась поддерживающая терапия внутривенным введением бортезомиба 1,6 мг/м2, дни 1, 8, 15 и 22. Результаты показывают, что ответы, включая ПО и ≥охЧО, улучшились после продолжения лечения бортезомибом во всех группах больных [21]. После медианы наблюдения 42,7 мес. медиана выживаемости без прогрессирования при VD, VTD и VMP составила 14,7, 15,4 и 17,3 мес. соответственно, а медиана общей выживаемости – 49,8, 51,5 и 53,1 мес., то есть без существенных различий между методами лечения (рис. 2).
Общий уровень ответов составил 73% (VD), 80% (VTD) и 70% (VMP). Несмотря на то, что все схемы, содержащие бортезомиб, давали хорошие результаты, VTD и VMP не имело преимуществ перед VD у пациентов, не подходящих для аутоТГСК. Нежелательные явления были более частыми среди больных. получавших VTD, чем при VD или VMP. Наиболее распространенным нежелательным событием была периферическая нейропатия: VD – 50%; VTD – 60%; VMP – 47%. Частота инфекций 3-й степени составила 21%, 16% и 18%, а сепсис 3-й степени был зарегистрирован у 3%, 3% и 2% пациентов соответственно. По мнению авторов исследования, поддерживающая терапия бортезомибом приводила к ограниченной
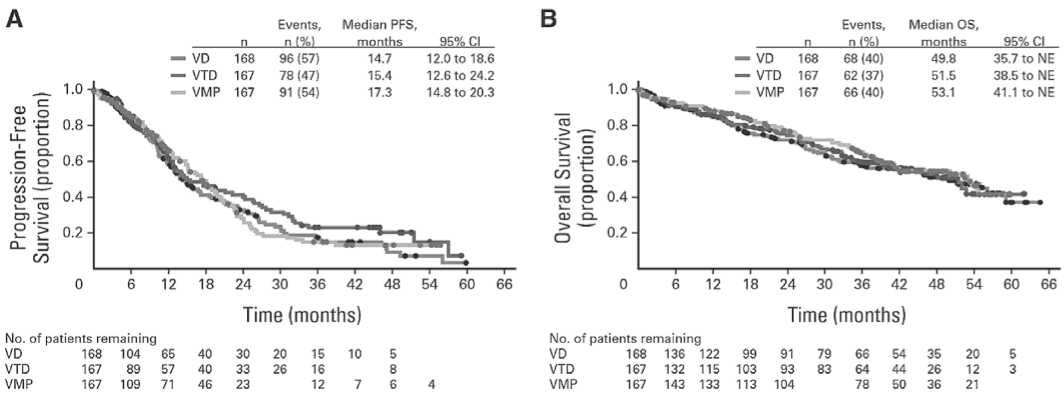
Рисунок 2. Kaplan-Meier анализ (A) беспрогрессивной (PFS) и (B) общей выживаемости (OS) больных ММ [21].
Примечание. NE – не оценивалось; VD - бортезомиб-дексаметазон; VMP – бортезомиб-мелфалан-преднизолон; VTD - бортезомиб-талидомид-дексаметазон.
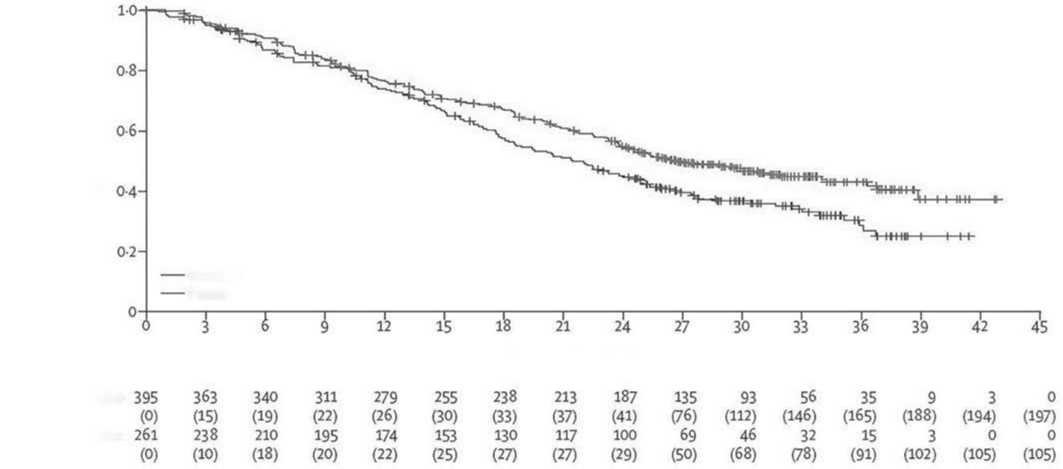
Рисунок 3. Анализ выживаемости без прогрессирования заболевания по методу Каплана-Мейера в популяции всех включённых в исследование пациентов, получивших по крайней мере одну дозу исследуемого препарата [26].
дополнительной токсичности по сравнению с индукционной терапией, при сохранении ответов [21]. Более низкая токсичность и частота прекращения лечения, а также большее количество завершенных циклов при использовании схемы VD по сравнению с VTD и VMP могут компенсировать возможный дефицит эффективности при VD при отсутствии третьего лекарственного средства.
В одном из одноцентовых исследований показано, что при высоком риске хорошо зарекомендовал себя в консолидации и поддерживающей терапии после аутоТГСК триплет VRd. Так, среди пациентов с ММ высокого риска [(del17p, del1p, t(4;14), t(14;16)] частота очень хорошего частичного ответа (охЧО) превысила 96%, медиана PFS составила 32 мес., а 3-летняя OS – 93%) [22]. Однако необходимо отметить, что роль терапии на основе бортезомиба исключительно в качестве поддерживающей терапии не может быть экстраполирована из этих исследований, в которых пациенты получили индукцию на основе бортезомиба. В то же время приводится примечательный факт для реальной клинической практики. В ретроспективном одноцентровом анализе из клиники Мейо, поддержка бортезомибом после аутоТГСК продемонстрировала преимущество PFS в реальных условиях у пациентов с высоким риском [23], что, безусловно, увеличивает шансы бортезо-миба при выборе варианта поддерживающей терапии. Между тем, необходимость парентерального введения и профиль токсичности бортезомиба (в первую очередь частое развитие периферической нейропатии) являются ограничительным фактором для длительного использования бортезомиба в кли- нической практике. Рекомендуемая длительность поддерживающей терапии бортезомибом не более 2 лет [24].
Поскольку возможность проведения поддерживающей терапии бортезомибом в рутинной клинической практике ограничена, необходима его замена. В настоящее время для этих целей получает все большее распространение пероральный ингибитор протеасомы иксазомиб.
Иксазомиб зарегистрирован для лечения рецидивирующей или рефрактерной множественной миеломы в комбинации с леналидомидом и дексаметазоном. Однако существует ряд клинических исследований, по результатам которых иксазомиб эффективен и в первой линии терапии множественной миеломы, и в поддерживающей терапии, причем независимо от возраста. Поэтому NCCN 2022, основываясь на результатах клинических рандомизированных исследований [25], рекомендует в качестве поддерживающей терапии, наряду с леналидомидом и бортезомибом, использовать иксазомиб (категория 2B).
В двойном слепом рандомизированном пла-цебо-контролируемом исследовании фазы III TOURMALINE-MM3 иксазомиб назначался в поддерживающей терапии пациентам с ММ в посттрансплантационном периоде [26]. Пациентов рандомизировали в соотношении 3:2 для получения иксазомиба, либо соответствующего плацебо в форме капсул не позднее, чем через 115 дней после проведения трансплантации. Рандомизацию стратифицировали по схеме индукционной терапии (ингибитор протеасом без иммуномодулирующего препарата или иммуномодулирующий препарат без ингибитора протеасом или ингибитор протеасом в комбинации с иммуномодулирующим препаратом), стадии по ISS до начала индукционной терапии (I по сравнению с II или III) и ответу на лечение после трансплантации (полный ответ или очень хороший частичный ответ по сравнению с частичным ответом) при скрининге. Пациенты получали иксазомиб внутрь в дозе 3 мг, или соответствующее плацебо, в 1, 8 и 15 дни 28-дневных циклов. Если в течение первых четырех циклов пациент удовлетворительно переносил лечение, с 5 цикла дозу препарата увеличивали до 4 мг. Пациенты продолжали лечение до 24 мес. (эквивалентно 26 циклам) или до прогрессирования заболевания или развития неприемлемой токсичности.
При медиане последующего наблюдения 31 мес. в группе пациентов на иксазомибе выявлено снижение риска прогрессирования заболевания или смерти на 28% по сравнению с группой плацебо, при этом медиана беспрогрессивной выживаемости составила 26,5 мес. (95% CI: 23,7-33,8) и 21,3 мес. (95% CI: 18,0-24,7) соответственно (рис. 3).
При анализе результатов в выделенных подгруппах больных обнаружено увеличение PFS при использовании иксазомиба по сравнению с плацебо у пациентов в возрасте ≥60 лет (p=0,012) и пациентов с ММ III стадии по ISS до начала индукции (p=0,047). В группе пациентов с высоким цитогенетическим риском доля пациентов, достигших медианы бес-прогрессивной выживаемости через 24 месяца, была численно выше при применении иксазомиба, чем плацебо (46% vs. 24%). У 46% и 32% пациентов соответственно, достигших после трансплантации охЧО или частичного ответа (ЧО), в период поддерживающей терапии глубина ответа увеличилась. На момент включения в исследование, у большинства пациентов, статус минимальной остаточной болезни (МОБ) был положительным; доли пациентов с положительным или отрицательным МОБ-статусом, были сопоставимы между группами лечения. Медиана PFS у пациентов с МОБ [-] на момент включения в исследование составила 38,6 мес. (95%CI: 33,8 – не подлежит оценке) в группе иксазомиба по сравнению с 32,5 мес. (95%CI: 19,3 – не подлежит оценке) в группе плацебо. Среди участников с положительным статусом МОБ, 12% пациентов в группе икса-зомиба и 7% пациентов в группе плацебо достигли отрицательного статуса в период поддерживающей терапии. Однако обращало на себя внимание, что наиболее значимое увеличение PFS наблюдалось среди больных, находящихся на иксазомибе, независимо от статуса МОБ на момент включения в исследование [26].
Наиболее частыми гематологическими нежелательными явлениями (НЯ) были нейтропения, тромбоцитопения и анемия, негематологическими – инфекции, нарушения со стороны желудоч- но-кишечного тракта и высыпания на коже. Периферическая нейропатия зарегистрирована у 19% пациентов в группе иксазомиба и у 15% пациентов в группе плацебо. Нарушения со стороны сердечнососудистой системы были зарегистрированы у 3% и 2% соответственно. Случаев тромбоза в группе ик-сазомиба не было, в группе плацебо тромбоз возник у одного пациента (<1%). Случаи тромбоцитопении чаще регистрировались в группе иксазомиба, чем в группе плацебо. В обеих группах нарушения со стороны желудочно-кишечного тракта в большинстве случаев были низкой степени тяжести, и чаще регистрировались в группе иксазомиба, чем в группе плацебо. Опоясывающий герпес зарегистрирована у 10% и у 5% соответственно. На фоне профилактического лечения опоясывающий герпес отмечался реже (у 2% и 1% соответственно) [26].
Таким образом, в исследовании TOURMALINE-MM3 убедительно продемонстрирована польза поддерживающей терапии иксазомибом у пациентов в посттрансплантационном периоде. Увеличение PFS было постоянным у пациентов с характеристиками заболевания, связанными с неблагоприятным прогнозом, в том числе с ISS-III и наличием цитогенетических факторов высокого риска. Более того, лечение характеризовалось хорошей переносимостью с минимальным увеличением частоты развития серьезных нежелательных явлений, периферической нейропатии и тромбозов, при этом на момент проведения этого анализа не было выявлено увеличения частоты развития других первичных злокачественных новообразований после периода наблюдения 31 мес. (медиана). Частота досрочного прекращения иксазомиба по причине нежелательных явлений, возникших во время лечения, составила 7%. Серьезным аргументом в пользу иксазомиба является возможность достижения отрицательного статуса МОБ. Доля пациентов, достигших МОБ [-] на фоне лечения иксазомибом, была 1,7 раз выше, чем в группе плацебо. Более того, медиана времени до развития документально подтвержденного положительного статуса МОБ, прогрессирования заболевания или смерти также была значимо выше.
Качество жизни, связанное со здоровьем (HRQoL), особенно важно во время поддерживающей терапии пациентов с множественной миеломой после трансплантации, когда симптомы заболевания ограничены. F. Schjesvold et al. подробно оценили влияние поддерживающей терапии иксазомибом по сравнению с плацебо на HRQoL больных в исследовании TOURMALINE-MM3. Ими установлено, что в дополнение к улучшению выживаемости без прогрессии в группе больных с иксазомибом HRQoL поддерживалось в обеих группах больных на вполне удовлетворительном уровне, то есть активное лечение икса-зомибом не оказало негативного влияния на HRQoL [27].
В исследовании фазы III TOURMALINE-MM4
(NCT02312258) оценивали поддерживающую терапию препаратом иксазомиб у пациентов с впервые диагностированной множественной миеломой, которым не проводилась аутоТГСК [28]. Используя централизованную рандомизацию через интерактивную систему голосового/веб-ответа, пациенты были случайным образом распределены в соотношении 3:2 для приема либо перорально иксазомиба в дозе 3 мг, либо соответствующего плацебо, в дни 1, 8 и 15-й 28-дневных циклов. Доза была увеличена до 4 мг с 5-го цикла при условии переносимости в течение 1-4 циклов. В общей сложности было зарегистрировано 706 пациентов с ВДММ: 425 в группе иксазомиба и 281 в группе плацебо. Исходные характеристики пациентов были хорошо сбалансированы между обеими группами. Рандомизация была стратифицирована по режиму индукции (терапия, содержащая или не содержащая ингибиторы про-теасомы); стадии заболевания (I или II или III), возрасту при рандомизации (< 75 или ≥ 75 лет); ответу на начальную терапию при скрининге (полный ответ [ПО] или охЧО). Так же, как и в исследовании TOURMALINE-MM3, пациенты продолжали лечение в течение 24 мес. (при отсутствии задержек в лечении, что эквивалентно 26 циклам) или до прогрессирования заболевания или неприемлемой токсичности.
Согласно полученным результатам, при медиане продолжительности последующего наблюдения равной 21,1 мес., медиана PFS с момента рандоми- зации (в группах больных ММ, получавших поддерживающую терапию иксазомибом или плацебо) составила 17,4 мес. и 9,4 мес. (HR=0,659; 95% CI: 0,542–0,801; р <0,001) (рис. 4). Разница в PFS с начала индукционной терапии также была статистически значимой (26,3 и 20,3 мес. в группе препарата иксазомиб по сравнению с плацебо; р <0,001). Клинические преимущества наблюдались у пациентов с ISS-III (HR=0,695; 95% CI: 0,499–0,967; р=0,030) и пациентов в возрасте ≥ 75 лет (HR=0,738; 95% CI 0,537–1,014; р=0,060). Увеличение PFS у пациентов с охЧО или ПО после индукционной терапии было статистически значимым (р <0,001). Медиана PFS составила 25,6 мес. в группе больных на иксазоми-бе по сравнению с 12,9 месяца в группе больных на плацебо (HR=0,586). Более значимое увеличение PFS наблюдалось у пациентов, достигших ПО или оxЧО при начальной терапии, в ходе поддерживающей терапии иксазомибом по сравнению с плацебо, в выделенных подгруппах с момента рандомизации на (HR=0,586; 95% CI: 0.449–0.765; р <0,001).
Медиана времени до прогрессирования составила 17,8 против 9,6 мес. при применении иксазоми-ба по сравнению с плацебо, а повышение ответа во время поддерживающей терапии выявлено у 14,6% и 8,2% пациентов соответственно. Медиана количества циклов, которые получили пациенты, составила 13 (диапазон 1-26) и 12 (диапазон 1-26) циклов, при этом 16,0% и 10,1% пациентов завершили все указанные протоколом циклы, а 19,5% и 15,3%
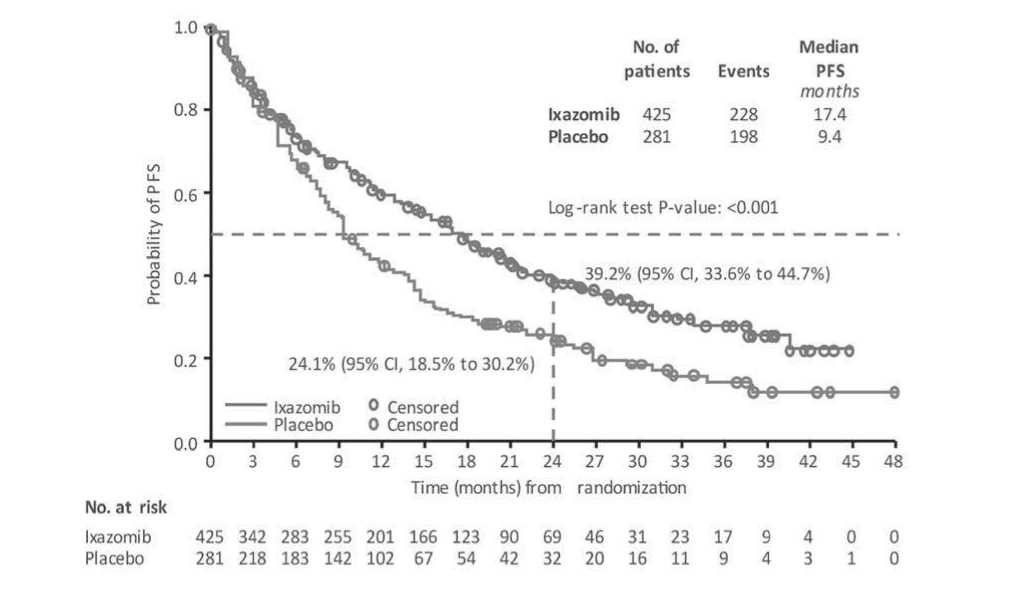
Рисунок 4. Беспрогрессивная выживаемость больных ММ, получавших поддерживающую терапию иксазомибом (верхняя кривая) или плацебо (нижняя кривая) [28].
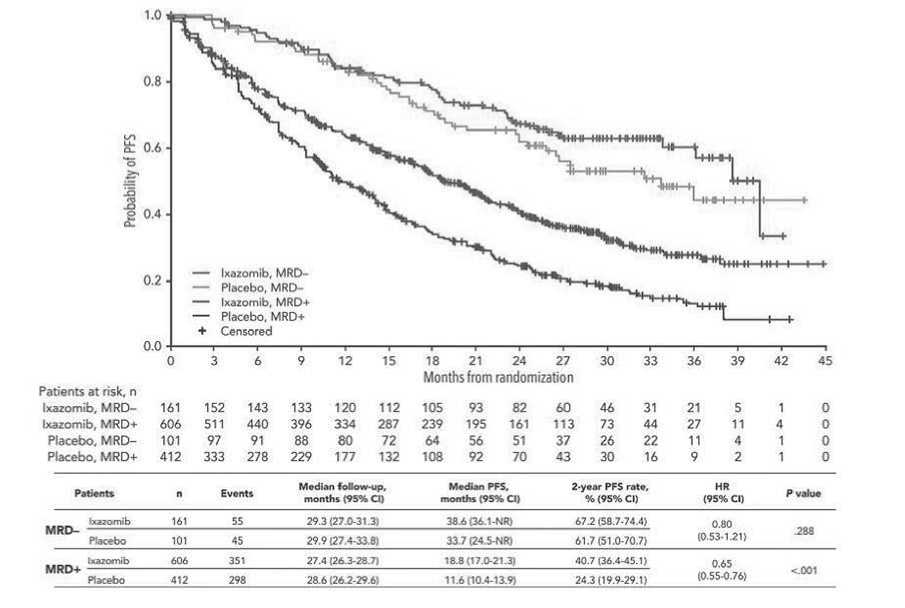
Рисунок 5. Беспрогрессивная выживаемость больных ММ при изменении МОБ-статуса по результатам исследований TOURMALINE-MM3 и -MM4 [29].
больных лечение продолжали. У 70,7% и 78,3% пациентов (иксазомиб по сравнению с плацебо) удалось повысить дозу с 3 мг до 4 мг [28].
В исследовании TOURMALINE-MM4 провели также анализ подгрупп пациентов, стратифицированных по возрасту (<65 лет, 65-74 года и ≥75 лет) и статусу «хрупкости»/астении (хорошая физическая форма, плохая физическая форма, ослабленное состояние). В подгруппах пациентов, разделенных в зависимости от статуса «хрупкости»/астении, более высокая частота ≥охЧО после индукционной терапии наблюдалась у пациентов в хорошей физической форме, у пациентов в плохой физической форме реже верифицирована ISS- III. У ослабленных пациентов чаще обнаруживалась III стадия по ISS и реже достигался ≥охЧО после индукционной терапии. Увеличение PFS на фоне поддерживающей терапии иксазомибом по сравнению с плацебо отмечалось во всех возрастных подгруппах и подгруппах с различным статусом «хрупкости»/астении.
В целом частота тяжелых НЯ между группами была сходной. При применении иксазомиба по сравнению с плацебо у 36,6% против 23,2% пациентов наблюдались нежелательные явления ≥ 3 степени, связанные с лечением; 12,9% против 8,0% прекратили лечение. Наиболее частые НЯ, которые на ≥5% чаще возникали в группе препарата иксазомиб, чем в группе плацебо, включали тошноту (26,8% и 8%), сыпь (25,6% и 10,5%), рвоту (24,2% и 4,3%), диарею (23,2% и 12,3%), периферическую нейро- патию (19,5% и 10,9%) и повышение температуры тела (11,3% и 5,1%). Частота сердечной аритмии, сердечной недостаточности, гипотензии, нарушений функции печени и почек были низкими и одинаковыми между группами. В обеих группах зарегистрировано лишь несколько случаев смерти (2,6% и 2,2%). Развитие herpes zoster наблюдалось у 3,1% с иксазомибом и 0,7% с плацебо; у пациентов, получающих противовирусную профилактику, показатели составляли 0,4% и 0% соответственно. у 5,2% и 6,2% пациентов в группах иксазомиба и плацебо были выявлены новые первичные злокачественные новообразования.
Таким образом, поддерживающая терапия икса-зомибом после индукционной терапии у пациентов с ВДММ, не являющихся кандидатами на трансплантацию, привела к статистически значимому 8-месячному увеличению медианы PFS со снижением риска прогрессирования или смерти на 34,1% по сравнению с плацебо. Преимущества PFS наблюдались в предварительно определенных подгруппах пациентов, включая пациентов с ПО или охЧО для начальной терапии, пожилых пациентов и пациентов с ISS III стадии. Преимущества поддерживающей терапии иксазомибом были реализованы в контексте хорошо переносимого профиля безопасности и отсутствия неблагоприятного воздействия на качество жизни пациентов.
Paiva B. et al. изучили прогностическую ценность динамики МОБ статуса в объединенной когорте пациентов из исследований III фазы TOURMALINE-MM3 и -MM4 [29]. У участников, достигших полного ответа, были взяты аспираты костного мозга для оценки МОБ при рандомизации, после цикла 13 и в конце лечения. Медиана выживаемости без прогрессирования (PFS) от рандомизации была достигнута, но была более длительной у пациентов с МОБ-отрицательным против МОБ-положительного статуса (38,6 против 15,6 мес. соответственно). МОБ-отрицательный статус был связан с более длительной PFS по сравнению с МОБ-положительным статусом в большинстве подгрупп пациентов, независимо от демографии, особенностей заболевания при постановке диагноза (например, цитогенетический риск, предшествующее лечение, обычный ответ) или географического региона тестирования
Time (months)
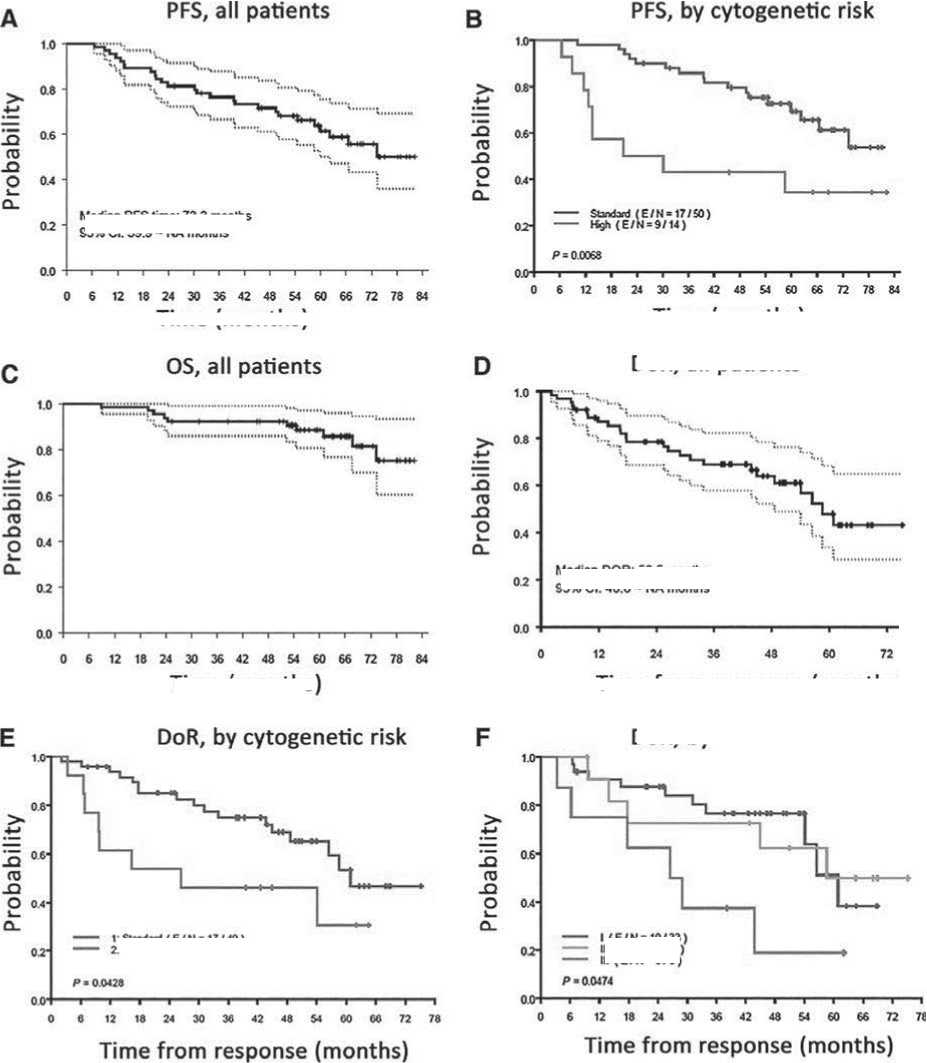
Рисунок 6 . Эффективность поддерживающей терапии леналидомидом+иксазомибом. A – PFS у всех больных. B – PFS в группах цитогенетического риска. C – OS у всех больных. D – продолжительность ответа у всех больных. E – продолжительность ответа [(DoR, by cytogenenic risk) при стандартном (standard) и высоком (high) риске]. F – продолжительность ответа с учетом стадий по ISS. E/N, события/количество пациентов.
Median PFS time: 73.3 months 95% Cl: 59.9 * NA months
Time (months)
i SUndord ( E/N ■ 17/49) 2:H^h(E/N = 8/13)
Time (months)
DoR, all patients
Median DOR: 58.5 months 95% Cl: 48.6 - NA months
Time from response (months)
DoR, by ISS stage
I (E/N- 10/33 II (E/N-S/12)
UI (E/N = 6/8)
МОБ. Статус МОБ при скрининге был особенно значим у пациентов в возрасте <60 лет (HR=0,591), от 60 до <75 лет (HR=0,415) и ≥75 лет (HR=0,298), а также у пациентов с I (HR=0,614), II (HR=0,456) и III (HR=0,366) стадиями заболевания по классификации ISS. Более длительная PFS наблюдалась у пациентов с устойчивым МОБ [-] статусом по сравнению с пациентами, переходящими из МОБ [-] в МОБ [+] (2-летняя PFS – 75,0% против 34,2%). Поддерживающая терапия в течение 28 мес. иксазомибом по сравнению с плацебо улучшила PFS у пациентов с MRD [+] (медиана 18,8 против 11,6 месяцев; OR=0,65). Никакой разницы не наблюдалось у пациентов с МОБ [-] (рис. 5). Риск прогрессирования заболевания и/ или смерти у пациентов, у которых не удалось достичь или сохранить отрицательный статус МОБ после скрининга, был выше в 8 раз (HR=8,20, 95% CI: 5,49–12,2, p <0,001).
Вызывает интерес исследование Patel K.K. et al., которые поставили цель – установить безопасность и эффективность леналидомида в сочетании с ик-сазомибом при назначении их в поддерживающей терапии после аутоТГСК [30]. В исследование включались пациенты с ВДММ, через 60-180 дней после инфузии стволовых клеток. Больным был назначен леналидомид (начальная дозы 10 мг/сутки перорально в течение 28 дней с возможностью увеличения дозы до 15 мг после трех циклов) и иксазомиб по 3 мг (48 пациентов) или 4 мг (16 пациентов) перорально 1, 8 и 15 дни каждого 28-дневного цикла. Зарегистрировано в общей сложности 64 пациента, из них 41 (64,06%) в возрасте 60 лет и старше. Четырнадцать пациентов имели цитогенетические аномалии высокого риска [амплификация 1q, del17p, t(14:16), t(4:14)], а 50 пациентов – стандартного риска [t(11:14), t(6:14), гипердиплоидия, нормальная], у 9 пациентов верифицирована 3 ст. по ISS. У всех больных исходно был зарегистрирован ПО (n=3), охЧО (n=39), ЧО (n=19), стабилизация (n=2) и 1 пациент был с неясным ответом. При проведении поддерживающей терапии у 31 (48,4%) пациента наблюдалось отчетливое улучшение всех показателей по сравнению с их исходным ответом: у 6 пациентов от ЧО до охЧО; у 7 – от ЧО до строгого ПО /ПО; у 16 от охЧО до строгого ПО/ПО; у 1 – от стабилизации до ПО; у 1 – от стабилизации до охЧО. Медиана времени до достижения более высоких показателей ответа на поддерживающую терапию двумя препаратами составила 10,9 мес. (диапазон 0,9–51,3 мес.) [30].
Что касается выживаемости, то установлено, что медиана PFS для всех пациентов составила 73,3 мес. [95% CI: 59,9 мес. – не достигнуто] с 5-летней PFS 61,4% (95% CI: 49,9-75,5; рис. 6 А). Медиана PFS у пациентов со стандартным цитогенетическим риском не была достигнута, а 5-летняя PFS составила 69% (95% CI=57-85). У пациентов с высоким риском указанные показатели были ниже. Медиана PFS составила 25,41 мес. (95% CI=13,5 мес. – не достигнута), а 5-летняя PFS – 34% (95% CI: 16–72; р=0,0068; рис. 6 B).
По состоянию на дату окончания этого исследования было зарегистрировано 10 случаев смерти пациентов. При медиане времени наблюдения 62,04 мес. (диапазон 25,43-83,13 мес.), медиана OS не была достигнута, а 5-летняя OS составила 88,4% (95% CI: 80,6–96,9; рис. 6 С). Медиана продолжительности ответа для всех пациентов составила 58,5 мес. (95% CI: 48,6 мес. – не достигнута), со статистически значимым увеличением продолжительности ответа у пациентов со стандартным цитогенетическим риском (60,84 мес.; 95% CI: 56,44 мес. – не достигнута) по сравнению с высоким риском (26,38 мес.; 95% CI= 9,63 мес. – не достигнута; р <0,043; рис. 6 D и E). Также наблюдалась статистически значимая разница в медиане продолжительности ответа в зависимости от стадии ISS на момент постановки диагноза (рис. 6 F).
Из 64 пациентов, вошедших в это исследование, 45 были исключены из исследования по следующим причинам: прогрессирование заболевания, отзыв согласия, периферическая нейропатия, токсичность и второе злокачественное заболевание. Медиана количества циклов для пациентов, вышедших из исследования, составила 20.
Наиболее частыми гематологическими (любыми) нежелательными явлениями были нейтропения (89,1%), лейкопения (78,1%), тромбоцитопения (76,6%) и анемия (68,8%), в то время как наиболее частыми негематологическими явлениями были диарея (82,8%) усталость (78,1%), тошнота (75%), запоры (67,2%), инфекции верхних дыхательных путей (65,6%), рвота (64,1%) и гипергликемия (60,9%). Наиболее частыми гематологическими НЯ 3 ст. и выше были нейтропения (46,9%), лейкопения (20,3%), тромбоцитопения (15,6%) и анемия (3,1%), а негематологическими – легочная инфекция (26,6%), диарея (12,5%), макулопапулярная сыпь (12,5%), усталость (10,9%), периферическая сенсорная нейропатия (10,9%), инфекция верхних дыхательных путей (7,8%), тошнота (6,7%). Серьезные нежелательные явления включали легочные инфекции (12 пациентов), связанные с лечением вторичные злокачественные заболевания (9 пациентов), респираторные расстройства, включая дыхательную недостаточность (8 пациентов). Снижение дозы леналидомида произошло у 52% пациентов. Из 64 зарегистрированных пациентов, первые 16 пациентов начали прием иксазомиба в дозе 4 мг в дни 1, 8 и 15. Однако доза иксазомиба была снижена до 3 мг для всех последующих пациентов (n=48), что было связано с развитием цитопении. Снизить дозу иксазомиба до 2,4 мг пришлось у 20 пациентов в связи с нейропатией, нейтропенией, потерей слуха, тромбоцитопенией и сыпью.
Таким образом, результаты применения в поддерживающей терапии леналидомида в сочетании к иксазомибом показали лучшую, чем ожидалось, медиану PFS (73,3 мес.) по сравнению с поддерживающей терапией только леналидомидом (медиана PFS 41-52,8 мес.) [10,31]. При этом 3-летняя OS составила 92,2%, что также больше, чем 3-летняя OS, наблюдаемая при использовании только леналидомида (80-88%). Кроме того, выявлена статистически значимая разница в ответе на поддерживающую терапию леналидомидом и иксазомибом у пациентов со стандартным и высоким риском.
В целом, никаких новых сигналов опасности при комбинированной поддерживающей терапии не наблюдалось. Дополнительным преимуществом этой комбинации является то, что оба препарата дают перорально, что обеспечивает более удобное лечение и предпочитается многими пациентами.
Заключение
Подводя итог, представленным выше результатам, следует отметить, что основной целью поддерживающей терапии является улучшение прогноза пациентов с ММ путем углубления и поддержания ремиссии заболевания, достигнутой при первичном лечении. Интерферон и глюкокортикоиды, такие как преднизолон и дексаметазон, либо по отдельности, либо в комбинации, были первыми препаратами, протестированными и применявшимися для поддержания ММ в 1990-х годах. Попытки замедлить прогрессирование ММ с их помощью сопровождались развитием токсических эффектов без стойкой или значимой клинической пользы. Уже в первом десятилетии 21 века в поддерживающей терапии ММ стали использовать новые лекарственные средства – иммуномодулирующие препараты, включающие талидомид и леналидомид, и ингибиторы протеасом, такие как бортезомиб и иксазомиб. Иммуномодулирующие препараты и ингибиторы протеасом оказывают более отчетливые анти-ММ эффекты посредством различных биологических механизмов в сравнении с интерферонами и глюкокортикоидами. В результате их применения в качестве поддерживающей терапии была зарегистрирована задержка рецидива и более длительная выживаемость без прогрессирования.
В то же время, среди десятков отчетов рандомизированных контролируемых исследований лишь в нескольких были выявлены значительные преимущества общей выживаемости в результате проведения поддерживающей терапии ММ; другие указали на то, что поддерживающее лечение не оказало существенного влияния на общую выживаемость. С другой стороны, вопросы безопасности представляют собой основную проблему поддерживающей терапии ММ. Длительное применение средств против ММ может вызвать незначительные или тяжелые побочные лекарственные реакции из-за накопленной токсичности препарата, такие как нарушение кроветворения, тромбоз, иммунную дисфункцию, рецидивирующую инфекцию, побочные эффекты со стороны желудочно-кишечного тракта, нарушения обмена веществ, периферическую нейропатию и другие. Эти нежелательные явления наносят вред здоровью и качеству жизни пациентов и могут привести к преждевременному прекращению лечения из-за непереносимости побочных эффектов. Более того, длительное лечение также может стать огромным экономическим бременем для пациентов и общества.
Поддерживающая терапия леналидомидом неизменно приводит к значимому увеличению бес-прогрессивной выживаемости и является действующим стандартом лечения во многих странах. Большинство пациентов прогрессируют в течение 2-3 лет после аутоТГСК без поддерживающей терапии. Леналидомидная поддержка продемонстрировала улучшение PFS по сравнению с наблюдением пациентов, после индукции и аутоТГСК, и пациентов с цитогенетическими факторами высокого риска. На фоне поддерживающей терапии леналидомидом риск прогрессирования заболевания или смерти снижался более чем на 50% по сравнению с плацебо или наблюдением. Поддерживающая терапия после трансплантации является эффективным вмешательством, нередко способным увеличить и общую выживаемость. Поддерживающая терапия у пожилых пациентов также не вызывает сомнений. Пациенты с ВДММ, которые не являются кандидатами на трансплантацию, продемонстрировали улучшение PFS при поддерживающей терапии леналидомидом с наибольшей пользой, наблюдаемой в возрасте 65-75 лет. В некоторых исследованиях рассматривался вопрос о том, следует ли использовать поддерживающую терапию при множественной миеломе в течение фиксированного времени или до прогрессирования заболевания. Имеются данные о том, что сокращение продолжительности терапии леналидомидом приводит снижению PFS и OS. Обращает на себя внимание токсичность леналидомида, включающая лихорадку, нейтропению, тромбоцитопению, панцитопению и диарею, которые могут быть причиной снижения качества жизни и отмены поддерживающей терапии. Между тем, результаты клинического исследования IFM 2009 показывают, что индукция и аутоТГСК с последующим поддержанием до прогрессии обеспечивают улучшение качества жизни пациентов с ВДММ. Кроме того, смущает частота вторых первичных злокачественных новообразований, которая, по данным клинических исследований, была относительно увеличена в когортах больных, получавших леналидомид. Тем не менее, значительное клиническое преимущество поддерживающей терапии, улучшении PFS и, в некоторых исследованиях, общей выживаемости, позволили рекомендовать леналидомид в качестве предпочитаемого режима поддерживающей терапии (категория 1 по версии NCCN 2022). Поддержание леналидомидом считается стандартным режимом для пациентов с ММ после аутоТГСК и по версии ESMO 2021 [I, A]. Однако его назначение должно быть взвешенным с учетом повышенной частоты тяжелой (степени 3 и 4) нейтропении, риска злокачественных неоплазий и других видов токсичности.
Бортезомиб также рекомендуется в качестве поддерживающей терапии у пациентов с ММ. Применение бортезомиба в рамках режима индукции с последующей аутоТГСК и назначение его в качестве поддерживающей терапии продемонстрировало улучшенные показатели PFS и OS. Поддерживающая терапия бортезомибом после индукции бортезомиб-содержащими режимами у пациентов, не являющихся кандидатами на трансплантацию, также привела к хорошим результатам. Бортезомиб хорошо зарекомендовал себя при высоком цитогенетическом риске. Основываясь на результатах клинических исследований III фазы HOVON и UPFRONT, эксперты NCCN добавили бортезомиб в качестве варианта поддерживающей терапии для пациентов, являющихся кандидатами на трансплантацию, а также для пациентов, не имеющих показаний для трансплантации. По мнению экспертов ESMO 2021, бортезомиб может рассматриваться для пациентов с ММ высокого риска [II, B]. Однако, несмотря на перспективность поддерживающей терапии бортезо-мибом, такая терапия ограничена необходимостью парентерального введения препарата и риском развития периферической нейропатии. Поэтому использование бортезомиба требует тщательного мониторинга, а продолжительность терапии не должна превышать 2 лет.
Масштаб полезных эффектов применения икса-зомиба, выявленных в клинических исследованиях, соответствует эффектам, ожидаемым от применения ингибиторов протеасом в качестве поддерживающей терапии. В исследовании TOURMALINE-MM3 были получены данные, указывающие на значимость поддерживающей терапии при множественной миеломе и подтверждающие эффективность монотерапии иксазомибом с фиксированной продолжительностью при этом заболевании. Хотя сравнения абсолютных значений медианы PFS между разными клиническими исследованиями следует избегать из-за вмешивающихся факторов, таких как различия между популяциями пациентов, продолжительность лечения и предшествующее лечение, можно оценить относительную пользу по сравнению с общепринятым препаратом сравнения. В исследовании TOURMALINE-MM3 увеличение PFS, наблюдаемое на фоне применения иксазомиба по сравнению с плацебо, составляло более 5 месяцев, в то время как при поддерживающей терапии леналидомидом по сравнению с плацебо или наблюдением было показано увеличение этого показателя более чем на 2 года. Несмотря на то, что польза поддерживающей терапии леналидомидом значительна, у пациентов с цитогенетическими аномалиями вы- сокого риска она нестабильна и это обстоятельство является неудовлетворенной клинической потребностью.
Как указано выше, увеличение PFS в посттрансплантационном периоде на фоне терапии иксазомибом было постоянным у пациентов с характеристиками заболевания, связанными с неблагоприятным прогнозом, в том числе с ММ III стадии по ISS и наличием цитогенетических факторов высокого риска, что является пользой применения ингибиторов протеасом в этих обстоятельствах. Поддерживающая терапия иксазомибом сопровождалась значимо более высокой частотой углубления ответа по сравнению с плацебо. Кроме того, доля пациентов, достигших отрицательного статуса МОБ, на фоне лечения иксазомибом была численно выше, чем в группе плацебо, хотя это повышение было незначительным. Важно отметить хорошую переносимость иксазомиба, низкую частоту досрочного прекращения применения препарата по причине нежелательных явлений, возникших во время лечения. Более того, не было выявлено увеличения частоты развития других первичных злокачественных новообразований после периода последующего наблюдения, медиана которого составляла 31 месяц. Основываясь на результатах исследования TOURMALINE-MM3, группа NCCN включила иксазо-миб в качестве «другого рекомендуемого» варианта поддержания для пациентов, имеющих право на трансплантацию (категория 2B).
Поддерживающая терапия иксазомибом после индукционной терапии у пациентов с ВДММ, не являющихся кандидатами на трансплантацию, привела к 8-месячному увеличению медианы PFS со снижением риска прогрессирования или смерти более, чем на 30% по сравнению с плацебо. Преимущества PFS наблюдались в предварительно определенных подгруппах пациентов, включая пожилых пациентов и пациентов с ISS III стадии. Терапии иксазомибом характеризовалась удовлетворительным профилем безопасности и отсутствием неблагоприятного воздействия на качество жизни пациентов. Экспертная группа NCCN включила иксазомиб в качестве одного из рекомендуемых вариантов поддерживающей терапии для пациентов с ММ, не имеющих право на трансплантацию (категория 2B).
Сочетание ингибиторов протеасом и иммуномодулирующих агентов в рамках схемы индукции при лечении пациентов с миеломой существенно увеличило частоту и качество ответов. Возможно, режим поддерживающей терапии, состоящий из леналидомида и иксазомиба, принесет дополнительную клиническую пользу пациентам с ММ после аутоТГСК. Применение иксазомиба один раз в неделю в сочетании с леналидомидом и дексаметазоном для индукционной терапии, консолидации и поддерживающей терапии для сохранения ремиссии было изучено и характеризовалось благоприятными ре- зультатами лечения. Как оказалось, поддерживающая терапия иксазомибом и леналидомидом имеет свои собственные профили риска и пользы, которые необходимо учитывать, и их следует рассматривать с учетом особенностей каждого отдельного пациента. Существенное преимущество, которое предлагает сочетание леналидомида и иксазомиба, заключается в том, что оба агента являются пероральными методами лечения, которые более удобны и предпочитаются многими пациентами. Эта комбинация, вероятно, обеспечит дополнительное преимущество в углублении ответа на аутологичную трансплантацию гемопоэтических стволовых клеток у пациентов с множественной миеломой.
В будущем стратегии поддерживающей терапии, будут, вероятно, отдавать предпочтение комбинированному подходу, например, у пациентов из группы высокого риска. Действительно, в целом существует необходимость в проведении дальнейших исследований для определения наиболее подходящих подходов к поддерживающей терапии для применения в различных подгруппах пациентов, определенных в соответствии с характеристиками, связанными с пациентом, заболеванием и предшествующим лечением. В настоящее время изучают и применяют в клинической практике несколько комбинированных режимов, включая поддерживающую терапию иксазомибом и леналидомидом у пациентов с впервые выявленной множественной миеломой, которые могут повлиять на будущую целесообразность поддерживающей терапии иксазомибом. Продолжаются исследования пользы применения комбинации леналидомида и иксазомиба в качестве поддерживающей терапии по сравнению с монотерапией иксазомибом или леналидомидом, отдельно оценивают применение этой комбинации у пациентов с высоким риском, а также подход с чередованием этих препаратов.
В клинической практике при выборе стратегии поддержания следует учитывать и сбалансировать потенциальные выгоды, риски нежелательных явлений, затраты и предпочтения пациента. В отличие от консолидации, которая используется исключительно после трансплантации, поддерживающее лечение может применяться у пациентов, планируемых на трансплантацию, и у пациентов, не являющихся кандидатами на трансплантацию.
Поэтому важно взвесить пользу длительной поддерживающей терапии против стоимости терапии, риска токсичности и побочных эффектов. Гетерогенность заболевания может быть дополнительным фактором при принятии решений о лечении. Глубина ответа на поддерживающую терапию может зависеть от первоначального ответа на индукционную терапию. Дальнейшие исследования с более крупными когортами могут решить этот вопрос и определить, есть ли конкретные пациенты, у которых рекомендуется поддерживающая терапия леналидомидом в сочетании с иксазомибом.
Несколько комбинаций леналидомида с другими агентами оцениваются в качестве поддерживающей терапии у пациентов с множественной миеломой в условиях после аутоТГСКТ, включая моноклональные антитела, ингибиторы гистондеацетилазы и опухолевые вакцины. Поскольку эти комбинированные подходы дополнительно исследуются в конкретных подгруппах пациентов с множественной миеломой, вероятно, появится оптимальная терапия для пациентов на основе глубины их первоначального ответа, типа миеломы и цитогенетических факторов риска.
Список литературы Поддерживающая терапия при множественной миеломе
- Бессмельцев С.С., Абдулкадыров К.М. Альфа-2а-интерферон (Реаферон) в лечении больных множественной миеломой// Вопросы Онкол. – 1999. - №4. – С. 393 – 397.
- Бессмельцев С.С., Абдулкадыров К.М. Множественная миелома. Современный взгляд на проблему. – Алматы: Коста, 2007. – 480 с.
- Myeloma Trialists’ Collaborative Group. Interferon as therapy for multiple myeloma: an individual patient data overview of 24 randomized trials and 4012 patients// Br J Haematol. - 2001. – Vol. 113, N 4. – P. 1020-1034.
- Morgan G.J., Gregory W.M., Davies F.E. et al. The role of maintenance thalidomide therapy in multiple myeloma: MRC Myeloma IX results and meta-analysis. // Blood. – 2012. – Vol. 119, N 1. – P. 7–15.
- Lokhorst H. M., van der Holt B., Zweegman S. et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high-dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. // Blood. – 2010. – Vpl. 115. – P. 1113–1120.
- Stewart A. K., Trudel S., Bahlis N.J. et al. A randomized phase 3 trial of thalidomide and prednisone as maintenance therapy after ASCT in patients with MM with a quality-of-life assessment: the National Cancer Institute of Canada Clinicals Trials Group Myeloma 10 Trial. // Blood. – 2013. – Vol. 121. – P. 1517–1523.
- van de Donk N. W., van der Holt B., Minnema M. et al. Thalidomide before and after autologous stem cell transplantation in recently diagnosed multiple myeloma (HOVON-50): long- term results from the phase 3, randomized controlled trial. // Lancet Haematol. – 2018. – Vol. 5. – P. e479–e492.
- Ludwig H., Durie B.G.M., McCarthy Ph. et al. IMWG consensus on maintenance therapy in multiple myeloma. // Blood. – 2012. – Vol. 119. – P. 3003–3015.
- Dimopoulos M. A., Moreau P., Terpos E. et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up// Ann. Oncology. – 2921. – Vol. 32, N3. – P. 309-322.
- McCarthy P.L., Holstein S.A., Petrucci M.T. et al. Lenalidomide maintenance after autologous stem-cell transplantation in newly diagnosed multiple myeloma: a meta-analysis. J Clin Oncol. // 2017. – Vol. 35. – P. 3279-3289.
- Jackson G.H., Davies F.E., Pawlyn C. et al. Lenalidomide maintenance versus observation for patients with newly diagnosed multiple myeloma (Myeloma XI): a multicentre, open-label, randomized, phase 3 trial. Lancet Oncol. // 2019. – Vol. 20. – P. 57-73.
- McCarthy P.L., Owzar K., Hofmeister C.C. et al. Lenalidomide after stem-cell transplantation for multiple myeloma. // N Engl J Med. – 2012. – Vol. 366. – P. 1770-1781.
- Holstein S.A., Jung S.H., Richardson P.G. et al. Updated analysis of CALGB (Alliance) 100104 assessing lenalidomide versus placebo maintenance after single autologous stem-cell transplantation for multiple myeloma: a randomised, double-blind, phase 3 trial. // Lancet Haematol. – P. 2017. – Vol. 4. – P. e431-e442.
- Attal M., Lauwers-Cances V., Marit G. et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. // N Engl J Med. – 2012. – Vol. 366. – P. 1782-1791.
- Palumbo A., Hajek R., Delforge M. et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. // N Engl J Med. –2012. - Vol. 366. – P. 1759-1769.
- Kumar S.K., LaPlant B.R., Gertz M.A. et al. Lenalidomide Maintenance Therapy In Multiple Myeloma: A Meta-Analysis Of Randomized Trials. // 2013. – Vol. 122. – P. 407-417.
- Goldschmidt H., Lokhorst H.M., Mai E.K. et al. Bortezomib before and after high-dose therapy in myeloma: long-term results from the phase III HOVON-65/GMMG-HD4 trial. // Leukemia. – 2018. – Vol. 32. – P. 383-390.
- Бессмельцев С.С., Стельмашенко Л.В., Карягина Е.В. и др. Бортезомиб (Велкейд) в индукционной терапии множественной миеломы//Клиническая Онкогематология. // 2008. – Т. 1, №4. - С. 315-322.
- Jagannath S., Brian D., Wolf J. L. et al. A Phase 2 Study of Bortezomib as First-Line Therapy in Patients with Multiple Myeloma// Blood (ASH Annual Meeting Abstracts). 2004. Vol. 104. Abstr. 333.
- Jagannath S., Richardson P. G., Sonneveld P. et al. Bortezomib appears to overcome the poor prognosis conferred by chromosome 13 deletion in phase 2 and 3 trials// Leukemia. – 2007. – Vol. 21, N 1. – P. 151-157.
- Niesvizky R., Flinn I.W., Rifkin R. et al. Community-Based Phase IIIB Trial of Three UPFRONT Bortezomib-Based Myeloma Regimens. // J Clin Oncol. – 2015. – Vol. 33. – P. 3921-3929.
- Nooka, A. K. et al. Consolidation and maintenance therapy with lenalidomide, bortezomib and dexamethasone (RVD) in high-risk myeloma patients. // Leukemia. – 2014. – Vol. 28. – P. 690–693.
- Chakraborty R., Muchtar E., Kumar S.K. et al. Outcomes of maintenance therapy with lenalidomide or bortezomib in multiple myeloma in the setting of early autologous stem cell transplantation. // Leukemia. – 2018. – Vol. 32. – P. 712–718.
- Бессмельцев С.С. Аутологичная трансплантация гемопоэтических стволовых клеток у больных с впервые диагностированной множественной миеломой. // Вестник гематологии. – 2023. – Т. XIX, №1. – С. 4-22.
- Multiple Myeloma. NCCN Guidelines for Patients. Version 4.2022 www.nccn.org/patients.
- Dimopoulos M.A., Gay F., Schjesvold F. et al. Oral ixazomib maintenance following autologous stem cell transplantation (TOURMALINE-MM3): a double-blind, randomised, placebo-controlled phase 3 trial // Lancet. – 2019. – Vol. 393. – P. 253-264.
- Schjesvold F., Goldschmidt H., Maisnar V. et al. Quality of life is maintained with ixazomib maintenance in posttransplant newly diagnosed multiple myeloma: The TOURMALINE-MM3 trial// Eur J Haematol. // 2020. – Vol. 104. – P. 443–458.
- Dimopoulos M.A., Spicka I., Quach H. et al. Ixazomib as Postinduction Maintenance for Patients with Newly Diagnosed Multiple Myeloma Not Undergoing Autologous Stem Cell Transplantation: The Phase III TOURMALINE-MM4 Trial//Journal of Clinical Oncology. – 2020. – Vol. 38. – P. 4030-4041.
- Paiva B., Manrique I., Dimopoulos M.A. et al. MRD dynamics during maintenance for improved prognostication of 1280 patients with myeloma in the TOURMALINE-MM3 and -MM4 trials// Blood. – 2023. – Vol. 141, N 6. – P. - 579–591.
- Patel K.K., Shah J.J., Feng L. et al. Safety and Efficacy of Combination Maintenance Therapy with Ixazomib and Lenalidomide in Patients with Posttransplant Myeloma // Clin Cancer Res. – 2022. – Vol. 28. – P. 1277–1284.
- Jagannath S., Abonour R., Durie B.G.M. et al. Impact of post-ASCT maintenance therapy on outcomes in patients with newly diagnosed multiple myeloma in Connect MM. // Blood Adv. - 2018. – Vol. 2. – P. 1608–1615.


