Поиск антигипертензивных пептидов в гидролизатах свиных субпродуктов с помощью пептидомических подходов
Автор: Разумовская Е.С., Милентьева И.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (103) т.87, 2025 года.
Бесплатный доступ
В последнее время, повышенным спросом пользуются продукты питания с функциональной направленностью, способствующие укреплению здоровья. Перспективным сырьем для такой продукции могут быть субпродукты мясные, например, свиные желудки, богатые источником биологически доступного белка. Целью данного исследования был поиск и идентификация пептидов на предмет ингибиторной активности ангиотензин-превращающего фермента (АПФ) с помощью пептидомических подходов in silico. В качестве объекта исследования предстал белок, идентифицированный в базе UniProt, как P01284. Комбинируя биоинформационные инструменты, можно значительно упростить рабочий процесс, необходимый для скрининга ингибирующих АПФ пептидов, и значительно сократить расходы на поиск активных пептидов, повысив общую эффективность. Установлено, что монопептиды L (Leu), F (Phe) и M (Met) — это активные фрагменты, известных пептидов, обладающих функцией снижать артериальное давление, которые ранее были обнаружены в белках рыбной, растительной, молочной продукции. VF (Val-Phe) содержится в 103 последовательностях, из которых 29 содержат точный пептид Val-Phe. За прототип был выбран точный пептид VF (Val-Phe) выделенный из саркоплазматических белков свинины. Дальнейшие исследования должны включать изучение анти-АПФ-активности in vivo и поиск новых пептидов, что приведет к появлению на рынке более полезных обогащенных продуктов. Комплексный подход позволил ускорить и удешевить процесс идентификации перспективных антигипертензивных пептидов. Представленная методология может быть эффективно применена для дальнейшего поиска биоактивных соединений в животном сырье. Полученные результаты подтверждают потенциал использования свиных субпродуктов для производства функциональных пищевых ингредиентов. В перспективе планируются исследования in vivo для подтверждения биологической активности идентифицированных пептидов и расширения ассортимента нутрицевтиков с доказанным действием.
Животный белок, пептиды, методы in silico, гипертония, антигипертензивная активность, токсичность
Короткий адрес: https://sciup.org/140309699
IDR: 140309699 | УДК: 543.645.6 | DOI: 10.20914/2310-1202-2025-1-93-99
Текст научной статьи Поиск антигипертензивных пептидов в гидролизатах свиных субпродуктов с помощью пептидомических подходов
Гипертония или высокое кровяное давление – это тяжёлое заболевание, от которого страдают более 1,28 миллиарда человек в возрасте от 30 до 79 лет. Это хроническое, часто бессимптомное заболевание, которое является одним из основных факторов риска сердечнососудистых заболеваний, а также заболеваний сердца, почек и других органов [1–2].
Кровяное давление у людей регулируется ренин-ангиотензин-альдостероновой системой (РААС) с помощью двух основных протеаз – ренина и АПФ. Благодаря тому, что ингибиторы АПФ, обладают способностью снижать уровень ангиотензина II, а также сужать кровеносные сосуды, они часто используются при таких заболеваниях, как гипертония [3].
Однако эти синтетические препараты обычно вызывают побочные эффекты, такие как постоянный сухой кашель, ангионевротический отёк и врождённые пороки развития [4].
Патогенез гипертонии сложен и до конца не изучен, так как в его развитии участвуют многие факторы: такие как индекс массы тела, пол, стресс, старение и малоподвижный образ жизни [5].
Следовательно, снижение распространённости гипертонии имеет важное значение, а также существует потребность в новых стратегиях лечения гипертонии [6].
В этом контексте всё больший интерес представляют биоактивные пептиды, которые представляют собой небольшие специфические фрагменты белка (2–20 аминокислотных остатков), высвобождающиеся из натурального белка в результате гидролиза. Таким образом, эти функциональные пептиды обладают разнообразными биологическими свойствами, такими как противовоспалительные, противодиабетические, противо-микробные, а также антигипертензивные [7–8].
Даская-Дикмен и др. отметили, что количество аминокислот в пептидах с антигипертензивными свойствами, полученных из микроводорослей, варьируется от 2 до 11 [9].
Что касается гипертонии, то есть достоверные сведения того, что пептиды могут помочь предотвратить или облегчить это заболевание [10–12].
Так, в последние годы сообщалось о ряде пептидов, снижающих кровяное давление, включая Leu-Ile-Val-Gly-Ile-Ile-Arg-Cys-Val, полученный из миофибриллярных белков говядины [13].
Abachi S и др., доказали наличие антигипертензивного воздействия пептидов на организм, полученных из гидролизата сушёного морского окуня [14].
Синтетические пептиды (QTDEYGNPPR, AGFAGDDAPR, IDESLR и IQDKEGIPPDQQR), обнаруженные в чёрном чае, были протестированы авторами на ингибирующую активность АПФ [15].
Пшеничная клейковина, гидролизованная алкалазой с образованием небольших фрагментов (<1 кДа), была особенно предпочтительной из-за ингибирующего потенциала АПФ. Это говорит о том, что пептиды, полученные из гидролизата пшеничного глютена могут использоваться в нутрицевтиках и функциональных продуктах для профилактики и / или лечения гипертонии [16].
Среди множества потенциальных источников питания, используемых для получения биоактивных пептидов, отличным вариантом являются побочные продукты агропродоволь-ственной промышленности [17].
В частности, особый интерес представляют продукты животного происхождения, поскольку они богаты белками, которые обычно легко извлекаются, и являются недорогими [18–19].
Побочные продукты животного происхождения или субпродукты, являются ценными источниками пептидов, кроме того, повторное использование этих отходов, позволит прийти к безотходному производству [20–22].
Биоинформационные программы является распространённым и эффективным методом поиска антигипертензивных пептидов.
Принимая во внимание все эти факты, в настоящей статье основное внимание уделяется оценке потенциальной роли побочных продуктов свиноводства в качестве источника пептидов, необходимых для разработки физиологически-полезных функциональных пищевых продуктов.
Цель работы – поиск и идентификация пептидов на предмет ингибиторной активности ангиотензин-превращающего фермента (АПФ) с помощью пептидомических подходов in silico .
Материалы и методы
В предыдущих исследованиях, для получения аминокислотной последовательности интересующего белка Р01284, была использована база данных протеомики – UniProt (. Дальнейший гидролиз белка с использованием оптимального фермента (пепсин (рН > 2) осуществлялся в онлайн – режиме с использованием программы Peptide cutter , а полученные пептиды были дополнительно протестированы. Оценку биологической активности идентифицированных пептидов проводили при помощи программы Peptide Ranker . Для дальнейшего анализа были отобраны пептиды со значением ≥ 0,5.
Прогнозирование растворимости полученных пептидов в воде осуществляли с использованием инструмента Innovagen .
Кроме того, для систематического прогнозирования антигипертензивных свойств пептидов, с использованием комплексной программы AHTPDB были отобраны пептиды с «хорошей растворимостью в воде». Наконец, все потенциально биоактивные пептиды, были проверены на токсичность с помощью инструмента ToxinPred .
Комбинируя вышеперечисленные биоин-формационные инструменты, можно значительно упростить рабочий процесс, необходимый для скрининга ингибирующих АПФ пептидов, и значительно сократить расходы на поиск активных пептидов, повысив общую эффективность.
Результаты
Таблица 1.
Идентифицированные пептидные последовательности из фракции гидролизата белка (Р01284) с молекулярной массой 8,539 кДа *
Table 1.
Identified peptide sequences from the protein hydrolyzate fraction (Р01284) with a molecular weight of 8.539 kDа*
|
Пептидная последовательность Peptide sequence |
Значение ранкера пептидов Peptide ranker value |
Используемые ферменты Enzymes used |
|
F (Phe) |
0,999052 |
Протеиназа K |
|
DGVF (Asp-Gly-Val-Phe) |
0.729146 |
Пепсин (рН > 2) |
|
L (Leu) |
0,639092 |
Пепсин (рН > 2) |
|
VF (Val-Phe) |
0,815398 |
Пепсин (рН > 2) |
|
MA (Met – Ala) |
0,693293 |
Пепсин (рН > 2) |
|
M (Met) |
0,970074 |
Термолизин |
* Информация получена авторами из результатов поиска с помощью программного обеспечения Peptide Ranker 12 декабря 2024 г
* Information obtained by the authors from a search using Peptide Ranker software on December 12, 2024
Белок был выделен с помощью масс-спектрометрии, а показатель Peptide Ranker указывает на потенциальную биологическую активность (чем ближе показатель к 1, тем выше биологическая активность).
Идентифицированные моно-пептид Phe и Met получили оценку 0,9 по шкале Peptide Ranker, что является самым высоким значением, полученным для любого пептида.
Это указывает на то, что данные пептиды, обладают биологической активностью. Допустимые значения вероятности биологической активности находятся в диапазоне от 0,5 до 1,0. Ди-пептид Val-Phe получил оценку 0,81 по шкале Peptide Ranker, что указывает на высокую потенциальную биологическую активность. Тетрапептид Asp – Gly-Val-Phe получили оценку 0,78. Пептиды Met – Ala и Leu получил оценку 0,6.
Далее, определяем молекулярную массу, изоэлектрическую точку и растворимость пептидов в воде.
Установлено, что пептиды, имеющие буквенный код MA (Met – Ala) и DGVF (Asp – Gly-Val-Phe) имеют плохую растворимость в воде.
Наибольшую изоэлектрическую точку имеют пептиды VF (Val-Phe), L (Leu) и M (Met) равную 3,67, 3,63 и 3,46 соответственно.
Молекулярная масса равная 436,46 g/mol соответствует пептиду DGVF (Asp – Gly-Val-Phe) (таблица 2).
Таблица 2.
Определение физико-химических свойств пептидов
Table 2.
Determination of physicochemical properties of peptides
|
Singie letter code (Буквенный код) |
Triple letter code (Трехбуквенный код) |
Physiochemical properties (Физико-химические свойства) |
|||||
|
number of residues (количество остатков) |
molecular weight (молекулярная масса) |
extinction coefficient (коэффициент вымирания) |
iso-electric point (изоэлектрическая точка) |
net charge at ph 7 (чистый расход при ph 7) |
estimated solubility (расчетная растворимость) |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
L (Leu) |
NН2-Leu-COOH |
1 |
131,17 g/mol |
0 М - 1 cm ’ 1 |
3,63 |
0 |
good water solubility хорошая растворимость в воде |
|
MA (Met-Ala) |
NН2-Met-Ala-COOH |
2 |
220,29 g/mol |
0 М - i cm ’ i |
3,37 |
0 |
poor water solubility плохая растворимость в воде |
Продолжение таблицы 2 | Continuation of table 2
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
DGVF (Asp-Gly-Val-Phe) |
NН2-Asp-Gly-Val-Phe-COOH |
4 |
436,46 g/mol |
0 М ’ 1 cm ’ 1 |
0,76 |
-1 |
poor water solubility плохая растворимость в воде |
|
VF (Val-Phe) |
NН2-Val-Phe-COOH |
2 |
264,32 g/mol |
0 М ’ i cm ’ i |
3,67 |
0 |
good water solubility хорошая растворимость в воде |
|
M (Met) |
NН2-Met-COOH |
1 |
149,21 g/mol |
0 М ’ i cm ’ i |
3,46 |
0 |
good water solubility хорошая растворимость в воде |
|
F (Phe) |
NН2-Phe-COOH |
1 |
165,19 g/mol |
0 М " i cm ’ i |
3,45 |
0 |
good water solubility хорошая растворимость в воде |
* Информация получена авторами из результатов поиска с помощью инструмента Innovagen 27 декабря 2024 г.
Следующий этап работы заключался в анализе токсичности пептидов. Проводили сравнительную оценку шести анализируемых пептидов. Последующая оценка токсичности показала, что все исследуемые пептиды «нетоксичны» (таблица 3).
Таблица 3.
Предсказание токсичности пептидов
Table 3.
Peptide Toxicity Prediction
|
Пептидная последовательность Peptide sequence |
Положение мутации Mutation position |
Оценка SVM SVM score |
Предсказание Prediction |
Гидрофобность Hydrophobicity |
Гидрофильность Hydrophilicity |
Моль вес Mole weight |
|
VF (Val-Phe) |
Никакой мутации No mutation |
-0.80 |
Не токсичен Non-toxic |
0.57 |
-2.00 |
264.34 |
|
MA (Met-Ala) |
-0.80 |
0.26 |
-0.90 |
220.30 |
||
|
F (Phe) |
0.61 |
0.70 |
0.00 |
– |
||
|
DGVF (Asp-Gly-Val-Phe) |
-0.90 |
0.15 |
-0.25 |
436.51 |
||
|
L (Leu) |
0.53 |
0.53 |
0.00 |
– |
||
|
M (Met) |
0.26 |
0.78 |
0.00 |
– |
* Информация получена авторами из результатов поиска с помощью инструмента ToxinPred 28 декабря 2024 г.
* Information retrieved by the authors from search results using the ToxinPred tool on December 28, 2024.
Для дальнейшего прогнозирования ингибирующей активности АПФ были отобраны пептиды с «хорошей растворимостью в воде».
Идентификация пептидной последовательности во фракциях, демонстрирующих антигипертензивную активность, была проведена с помощью комплексной программы AHTPDB.
В ходе исследования было установлено, что монопептиды L (Leu), F (Phe) и M (Met) – это активные фрагменты, известных пептидов, обладающих функцией снижать артериальное давление, которые ранее были обнаружены в белках рыбной, растительной, молочной продукции [23–25].
Монопептид L (Leu) содержался в 1984, F (Phe) – в 1265, M (Met) – в 413 последовательностях белков, обладающих функцией снижать артериальное давление.
VF (Val-Phe) содержится в 103 последовательностях, из которых 29 содержат точный пептид Val-Phe. За прототип был выбран точный пептид VF (Val-Phe) выделенный из саркоплазматических белков свинины. Молярный вес которого составляет 264.32, изоэлектрическая точка = 5.49.
Дальнейшее исследование было направлено на определение физико-химических свойств антигипертензивного пептида VF.
Данные по определению состава, гидрофобности, полярности представлены на рисунке 1.
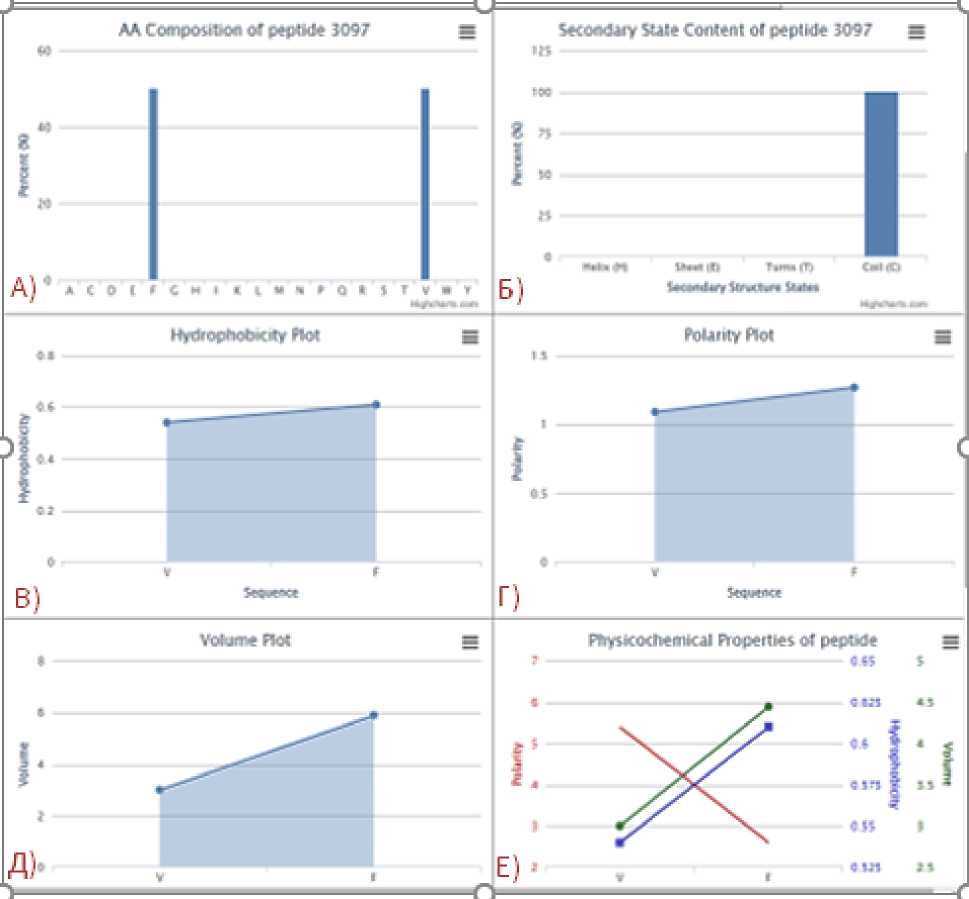
Рисунок 1. Отображаемые физико-химические свойства пептида VF (Val-Phe): А) Состав пептида (процент,%): V50%, F 50%; Б) Содержание пептида во вторичном состоянии: 100%; В) График гидрофобности: последовательность от V = 0,54 до F = 0,61; Г) График полярности: последовательность от V = 1,09 до F = 1,27; Д) График объема: последовательность от V = 3 до F = 5,89; Е) Физико-химические свойства пептида: (полярность от F = 2,8 до V = 4,2; гидрофобность от V = 0,5 до F = 0,61, объем от V = 3 до F = 5,89)
Figure 1. Displayed physicochemical properties of VF peptide (Val-Phe): А) Composition of peptide (percent,%): V50%, F 50%; Б) Secondary state content of peptide: 100%; В) Hydrophobicity plot (V = 0,54, F = 0,61; Г) Polarity plot: V = 1,09, F = 1,27; Д) Volume plot: V = 3, F = 5,89; Е) Physicocchemical propertias of peptide: (роlаritу F = 2,8, V = 4,2; нуdrорhоbiсitу V = 0,5, F = 0,61, volume V = 3 F = 5,89)
Анализ показывает, что исследуемый пептид состоит из аминокислот с полярными и гидрофобными свойствами. Наши исследования согласуются с ранее опубликованными и подтверждают то, что гидрофобные аминокислоты с положительнымзарядом могут способствовать взаимодействию пептидов с АПФ [26].
Заключение
Протеомными методами, а также при помощи платформы AHTPDB, был успешно отобран пептид VF (Val-Phe) с доказанной антигипертензивной активностью.
Полученные результаты дают дополнительные доказательства наличия пептидов в свиных субпродуктах, ингибирующих АПФ.
Рабочий процесс, описанный в этом исследовании, может быть применён для быстрой и точной идентификации пептидов. Дальнейшие исследования будут включать изучение анти-АПФ-активности in vivo и поиск новых пептидов, что приведет к появлению на рынке более полезных обогащенных продуктов.


