Поиск ассоциаций полиморфных вариантов гена кислой хитиназы человека с бронхиальной астмой у детей г. Новосибирска
Автор: Макарова С.И., Митрофанов Д.В., Шинтяпина А.Б., Комова Е.Г., Зеленская В.В., Карцева Т.В., Кондюрина Е.Г., Вавилин В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
Высокая распространенность бронхиальной астмы (БА) среди населения (около 300 млн чел. во всем мире) делает актуальным поиск кандидатных генов заболевания. Кислая хитиназа человека (CHIA (AMCase)), кодируемая геном CHIA, участвует в деградации хитина, компонента клеточных стенок грибов и экзоскелета членистоногих, присутствие которых в пище или домашней пыли является провоцирующим фактором развития БА. Функционально значимые мутации в гене CHIA могут, по-видимому, усиливать риск подверженности БА.Цель исследования: оценка ассоциации однонуклеотидных замен (SNP) rs12033184 и rs3806448 в гене CHIA с БА у детей г. Новосибирска.Материал и методы. Исследование было организовано как «случай - контроль». В работе были использованы 537 образцов крови. SNP определяли методом ПЦР с детекцией в реальном времени. Ассоциацию полиморфных вариантов с заболеванием оценивали по отношению шансов (odds ratio - OR).Результаты. Не обнаружено ассоциации rs12033184 и rs3806448 с БА. Эти результаты приводят к выводу, что роль гена кислой хитиназы в развитии БА в популяции жителей г. Новосибирска менее существенна, чем в индийской популяции, где ранее была показана ее связь с заболеванием.
Ген кислой хитиназы человека, бронхиальная астма, rs12033184, rs3806448
Короткий адрес: https://sciup.org/149139373
IDR: 149139373 | УДК: 575.174.015.3:616.248](571.14) | DOI: 10.29001/2073-8552-2021-36-4-92-98
Текст научной статьи Поиск ассоциаций полиморфных вариантов гена кислой хитиназы человека с бронхиальной астмой у детей г. Новосибирска
Makarova S.I., Mitrofanov D.V., Shintyapina A.B., Komova E.G., Zelenskaya V.V., Kartseva T.V., Kondyurina E.G., Vavilin V.A. Search for associations between polymorphic variants of human acid chitinase gene and bronchial asthma in children of Novosibirsk. The Siberian Journal of Clinical and Experimental Medicine. 2021;36(4):92–98.
Бронхиальная астма (БА) – это хроническое воспалительное заболевание легких, характеризующееся воспалением дыхательных путей, обструкцией и ремоделированием. Воздействие аллергенов приводит к адаптивным и врожденным иммунным реакциям и усилению провос-палительных и профибротических факторов. В результате происходит реконструкция дыхательных путей. Тем не менее механизмы, лежащие в основе воспалительных и структурных изменений при астме, до сих пор до конца неясны [1].
Поиск кандидатных генов для различных заболеваний продолжается по сей день. Ген кислой хитиназы ( CHIA )
привлекает внимание в качестве кандидатного гена для БА по нескольким причинам: во-первых, он располагается на первой хромосоме в районе 1p13.2, который ассоциирован с астмой в полногеномных исследованиях (Genome-wide Association Studies – GWAS) [2, 3]. Во-вторых, этот ген кодирует белок, деградирующий хитин, содержащийся в клеточных стенках большинства грибов и насекомых (в частности клещей), которые часто являются провоцирующими агентами для развития астмы [4, 5]. Кроме того, этот белок играет роль в иммунном ответе Т-хелперных клеток 2-го типа (Th2), способствует ответу на IL-13 и воспалению в ответ на IL-13, стимулирует выработку хемокинов эпителиальными клетками легких, защищает эпителиальные клетки легких от апоптоза и способствует фосфорилированию AKT1 [5]. Ген CHIA полиморфен [6].
В некоторых работах [7–9] показана ассоциация полиморфизмов CHIA c предрасположенностью к БА, тогда как в работе [10] не выявлено ассоциаций полиморфных вариантов этого гена с заболеванием астмой. В российских популяциях ген CHIA не изучен ни в отношении распространения полиморфных вариантов, ни в отношении их связи с БА. Необходимость таких исследований обусловлена значительной генетической дифференциацией популяций по генам, ассоциированным с различными заболеваниями [11, 12]. Мы оценили два варианта этого гена: rs12033184 (C/A) и rs3806448 (G/A), которые находятся в промоторной области гена и для которых показано, что rs12033184 снижает транскрипцию гена, а rs3806448 не влияет на нее [7].
Материал и методы
В работе использовались 537 образцов цельной крови от двух групп населения г. Новосибирска. Группу I составили больные атопической БА, установленной в рамках исследования по протоколу Международного исследования астмы и аллергии у детей (International Study of Asthma and Allergy in Childhood – ISAAC) (n = 92, возраст от 7 до 14 лет, средний возраст – 10,2 года, 64,8% мальчиков и 35,2% девочек). Дети были отобраны в ходе эпидемиологического исследования, проведенного по программе ISAAC, в результате которого были выявлены школьники с врачебно-установленным диагнозом БА. Диагноз был подтвержден в соответствии с критериями, обозначенными в международных и российских согласи- тельных документах; факторы риска изучены на основании опросника 2-й фазы программы ISAAC. Всем детям было проведено исследование функции внешнего дыхания, в том числе с выполнением провокационных (физическая нагрузка) и бронходилатационных тестов, аллергологическое обследование методом прик-тестирования со стандартным набором аллергенов. У всех детей выявлено персистирующее течение БА: у 66 детей – легкой и у 26 – среднетяжелой степени.
Группа II – популяционная выборка жителей г. Новосибирска, предоставленная АО «Вектор-Бест» ( n = 445).
Информированное согласие на исследование детей подписывали их родители.
Выделение ДНК осуществлялось при помощи набора «РеалБест экстракция 100» (АО «Вектор-Бест», Новосибирск) согласно рекомендациям производителя. Предварительно размороженная кровь обрабатывалась гемолитическим реагентом «РеалБестГемолитик» той же фирмы.
Оценка полиморфных вариантов гена CHIA проводилась ПЦР с детекцией в реальном времени с использованием «БиоМастер HS-qPCR SYBR Blue(2×)» компании «Биолабмикс». Условия проведения реакции для rs12033184: первичная денатурация и активация Taq-полимеразы при 95 °C 3 мин; затем 44 цикла (95 °C – 10 с, 59 °C – 30 с). Для rs3806448: 95 °C – 3 мин; затем последующие 44 цикла (95 °C – 10 с, 61 °C – 30 с). Праймеры для аллель-специфичной ПЦР в реальном времени подбирали с использованием программы PrimerBlast. Для каждого полиморфного варианта предложено по три праймера (два прямых и один обратный), таблица 1.
Таблица 1. Праймеры для аллель-специфичной ПЦР
Table 1. Primers for allele-specific Real-Time PCR
|
Варианты Variants |
Название Primer title |
Последовательность праймера Primer sequence |
Tm, °C |
|
rs12033184 (A/C) |
CHIA -184FC |
5’- TCATAAAGACATCATGGTTGA T G C |
60,3 |
|
CHIA -184FA |
5’- TCATAAAGACATCATGGTTGA C G A |
60,3 |
|
|
CHIA -184R |
5’- AACAACTTAAGTCCAGTGTCCG |
60,1 |
|
|
rs3806448 (G/A) |
CHIA -448FG |
5’- GATACTGCGTAGTTAAGATCA A C G |
62,0 |
|
CHIA -448FA |
5’- GATACTGCGTAGTTAAGATCA C C A |
62,0 |
|
|
CHIA -448R |
5’- TTGATCCTGCTTGGATAAGACCAT |
62,0 |
На рисунках 1, 2 показан метод оценки генотипа пациента. В зависимости от генотипа различалось пороговое число циклов: если в геноме пациента присутствуют оба аллеля rs12033184 – А и С, то пороговое значение было примерно 25 циклов. Если генотип гомозиготный, то наблюдаются два пороговых значения цикла: 25 – для комплементарного данному аллелю праймера и 32 – для отсутствующего rs12033184 А или 36 – для rs12033184 С (см. рис. 1). Для гетерозиготного генотипа rs3806448 пороговое значение также составляло 25 циклов. В случае гомозиготного генотипа наблюдается два пороговых значения цикла: 25 – для комплементарного аллелю праймера и 29 – для отсутствующего rs3806448G или 33 для rs3806448A (см. рис. 2).
Статистическая обработка результатов проводилась в программе Epi_Info6. На этапе планирования были рассчитаны величины выборок, достаточных для получения достоверных величин отношения шансов (odds ratio – OR) при статистической значимости 0,05 и мощности 80% при известных частотах встречаемости мутации. Для OR = 2 достаточной является численность 360 в контрольной группе и 90 – в группе пациентов при организации исследования «случай – контроль» при частоте встречаемости SNP в контрольной группе 44–47%, которая и сообщается для европеоидов [13, 14]. Таким образом, размер наших выборок был достаточным для того, чтобы заметить ассоциации полиморфных вариантов гена кислой хитиназы человека с БА.
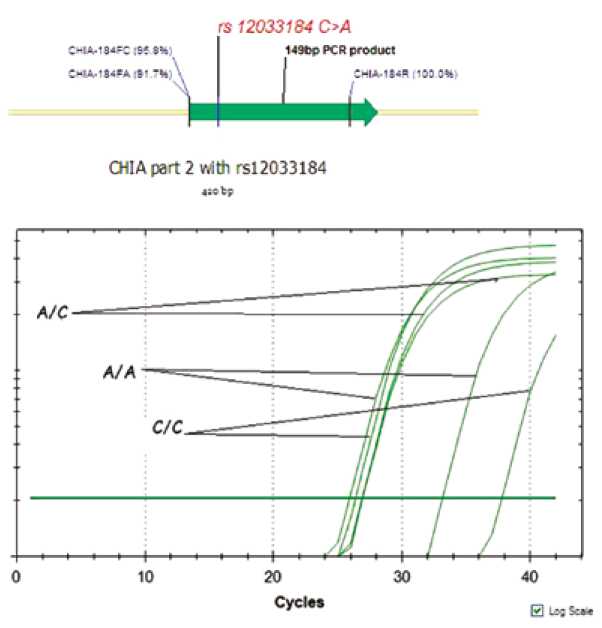
Рис. 1. Генотипирование rs12033181
Fig. 1. Genotyping of rs12033181
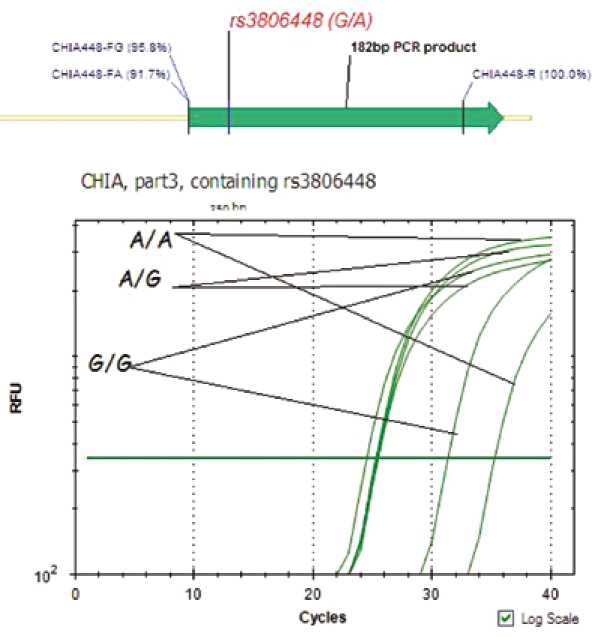
Рис. 2. Генотипирование rs3806448
Fig. 2. Genotyping of rs3806448
Результаты
Мы оценили частоты встречаемости в гене CHIA (rs3806448(G→A) и rs12033184 (С→A)) в 445 образцах крови жителей г. Новосибирска (популяционный контроль) и в 91 образце крови детей с признаками астмы, выявленной по опроснику ISAAC. Частоты встречаемости полиморфных вариантов составили для rs3806448 G – 0,5272: A – 0,4728 – для популяционного контроля и G 0,5055: A – 0,4945 – для детей с признаками астмы. Соответственно для rs120033184 G 0,5528: A – 0,4472 – для популяционного контроля и G – 0,5281: A – 0,4719 – для детей с признаками астмы. Частоты встречаемости этих вариантов соответствуют данным по другим выборкам европеоидов [13, 14]. Расчеты величин отношения шансов показали отсутствие ассоциации исследованных полиморфных вариантов с заболеванием (OR = 0,92 для rs3806448 G; OR = 0,91 для rs120033184), таблица 2.
Таблица 2. Ассоциация полиморфных вариантов гена CHIA с бронхиальной астмой
Table 2. Associations between polymorphic variants of the CHIA gene and bronchial asthma
|
Показатель |
Популяционный контроль Population control |
БА Asthma |
OR (95% ДИ) |
p |
|
CHIA rs3806448 |
||||
|
GG |
116 |
23 |
– |
– |
|
AG |
233 |
46 |
– |
– |
|
AA |
92 |
22 |
– |
– |
|
G |
465 |
92 |
0,92 (0,66–1,28) |
0,5933 |
|
A |
417 |
90 |
1,09 (0,78–1,52) |
0,5933 |
|
СН IA rs12033184 |
||||
|
CC |
133 |
23 |
– |
– |
|
AC |
226 |
48 |
– |
– |
|
AA |
86 |
18 |
1,1 (0,79–1,54) |
0,5452 |
|
C |
492 |
94 |
0,91 (0,65–1,27) |
0,5452 |
|
A |
398 |
84 |
– |
– |
Обсуждение
Для защиты от хитинсодержащих патогенов у человека экспрессируются хитиназы ( CHIT 1 и CHIA ) и хитиназоподобные белки, включая CHI3L 1 (хитиназа 3-like 1), CHI3L 2 (хитиназа 3-like 2), OVGP 1 (специфичный для яйцевода гликопротеин) и CHID 1 (стабилизин-1 – взаимодействующий хитиназоподобный белок). Хитин поступает в дыхательные пути с частичками пылевых клещей и других организмов. В стенке дыхательных путей эти частицы инициируют врожденный иммунный ответ, стимулируя, в том числе, выработку цитокинов, хитиназ ( CHIT 1 и CHIA и CHI3L 1) в макрофагах, нейтрофилах и эозинофилах.
Хитиназы, продуцируемые в стенке дыхательных путей, расщепляют хитины (полимеры) на фрагменты, или хитины связываются с хитиназоподобными белками, такими как CHI3L 2, которые изменяют биологические эффекты фрагментов хитина на иммунный ответ [15, 16]. Они также индуцируют Th2-доминантные иммунные ответы, которые связаны с аллергическим воспалением, включая повышенную выработку провоспалительных цитокинов, сывороточного IgE и выраженную эозинофилию ткани. Эти цитокины и профибротические факторы, в свою очередь, управляют воспалением и ремоделированием в стенках бронхов [17]. Несмотря на столь многообещающие свойства хитиназ и хитиназоподобных белков для изучения их в качестве кандидатных генов для БА, работ по исследованию ассоциации полиморфных вариантов CHIA c астмой немного, хотя интерес к этим белкам наблюдается с начала 2000-х гг. В настоящее время известно множество полиморфных вариантов гена CHIA [6].
В нескольких работах показана ассоциация вариантов этих генов с астмой в индийской [7] и китайской [8] популяциях при значительно меньших выборках, чем в нашем исследовании. Противоречивые результаты получены в европеоидных выборках [9, 10]. Ассоциация с БА именно тех вариантов, что мы исследовали в своей работе, наблюдалась в работах [7, 10]. Указанные различия могут объясняться, по-видимому, как этническими особенностями изученных выборок, так и средовыми различиями и гетерогенностью факторов риска БА в нашем и цитируемых исследованиях. В пользу наличия связи между функциональной активностью хитиназ и астмой говорят результаты работы [18], в которой исследовано влияние на госпитализацию с приступами астмы пациентов с разными генотипами хитиназ и разным уровнем пыли от плесневых грибов в их домах.
Показано, что роль полиморфных вариантов хитиназ способна меняться в зависимости от экспозиции плесневыми грибами. Поскольку в нашей работе и в работах [7, 10, 18] выборки составлены из европеоидов, и мы не видим значимых различий в частотах изученных SNP между этими выборками, этнические особенности не имели существенного значения. Наши результаты имеют определенные ограничения, так как в анализ вошли дети только с легкой и среднетяжелой персистирующей БА, что не исключает возможной связи полиморфных вариантов гена кислой хитиназы человека с тяжелой формой патологии и может быть предметом дальнейших изучений, в том числе с учетом характера и степени сенсибилизации к определенным аллергенам, в частности к клещам-дер-матофагоидам. В то же время эти результаты отражают, по-видимому, тот факт, что в условиях больших городов, к числу которых относится и г. Новосибирск, относительно больший вклад в развитие БА вносят присущие им антропогенные загрязнители, что подтверждается высокими показателями ассоциаций с этим заболеванием полиморфных вариантов генов метаболизма ксенобиотиков [19, 20].
Список литературы Поиск ассоциаций полиморфных вариантов гена кислой хитиназы человека с бронхиальной астмой у детей г. Новосибирска
- Grayson M.H., Feldman S., Prince B.T., Patel P.J., Matsui E.C., Apter АЛ. А^апсеэ in asthma in 2017: Mechanisms, biologies, and genetics. J. Allergy Clin. Immunol. 2018;142(5):1423-1436. DOI: 10.1016/j. jaci.2018.08.033.
- García-Sánchez А., Isidoro-García M., García-Solaesa V., Sanz C., Hernández-Hernández L., Padrón-Morales J. et al. Genome-wide association studies (GWAS) and their importance in asthma. Aller-gol. Immunopathol. (Madr.). 2015;43(6):601-608. DOI: 10.1016/j.al-ler.2014.07.004.
- Ober C. Asthma genetics in the Post-GWAS Era. Ann. Am. Thorac. Soc. 2016;13(1):S85-S90. DOI: 10.1513/AnnalsATS.201507-459MG.
- Masaki K., Fukunaga K., Matsusaka M., Kabata H., Tanosaki T., Mochi-maru T. et al. Characteristics of severe asthma with fungal sensitization. Ann. Allergy Asthma Immunol .2017;119(3):253-257. DOI: 10.1016/j. anai.2017.07.008.
- Agache I., Lau S., Akdis C.A., Smolinska S., Bonini M., Cavkaytar O.J. et al. EAACI Guidelines on Allergen Immunotherapy: House dust mite-driven allergic asthma. Allergy. 2019;74(5):855-873. DOI: 10.1111/all.13749.
- dbSNP. CHIA. URL: https://www.ncbi.nlm.nih.gov/snp/?term=CHIA
- Chatterjee R., Batra J., Das S., Sharma S.K., Ghosh B. Genetic association of acidic mammalian chitinase with atopic asthma and serum total IgE levels. J. Allergy Clin. Immunol. 2008;122 (1):202-208,208.e1-7. DOI: 10.1016/j.jaci.2008.04.030.
- Zhu Y., Yan X., Zhai C., Yang L., Li M. Association between risk of asthma and gene polymorphisms in CHI3L1 and CHIA: A systematic meta-analysis. BMC Pulm. Med. 2017;17(1):193. DOI: 10.1186/s12890-017-0515-2.
- Bierbaum S., Nickel R., Koch A., Lau S., Deichmann K.A., Wahn U. et al. Polymorphisms and haplotypes of acid mammalian chitinase are associated with bronchial asthma. Am. J. Respir. Crit. Care Med. 2005;172(12):1505-1509. DOI: 10.1164/rccm.200506-890OC.
- Wu A.C., Lasky-Su J., Rogers C.A., Klanderman B.J., Litonjua A. Polymorphisms of chitinases are not associated with asthma. J. Allergy Clin. Immunol. 2010;125(3):754-757,757.e1-757.e2. DOI: 10.1016/j. jaci.2009.12.995.
- Пузырев В.П., Кучер А.Н. Эволюционно-онтогенетические аспекты патогенетики хронических болезней человека. Генетика. 2011;47(12):1573-1585.
- Степанов В.А. Геномы, популяции, болезни: этническая геномика и персонифицированная медицина. Acta Naturae. 2010;2(4):18-34.
- dbSNP. rs3806448. URL: https://www.ncbi.nlm.nih.gov/snp/rs3806448#-frequency_tab
- dbSNP. rs12033184. URL: https://www.ncbi.nlm.nih.gov/snp/ rs12033184#frequency_tab
- Tjoelker L.W., Gosting L., Frey S., Hunter C.L., Trong H.L., Steiner B. et al. Structural and functional definition of the human chitinase chi-tin-binding domain. J. Biol. Chem. 2000;275(1):514-520. DOI: 10.1074/ jbc.275.1.514.
- Ober C., Chupp G.L. The chitinase and chitinase-like proteins: A review of genetic and functional studies in asthma and immune-mediated diseases. Curr. Opin. Allergy Clin. Immunol. 2009;9(5):401-408. DOI: 10.1097/ACI.0b013e3283306533.
- Van Eijk M., van Roomen C.P., Renkema G.H., Bussink A.P., Andrews L., Blommaart E.F. et al. Characterization of human phagocyte-derived chitotriosidase, a component of innate immunity. Int. Immunol. 2005;17(11):1505-1512. DOI: 10.1093/intimm/dxh328.
- Wu A.C., Lasky-Su J., Rogers C.A., Klanderman B.J., Litonjua A. Fungal exposure modulates the effect of polymorphisms of chitinases on emergency department visits and hospitalizations. Am. J. Respir. Crit. Care Med. 2010;182(7):884-889. DOI: 10.1164/rccm.201003-0322OC.
- Вавилин В.А., Макарова С.И., Ляхович В.В., Гавалов С.М. Ассоциация полиморфных генов ферментов биотрансформации ксенобиотиков с предрасположенностью к бронхиальной астме у детей с наследственной отягощенностью и без таковой. Генетика. 2002;38(4):539-545.
- Карунас А.С., Юнусбаев Б.Б., Федорова Ю.Ю., Гималова Г.Ф., Рама-занова Н.Н., Гурьева Л.Л. и др. Полногеномный анализ ассоциации бронхиальной астмы в Волго-Уральском регионе России. Молекулярная биология. 2011;45(6):992-1003.


