Поиск генов, ассоциированных с возрастом начала яйцекладки у кур-несушек (Gallus gallus L.)
Автор: Джагаев А.Ю., Волкова Н.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Возраст начала яйцекладки - важный селекционный признак, учитываемый при разведении сельскохозяйственной птицы, особенно при получении высокопродуктивных яичных кроссов. Выравненность по этому показателю в популяции кур-несушек, используемой в условиях промышленного производства яиц, приобретает особую актуальность, так как позволяет синхронизировать продолжительность продуктивного использования птицы и повысить общую яичную продуктивность стада. Начало периода яйцекладки зависит от ряда факторов и связано прежде всего с наступлением половой зрелости самок. На сельскохозяйственной птице в ряде исследований (в том числе полногеномных) показана генетическая обусловленность этого признака и выявлены соответствующие генетические маркеры для срока полового созревания и снесения первого яйца у несушек. Тем не менее этот вопрос все еще требует изучения с учетом особенностей видов, пород, кроссов, популяций. Мы провели полногеномные ассоциативные исследования (genome-wide association studies, GWAS) возраста начала яйцекладки у кур (Gallus gallus) F2 ресурсной популяции на основании данных полногеномного генотипирования. Цель работы - поиск однонуклеотидных полиморфизмов (single nucleotide polymorphisms, SNPs) и идентификация генов, ассоциированных у кур-несушек с началом периода продуктивного использования. Исследования проводили на курах F2 модельной ресурсной популяции (n = 95), полученной посредством скрещивания двух пород, контрастных по показателям яичной продуктивности, - русская белая и белый корниш (физиологический двор ФГБНУ ФИЦ животноводства - ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы). Птицу F2 ресурсной популяции генотипировали с использованием чипов средней плотности Illumina Chicken 60K SNP iSelect BeadChip («Illumina, Inc.», США). Для оценки возраста начала яйцекладки проводили индивидуальный учет показателей яичной продуктивности. В возрасте 12 нед птицу переводили на индивидуальное клеточное содержание. Возрастом начала яйцекладки считали возраст снесения полноценного яйца. На основании полученных генотипических и фенотипических экспериментальных данных выполнили GWAS анализ, используя программное обеспечение PLINK 1.9 (https://www.cog-genomics.org/plink/). Полученная F2 ресурсная популяция кур-несушек характеризовалась высокой вариабельностью возраста начала яйцекладки: внутрипопуляционные различия по этому показателю достигали 58,2 %. На основании проведенного GWAS анализа идентифицированы однонуклеотидные полиморфизмы и гены-кандидаты, ассоциированные с началом яйцекладки у кур исследованной F2 ресурсной популяции. Установлено 8 значимых SNPs (p -4), связанных с изученным показателем и локализованных на хромосоме GGA3. В области обнаруженных SNPs мы выявили 60 генов, в том числе 4 гена, совпадающих с позициями этих SNPs, - AIDA, NKAIN2, LIN9 и MAP4K3 . Результаты исследования могут быть использованы в геномной селекции кур на повышение яичной продуктивности и продуктивного потенциала.
Gallus gallus, куры, gwas, snps, гены-кандидаты, яичная продуктивность, начало продуктивного использования
Короткий адрес: https://sciup.org/142243761
IDR: 142243761 | УДК: 636.5:575.2 | DOI: 10.15389/agrobiology.2024.4.658rus
Текст научной статьи Поиск генов, ассоциированных с возрастом начала яйцекладки у кур-несушек (Gallus gallus L.)
Возраст начала яйцекладки — важный селекционный признак, учитываемый при разведении сельскохозяйственной птицы, особенно при получении высокопродуктивных яичных кроссов. Выравненность по этому показателю в популяции кур-несушек, используемой в условиях промышленного производства яиц, приобретает особую актуальность, так как позволяет синхронизировать продолжительность продуктивного использования птицы и повысить общую яичную продуктивность стада. Начало периода яйцекладки зависит от ряда факторов и связано прежде всего с наступлением половой зрелости самок. На сельскохозяйственной птице в ряде исследований (в том числе полногеномных) показана генетическая обусловленность этого признака и выявлены соответствующие генетические маркеры для срока полового созревания и снесения первого яйца у несушек. Тем не менее этот вопрос все еще требует изучения с учетом особенностей видов, пород, кроссов, популяций. Мы провели полногеномные ассоциативные исследования (genome-wide association studies, GWAS) возраста начала яйцекладки у кур (Gallus gallus) F2 ресурсной популяции на основании данных полногеномного генотипирования. Цель работы — поиск однонуклеотидных полиморфизмов (single nucleotide polymorphisms, SNPs) и идентификация генов, ассоциированных у кур-несушек с началом периода продуктивного использования. Исследования проводили на курах F2 модельной ресурсной популяции (n = 95), полученной посредством скрещивания двух пород, контрастных по показателям яичной продуктивности, — русская белая и белый корниш (физиологический двор ФГБНУ ФИЦ животноводства — ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы). Птицу F2 ресурсной популяции генотипировали с использованием чипов средней плотности Illumina Chicken 60K SNP iSelect BeadChip («Illumina, Inc.», США). Для оценки возраста начала яйцекладки проводили индивидуальный учет показателей яичной продуктивности. В возрасте 12 нед птицу переводили на индивидуальное клеточное содержание. Возрастом начала яйцекладки считали возраст снесения полноценного яйца. На основании полученных генотипических и фенотипических экспериментальных данных выполнили GWAS анализ, используя программное обеспечение PLINK 1.9 . Полученная F2 ресурсная популяция кур-несушек характеризовалась высокой вариабельностью возраста начала яйцекладки: внутрипопуля-ционные различия по этому показателю достигали 58,2 %. На основании проведенного GWAS анализа идентифицированы однонуклеотидные полиморфизмы и гены-кандидаты, ассоциированные с началом яйцекладки у кур исследованной F2 ресурсной популяции. Установлено 8 значимых SNPs (p < 1,05½10-4), связанных с изученным показателем и локализованных на хромосоме GGA3. В области обнаруженных SNPs мы выявили 60 генов, в том числе 4 гена, совпадающих с позициями этих SNPs, — AIDA, NKAIN2, LIN9 и MAP4K3. Результаты исследования могут быть использованы в геномной селекции кур на повышение яичной продуктивности и продуктивного потенциала.
Птицеводство занимает одну из лидирующих позиций в структуре агропромышленного производства. Большим спросом пользуется как мясо, так и яйцо сельскохозяйственной птицы (1). При этом значительная доля птицеводческой продукции приходится на яйцо кур и перепелов. Устойчивое развитие и конкурентоспособность птицеводческой отрасли связаны прежде всего с использованием высокопродуктивных пород, линий и кроссов птицы. В яичном птицеводстве в условиях промышленного производства важное значение приобретает целенаправленная селекция по комплексу показателей, определяющих высокую яичную продуктивность (2-4). Один из таких показателей — возраст снесения первого яйца (начало яйцекладки). Селекция птицы по этому признаку при создании промышленных яичных линий и кроссов приобретает особую актуальность. Выравненность промышленной популяции несушек по срокам начала яйцекладки позволяет синхро-
∗ Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ, тема ¹ FGGN-2024-0015.
низировать продолжительность продуктивного использования птицы и повысить общую яичную продуктивность стада.
Начало яйцекладки связано с наступлением половой зрелости самок, поэтому возраст снесения первого яйца рассматривается как показатель, позволяющий прогнозировать не только яичную продуктивность, но и репродуктивную способность птицы. Половое созревание и наступление половой зрелости у животных и птицы регулируется гипоталамо-гипофи-зарно-гонадной системой. В ряде исследований показано влияние гормонов и генов гипоталамо-гипофизарно-гонадной оси на показатели яичной продуктивности, в том числе на возраст начала яйцекладки у разных видов сельскохозяйственной птицы, в частности у кур (5, 6) и гусей (7). Так, Y.G. Tan с соавт. (5) на 6 группах кур, разделенных по возрасту снесения первого яйца, установили низкую плодовитость и более короткую продолжительность пика яйценоскости у самок с поздним сроком полового созревания и началом яйцекладки.
Возраст снесения первого яйца зависит от множества внутренних и внешних факторов (8). К основным факторам, определяющим начало яйцекладки и яичную продуктивность у самок сельскохозяйственной птицы, можно отнести генотип (9, 10), условия кормления (11-13) и содержания, в том числе световой режим и микроклимат в помещении (14-16). У некоторых видов сельскохозяйственной птицы отмечается сезонность яйцекладки (17).
Генетическая обусловленность признаков яичной продуктивности у самок сельскохозяйственной птицы, в том числе возраста начала яйцекладки, описана в ряде исследований (18, 19). В частности, показано влияние на эти признаки генов рецептора инсулиноподобного фактора роста 1 IGF-1R (20), гормона роста (21, 22), пролактина (6, 22), миостатина (23), гонадотропин-рилизинг-гормона GnRH-I , нейропептида Y NPY (24). С помощью полногеномных исследований выявлен более широкий спектр генетических маркеров, связанных с яичной продуктивностью и началом яйцекладки у кур (25, 26), гусей (27, 28), перепелов (29, 30), уток (31, 32). Продолжение поиска и идентификации генов, ассоциированных с показателями яичной продуктивности (в том числе с возрастом начала яйцекладки), востребовано практикой селекции и отбора несушек с высоким продуктивным потенциалом.
В настоящем сообщении представлены результаты GWAS анализа сроков начала яйцекладки у кур F 2 модельной ресурсной популяции. Нами идентифицированы новые достоверно значимые SNPs (p < 1,05½10 - 4) и гены-кандидаты, ассоциированные с возрастом начала яйцекладки у кур-несушек. Детектированные SNPs и идентифицированные потенциальные гены-кандидаты могут послужить генетическими маркерами в геномной селекции кур на повышение яичной продуктивности.
Цель работы заключалась в поиске и идентификации генов, ассоциированных с возрастом начала яйцекладки у кур-несушек.
Методика. Исследование проводили на курах-несушках F 2 ресурсной популяции ( n = 95, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы). Для получения модельной популяции использовали две породы, контрастные по показателям яичной продуктивности, — белый корниш и русская белая; русская белая порода относится к яичным породам (33, 34), белый корниш — к мясным (34). На первом этапе сформировали 4 семьи (F 0 _1, F 0 _2, F 0 _3, F 0 _4), каждая из которых включала 1 петуха русской белой породы и 5 кур породы корниш. От каждой семьи получили потомков F 1 , из которых сформировали 4
группы — F 1 _1, F 1 _2, F 1 _3, F 1 _4 для получения кур F 2 (соответственно группы F 2 _1, F 2 _2, F 2 _3, F 2 _4). Полученных в результате последовательной серии скрещиваний кур F 2 использовали как модельную ресурсную популяцию для поиска генов, связанных с показателями яичной продуктивности.
Во все периоды выращивания экспериментальная птица содержалась в помещениях с приточной вентиляцией. Цыплят до 3-недельного возраста выращивали в брудерах с постепенным понижением температуры с 37 ° С до 25 ° С, затем переводили на напольное содержание. На каждом этапе птица имела постоянный доступ к полнорационному комбикорму и свежей воде. Перед началом яйцекладки самок в возрасте 12 нед рассаживали в отдельные клетки батарейного типа для индивидуального учета показателей яйценоскости. Возрастом начала яйцекладки считали возраст снесения первого полноценного яйца.
ДНК выделяли из пульпы пера с помощью коммерческого набора ДНК Экстран-2 (ООО «НПФ Синтол», Россия) в соответствии с протоколом, рекомендованным производителем. Нативность выделенной ДНК проверяли в 1 % агарозном геле методом горизонтального гель-электрофореза. Чистоту препарата оценивали на спектрофотометре NanoPhotometer N60 («Thermo Fisher Scientific», США), отбирали пробы с соотношением OD 260/280 больше 1,8. Концентрацию ДНК определяли на флуориметре Qubit 2.0 («Invitrogen/Life Technologies», США) c использованием набора для количественного определения ДНК Qubit dsDNA BR Assay («Invitrogen/Life Technologies», США).
Для генотипирования использовали ДНК-чип Illimina Chicken iSelect BeadChip, содержащий 60 тыс. SNPs («Illimina, Inc.», США). Контроль качества и фильтрацию данных генотипирования для каждого образца выполняли с помощью программного пакета PLINK 1.9 , применяя фильтры --mind 0.10; -geno 0.1; --maf 0.03.
Для выявления ассоциаций SNP с возрастом начала яйцекладки у кур применяли регрессионный анализ в PLINK 1.9. Достоверность влияния SNP и определение значимых регионов в геноме кур оценивали с использованием теста для проверки нулевых гипотез. В качестве порогового критерия достоверности было установлено значение (р < 1,05x10-4). Данные визуализировали в пакете qqman , язык программирования R.
Для поиска генов-кандидатов, локализованных в области идентифицированных SNPs, использовали геномный ресурс Gallus gallus (chicken) . Функциональное аннотирование генов проводили с привлечением базы данных GeneCards в программе DAVID .
Описательная статистика по изученному показателю включала учет минимального (min), максимального (max) показателей, расчет среднего ( M ), его стандартной ошибки (±SEM) и коэффициента вариации Cv (%) Результаты. Возраст снесения первого яйца (начала яйцекладки) у кур-несушек F 2 модельной ресурсной популяции варьировался от 13,1 до 31,4 нед и составил в среднем 19,0±0,3 нед. Внутрипопуляционные различия по этому признаку достигали 58,2 % (табл. 1). Высокая вариабельность возраста начала яйцекладки отмечалась также в группах кур-несушек F 2.
Для выявления генетической составляющей, влияющей на возраст начала яйцекладки у кур F 2 ресурсной популяции, был выполнен полногеномный анализ ассоциаций (GWAS). Полученные результаты представлены на рисунке.
-
1. Возраст начала яйцекладки у кур ( Gallus gallus L.) F 2 модельной ресурсной популяции, полученной при скрещивании контрастных по яичной продуктивности пород белый корниш и русская белая (физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы)
Группа
n 1
М
±SEM
min
max
Сv , %
F 2 _1
20
19,5
0,9
15,6
26,4
14,9
F 2 _2
26
18,8
0,3
14,1
23,4
11,0
F 2 _3
25
18,7
0,6
13,1
25,0
16,1
F 2 _4
24
19,5
0,7
16,1
31,4
17,3
В среднем по популяции ( n = 95)
19,0
0,3
13,1
31,4
14,6
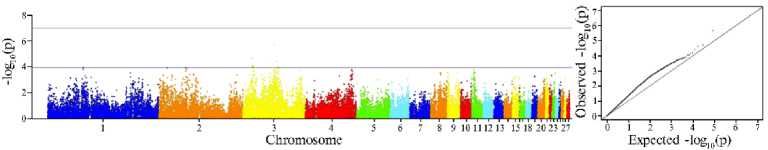
Распределение SNPs, ассоциированных с возрастом начала яйцекладки, по хромосомам (ось X) в зависимости от достоверности ассоциаций ( - log 10 , ось Y ) по вероятностному значению (нижняя линия, p < 0,0001) и критерию Бонферрони (верхняя линия, p < 1,05½10 - 7) (слева, Manhattan plot) и квантиль вероятностного распределения ожидаемого и наблюдаемого отклонений от нормального распределения для величин статистической значимости (справа, Q-Q). Куры ( Gallus gallus L.) F 2 модельной ресурсной популяции, полученной при скрещивании контрастных по яичной продуктивности пород белый корниш и русская белая ( n = 95, физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы).
-
2. SNPs и потенциальные гены-кандидаты, ассоциированные с возрастом начала яйцекладки у кур ( Gallus gallus L.) F 2 модельной ресурсной популяции, полученной при скрещивании контрастных по яичной продуктивности пород белый корниш и русская белая (физиологический двор ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2023-2024 годы)
Хромосома
SNP
Позиция
p
Ген
в позиции SNPs
в пределах ±0,2 Mb
GGA3
Gga_rs16282746
56284783
2,14E-06
–
EYA4 , RPS12 , MIR1454 , SLC18B1 , VNN2
GGA3
Gga_rs14320655
17705656
1,88E-05
AIDA
SUSD4 , TLR5 , DISP1 , BROX , MIA3 , TAF1A , HHIPL2 , TRNAT-UGU
GGA3
Gga_rs16711384
16502581
2,38E-05
CHGB , ARHGEF33 , SOS1 , MAP4K3 , THUMPD2 , GPCPD1 , MIR7464 , TRMT6 , MCM8 , CRLS1 , STUM
GGA3
Gga_rs14365946
60411929
3,80E-05
NKAIN2
TRDN
GGA3
Gga_rs14358676
51368131
6,30E-05
–
TMEM242 , ZDHHC14 , SNX9 , SYNJ2 , SERAC1 , GTF2H5 , TULP4
GGA3
GGaluGA209991
16749624
7,38E-05
LIN9
CHGB , MIR7464 , TRMT6 , MCM8 , CRLS1 , STUM , PARP1 , MIXL1 , ACBD3 , H3F3C , SDE2 , LEFTY1 , TMEM63A , EPHX1 , ENAH , SRP9
GGA3
Gga_rs15746045
16384413
9,28E-05
MAP4K3
HNRNPLL , GALM , SRSF7 , GEMIN6 , SRSF7L , DHX57 , MORN2 , ARHGEF33 , SOS1 , THUMPD2 , GPCPD1 , CHGB , MIR7464
GGA3
Примечан
Gga_rs16231691 18566573 9,40E-05
и е. Прочерки означают отсутствие генов.
MARK1 , SLC30A10 , IARS2 , RAB3GAP2 , MIR194-1 , MIR215 , BPNT1 , EPRS
Проведенные полногеномные ассоциативные исследования выявили 8 достоверно значимых SNPs (p < 1,05 ½ 10 - 4), ассоциированных с возрастом начала яйцекладки в исследованной популяции кур F 2 (табл. 2). Все идентифицированные SNPs локализованы на хромосоме GGA3.
Идентифицированные SNPs были использованы для аннотирования генов-кандидатов, потенциально ассоциированных с возрастом начала яйцекладки. В результате мы установили 60 генов, из них 4 гена ( AIDA , NKAIN2 , LIN9 , MAP4K3 ) локализовались в позициях выявленных SNPs. Эти гены отвечают за ряд биологических функций, вовлеченных в процессы роста и развития птицы, в том числе за сборку, связывание и фосфорилирование белков и регуляцию транспорта ионов натрия. Интенсивность роста влияет на возраст наступления половой зрелости и, соответственно, на начало яйцекладки.
Анализ открытых источников данных показал, что из четырех выявленных нами генов, которые ассоциированы с возрастом начала яйцекладки у кур, для двух генов в ряде исследований установлена связь с показателями роста и мясными качествами. В частности, установлены достоверные ассоциации гена MAP4K3 с вкусовыми качествами и ароматом мяса кур (35), гена LIN9 — с массой сердца (36), цветом мяса (37), ростом и развитием мышечной ткани (38) у кур. Показано влияние гена MAP4K3 на хондрогенез и развитие костной ткани бедра у бройлеров (39). Для других выявленных в наших исследованиях генов-кандидатов в ряде работ обнаружена связь с репродуктивными и продуктивными признаками у сельскохозяйственных животных. Так, обнаружены достоверные ассоциации гена AIDA с показателями роста у свиней (40), гена NKAIN2 — с плодовитостью свиноматок, в частности с числом и массой рожденных поросят (41).
Таким образом, в результате полногеномного анализа нами идентифицированы однонуклеотидные полиморфизмы (SNPs) и гены-кандидаты, ассоциированные с возрастом начала яйцекладки у кур F 2 модельной ресурсной популяции, полученной при скрещивании контрастных по яичной продуктивности пород белый корниш и русская белая. Мы выявили восемь новых значимых однонуклеотидных полиморфизмов, связанных с началом яйцекладки (p < 1,05½10 - 4). Эти SNPs локализованы на хромосоме GGA3. В области локализации обнаруженных SNPs установлено 60 генов-кандидатов, в том числе четыре гена ( AIDA , NKAIN2 , LIN9 , MAP4K3 ) в позициях обнаруженных нами SNPs. Результаты исследования могут быть использованы в геномной селекции кур на повышение их яичной продуктивности и продуктивного потенциала.
Список литературы Поиск генов, ассоциированных с возрастом начала яйцекладки у кур-несушек (Gallus gallus L.)
- Фисинин В.И., Буяров В.С., Буяров А.В., Шуметов В.Г. Мясное птицеводство в регионах России: современное состояние и перспективы инновационного развития. Аграрная наука, 2018, 2: 30-38.
- Chomchuen K., Tuntiyasawasdikul V., Chankitisakul V., Boonkum W. Genetic Evaluation of body weights and egg production traits using a multi-trait animal model and selection index in thai native synthetic chickens (Kaimook e-san2). Animals, 2022, 12(3): 335 (doi: 10.3390/ani12030335).
- Буяров В.С., Ройтер Я.С., Кавтарашвили А.Ш., Червонова И.В., Буяров А.В. Оценка племенных качеств сельскохозяйственной птицы яичного направления продуктивности (обзор). Вестник аграрной науки, 2019, 4(79): 46-55 (doi: 10.15217/issn2587-666X.2019.4.46).
- Штеле А.Л. Повышение яйценоскости у высокопродуктивных кур и проблема ее раннего прогнозирования. Сельскохозяйственная биология[Agricultural Biology], 2014, 6: 26-35 (doi: 10.15389/agrobiology.2014.6.26rus).
- Tan Y.G., Xu X.L., Cao H.Y., Zhou W., Yin Z.Z. Effect of age at first egg on reproduction performance and characterization of the hypothalamo-pituitary-gonadal axis in chickens. Poultry Science,2021, 100(9): 101325 (doi: 10.1016/j.psj.2021.101325).
- Xu H., Zeng H., Luo C., Zhang D., Wang Q., Sun L., Yang L., Zhou M., Nie Q., Zhang X. Genetic effects of polymorphisms in candidate genes and the QTL region on chicken age at first egg. BMC Genetics, 2011, 12: 33 (doi: 10.1186/1471-2156-12-33).
- He Z., Ouyang Q., Chen Q., Song Y., Hu J., Hu S., He H., Li L., Liu H., Wang J. Molecular mechanisms of hypothalamic-pituitary-ovarian/thyroid axis regulating age at first egg in geese. Poultry Science,2024, 103(3): 103478 (doi: 10.1016/j.psj.2024.103478).
- Vargas D., Galínde R., Basilio V., Martinez G. Age at the first egg in Japanese quail (Coturnix coturnix japonica) under experimental conditions. Revista Cientifica de la Facultad de Ciencias Veterinarias de la Universidad del Zulia, 2009, 19: 181-186.
- Balcha K.A, Mengesha Y.T, Senbeta E.K., Zeleke N.A. Evaluation of different traits from day-old to age at first eggs of Fayoumi and White leghorn chickens and their reciprocal crossbreeds. Journal of Advanced Veterinary and Animal Research, 2021, 8(1): 1-6 (doi: 10.5455/javar.2021.h478).
- Mesele T.L. Reproduction and production performance of improved chickens, their production constraints, and opportunities under Ethiopian conditions. Tropical Animal Health and Production, 2023, 55(4): 245 (doi: 10.1007/s11250-023-03653-w).
- Ахметова Л.Т., Ефимов Д.Н., Алимов А.М., Сибгатуллин Ж.Ж., Ахметова Р.Т., Алиев М.Ш. Применение кормовой добавки винивет в птицеводстве. Сообщение II. Естественная резистентность и продуктивность у кур. Сельскохозяйственная биология, 2012, 6: 83-87 (doi: 10.15389/agrobiology.2012.6.83rus).
- De Juan A.F., Scappaticcio R., Aguirre L., Mateos G.G., Camara L. Effects of the composition of the pre-peak diet fed from 18 to 29 wk of age on egg production, egg quality, and the development of the gastrointestinal tract of brown-egg laying hens from 18 to 61 wk. Journal of Applied Poultry Research, 2024, 33(2): 100415 (doi: 10.1016/j.japr.2024.100415).
- Ruichen B., Meixue Y., Xiangze L., Fangshen G., Zeqiong H., Jia H., Waseem A., Tiantian X., Wei L., Zhong W. Effects of chlorogenic acid on productive and reproductive performances, egg quality, antioxidant functions, and intestinal microenvironment in aged breeder laying hens. Poultry Science, 2024, 103(9): 104060 (doi: 10.1016/j.psj.2024.104060).
- Baxter M., Bédécarrats G.Y. Evaluation of the impact of light source on reproductive parameters in laying hens housed in individual cages. The Journal of Poultry Science, 2019, 56(2): 148-158 (doi: 10.2141/jpsa.0180054).
- Wang S.D., Jan D.F., Yeh L.T., Wu G.C., Chen L.R. Effect of exposure to long photoperiod during the rearing period on the age at first egg and the subsequent reproductive performance in geese. Animal Reproduction Science, 2002, 73(3-4): 227-234 (doi: 10.1016/s0378-4320(02)00115-x).
- Кавтарашвили А.Ш., Фисинин В.И., Буяров В.С., Колокольникова Т.Н. Влияние освещения на время яйцекладки и качество куриных яиц (обзор). Сельскохозяйственная биология, 2019, 54(6): 1095-1109 (doi: 10.15389/agrobiology.2019.6.1095rus).
- Siopes T.D. Initiation of egg production by turkey breeder hens: Sexual maturation and age at lighting. Poultry Science, 2010, 89(7): 1490-1496 (doi: 10.3382/ps.2009-00463).
- Liu Z., Yang N., Yan Y., Li G., Liu A., Wu G., Sun C. Genome-wide association analysis of egg production performance in chickens across the whole laying period. BMC Genetics, 2019, 20(1): 67 (doi: 10.1186/s12863-019-0771-7).
- Chen A., Zhao X., Wen J., Zhao X., Wang G., Zhang X., Ren X., Zhang Y., Cheng X., Yu X., Mei X., Wang H., Guo M., Jiang X., Wei G., Wang X., Jiang R., Guo X., Ning Z., Qu L. Genetic parameter estimation and molecular foundation of chicken egg-laying trait. Poultry Science, 2024, 103(6): 103627 (doi: 10.1016/j.psj.2024.103627).
- Junyan B., Xinle W., Jingyun L., Longwei W., Hongdeng F., Mengke Ch., Fanlin Z.g, Xiaoning L., Yuhan H. Research Note: Association of IGF-1R gene polymorphism with egg quality and carcass traits of quail (Coturnix japonica). Poultry Science, 2023, 102(6): 102617 (doi: 10.1016/j.psj.2023.102617).
- Wu X., Yan M.J., Lian S.Y., Liu X.T., Li A. GH gene polymorphisms and expression associated with egg laying in muscovy ducks (Cairina moschata). Hereditas, 2014, 151(1): 14-19 (doi: 10.1111/j.1601-5223.2013.00016.x).
- Кулибаба Р.А. Полиморфизм генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина в связи с яичной продуктивностью у кур породы полтавская глинистая. Сельскохозяйственная биология, 2015, 2: 198-207 (doi: 10.15389/agrobiology.2015.2.198rus).
- Zhang G., Zhang L., Wei Y., Wang J., Ding F., Dai G., Xie K. Polymorphisms of the myostatin gene and its relationship with reproduction traits in the Bian chicken. Animal Biotechnology, 2012, 23(3): 184-193 (doi: 10.1080/10495398.2012.681411).
- Ou J.T., Tang S.Q., Sun D.X., Zhang Y. Polymorphisms of three neuroendocrine-correlated genes associated with growth and reproductive traits in the chicken. Poultry Science, 2009, 88(4): 722-727 (doi: 10.3382/ps.2008-0049725).
- Chen A., Wang Q., Zhao X., Wang G., Zhang X., Ren X., Zhang Ya., Cheng X., Yu X., Mei X., Wang H., Guo M., Jiang X., Wei G., Wang X., Jiang R., Guo X., Ning Z., Qu L. Molecular genetic foundation of a sex-linked tailless trait in Hongshan chicken by whole genome data analysis. Poultry Science, 2024, 103(6): 103685 (doi: 10.1016/j.psj.2024.103685).
- Ma X., Ying F., Li Z., Bai L., Wang M., Zhu D., Liu D., Wen J., Zhao G., Liu R. New insights into the genetic loci related to egg weight and age at first egg traits in broiler breeder. Poultry Science, 2024, 103(5): 103613 (doi: 10.1016/j.psj.2024.103613).
- Zhao Q., Chen J., Zhang X., Xu Z., Lin Z., Li H., Lin W., Xie Q. Genome-wide association analysis reveals key genes responsible for egg production of lion head goose. Frontiers in Genetics, 2020, 10: 1391 (doi: 10.3389/fgene.2019.01391).
- Gao G., Gao D., Zhao X., Xu S., Zhang K., Wu R., Yin Ch., Li J., Xie Y., Hu S., Wang Q. Genome-wide association study-based identification of SNPs and haplotypes associated with goose reproductive performance and egg quality. Frontiers in Genetics, 2021, 12: 602583 (doi: 10.3389/fgene.2021.602583).
- Haqani M.I., Nakano M., Nagano A.J., Nakamura Y., Tsudzuki M. Association analysis of production traits of Japanese quail (Coturnix japonica) using restriction-site associated DNA sequencing. Scientific Reports, 2023, 13: 21307 (doi: 10.1038/s41598-023-48293-0).
- Haqani M.I., Nomura S., Nakano M., Goto T., Nagano A.J., Takenouchi A., Nakamura Y., Ishikawa A., Tsudzuki M. Mapping of quantitative trait loci controlling egg-quality and -production traits in Japanese quail (Coturnix japonica) using restriction-site associated DNA sequencing. Genes, 2021, 12: 735 (doi: 10.3390/genes12050735).
- Sun Y., Zhang Y., Wu Q., Lin R., Chen H., Zhang M., Lin J., Xu E., Li M., Cai Y., Deng F., Yue W., Pan H., Jiang X., Li Y. Whole-genome sequencing identifies potential candidate genes for egg production traits in laying ducks (Anas platyrhynchos). Scientific Reports, 2023, 13: 1821 (doi: 10.1038/s41598-022-21237-w).
- Tao Z., Song W., Zhu C., Xu W., Liu H., Zhang S., Huifang L. Comparative transcriptomic analysis of high and low egg-producing duck ovaries. Poultry Science, 2017, 96(12): 4378-4388 (doi: 10.3382/ps/pex229).
- Abdelmanova A.S., Dotsev A.V., Romanov M.N., Stanishevskaya O.I., Gladyr E.A., Rodionov A.N., Vetokh A.N., Volkova N.A., Fedorova E.S., Gusev I.V., Griffin D.K., Brem G., Zinovieva N.A. Unveiling comparative genomic trajectories of selection and key candidate genes in egg-type Russian White and meat-type White Cornish chickens. Biology, 2021, 10: 876 (doi: 10.3390/biology10090876).
- Romanov M.N., Shakhin A.V., Abdelmanova A.S., Volkova N.A., Efimov D.N., Fisinin V.I., Korshunova L.G., Anshakov D.V., Dotsev A.V., Griffin D.K., Zinovieva N.A. Dissecting selective signatures and candidate genes in grandparent lines subject to high selection pressure for broiler production and in a local Russian chicken breed of Ushanka. Genes, 2024, 15(4): 524 (doi: 10.3390/genes15040524).
- Yuan X., Cui H., Jin Y., Zhao W., Liu X., Wang Y., Ding J., Liu L., Wen J., Zhao G. Fatty acid metabolism-related genes are associated with flavor-presenting aldehydes in Chinese local chicken. Frontiers in Genetics, 2022, 13: 902180 (doi: 10.3389/fgene.2022.902180).
- Kanlisi R.A., Amuzu-Aweh E.N., Naazie A., Otsyina H.R., Kelly T.R., Gallardo R.A., Lamont S.J., Zhou H., Dekkers J., Kayang B.B. Genetic architecture of body weight, carcass, and internal organs traits of Ghanaian local chickens. Frontiers in Genetics, 2024, 15: 1297034 (doi: 10.3389/fgene.2024.1297034).
- Ветох А.Н., Джагаев А.Ю., Белоус А.А., Волкова Н.А., Зиновьева Н.А. Полногеномные ассоциативные исследования качества мяса по показателям цвета грудки у кур (Gallusgallus L.). Сельскохозяйственная биология, 2023, 58(6): 1068-1078 (doi: 10.15389/agrobiology.2023.6.1068rus).
- Li Y., Zhai B., Yuan P., Fan S., Jin W., Li W., Sun G., Tian Y., Liu X., Kang X., Li G. MiR-29b-1-5p regulates the proliferation and differentiation of chicken primary myoblasts and analysis of its effective targets. Poultry Science, 2022, 101(2): 101557 (doi: 10.1016/j.psj.2021.101557).
- Ibelli A.M.G., Peixoto J.O., Zanella R., Gouveia J.J.S., Cantão M.E., Coutinho L.L., Marchesi J.A.P., Pizzol M.S.D., Marcelino D.E.P., Ledur M.C. Downregulation of growth plate genes involved with the onset of femoral head separation in young broilers. Frontiers in Physiology, 2022, 13: 941134 (doi: 10.3389/fphys.2022.941134).
- Seong H.-S., Kim Y.-S., Sa S.-J., Jeong Y., Hong J.-K., Cho E.-S. Genetic parameter estimation and genome-wide association analysis of social genetic effects on average daily gain in purebreds and crossbreds. Animals, 2022, 12: 2300 (doi: 10.3390/ani12172300).
- Zhang Y., Lai J., Wang X., Li M., Zhang Y., Ji C., Chen Q., Lu S. Genome-wide single nucleotide polymorphism (SNP) data reveal potential candidate genes for litter traits in a Yorkshire pig population. Archives Animal Breeding, 2023, 66(4): 357-368 (doi: 10.5194/aab-66-357-2023).


