Поиск генов, ответственных за биосинтез токсинов гуанидинового ряда в бактериях Bacillus sp 1839 и Pseudoalteromonas sp 2138
Автор: Горобец Екатерина Алексеевна, Магарламов Тимур Юсифович, Мельникова Дарья Игоревна, Кузнецов Василий Геннадиевич, Власенко Анна Евгеньевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-3 т.18, 2016 года.
Бесплатный доступ
В работе проведен биоинформационный анализ 32 открытых рамок считывания (ОРС) в плазмиде pNe-1, влияющей на синтез ТТХ в бактерии Aeromonas sp., выделенной из рыбы фугу. Также проведен поиск генов, локализованных в pNe-1, в плазмидной ДНК ТТХ-продуцирующих штаммов Bacillus sp. 1839, Pseudoalteromonas sp. 2138 и в общей бактериальной ДНК из рыбы-фугу Takifugu sp. В плазмиде pNe-1 были выявлены ОРС с высокой степенью консервативности, кодирующие аминокислотные последовательности «hypothetical proteins», вероятно участвующие в синтезе ТТХ и его аналогов. Эти ОРС могут быть рекомендованы для генетических исследований биосинтеза гуанидиновых токсинов.
Бактерии-продуценты, гуанидиновые токсины, тетродотоксин, анальгетики, анестетики, нейротоксины, плазмида pne-1
Короткий адрес: https://sciup.org/148204550
IDR: 148204550 | УДК: 579.6
Текст научной статьи Поиск генов, ответственных за биосинтез токсинов гуанидинового ряда в бактериях Bacillus sp 1839 и Pseudoalteromonas sp 2138
Интенсивный рост антропогенной нагруз- Благодаря своей уникальной структуре
ки приводит к увеличению выброса промышленных, сельскохозяйственных, строительных, транспортных и бытовых отходов, загрязняющих окружающую среду. На фоне неблагоприятной экологической обстановки наблюдается устойчивая динамика роста острых респираторных, иммунных и аллергических заболеваний, сердечнососудистых патологий, а также онкологических заболеваний. Одним из симптомов этих болезней является боль. Боль является глобальной проблемой здравоохранения [1]. Было подсчитано, что диагноз «хронический болевой синдром» выявлен у 20% взрослого населения Земли и существенно ухудшает качество их жизни и условия труда. Становится очевидным необходимость в поиске и разработке новых лекарственных агентов анальгетического (анастетического) действия.
Наибольший интерес в поиске новых анестетиков представляют низкомолекулярные нейротоксины. Одним из таких токсинов бактериального происхождения являются гуанидиновые токсины - тетродотоксин (ТТХ) и его аналоги.
Горобец Екатерина Алексеевна, лаборант-
ТТХ-подобные токсины блокируют межмембранные токи в возбудимых тканях (мышечных и нервных), не нарушая гомеостаз окружающих тканей. Наиболее перспективным направлением применения ТТХ и его аналогов в терапевтической практике является купирование болей. Эти токсины могут использоваться в качестве анальгетиков общего или местного действия. Так, в Канаде на основе ТТХ и сакситоксина было создано лекарство-прототип для лечения болевого синдрома у больных с тяжелыми формами рака, оказывающее анальгетический эффект в течение 14 дней с момента приема [2]. Использование ТТХ-подобных токсинов в местной анестезии, представляет большой интерес, так как в отличие от других анестетиков, гуанидиновые токсины блокирует рефлекторные сокращения только в возбудимых тканях, не вызывает миокардиальную депрессию, а также не пересекает гематоэнцефалический барьер, что снижает риск развития судорог или повреждений центральной нервной системы [3]. Также есть попытки введения гуанидиновых токсинов в медицинскую практику в качестве препаратов для снятия абстинентного синдрома у наркотически зависимых пациентов [2].
Использование ТТХ-подобных токсинов в медицинской практике не представляется возможным из-за высокой стоимости производства токсинов. На сегодняшний день единственным сырьем для производства гуанидиновых ткоси-нов является рыба-фугу: из 1 тонны рыбы получают 1 грамм ТТХ. Отсутствие биотехнологического производства ТТХ и его аналогов связно с недостатком знаний о путях его биосинтеза в живых организмах. ТТХ и все его аналоги обладают необычной структурой, что является результатом сложных биосинтетических реакций. Для расшифровки биосинтетических путей в бактериях все большую популярность приобретают молекулярно-генетические методы, направленные на поиск генных кластеров ответственных за биосинтез токсинов у бактерий.
Впервые ТТХ-подобные токсины были обнаружены в рыбе-фугу, относящейся к семейству Tetraodontidae, а позже и в других организмах, принадлежащих к разным таксономическим группам [4]. Причем в большинстве токсин-содержащих организмов были найдены токсин-продуцирующие бактерии родов: Acinetobacter sp ., Aeromonas sp. , Bacillus sp ., Roseobacter sp ., Shewanella sp ., Tenacibaculum sp ., Vibrio sp. и др [5]. Учитывая, что столь филогенетически удаленные группы бактерий могут производить ТТХ-подобные токсины, можно предположить, что бактерии-продуценты могли освоить один и тот же путь биосинтеза токсина посредством горизонтального переноса генов, как это было показано для сакситоксина [6]. Так, бактерия Aeromonas sp ., выделенная из рыбы фугу Takifugu obscurus , способна продуцировать ТТХ и его аналоги, а их продукция прямо зависит от количества копий плазмиды pNe-1 [7]. Данный факт говорит о том, что среди белок-кодирующих последовательностей pNe-1 есть как минимум один ген-регулятор продукции токсинов. Полное секвенирование последовательности pNE-1 позволило идентифицировать 60 открытых рамок считывания (ОРС), кодирующих белки, причем 36 ОРС кодируют белки с неизвестными функциями [7]. Кроме того, в составе pNE-1 были идентифицированы последовательности мобильных генетических элементов секреторной системы 4 типа, ответственной за конъюгацию плазмид у грамм-положительных бактерий и транспозазы IS426 [4]. Исходя из данного факта, можно предположить, что эта плазмида попала в Aeromonas в результате горизонтального переноса генов [7].
Цель работы: провести биоинформаци-онный анализ 36 ОРС в плазмиде pNe-1 из ТТХ-продуцирующего штамма Aeromonas sp. Проверить наличие генов, локализованных в плазмиде pNe-1, в плазмидной ДНК токсин-продуци-рующего штаммов Bacillus sp. 1839, Pseudo-alteromonas sp. 2138 и в общей бактериальной ДНК из рыбы-фугу Takifugu sp..
Методика исследований. Штаммы, продуцирующие ТТХ-подобные токсины, Bacillus sp. 1839 (близкий к B. asahii ) и Pseudoalteromonas sp. 2138 (близкий к P. tetraodonis IAM 14160), были взяты из коллекции морских гетеротрофных микроорганизмов ИБМ ДВО РАН им. А.В Жирмунского. Для культивирования бактерий использовали питательную среду Йошимицу– Кимура следующего состава: пептон (5,0 г), дрожжевой экстракт (2,0 г), глюкоза (1 г), К 2 НРО 4 (0,2 г), MgSO 4 х7H 2 O (0,1 г), агар (12,0 г), дистиллированная вода (500 мл), и морская вода (500 мл);
рН среды 7,5–7,8. Для выделения ДНК бактерий культивировали в течение 7 сут в 5 мл среды. Для детекции ТТХ бактерий культивировали в 500 мл среды в течение 14 сут Pseudoalteromonas sp. 2138 и 30 сут Bacillus sp. 1839. Бактерий центрифугировали в течение 7 мин, при 4 ᵒ С и скорости 4000g, надосадочную жидкость сливали, а осадок помещали в холодильник на -80оС для последующих экспериментов.
Полимеразную цепную реакцию (ПЦР) проводили в реакционных объемах 10 мкл, содержащих 1 мкл Taq-полимеразного буфера, 0,2 мкл 2,5 мМ MgCl 2 , 0,8 мкл 2,5 mM дезоксинуклеотидтрифосфатов, по 0,5 мкл раствора прямого и обратного олигонуклеотидных праймеров в концентрации 10 пмоль/мкл (табл. 1), 1 мкл тотальной ДНК в концентрации 30 нг/мкл и 1U (единицы активности) в 0,2 мкл Taq-полимеразы. В качестве положительного контроля была составлена реакция с олигонуклеотидными праймерами B3/B4 на рибосомальные кластеры эубактерий. Негативным контролем служила реакция с оли-гонуклеотидными праймерами B3/B4, где матрицей являлась вода.
Термический цикл проводили в C1000 TouchTh Thermocycler (BioRad, США). Амплификация началась со стадии начальной денатурации при 95°С в течение 2 мин для ДНК, выделенной из тканей рыбы фугу, в течение 4 мин для бактериальных штаммов: Bacillus sp. 1839 и Pseudoalteromonas sp. 2138. Затем 33 цикла: денатурация при 95°С в течение 30 с, отжиг пары праймеров B1/B2 при температурах 60,8; 62,3 и 63°С, праймеров В3/В4 при 55°С и при 50, 52,6, 55,1°С для остальных праймеров в течение 30 с; элонгация при 72°С в течение 2 мин. Амплификация завершалась конечным этапом элонгации при 72°С в течение 5 мин. Далее 10 мкл ПЦР продукта смешивали с 4 мкл 6х загрузочного буфера (DNA Gel Loading Dye (6X) - Thermo Fisher Scientific) и разделяли с помощью электрофореза в 2% агарозном геле в ТАЕ-буфере 40 мин при 100В, затем 10 мин окрашивали бромистым этидием, промывали 3 раза по 7 мин дистиллированной водой. Визуализацию и документирование гелей ing System (BioRad, США). производили на системе ChemiDocTMTouch Imag-
Таблица 1. Праймеры, подобранные на консервативную последовательностьплазмиды pNE-1
|
Код |
Нуклеотидная последовательность праймера |
Участок в ДНК, на которую подобраны олигонуклеотидные праймеры |
|
B1 |
5’-tctctttcatgctgcggttcagc-3’ |
позиция 2252-2400 в плазмиде pNe-1 (праймеры взяты из статьи) -прямой |
|
B2 |
5’–gacaaggctcgg agacacgca– 3’ |
позиция 2252-2400 в плазмиде pNe-1 (праймеры взяты из статьи)- обратный |
|
B3 |
5’-gccagcagccgcggtaa-3’ |
на рибосомальные кластеры эубактерий - прямой |
|
B4 |
5’ggactaccagggtatctaat– 3’ |
на рибосомальные кластеры эубактерий - обратный |
|
B7 |
5′-gtactttgataattttggaata-3′ |
на гипотетический белок 2 (или на открытую рамку) прямой |
|
B8 |
5′- aaacatctagaattactact-3′ |
на гипотетический белок 2 (или на открытую рамку) обратный |
|
B9 |
5′-aagcttgacctttccctga-3′ |
на гипотетический белок 8 (или на открытую рамку) прямой |
|
B10 |
5′-gttcatggtacttcaagatg-3′ |
на гипотетический белок 8 (или на открытую рамку) обратный |
|
B11 |
5′-atcagcatggtgtaataa-3′ |
на гипотетический белок 5 (или на открытую рамку) прямой |
|
B12 |
5′-gctattcctgttaaagaa-3′ |
на гипотетический белок 5 (или на открытую рамку) обратный |
|
B13 |
5′-ggcgctttagctgaaaaat-3′ |
на гипотетический белок 10 (или на открытую рамку) прямой |
|
B14 |
5′-aagtgattcggtttattagc-3′ |
на гипотетический белок 10 (или на открытую рамку) обратный |
|
B15 |
5′-atcttgcacgctgatattgg-3′ |
на гипотетический белок 24 (или на открытую рамку) прямой |
|
B16 |
5′-atacttccaccaccatatac-3′ |
на гипотетический белок 24(или на открытую рамку) обратный |
|
B17 |
5′gaaaaaaatcttaaaaagaaaa-3′ |
на гипотетический белок 28 (или на открытую рамку) прямой |
|
B18 |
5′-attcgtctaaaacaaaatta-3′ |
на гипотетический белок 28(или на открытую рамку) обратный |
|
B19 |
5′-agaagtatttacattgtttgat-3′ |
на гипотетический белок 30 (или на открытую рамку) прямой |
|
B20 |
5′-ccaccaatatcctcataaa-3′ |
на гипотетический белок 30 (или на открытую рамку) обратный |
|
B21 |
5′-tatttaaaagag gatctagag-3′ |
на гипотетический белок 32 (или на открытую рамку) прямой |
|
B22 |
5′-atttaaatgtgcatatctagtt-3′ |
на гипотетический белок 32 (или на открытую рамку) обратный |
|
B23 |
5′-caaaagaaagcaagtttacaagg-3′ |
на гипотетический белок 31 (или на открытую рамку) прямой |
|
B24 |
5′-tatttgatccgctttataatgatg-3′ |
на гипотетический белок 31(или на открытую рамку) обратный |
|
B25 |
5′-ttacataggtactaaaaaaag-3′ |
на гипотетический белок 35 (или на открытую рамку) прямой |
|
B26 |
5′-cataaataatgtgtggatt-3′ |
на гипотетический белок 35 (или на открытую рамку) обратный |
Биоинформационный анализ. Анализ нуклеотидной последовательности и ОРС плазмиды pNe-1, выделенной из ТТХ-продуцирую-щего штамма Aeromonas sp., производили при помощи программы ApE (A plasmid Editor). Поиск гомологичных нуклеотидных последовательностей ОРС в других бактериях и их выравнивание выполнили с использованием программы BLAST (Basic Local Alignment Search Tool) и базы данных NCBI (ссылка на интернет ресурс). Дизайн праймеров составлялся на 10 ОРС, потенциально кодирующих белки с неизвестными функциями, плазмиды pNe-1 с использованием программы OligoCalc (Oligonucleotide Properties Calculator).
Бактериальный осадок, объемом около 2 мл, разбавляли 0,1% водным раствором уксусной кислоты до конечного объема 20 мл. Разрушение клеток проводили на ультразвуковом гомогенизаторе Sonopuls HD 2070 (Bandelin, Германия), в течение 3-х ч, с частотой 20 kHz, амплитудой 212 мкм, рабочим циклом 0,8 с и интервалом 0,2 с. Время обработки ультразвуком для бактерий Bacillus sp. 1839 составило 3 ч, а для Pseudo-alteromonas sp. 2138 – 30 мин. Полученный гомогенат центрифугировали при 13000g в течение 30 мин, супернатант отбирали и затем упаривали в вакуумном испарителе Centrivap Concentrator 2310905 (Labconco, Germany) при 500С. Получившийся после упаривания осадок растворяли в 2
мл водного раствора 0,1% уксусной кислоты. Раствор затем фильтровали с помощью 3кДа фильтров Microcon Ultarcel YM-3 (Millipore, США). Для удаления белковой фракции раствор нагревали до 85оС в течении 20 мин, затем коагулированные белки осаждали, а супернатант хранили при -80оС для дальнейших исследований.
Детекция и определение концентрации токсинов гуанидинового ряда. Клетки мышиной нейробластомы Neuro-2a (ATCC, CCL131) были взяты из коллекции культур университета Лозанны, Швейцария. Культивация велась в среде Игла в модификации Дюльбекко DMEM (Gibco) содержащей 4,5г/л D-глюкозы; глютамин, пируват и антибиотики – 1000 U/ml пенициллина и 10 mg/ml стрептомицина (Sigma, США), дополненной 10% эмбриональной сывороткой крупного рогатого скота FBS (Sigma, США). Культура клеток содержалась в СО 2 -инкубаторе при 37oC, 5% CO 2 и 80% важности. Пассирование клеток проводилось по достижению 80% конфлюэнтности раз в 2 дня.
Для проведения эксперимента клетки 2-х дневной культуры собирали из культурального флакона с помощью 0,25% раствора трипсина на фосфатном буфере (PBS) pH 7,4 и ресуспендиро-вали в культуральной среде (DMEM + 5% FBS) до плотности 4 х 105 клеток/мл. Посев клеток производили в 96-луночный планшет (Greiner Bio-One, Германия) по 50 мкл суспензии в каждую лунку, итоговое содержание клеток в каждой лунке составляло 2х104. Клетки преинкубировали 24 ч в СО2-инкубаторе при 37оС и 5% СО2. После 24 ч преинкубации в каждую лунку добавили по 100 мкл тестовых и контрольных растворов и инкубировали 24 ч в СО2-инкубаторе при 37оС и 5% СО2. Для приготовления тестовых растворов использовали среду DMEM с 5% FBS, содержащую различные разведения экстрактов Bacillus sp. 1839, и Pseudoalteromonas sp. 2138, а так же 133μМ вератридина (Sigma, США) в ДМСО и 0,4 мМ водного раствора уабаина (Sigma, США). Оценку жизнеспособности клеток проводили с помощью красителя МТТ (3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyltetrazolium bromide; thiazolyl blue) (Sigma, США). Раствор красителя 5мг/мл в PBS pH 7,4 стерилизовали фильтрованием через 0.22 мкм фильтр (Millipore, США) и добавляли по 15 мкл в каждую лунку 96-луночного планшета. После инкубации в течение 4-х ч при 37оС и 5% СО2, образовавшиеся кристаллы формазана растворили добавлением 150 мкл изопропанола c 0,04М HCl, и перемешивали на шейкере (Biosan PST-60HL4, Латвия) при 37оС и 450 rpm в течение 10 мин. Измерение поглощения растворенного красителя, для каждой лунки, проводили на спектрофотометре ELx800uv (Bio-Tek Instruments Inc., США) при длине волны 595нм с референсной длинной волны 630 нм.
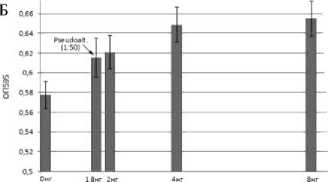
Результаты и их обсуждения. Согласно одной из гипотез, подтвержденной многочисленными исследованиями, первичными продуцентами ТТХ-подобными токсинами в морских экосистемах являются микроорганизмы. В качестве токсин-продуцирующих микроорганизмов были выбраны штаммы бактерий, относящиеся к разным систематическим группам: Firmicutes (штамм Bacillus sp. 1839) и Proteobacteria (штамм Pseudoalteromonas sp. 2138). Способность штамма Bacillus sp. 1839 продуцировать токсин была подтверждена иммуноцитохимическими методами с использованием антител против ТТХ [8]. Для штамма Pseudoalteromonas sp. 2138 способность к продукции ТТХ не была проверена, но было показано 100% сходство по рРНК со штаммом, продуцирующим ТТХ и его аналоги, Pseudoalteromonas tetraodonis IAM 14160 (не опубликованные данные). Для подтверждения способности продуцировать токсин штаммами Bacillus sp. 1839 и Pseudoalteromonas sp. 2138 был использован метод биотестирования на культуре клеток нейробластомы. Этот метод обладает высокой чувствительностью, определяет весь спектр ТТХ-подобных токсинов (ТТХ, сакситоксин, гуанотоксины I-IV и т.д.) и детектирует не только сам факт наличия токсинов, но и оценивает его концентрацию. Нами показано, что экстракты Bacillus sp. 1839 оказывали сильный токсический эффект на культуру клеток, эквивалентный концентрации чистого ТТХ - 28 нг. Так показатель оптической плотности в контроле в среднем составил 0,451 ОП (рис. 1А). При добавлении к культуре клеток ТТХ в концентрации от 2 нг/мл до 32 нг/мл показатель оптической плотности изменялся в диапазоне от 0,5 до 0,595 ОП. При добавлении к культуре клеток экстракта Bacillus sp. 1839 в разбавлении 1 к 50, оптическая плотность составила 0,585 ОП, что соответствует диапазону показателей оптической плотности для ТТХ в концентрации 16-32 нг/мл. Экстракты Pseudoalteromonas sp. 2138 оказывали токсичный эффект на культуру клеток, эквивалентный 1.8 нг ТТХ. При этом оптическая плотность в контроле в среднем составила 0,578 ОП (рис. 1Б). При добавлении к культуре клеток ТТХ в концентрации от 2 нг/мл до 8 нг/мл показатель оптической плотности изменялся в диапазоне от 0,655 до 0,621 ОП. При добавлении к культуре клеток экстракта Pseudoalteomonas sp. 2138 в разбавлении 1 к 50, оптическая плотность составила 0,615 ОП. Проведенные эксперименты доказывают способность коллекционных штаммов Bacillus sp. 1839 и Pseudoalteromonas sp. 2138 продуцировать ТТХ, а значит и правомочность их использования в качестве модельных объектов для поиска генетических основ биосинтеза ТТХ.
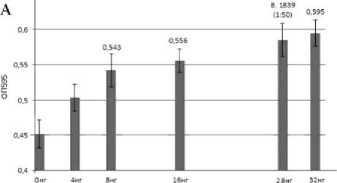
Рис. 1. Концентрация ТТХ-подобных токсинов в экстракте Bacillus sp. 1839 (А) и Pseudoalteomonas sp. 2138 (Б)
В настоящее время выявлено около 30 родов бактерий из разных систематических групп, способных продуцировать ТТХ и его аналоги. Существует гипотеза, что столь широкое распространение продуцентов токсинов гуанидинового ряда в филогинетически далёких систематических группах микроорганизмов связано с горизонтальным переносом генов. Известно, что горизонтальный перенос генов в бактериях осуществляется посредством плазмид. Исследователи Джинг и Лю [7] показали зависимость количества ТТХ, синтезируемого бактерией Aeromonas sp, от числа копий плазмиды pNE-1, т.е. как минимум один ген плазмиды pNE-1, влияет на синтез токсина. Возможно, благодаря горизонтальному переносу генов плазмида pNE-1 присутствует и в других ТТХ-продуцирующих бактериях, в том числе и Bacillus sp. 1839 и Pseudoalteromonas sp. 2138. Предварительные исследования показали, что оба исследуемых штамма Bacillus sp. 1839 и Pseudoalteromonas sp. 2138 содержали плазмид-ную ДНК (не опубликованные данные). На консервативный участок плазмиды pNE-1 были получены олигонуклеотидные праймеры B1/B2 (см. табл. 1). Однако ПЦР анализ не выявил наличие консервативных участков, соответствующих плазмиде pNE-1, в тотальной ДНК Bacillus sp. 1839 и Pseudoalteromonas sp. 2138.
Нами был проведен поиск плазмиды pNE-1 в ассоциативной микрофлоре рыбы-фугу, виды которой являются «богатым поставщиком» ток-син-синтезирующих бактерий [9]. С помощью ПЦР анализа был проведен скрининг микрофлоры из разных органов Takifugu sp. на наличие плазмиды pNE-1. ПЦР анализ не выявил наличие плазмиды pNE-1 в микрофлоре Takifugu sp. Отсутствие плазмиды в исследованных бактериальных образцах может быть связано с мутациями в составе консервативных участков, что сделало невозможным выявление плазмиды pNE-1, при помощи разработанных олигонуклеотидных праймеров (B1/B2, B7-B26). Для окончательного ответа о распространении плазмиды pNE-1 среди продуцентов ТТХ и его аналогов необходимо провести полный сиквенс плазмидной ДНК в токсин-продуцирующих бактериях.
Плазмида pNE-1 содержит 36 ОРС, кодирующих аминокислотные последовательности, которые фигурируют в базах данных NCBI как «белки с неопределенной функцией». Вероятно, один или несколько генов этой плазмиды могут принимать участие в биосинтезе ТТХ-подобных токсинов. При сравнении ОРС из pNE-1 с бактериальными нуклеотидными последовательностями из баз данных NCBI было обнаружено 10 последовательностей, с 60% уровнем гомологии в составе последовательности ДНК и выше, а в составе аминокислотной последовательности – более 90% (табл. 2). Все эти участки ДНК с высокой степенью гомологии были локализованы только в плазмидной ДНК бактерий. Наличие таких консервативных последовательностей в плазмидах разных видов бактерий говорит о важности этих генов в жизнедеятельности клетки. Можно предположить, что один или несколько белков, кодируемых этими консервативными ОРС, могут играть роль в синтезе токсинов гуанидинового ряда.
Таблица 2. Гомология ОРС плазмиды pNE-1 с базой данных BLAST
|
Организм |
OP C2 |
OP C5 |
OP C8 |
OP C10 |
OP C24 |
OP C28 |
OP C30 |
OP C31 |
OP C32 |
OP C35 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
Bacillus thuringiensis serovar indiana strain HD521 plasmid pBTHD521-4, complete sequence |
66 |
53 |
70 |
58 |
38 |
56 |
57 |
87 |
87 |
- |
|
Bacillus thuringiensis strain Bc601 plasmid pBTBC5, complete sequence |
79 |
53 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
- |
|
Bacillus thuringiensis strain YWC2-8 plasmid pYWC2-8-3, complete sequence |
79 |
- |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
- |
|
Bacillus thuringiensis strain YC-10 plasmid pYC20, complete sequence |
79 |
- |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
|
|
Bacillus thuringiensis serovar morrisoni strain BGSC 4AA1 plasmid pBMB76 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis serovar kurstaki strain HD 1 plasmid unnamed3 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis serovar galleriae strain HD-29 plasmid pBMB126 |
66 |
70 |
58 |
44 |
56 |
57 |
87 |
87 |
||
|
Bacillus thuringiensis serovar kurstaki str. YBT-1520 plasmid pBMB95 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
34 |
||
|
Bacillus thuringiensis serovar kurstaki str. HD-1 plasmid pBMB95 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis serovar kurstaki str. YBT-1520 plasmid pBMB94 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
34 |
||
|
Bacillus thuringiensis serovar thurin-giensis str. IS5056 plasmid pIS56-107 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis serovar kurstaki str. HD73 plasmid pHT77 |
79 |
70 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis serovar chinensis CT-43 plasmid pCT127 |
79 |
63 |
58 |
38 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis CT43 plasmid pBMB0558 |
53 |
44 |
58 |
38 |
59 |
87 |
87 |
|
Bacillus cereus H3081.97 plasmid pH308197_73 |
79 |
63 |
58 |
44 |
56 |
59 |
87 |
87 |
||
|
Bacillus thuringiensis HD1002 plasmid 7 |
85 |
|||||||||
|
Bacillus thuringiensis HD-789 plasmid pBTHD789-6 |
85 |
|||||||||
|
Bacillus thuringiensis strain 4Q2 plasmid pTX14-2 |
85 |
|||||||||
|
Bacillus thuringiensis serovar israelensis strain AM65-52 plasmid pAM65-52-8-7K |
85 |
|||||||||
|
Bacillus thuringiensis strain Al Hakam plasmid pBTZ_6 |
64 |
|||||||||
|
Bacillus mycoides strain 219298 plasmid |
64 |
|||||||||
|
Bacillus thuringiensis strain HS18-1 plasmid pHS18-7 |
56 |
Примечание: 1,2,3 - праймеры B1/B2; 4,5,6 – праймеры B7/B8; 7,8,9 – праймеры B9/B10; 10,11,12 – праймеры B11/B12; 13,14,15 – праймеры B13/B14; 16,17,18 – праймеры B15/B16; 19,20,21 – праймеры B17/B18; 22,23,24 – праймеры B19/B20; 25,26,27 – праймеры B21/B22; 28,29,30 – праймеры B23/B24; 31,32,33 – праймеры B25/B26; К - - негативный контроль; К+ - положительный контроль, Ст. – синтетические маркеры молекулярного веса

Рис. 2. Электрофорез ПЦР фрагментов ДНК рыбы-фугу Takifugu sp. (А – печень, Б – кожа, В – кишечник), Bacillus sp. 1839 (Г) и Pseudoalteromonas sp. 2138 (Д)
В текущей работе был осуществлен ПЦР анализ на предмет наличия 10 консервативных плазмидных ОРС в Bacillus sp. 1839, Pseudo-alteromonas sp. 2138 и в общей бактериальной ДНК из рыбы-фугу Takifugu sp. С использованием программы OligoCalc были разработаны олиго-нуклеотидные праймеры, специфичные к наиболее консервативным участкам, исходя из допущения, что данные участки будут консервативны в бактериях рода Bacillus и Pseudoalteromonas (табл. 1, рис. 2). Ни один из подобранных праймеров не выявил ОРС из плазмиды pNE-1 в исследованных образцах тотальной и плазмидной ДНК бактерий. Отрицательный результат работы, возможно, связан с вырожденностью генетического кода, т.е. наличие в ДНК нуклеотидных замен, не влияющих на структуру белка. Продолжением работы станет подбор праймеров с учетом вырожденности кода 10 консервативных ОРС плазмиды pNE-1 и поиск «hypothetical proteins» в Bacillus sp. 1839 и Pseudoalteromonas sp. 2138.
Выводы: из 36 ОРС содержащиеся в плазмиде pNE-1, 10 обладают высокой степенью консервативности. Эти консервативные ОРС, кодирующие «белки с неустановленной функцией», могут быть рекомендованы в дальнейшем для поиска генетических основ синтеза токсина.
Исследование выполнено при поддержке ДВФУ, проект №14-08-06-19 и и программой фундаментальных научных исследований «Дальний Восток» №15-I-3-036.
-
1.
-
2.
-
3.
-
4.
-
5.
-
6.
-
7.
-
8.
-
9.
Список литературы Поиск генов, ответственных за биосинтез токсинов гуанидинового ряда в бактериях Bacillus sp 1839 и Pseudoalteromonas sp 2138
- Nieto, F.R. Tetrodotoxin (TTX) as a therapeutic agent for pain/F.R. Nieto, E.J. Cobos, M.Á. Tejada et al.//Mar Drugs. 2012. No10(2). P. 281-305.
- Lago, J. Tetrodotoxin, an Extremely Potent Marine Neurotoxin: Distribution, Toxicity, Origin and Therapeutical Uses/J. Lago, L. P. Rodríguez, L. Blanco et al.//Mar. Drugs. 2015. No 13. P. 6384-6406.
- Verde, C.B. Tetrodotoxin-Bupivacaine-Epinephrine Combinations for Prolonged Local Anesthesia/C.B. Berde, U. Athiraman, B. Yahalom et al.//Mar. Drugs. 2011. No 9. P. 2717-2728.
- Goessweiner-Mohr, N. Conjugative type IV secretion systems in Gram-positive bacteria/N. Goessweiner-Mohr, K. Arends, W. Keller, E. Grohmann//Plasmid. 2013. V. 70(3). P. 289-302.
- Chau, R. Diversity and biosynthetic potential of culturable microbes associated with toxic marine animals/R. Chau, J.A. Kalaitzis, S.A. Wood, B.A. Neilan//Mar. Drugs. 2013. No 11. P. 2695-2712.
- Kellmann, R. Identification of a saxitoxinbiosynthesis gene with a history of frequent horizontal gene transfers/R. Kellmann, T.K. Michali, B.A. Nielan//J. Mol. Evol. 2008. V. 67. P. 526-538.
- Liu, J. Production level of tetrodotoxin in Aeromonas is associated with the copy number of a plasmid/J. Liu, F. Wei, Y. Lu et al.//Toxicon. 2015. V. 101. P. 27-34.
- Magarlamov, T.Y. Tetrodotoxin-producing Bacillus sp. from the ribbon worm (Nemertea) Cephalothrix simula (Iwata, 1952)/T.Y. Magarlamov, I. Beleneva, A. Chernyshev, A. Kuhlevsky//Toxicon. 2014. V.85. P. 46-51.
- Chau, R. On the origins and biosynthesis of tetrodotoxin/R. Chau, J.A. Kalaitzis, B.A. Neilan//Aquatic Toxicology. 2011. V. 104. P. 61-72.


