Поиск молекулярно-генетических предикторов развития агрессивных лимфом
Автор: Березина Ольга Валерьевна, Поспелова Татьяна Ивановна, Филипенко Максим Леонидович, Воропаева Елена Николаевна, Овчинников Виктор Сергеевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.32, 2017 года.
Бесплатный доступ
Изучены полиморфные локусы генов фолатного обмена: C677T и A1298C MTHFR, A2756G MTR, A66G MTRR, G1958A MTHFD1 и 844ins68 CBS у больных агрессивными неходжкинскими злокачественными лимфомами. Обнаружена ассоциация редкого аллеля 1958A гена MTHFD1 со снижением риска развития диффузной В-крупноклеточной лимфомы (OR=0,429; C.I. [0.279-0.659], p
Генетический полиморфизм, фолаты, лимфома, предрасположенность
Короткий адрес: https://sciup.org/14920190
IDR: 14920190 | УДК: 616
Текст научной статьи Поиск молекулярно-генетических предикторов развития агрессивных лимфом
Выявление молекулярно-генетических маркеров развития и прогноза для опухолевых заболеваний крови составляет суть предиктивной онкогематологии, основной задачей которой является поиск доказательств диагностической ценности тех или иных генных полиморфизмов [3]. В качестве потенциальных маркеров исследуются гены различных систем клетки: метаболизма ксенобиотиков, апоптоза, цитокинов и др. Среди них большой интерес представляют гены фолатного обмена – важной биохимической системы клетки, влияющей на регуляцию экспрессии генов путем эпигенетической модификации ДНК (рис. 1). Метилирование CpG-островков в промоторе гена является нормальным процессом регуляции степени экспрессии генов в клетках. Гиперметилирование промоторов генов, которое связано с подавлением транскрипции, так же как и мутации, является механизмом инактивации классических генов-супрессоров опухолевого роста [12]. Аномальное метилирование генов-супрессоров опухолей встречается на ранних стадиях онкогенеза и прогрессивно увеличивается, что в конечном итоге приводит к злокачественной трансформации. Аберрантное метилирование ДНК и, как следствие, измененная экспрессия генов описаны при В-клеточных неходжкин-ских злокачественных лимфомах (НХЗЛ) [10]. Полимор- фные варианты генов фолатного цикла, которые влияют на метилирование ДНК, могут способствовать возникновению неходжкинских злокачественных лимфом, вызывая гипо- или гиперметилирование протоонкогенов и генов супрессоров опухолевого роста соответственно [11].
В связи с тем, что отмечается увеличение частоты агрессивных НХЗЛ в г. Новосибирске [5] актуально исследование однонуклеотидных замен (SNPs) в генах фолат-ного цикла как потенциальных молекулярно-генетических маркеров развития лимфоидных неоплазий.
Цель работы: изучить роль полиморфных локусов C677T и A1298C гена метилентетрагидрофолатредукта-зы ( MTHFR ), A2756G гена метионинсинтазы ( MTR ), A66G гена метионинсинтазыредуктазы ( MTRR ), G1958A гена метилентетрагидрофолатдегидрогеназы ( MTHFD1 ) и 844ins68 гена цистатион- β -синтазы ( CBS ) в формировании предрасположенности к развитию агрессивных НХЗЛ.
Материал и методы
Выборки. Группу обследованных составили 89 пациентов (46 мужчин и 43 женщины; средний возраст 49,4±14,2 года) Городского гематологического центра города Новосибирска с диагнозом агрессивной неходж-кинской лимфомы. Диагностика и лечение НХЗЛ прово-
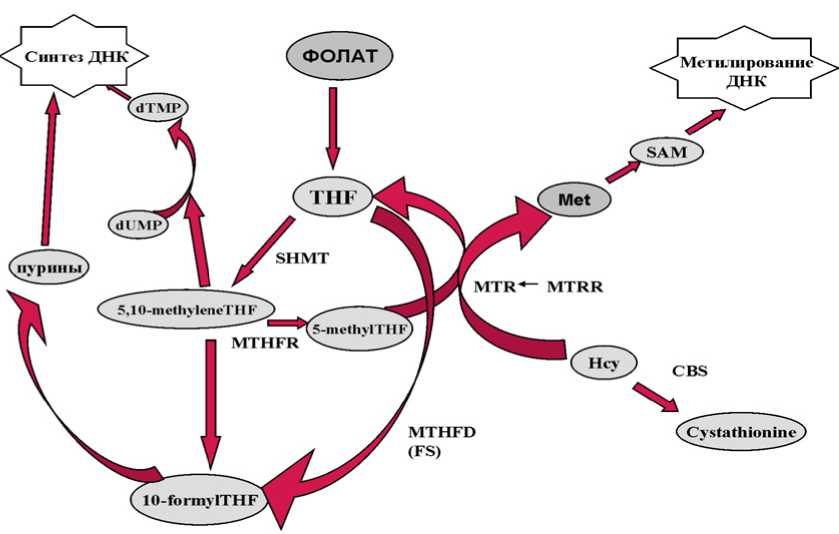
Рис. 1. (адаптировано из [15]) Фолатный цикл: dTMP – тимидин; dUMP – уридин; THF – тетрагидрофолат; 5,10-methyleneTHF – 5,10-метилентетрагидрофолат; 5-methylTHF – 5-метилтетрагидрофолат; 10-formylTHF – 10-формилтетрагидрофолат; Met – метионин; Hcy – гомоцистеин; SAM – S-аденозилметионин; MTHFR – метилентетрагидрофолатредуктаза; SHMT – серилгидрокси-метилтрансфераза; MTHFD – метилентетрагидрофолатдегидрогеназа; MTR – метионинсинтаза; MTRR – редуктаза метионинсин-тазы; SHMT – серингидроксиметилтрансфераза; CBS – цистатионин- β -синтаза; Cystathionine – цистатионин
дилось согласно Российским клиническим рекомендациям по диагностике и лечению лимфопролиферативных заболеваний [1]. Вариант НХЗЛ оценивался согласно классификации лимфоидных неоплазий ВОЗ 2008 года. В-клеточные лимфомы имели 79 (88,8%) человек. Диффузная В-крупноклеточная лимфома диагностирована у 56 (71%) пациентов, анапластическая и мантийноклеточная – у 8 (10,1%) человек каждая, лимфобластная и фолликулярная 3-го цитологического типа – у 3 (3,8%) человек каждая, беркиттоподобная у 1 (1,2%) пациента. Т-кле-точные лимфомы диагностированы у 10 (11,2%) больных.
Контрольную группу составили 549 доноров Новосибирского центра крови, средний возраст обследованных 33,0 ± 11,01 лет.
Все пациенты подписывали информированное согласие на участие в исследовании в соответствии с требованиями этического комитета.
Генотипирование. ДНК выделяли из венозной крови с использованием стандартной процедуры, включающей выделение и лизис клеток крови, гидролиз белков протеиназой К, очистку ДНК экстракцией примесей фенол-хло-роформом и осаждение ДНК этанолом; а также из буккального эпителия с использованием стандартной методики выделения ДНК на силике.
Определение генотипов полиморфных локусов G1958A гена MTHFD1 и 844ins68 гена CBS проводилось методом ПЦР-ПДРФ анализа. Определение полиморфных вариантов генов MTHFR, MTR, MTRR и SHMT1 проводилось методом ПЦР в режиме реального времени с использованием конкурирующих TaqMan-зондов, комплементар- ных полиморфной последовательности ДНК. Генотипирование осуществлялось по методике, описанной в [16].
Статистическая обработка данных. Частоты встречаемости аллелей и генотипов однонуклеотидных замен в генах фолатного цикла в выборке больных НХЗЛ сравнивали с таковыми в контрольной группе. Значимость различий оценивалась с помощью критерия χ2, статистически значимыми считались различия при р<0,05. Соответствие контрольной выборки равновесию Харди-Вайнберга также проверяли с помощью критерия χ2. Для оценки величины относительного риска использовали отношение шансов (OR) с его доверительным интервалом (C.I.) при уровне доверия 95%. Вычисления производились с помощью программы DeFinetti на сайте Института генетики человека (Мюнхен, Германия, . При оценке количественных признаков использовали вычисление средней арифметической (М) и ее ошибки (m).
Результаты
Исследованные SNPs имеют доказанное функциональное значение, т.е. изменяют активность, стабильность или количество соответствующих ферментов, что может привести к нарушению баланса между важнейшими метаболическими путями цикла фолиевой кислоты – синтезом dTMP и пуриновых нуклеотидов и метилированием ДНК, приводить к повреждению ДНК и, как следствие, инициировать онкогенез и обусловливать опухолевую прогрессию.
Таблица 1
Распределение аллелей и генотипов полиморфного локуса G1958A гена MTHFD1 в группе пациентов с агрессивными лимфомами
|
Аллели |
Контроль |
Больные ДВККЛ |
OR |
Больные ККЛ |
|
Генотипы |
1 |
2 |
С.I. |
3 |
|
Абс. % |
Абс. % |
P |
Абс. % |
|
|
n=539 |
n=54 |
ДВККЛ |
n=27 |
|
|
G |
544 50,5 |
76 70 |
2,331 |
24 44 |
|
p1–2< 0,0008 |
1,517–3,584 |
p1–3 > 0,05 |
||
|
p2–3< 0,001 |
0,0008 |
|||
|
A |
534 49,5 |
32 30 |
0,429 |
30 56 |
|
p1–2< 0,0008 |
0,279–0,659 |
p1–3 > 0,05 |
||
|
p2–3< 0,001 |
0,0008 |
|||
|
G/G |
141 26 |
27 50 |
5,209 |
3 11 |
|
p1–2< 0,003 |
1,949–13,918 |
p1–3 > 0,05 |
||
|
p2–3< 0,002 |
0,003 |
|||
|
G/A |
262 49 |
22 41 |
0,439 |
18 67 |
|
p1–2< 0,006 |
0,241–0,798 |
p1–3 > 0,05 |
||
|
0,006 |
||||
|
A/A |
136 25 |
59 |
0,192 |
6 22 |
|
p1–2< 0,003 |
0,072–0,513 |
p1–3 > 0,05 |
||
|
p2–3< 0,002 |
0,003 |
При анализе частот аллелей исследуемых полиморфных локусов в общей группе агрессивных лимфом отмечено увеличение частоты дикого 1958G-аллеля гена MTHFD1 (64%) по сравнению с контролем (50,5%, p < 0,001), тогда как редкий 1958A-аллель в группе агрессивных НХЗЛ встречался реже: 36% против 49,5% (p < 0,001).
Из группы агрессивных НХЗЛ, с учетом наибольшей представленности, были выделены пациенты с диффузной В-крупноклеточной лимфомой (ДВККЛ, n=56). Отдельному анализу также подверглись больные с другими вариантами агрессивных лимфом (Т- и В-анапластичес-кой, Т и В-лимфобластной, беркиттоподобной, мантийноклеточной, фолликулярной 3-го цитологического типа, плеоморфной, n=33), преимущественно крупноклеточными (ККЛ).
Дикий 1958G-аллель MTHFD1 в группе больных ДВККЛ встречался чаще как по сравнению с группой контроля: 70% против 50,5% (p < 0,0008), так и с группой больных ККЛ, в которой частота 1958G-аллеля составила 44% (p < 0,001). В свою очередь, частота редкого 1958A-аллеля MTHFD1 в группе больных ДВККЛ составила лишь 30%, тогда как в группе пациентов с ККЛ – 56%, а в популяции г. Новосибирска – 49,5% (табл. 1).
Учитывая различия в распределении аллелей и генотипов в группе ДВККЛ, была проведена оценка риска развития данной группы неоплазий.
Для полиморфного локуса G1958A гена MTHFD1 выявлена сильная ассоциация редкого 1958A-аллеля со сниженным риском развития ДВККЛ (OR=0,429 C.I. [0,279– 0,659], p<0,0008, табл. 1), в то время как связи данной однонуклеотидной замены с другими вариантами агрессивных лимфом не обнаружено.
Объяснением полученным данным может служить то, что однонуклеотидная замена G1958A приводит к замене Arg653Gln в формилтетрагидрафолатсинтетазном домене фермента MTHFD и уменьшает его термостабильность и метаболическую активность [7]. Поскольку субстратом данного фермента является тетрагидрофолат, потенциально его накопление способствует повышению концентрации 5,10-метилентетрагидрофолата, что, в свою очередь, может увеличивать эффективность синтеза тимидилата и метилирования ДНК, тем самым препятствуя злокачественной трансформации (рис. 1). Подтверждением этому служит ряд исследований, указывающих на протективный эффект фолата (предшественника тетрагидрофолата) в отношении НХЗЛ [6, 9].
Анализ остальных исследуемых локусов системы фо-латного цикла ассоциации с агрессивными НХЗЛ в выборке жителей г. Новосибирска не выявил.
Заключение
Проведенное исследование выявило ассоциацию полиморфного локуса G1958A гена MTHFD1 с предрасположенностью к развитию диффузной-В-крупноклеточ-ной лимфомы, что позволяет рассматривать данный локус как потенциальный маркер для включения в панель
SNPs, вклад которых в развитие и прогноз неходжкинс-ких злокачественных лимфом у жителей Западно-Сибирского региона был показан ранее [2, 4, 13]. Рискометрия НХЗЛ – это первый этап работы, направленный на выявление молекулярно-генетических предикторов, которые могут использоваться в рутинной диагностике лимфоидных неоплазий. В дальнейшем необходимо продолжить исследование на большем объеме выборки с изучением биохимических механизмов, определяющих действие полиморфных локусов генов фолатного обмена на лимфо-могенез.
Список литературы Поиск молекулярно-генетических предикторов развития агрессивных лимфом
- Аль-Ради Л.С., Барях Е.А., Белоусова И.Э. и др. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний//Современная онкология. -2014. -№S. -С. 6-126.
- Березина О.В., Поспелова Т.И., Овчинников В.С. и др. Полиморфизм глутатион-s-трансфераз m1 и т1 (GSTM1 и GSTT1) у больных неходжкинскими злокачественными лимфомами//Сибирский научный медицинский журнал. -2013. -Т. 33. -№1. -С. 40-46.
- Воропаева Е.Н., Березина О.В., Овчинников В.С. и др. Предиктивное значение тестирования полиморфного локуса Arg72Pro 4 экзона антионкогена TP53 у пациентов с неходжкинскими лимфомами//Сибирский научный медицинский журнал. -2013. -Т. 33, № 1. -С. 28-33.
- Воропаева Е.Н., Поспелова Т.И., Воевода М.И. Ассоциация полиморфизма Arg399Gln гена репарации ДНК XRCC1 с риском развития неходжкинских лимфом высокой степени злокачественности//Гематология и трансфузиология. -2013. -Т. 58, № 1. -С. 10-14.
- Ковынев И.Б., Поспелова Т.И., Агеева Т.А. и др. Частота и структура неходжкинских злокачественных лимфом в Новосибирске, НСО и городах Сибирского федерального округа//Сибирский научный медицинский журнал. -2006. -Т. 26, № 4. -С. 175-181.
- Christensen K.E., Rohlicek C.V., Andelfinger G.U. et al. The MTHFD1 p.Arg653Gln variant alters enzyme function and increases risk for congenital heart defects//Human Mutation. -2009. -Vol. 30, No. 2. -P. 212-220.
- Koutros S., Zhang Y., Zhu Y. et al. Nutrients contributing to one-carbon metabolism and risk of non-Hodgkin lymphoma subtypes//American Journal of Epidemiology. -2008. -Vol. 167, No. 3. -P. 287-294.
- Liu H., Jin G., Wang H. et al. Association of polymorphisms in one-carbon metabolizing genes and Lung Cancer risk: a case-control study in Chinese population//Lung Cancer. -2008. -Vol. 61, No. 1. -P. 21-29
- Polesel J., Dal Maso L., La Vecchia C. et al. Dietary folate, alcohol consumption and risk of non-Hodgkin lymphoma//Nutrition and Cancer. -2007. -Vol. 57, No. 2. -P. 146-150.
- Shaknovich R., Melnick A. Epigenetics and B-cell lymphoma//Curr. Opin. Hematol. -2011. -Vol. 18, No. 4. -P. 293-299.
- Skibola C.F., Curry J.D., Nieters A. Genetic susceptibility to lymphoma//Haematologica. -2007. -Vol. 92, No. 7. -P. 960-969.
- Tsou J.A., Hagen J.A. et al. DNA methylation analysis: a powerful new tool for lung cancer diagnosis//Oncogene. -2002. -Vol. 21, No. 35. -P. 5450-5461.
- Voropaeva E.N., Voevoda M.I., Maksimov V.N. et al. Prognostic impact of the tp53 rs1625895 polymorphism in dlbcl patients//British Journal of Haematology. -2015. -Vol. 169, No. 1. -P. 32-35.
- Wang L., Ke Q., Chen W. et al. Polymorphisms of MTHFD, plasma homocysteine levels, and risk of gastric cancer in a high-risk Chinese population//Clin. Cancer Res. -2007. -Vol. 13, No. 8. -P. 2526-2532.
- Weiner A.S., Gordeeva L.A., Voronina E.N. et al. Polymorphisms in folate-metabolizing genes and risk of having an offspring with congenital anomalies in the West Siberian region of Russia: a case-control study//Prenat. Diagn. -2012. -Vol. 32, No. 11. -P. 1041-1048
- Weiner A.S., Voronina E.N., Boyarskih U.A. et al. Polymorphisms in folate-metabolizing genes and risk of non-hodgkin’s lymphoma//Leukemia Research. -2011. -Vol. 35, No. 4. -P. 508-515.


