Поиск новых эффективных антиоксидантов для импрегнирования товарных форм витамина а с целью кормления сельскохозяйственных животных
Автор: Каленик Т.К., Сенотрусова Т.А., Добрынина Е.В., Фади Д., Текутьева Л.А., Матвеев В.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (90), 2021 года.
Бесплатный доступ
Согласно Указу Президента РФ от 21 января 2020 г. N 20 "Об утверждении Доктрины продовольственной безопасности Российской Федерации", основой для формирования национальной системы управления качеством пищевой и сельскохозяйственной продукции, основной целью которого является обеспечение качества продукции как важнейшей составляющей повышение уровня здоровья населения, повышение качества сельскохозяйственной продукции с помощью современных инновационных технологий и кормовых добавок, содействие и стимулирование роста спроса и предложения на более качественные пищевые продукты и обеспечение соблюдения прав потребителей на приобретение качественной продукции. Достижение целей Доктрины в области повышения уровня качества пищевых и кормовых продуктов предполагается реализовать с помощью некоторых задач, где одной из них является развитие в Российской Федерации производства пищевых добавок и ингредиентов, а также разработка и внедрение системы управления качеством сельскохозяйственной, пищевой продукции и создание условий для производства продукции нового поколения с заданными характеристиками качества. В связи с этим, в данной работе рассматриваются оптимальные и экономичные методы экстракции красителя из цветков Clitoria ternatea с целью сокращения длительности производственного цикла и внедрения малоотходных технологий, что может исключить нерациональное использование сырья, приводить к увеличению выпуска продукции, понижению себестоимости готового продукта, увеличению экономических показателей производства, снижению антропогенного воздействия производства на окружающую среду. Также в работе разработана и описана современная технология производства красителя, по которой возможно совершенствовать систему мониторинга качества и безопасности. Рассмотрены перспективы применения красителя из цветков Clitoria ternatea в кормовых добавках для сельскохозяйственных животных и птиц. Это несомненно может вызывать интерес у предпринимательского сообщества, поэтому можно считать, что производство натурального красителя из растительного сырья и данная работа является достаточно актуальным предметом в рамках Доктрины продовольственной безопасности Российской Федерации не только с медико-биологической, но и с технологической стороны.
Clitoria ternatea, синий краситель, антиоксиданты, антоцианы, тернатины, дельфинидин, витамин а
Короткий адрес: https://sciup.org/140290639
IDR: 140290639 | УДК: 661.155.3, | DOI: 10.20914/2310-1202-2021-4-131-141
Текст научной статьи Поиск новых эффективных антиоксидантов для импрегнирования товарных форм витамина а с целью кормления сельскохозяйственных животных
Клитория ( Clitoria ternatea ) относится к семейству Бобовые, или Мотыльковые ( Fabaceae ), род Clitoria – вечнозелёное дикорастущее травянистое растение высотой 2–3 метра с ярко выраженным голубым или белым цветком, напоминающим раковину. Ареал вида занимает всю тропическую часть Азии. К общеупотребительным названиям C. ternatea можно отнести – Butterfly Pea (мотыльковый горошек) и Pigeon Wings (голубиные крылья). Тайское название растения – анчан. Под таким названием он поступает из Таиланда на российский рынок [2]. Пигмент цветков C. ternatea в восточно-азиатских странах используется в качестве пищевого красителя из-за своей высокой стабильности и необычной колористики [3].
Установлено, что роль в образовании голубого цвета играют различные антоцианы, где их основу составляют тернатины. Тернатины ацилированные антоцианы на основе антоцианидина дельфинидина. Обнаружены 6 основных тернатинов: тернатин А 1 , тернатин А 2 , терна-тин В 1 , тернатин В 2 , тернатин D 1 , тернатин D 2 . Все они были охарактеризованы как дельфини-дин–3,3,5–тригликозиды, имеющие 3,5–сторонние цепи с D-глюкозой и пара-кумаровой кислотой (рисунок 1) [4].
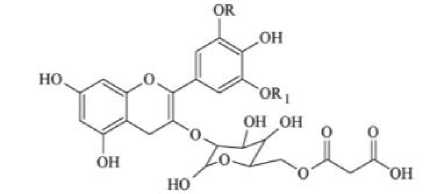
Рисунок 1. Дельфинидин–3,3,5–тригликозид с посторонними цепями
Figure 1. Delphinidin –3,3,5– triglycoside with extraneous chains
Кроме тернатинов в цветках был обнаружен кемпферол (антиоксидант) и его производные кемпферол-3-неогесперидозид, кемпферол-3-рутинозид, кемпферол-3-гликозид. Кверцетин (антиоксидант) и его производные кверцетин-3-неогесперидозид, кверцетин-3-рутинозид, квер-цетин-3-гликозид, мирицетин-3-неогесперидозид (производные антиоксидантов), мирицетин-3-рути-нозид и мирицетин-3-глюкозид также были идентифицированы и выделены из цветков C. ternatea .
С помощью жидкостной хроматографии с тандемной масс-спектроскопией были дополнительно обнаружены другие антоцианы (таблица 1) [5].
Из всех антоцианов, отображенных в таблице, наибольшую часть составляют тер-натины – они определены как большие антоциановые группы в цветках C. ternatea .
C. ternatea широко обследовалась на предмет различных фармакологических активностей [6]. В индийской медицине экспериментально доказано, что C. ternatea повышает содержание ацетилхолина в организме человека, действует как ноотроп, анксиолитик, антидепрессант, оказывает противосудорожное действие, что оправдывает его использование при заболеваниях центральной нервной системы [7]. Зарегистрировано, что C. ternatea также оказывает антимикробное, жаропонижающее, противовоспалительное, местное анестезирующее, мочегонное, противодиабетическое, инсектицидное действия, а также ингибирующее агрегацию тромбоцитов [8].
Продление периода хранения и уровня стабильности в процессе хранения является важным для производителей кормовых добавок, поскольку многие компоненты, входящие в кормовые добавки, являются весьма неустойчивыми к воздействию факторов окружающей среды.
Таблица 1.
Антоцианы, идентифицированные в экстракте с помощью жидкостной хроматографии с тандемной масс-спектроскопией
Table 1.
Anthocyanins identified in the extract by liquid chromatography with tandem mass spectroscopy
|
Соединение | Compound |
Химическая формула Chemical formula |
Молекулярная масса Molecular mass |
|
Тернатин В 1 | Ternatin В1 |
С 90 Н 97 О 48 |
1945 |
|
Тернатин В 2 | Ternatin В2 |
С 75 Н 81 О 41 |
1637 |
|
Тернатин С 1 | Ternatin С1 |
С 60 Н 65 О 34 |
1329 |
|
Тернатин D 1 | Ternatin D1 |
С 84 Н 87 О 43 |
1783 |
|
Тернатин D 2 | Ternatin D2 |
С 69 Н 71 О 36 |
1475 |
|
Дельфинидин–3–гликозид | Delphinidin–3–glucoside |
С 27 Н 31 О 17 |
627 |
|
Дельфинидин | Delphinidin |
С 15 Н 11 О 7 |
303 |
|
Пеонидин–3–О–гликозид | Peonidin–3–o–glucoside |
С 28 Н 33 О 16 |
625 |
|
Пеонидин–3–самбубиозид | Peonidin–3–sambubioside |
С 27 Н 31 О 15 |
595 |
|
3–О–β–D–гликозид–5–O–(6–кумарил–β–D–гликозид) 3–O–β–D–glucoside–5–O–(6–coumarin–β–D–glucoside) |
С 36 Н 37 О 18 |
757 |
|
Цианидин–3–(6´´–каффеил–2´´´–синапилсамбубиозид)–5–(6–малонилгликозид) Cyanidin–3–(6´´–caffeyl–2´´´–sinapilsambubioside)–5–(6–malonylglucoside) |
С 55 Н 37 О 30 |
1177 |
|
Цианидин–3–O–[2–O–(6–O–E–кумарил–β–D–гликопиранозил)]– {6–O–[4–O–(6–O–E–кумарил–β–D–гликопиранозил)–E–каффеил]– β–D–гликопиранозил}–5–O–β–D–гликопиранозид Cyanidin–3–O–[2–O–(6–OE–coumaril–β–D–glycopyranosyl)]– {6–O–[4–O–(6–OE–coumaril–β–D–glycopyranosyl)–E–caffeyl]– β–D–glycopyranosyl}–5–O–β–D–glycopyranoside |
С 66 Н 69 О 33 |
1389 |
Известно, что витамин А (полностью транс-ретинол), его активные производные ретиналь и ретиноевая кислота, а также их синтетические аналоги составляют группу ретиноидов. Его получают с пищей, кормом либо в виде предварительно сформированного витамина А, либо в виде каротиноидов. Ретиналь играет биологическую роль для зрительной системы, но большинство эффектов витамина А осуществляется ретиноевой кислотой, которая связывается с ядерными рецепторами и регулирует транскрипцию генов.
Известно, что витамин А оказывает несколько плейотропных эффектов на дифференцировку клеток и эмбриогенез. Ретиноевая кислота и ее предшественник ретинол, как известно, участвуют в поддержании, дифференцировке и функции многих эпителиальных тканей.
Дефицит витамина А в рационе сельскохозяйственных животных и птиц является важной проблемой в настоящее время, особенно в развивающихся странах. Ретинол и каротиноиды из рациона во время беременности и кормления грудью влияют на их концентрацию в грудном молоке, что в долгосрочной перспективе важно не только для потомства, но и для здоровья матери [9].
Цель работы – выбрать оптимальный и экономичный метод извлечения красителя из цветков C. ternatea с целью сокращения длительности производственного цикла и внедрения малоотходных технологий, а также изучение влияния экстракта цветков C. ternatea на микробиологические показатели микрокапсулированного кормового витамина А в процессе хранения.
Материалы и методы
Метод определения зависимости цвета водного экстракта C. ternatea от активной кислотности раствора заключается в определении длины волны, соответствующей максимуму светопоглощения раствора анализируемого красителя. Для этого 1 г порошкообразной C. ternatea пересыпали в коническую колбу объемом 500 см3 и добавляли 300 см3 дистиллированной воды. Нагревали на водном термостате в течение 40–45 мин в диапазоне температур от 60 до 65 ℃. После окончания экстракции полученную жидкость фильтровали, а шрот отправляли на прессование. Отжатую жидкость смешивали с первоначальной и отправляли на вторичное фильтрование. Полученный экстракт оставляли на хранение. Далее водный экстракт перелили в 13 колб объемом 50 см3 по 20 см3 каждый. В каждой колбе создали собственный рН от 1 до 13. Для регистрирования значения активной кислотности пользовались рН-метром со стеклянным электродом.
Получившиеся растворы дозировали пипеткой в кюветы спектрофотометра, имеющие рабочую длину 1 см. Регистрировали спектр поглощения относительно оптической плотности дистиллированной воды (раствор сравнения)
в диапазоне длин волн от 400 нм до 700 нм в соответствии с инструкцией по эксплуатации спектрофотометра Shimadzu UV-1800 (Япония).
Полученные спектральные графики были анализированы и расшифрованы, составлена колористика.
Экстракт высушивали при 50 ℃ на роторном испарителе. Чтобы получить водный экстракт к 10 мг высушенного экстракта добавляли 100 мл дистиллированной воды (10 мг/100 мл).
Микробиологические показатели безопасности определяли стандартным методом. Количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) определяли по ГОСТ 10444.15–94 [11]. Наличие дрожжей и плесневыех грибов определяли по 14. ГОСТ10444.12–2013 [12].
Результаты
Базовые режимы экстракции были определены из трёх разных научных трудов по экстракции пигментов из C. ternatea (таблица 2).
I метод извлечения описывал холодную экстракцию антоцианов. Для этого 10 г. порошка C. ternatea замачивали в 100 мл воды и оставляли на 24 часа при 25 ℃ (гидромодуль 1:10) [12].
II метод описывал тёплую экстракцию антоцианов при температуре 54 ℃. Для этого 2,7 г порошка C. ternatea замачивали в 100 мл воды (гидромодуль 1:37) и оставляли экстрагироваться в термостате на 74 мин при 54 °C [13].
III метод описывал горячую экстракцию антоцианов при температуре 59,6 ℃. Для этого 0,3 г порошка C. ternatea замачивали в 100 мл воды (гидромодуль 1:333) и оставляли экстрагироваться в термостате на 37 мин при 59,6 °C [14].
Таблица 2.
Table 2.
Базовые режимы экстракции цветков
Basic Flower Extraction Modes
|
Показатели | Indicators |
I метод | Method I |
II метод | Method II |
III метод | Method III |
|
Температура экстрагирования, ℃ | Extraction temperature, ℃ |
25 |
54 |
59,6 |
|
Время экстрагирования, мин | Extraction time, min |
1440 |
74 |
37 |
|
Значение Гидромодуля | Hydro module value |
1:10 |
1:37 |
1:333 |
|
Содержание сухих веществ, г | Dry matter content, gr |
5,643 |
1,578 |
0,184 |
|
Выход пигмента η, % | Pigment yield η, % |
56,43 |
58,4 |
61,3 |
Данные таблицы показывают, что из предложенных методов извлечения пигментов – горячая экстракция (III метод) является самой эффективной (по времени, гидромодулю и выходу продукта). С помощью алгебраических подсчетов был выявлен собственный наиболее оптимальный гидромодуль (1:300), оптимальный временной промежуток (40–45 мин), а экспериментально была определена оптимальная температура экстракции. Диапазон температур от 35 до 80 ℃.
Таблица 3.
Определение оптимального температурного режима
Table 3.
Determination of the optimal temperature regime
|
Показатель | Indicators |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Температура экстрагирования, ℃ | Extraction temperature, ℃ |
35 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
75 |
80 |
|
Содержание сухих веществ, г | Dry matter content, gr |
0,566 |
0,625 |
0,649 |
0,634 |
0,645 |
0,651 |
0,667 |
0,656 |
0,615 |
0,581 |
|
Выход пигмента η, % | Pigment yield η, % |
56,6 |
62,5 |
64,9 |
63,4 |
64,5 |
65,1 |
66,7 |
65,6 |
61,5 |
58,1 |
Для более удобной оценки результатов данные представлены в виде точечной диаграммы на рисунке 2.
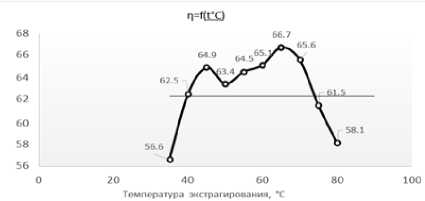
Рисунок 2. Зависимость выхода пигмента от температур в диапазоне от 35 до 80 ℃
Figure 2. Dependence of the pigment yield on temperatures in the range from 35 to 80 ℃
Влияние активной кислотности (рН) наблюдали путем добавления концентрированных растворов кислот и щелочей в свежеприготовленный экстракт цветков C. ternatea , выработанный по режиму экстракции с оптимальными технологическими параметрами.
Смена окраски антоцианов связана с ионным механизмом Оствальда. Оствальд предполагал, что антоцианы являются кислотно-основными индикаторами, а, следовательно, являются слабыми кислотами или слабыми основаниями, которые способны диссоциироваться в водных растворах. При этом наблюдается образование равновесия ионизированных форм (щелочная среда) и протонированных (молекулярных) форм
(кислая среда). В зависимости от соотношения последних и наблюдается определенная окраска в растворе. В результате изменения значения водородного показателя происходит смещение равновесия диссоциации антоциана, и, как следствие, изменение его окраски.
Дельфинидин-3-гликозид, содержащийся в экстракте, является слабой кислотой, так как отвечает уравнению диссоциации (1):
НInd + Н 2 O = Н 3 O + Ind– (1) где НInd (протонированная форма антоциана) – цвет красный; Ind– (ионизированная форма антоциана) – цвет синий.
В кислой среде (рН <7) равновесие смещается влево, в сторону кислой формы НInd. В щелочной среде (рН > 7) равновесие смещается вправо, в сторону основной формы Ind– При рН = 1–3 антоцианидин существует в молекулярной форме. При рН = 4–5 происходит присоединение гидроксид-иона с образованием псевдооснования. При повышении рН до значений 6–7 отщепляется вода и образуется хиноидная форма. Наконец, при рН = 8–9 хиноидная форма гидролизуется с разрывом цикла и образованием халкона. Ниже представлены спектральные графики экстрактов цветков C. ternatea .
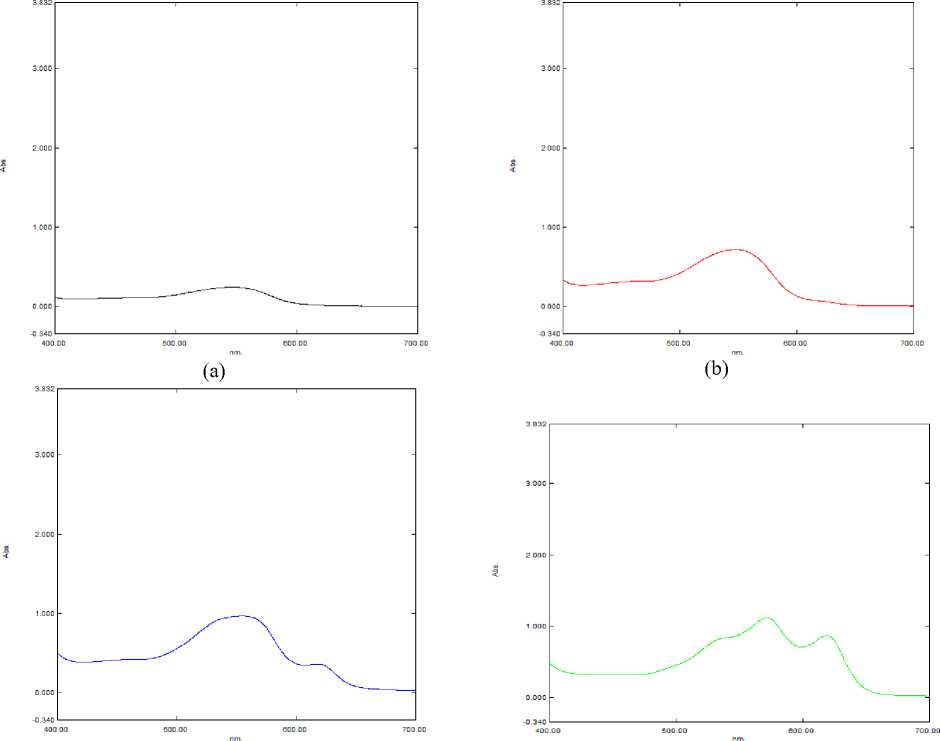
(c) (d)
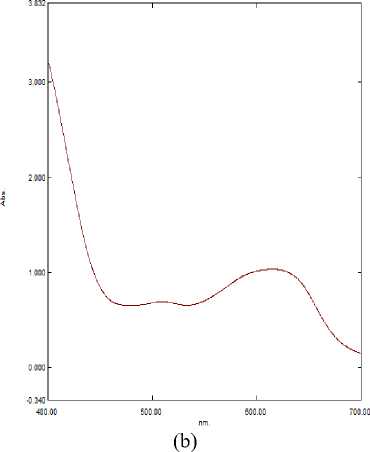
Рисунок 3. Спектр поглощения экстракта цветков при (a) pH = 1; pH = 2 (b); (c) pH = 3; (d) pH = 4
Figure 3. Absorption spectrum of flower extract at (a) pH = 1; pH = 2 (b); (c) pH = 3; (d) pH = 4
На спектральном графике (рисунок 3а) заметно, что пик достаточно «смазан», трудно определить значение пика оптической плотности и длины волны. Это говорит о том, что преобладает протонированная форма дельфинидина, которая считается достаточно неустойчивой. Образование ионизированной формы подавлено.
На спектральном графике (рисунок 3b) пик менее «смазан». Можно определить четкое значение оптической плотности. Равновесие
«готовится» сместиться в сторону ионизированной формы.
На спектральном графике (рисунок 3c) наблюдается батохромный сдвиг (сдвиг максимума поглощения в красную сторону) из 548 нм в 555 нм. Происходит ионизация антоциана; второй пик с длиной волны в 618 нм характеризует ионизированную форму дельфинидина. Равновесие смещается в правую сторону, доля протонированной формы начинает падать.
На спектральном графике (рисунок 3d) продолжается батохромный сдвиг в красную область (из 555 нм в 572 нм). Четко видно два пика и плечо, наблюдаемое в синей области. Появляется промежуточная форма. Доля протонированной формы продолжает падать.
На спектральном графике (рисунок 4а) заметно, что достигается равновесие между протонированной и ионизированной формой антоциана. Начало образования стабильной формы антоциана.
На спектральном графике (рисунок 4б) наблюдается образование стабильной и устойчивой формы антоциана. Батохромного сдвига не наблюдалось.
На спектральном графике (рисунок 4в) наблюдается резкое повышение доли ионизированной формы антоциана с батохромным сдвигом. Первый пик начинает «смазываться». Образование протонированной формы подавлено. Это устойчивая форма антоциана.
На спектральном графике (рисунок 4г) первый пик полностью редуцируется. Это говорит о том, что при таком значении рН преобладает ионизированная форма. Наблюдается полный батохромный сдвиг
На спектральном графике (рисунок 5а) пик уплотняется, дополнительного батохромного сдвига не наблюдается. Преобладает ионизированная форма.
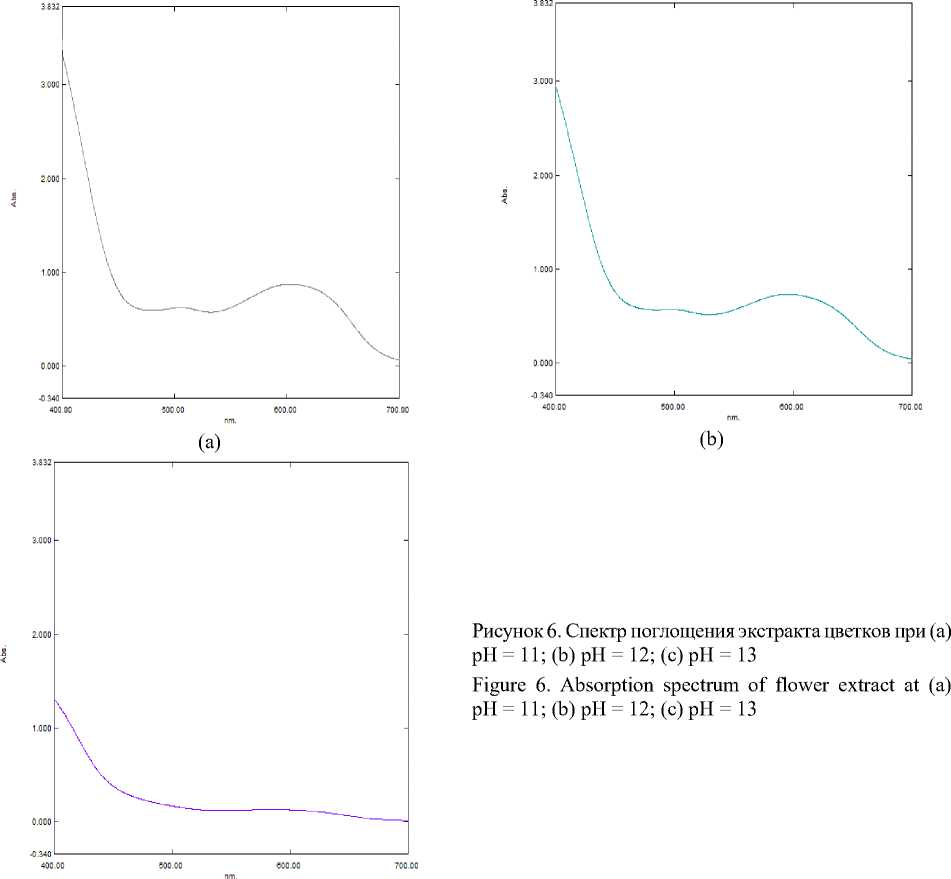
На спектральном графике (рисунок 5б) в синей области (ближе к ультрафиолетовой) наблюдается резкое повышение значения оптической плотности. Пик постепенно «смазывается». На спектральном графике (рисунок 6а) наблюдается дальнейшее «смазывание» пика. Это говорит о деградации ионизированной формы антоциана и ее разрушении, вследствие повышенной щелочности среды.
На спектральных графиках (рисунок 6б и 6в) показано полное разрушение ионной формы антоциана. При рН = 13 пик полностью «смазывается».
Для итогового понимания зависимости цветового параметра от кислотности раствора составлена таблица 4, отражающая колори-стику экстрактов.
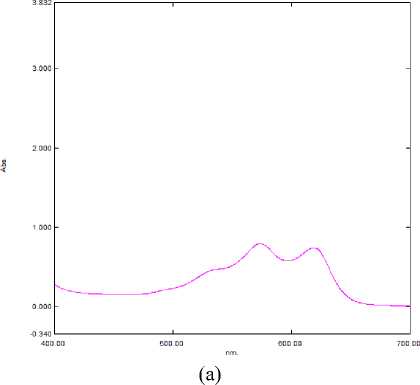
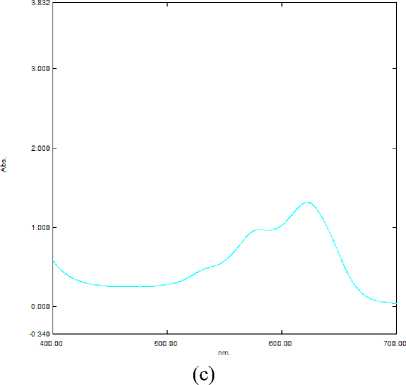
Рисунок 4. Спектр поглощения экстракта цветков при (a) pH = 5; (b) pH = 6; (c) pH = 7; (d) pH = 7
Figure 4. Absorption spectrum of flower extract at (a) pH = 5; (b) pH = 6; (c) pH = 7; (d) pH = 7
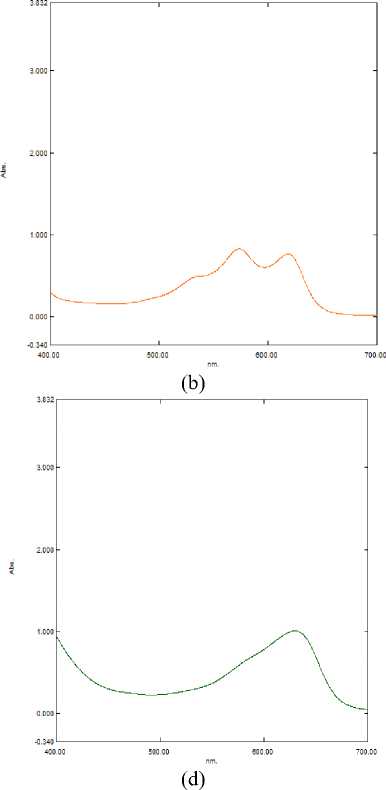
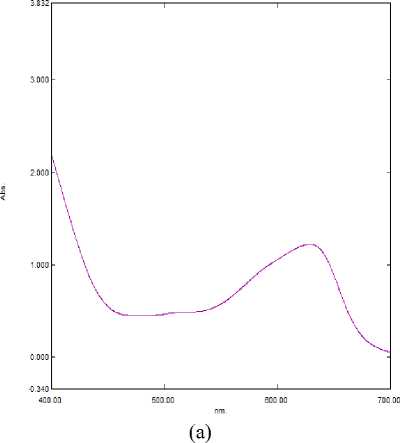
Рисунок 5. Спектр поглощения экстракта цветков при (a) pH = 9; (b) pH = 10
Figure 5. Absorption spectrum of flower extract at (a) pH = 9; (b) pH = 10
(c)
Таблица 4.
Зависимость цветового параметра экстракта от активной кислотности раствора
Dependence of the color parameter of the extract on the active acidity of the solution
Table 4.
|
Проба Sample |
рН |
ʎ, нм (I пик) ʎ, nm (I peak) |
ʎ, нм (II пик) ʎ, nm (II peak) |
Цвет экстракта Color of extract |
Примечание* Note* |
|
I |
1,0 |
548 |
- |
Светло-розовый | Light pink |
I пик «смазан» | I peak is "blurred" |
|
II |
2,0 |
548 |
- |
Пурпурный | Purple |
I пик менее «смазан» | I peak is less "blurred" |
|
III |
3,0 |
555 |
618 |
Светло-Фиолетовый Light purple |
II пик в виде плеча | II peak in the form of a shoulder |
|
IV |
4,0 |
572 |
619 |
Темно-Фиолетовый Dark – purple |
I и II пик хорошо выражены I and II peaks are well pronounced |
|
V |
5,0 |
574 |
619 |
Синий | Blue |
|
|
VI |
6,0 |
574 |
619 |
Темный индиго | Dark indigo |
|
|
VII |
7,0 |
581 |
622 |
Насыщенный ярко-синий Saturatedbright blue |
I пик в виде плеча I peak in the form of a shoulder |
|
VIII |
8,0 |
– |
630 |
Изумрудный | Emerald |
I пик редуцируется | I peak is reduced |
|
IX |
9,0 |
629 |
Темно-зеленый | Dark green |
I пик редуцируется | I peak is reduced |
|
|
X |
10,0 |
613 |
Зеленый | Green |
II пик «смазан» | II peak is "blurred" |
|
|
XI |
11,0 |
601 |
Светло-зеленый | Light green |
II пик «смазан» | II peak is "blurred" |
|
|
XII |
12,0 |
601 |
Болотный | Swamp |
II пик редуцируется | II peak is reduced |
|
|
XIII |
13,0 |
– |
Желто-зеленый | Yellow green |
II пик редуцируется | II peak is reduced |
*(I пик – протонированная форма, II пик – ионная форма)
*(I peak – protonated form, II peak – ionic form)
Анализ экстрактов цветков при разных значениях водородного показателя на спектрофотометре показал, что антоцианы могут принимать различные формы. Наиболее стабильной и биодо-ступной формой для человека является ионизированная форма дельфинидина. Протонированная форма является сравнительно неустойчивой и в кишечнике человека всасывается в несколько раз хуже. Поэтому очень важно при использовании экстракта в качестве натурального красителя соблюдать его рН. С помощью исследований, проведенных с помощью спектрофотометра, было выявлено оптимальное значение водородного показателя антоциана дельфинидина, который равен диапазону от 4,5 до 7,5.
Определив оптимальные параметры получения экстракта цветков C. ternatea , далее изучили его влияние на процесс хранения микрокапсулированного кормового витамина А. В таблице 5 показана влияние добавления экстракта цветков C. ternatea на изменение микробиологических показателей микрокапсулированного витамина А при хранении, 6 месяцев.
Таблица 5.
Микробиологические показатели микрокапсулированного витамина А при хранении, 6 месяцев
Table 5.
Microbiological indicators of microencapsulated vitamin A during storage, 6 months
|
Месяц Month Показатель Indicator |
1 |
2 |
3 |
4 |
5 |
6 |
|
ОЧГ, КОЕ/г, не более: без экстракта цветков C. ternatea ОЧГ, CFU / g, no more: without extract of flowers of C. ternatea |
1,4x102 |
1,6x102 |
1,8x102 |
2,1x102 |
2,5x102 |
2,8x102 |
|
ОЧГ, КОЕ/г, не более: с экстрактом цветков C. ternatea ОЧГ, CFU / g, no more: with extract of flowers of C. ternatea |
1.2х102 |
1.2х102 |
1.4x102 |
1.8x102 |
2,1х102 |
2.5х102 |
|
ОМЧ, КОЕ/г, не более: без экстракта цветков C. ternatea ОМЧ, CFU / g, no more: without extract of flowers of C. ternatea |
1x103 |
1,6x103 |
1,8x103 |
2,1x103 |
3,2x103 |
4,3x103 |
|
ОМЧ, КОЕ/г, не более: с экстрактом цветков C. ternatea ОМЧ, CFU / g, no more: with an extract of flowers of C. ternatea |
1x103 |
1,2x103 |
1.4x103 |
1,6х103 |
2,4x103 |
2,6x103 |
Из таблицы можно отметить, что наименьшее значение общего числа грибов и общего микробного числа было в образце, содержащем экстракт цветков C. ternatea в концентрации 10 мг/100 мл, в то время как наибольшее количество было отмечено в образце без экстракта цветков C. ternatea при хранении, 6 месяцев Результаты показали, что экстракт уменьшил рост микроорганизмов. Это связано с тем, что экстракт обладает высокимсодержанием биологически активных веществ, обладающих антимикробной активностью.
Заключение
Выбран наиболее оптимальный метод экстракции пигмента цветков C. ternatea и экспериментально подобраны наиболее экономичные технологические параметры. Выявлено, что оптимальный режим экстракции антоцианов цветков C. ternatea составляет при гидромодуле 1:300, температурном диапазоне 60-65 ℃, временном промежутке 40–45 мин. Исследовано влияние активной кислотности (рН) на изменение цвета экстракта, полученного из C. ternatea . Установлено, что при добавлении красителя в сильнокислотные или сильнощелочные пищевые системы происходит деградация антоцианов и изменение цвета. Выявлен диапазон оптимального значения рН (от 4,5 до 7,5).
Описаны и расшифрованы спектры поглощения экстрактов C. ternatea при разных значениях рН. Спектральные графики помогли объяснить и понять процессы деградации антоцианов при разных значениях водородного показателя, что безусловно имеет значение при моделировании технологических процессов производства.
Изучено влияние экстракта цветков C. ternatea на микробиологические показатели безопасности микрокапсулированного кормового витамина А. Из полученных результатов следует, что снижение активности развития микроорганизмов связано с содержанием в экстракте цветков C. ternatea биологически активных веществ, обладающих антимикробной активностью.
Работа выполнена при финансовой поддержке Минобрнауки России в рамках реализации комплексного проекта по созданию высокотехнологичного производства, предусмотренного постановлением Правительства Российской Федерации от 9 апреля 2010 г. № 218. Проект «Разработка промышленной технологии и организация в Дальневосточном федеральном округе высокотехнологичного производства кормового витамина А повышенной стабильности и биодоступности», соглашение № 075–11–2021–065 от 25 июня 2021 г.
Список литературы Поиск новых эффективных антиоксидантов для импрегнирования товарных форм витамина а с целью кормления сельскохозяйственных животных
- Об утверждении Доктрины продовольственной безопасности Российской Федерации: указ Президента РФ от 21 января 2020 г. №20.
- Shamnad J. Mineral and nutritional potential of Clitoria ternatea L. variants as forage // Journal of Tropical Agriculture. 2020. V. 57. №. 2.
- Adhikary R., Sultana S., Bishayi B. Clitoria ternatea flower petals: Effect on TNFR1 neutralization via downregulation of synovial matrix metalloproteases // Journal of Ethnopharmacology. 2018. № 210. P.209-222. doi: 10.1016/j.jep.2017.08.017
- Thuy N.M., Minh V.Q., Ben,T.C., Thi Nguyen M.T. et al. Identification of Anthocyanin Compounds in Butterfly Pea Flowers (Clitoria ternatea L.) by Ultra Performance Liquid Chromatography/Ultraviolet Coupled to Mass Spectrometry // Molecules. 2021. V. 26. №. 15. P. 4539. dot: 10.3390/molecules26154539
- Ahmad N.A., Yook Heng L., Salam F., Mat Zaid M.H. et al. A Colorimetric pH Sensor Based on Clitoria sp and Brassica sp for Monitoring of Food Spoilage Using Chromametry // Sensors MDPI. 2019. № 19(21). P.4813. doi: 10.33 90/s 19214813
- Rao A.S., Shobha K.L., Md'Almeida P., Rai K.S. In vitro antimicrobial activity of root extract of Clitoria ternatea // Asian Journal of Pharmaceutical and Clinical Research. 2017. V. 10. №. 11. P. 52-54. doi: 10.22159/ajpcr.2017.vl0il 1.19992
- Raghu K.S., Shamprasad B.R., Kabekkodu S.P., Paladhi P. et al. Age dependent neuroprotective effects of medhya rasayana prepared from Clitoria ternatea Linn in stress induced rat brain // Journal of ethnopharmacology. 2017. № 197. P.173-183. doi: 10.1016/j.jep.2016.07.068
- Chayaratanasin P., Barbieri M.A., Suanpairintr, N., Adisakwattana S. Inhibitory effect of Clitoria ternatea flower petal extract on fructose-induced protein glycation and oxidation-dependent damages to albumin in vitro // BMC Complement & Alternative Medicine. 2015. № 15. P.27-32. doi: 10.1186/sl2906-015-0546-2
- Cabezuelo M.T., Zaragozá R., Barber T., Viña J.R. Role of vitamin A in mammary gland development and lactation // Nutrients. 2020. V. 12. №. 1. P. 80. doi: 10.3390/nul2010080
- ГОСТ 10444.15-94. Продукты пищевые. Методы определения количества мезофильных аэробных и факультативно -анаэробных микроорганизмов.
- ГОСТ10444.12-2013. Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества дрожжей и плесневых грибов.
- Rocha R., Pinela J., Abreu R., Añibarro-Ortega M. et al. Extraction of Anthocyanins from Red Raspberry for Natural Food Colorants Development: Processes Optimization and in vitro Bioactivity // Processes. 2020. V. 8. №2. 11. P. 1447. doi: 10.3390/pr8111447
- Baskaran A., Mudalib S. K. A., Izirwan I. Optimization of aqueous extraction of blue dye from butterfly pea flower // Journal of Physics: Conference Senes. IOP Publishing, 2019. V. 1358. №. 1. P. 012001.
- Lakshan S.A.T., Jayanath N.Y., Abeysekera W.P.K.M., Abeysekera W.K.S.M. A commercial potential blue pea (Clitoria ternatea L.) flower extract incorporated beverage having functional properties // Evidence-Based Complementary and Alternative Medicine. 2019. V. 2019. doi: 10.1155/2019/2916914
- McDowell L.R. Vitamins in animal nutrition: comparative aspects to human nutrition. Elsevier, 2012.
- Salami S.A., Guinguina A., Agboola J.O., Omede A.A. et al. In vivo and postmortem effects of feed antioxidants in livestock: a review of the implications on authorization of antioxidant feed additives // Animal. 2016. V. 10. №. 8. P. 1375-1390.
- Kafantaris I., Kotsampasi B., Christodoulou V., Kokka E. et al. Grape pomace improves antioxidant capacity and faecal microflora of lambs//Journal of Animal Physiology and Animal Nutrition. 2017. V. 101. №. 5. P. el08-el21. doi: 10.1111/ipn. 12569
- Mirzaei-Aghsaghali A. Importance of medical herbs in animal feeding: A review // Ann. Biol. Res. 2012. V. 3. №2. 9. P. 3-933.
- Celi P., Gabai G. Oxidant/antioxidant balance in animal nutrition and health: the role of protein oxidation // Frontiers m Veterinary Science. 2015. V. 2. P. 48. doi: 10.3389/fvets.2015.00048
- Blaszczyk A., Augustyniak A., Skolimowski J. Ethoxyquin: an antioxidant used in animal feed // International journal of food science. 2013. V. 2013. doi: 10.1155/2013/585931


