Показатели антиоксидантной активности при идиопатическом бесплодии: когортное исследование
Автор: Кудрявцева Е.В., Березина Д.А., Ковалев В.В., Гаврилов И.В., Базарный В.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Акушерство и гинекология
Статья в выпуске: 1 т.20, 2024 года.
Бесплатный доступ
Цель: оценить уровень маркеров антиоксидантной защиты у женщин с бесплодием неясного генеза в сравнении с женщинами, имевшими хотя бы одни срочные роды живым доношенным плодом. Материал и методы. Проведено сравнительное когортное ретроспективное исследование, в которое включены 52 женщины с бесплодием неясного генеза и 85 женщин, не страдающих бесплодием. В процессе работы изучены стандартные биохимические показатели, антиоксидантная и пероксидазная активность.
Бесплодие, антиоксиданты, оксидативный стресс, пероксидаза, экстракорпоральное оплодотворение
Короткий адрес: https://sciup.org/149146384
IDR: 149146384 | УДК: 618.177 | DOI: 10.15275/ssmj2001007
Текст научной статьи Показатели антиоксидантной активности при идиопатическом бесплодии: когортное исследование
EDN: FOJDCF
1 Введение. Роль про- и антиоксидантного статуса в патологии репродуктивной системы активно изучается на протяжении многих лет. Считается, что нарушение диалектического взаимодействия между про- и антиоксидантами приводит к оксидативному стрессу (ОС). Описаны различные патогенетические механизмы ассоциации ОС с бесплодием. Предполагается, что развитие ооцитов и овуляция находятся в тесной взаимосвязи с балансом антиоксидантов и уровнем активных форм кислорода, и их дисбаланс
может приводить к бесплодию, эндометриозу, синдрому поликистозных яичников [1, 2].
Есть данные о том, что уровень маркеров ОС по-разному изменяется в зависимости от формы бесплодия [3]. Например, в работе 2013 г. A. Singh и со-авт. показано, что при бесплодии, ассоциированном с эндометриозом, уровень антиоксидантов (глутатион пероксидазы, суперооксиддисмутазы, витаминов А , С , Е ), а также общая антиоксидантная способность ниже, чем при трубном бесплодии [4]. В 2014 г. M. Rashidi и соавт. показали, что уровень маркеров ОС в фолликулярной жидкости различен при мужском и женском факторах бесплодия [3].
N. Peker и соавт. в 2021 г. продемонстрировали то, что уровень антиоксидантов снижен у женщин
с синдромом поликистозных яичников, причем наиболее низкий уровень этих показателей был у пациенток, резистентных к терапии кломифена цитратом [2]. Аналогичные результаты ранее получены в 2019 г. Е. Yildirim и соавт. [5]. Таким образом, маркеры ОС могут использоваться для выбора метода лечения бесплодия. Кроме этого известно, что препараты, используемые для стимуляции овуляции в программах экстракорпорального оплодотворения (ЭКО), могут дополнительно усугублять ОС, что связано с низким качеством ооцитов и эмбрионов, этот фактор также необходимо учитывать при подборе персонифицированной терапии [6].
Изучение маркеров ОС у женщин с бесплодием важно не только с точки зрения понимания патогенеза данной патологии, но и для предикции эффективности вспомогательных репродуктивных технологий. Известно, что ОС ассоциирован со снижением качества ооцитов и эмбрионов и, следовательно, неудачами ЭКО [7, 8]. В частности, частые неудачи ЭКО при эндометриозе объясняются высоким уровнем активных форм кислорода в сыворотке крови и фолликулярной жидкости [7, 9].
Значительную долю в структуре бесплодия занимает бесплодие неясного генеза (идиопатическое). Данная группа представляется нам особенно интересной, поскольку при отсутствии у них значимых причин бесплодия затруднительно применение этиотропной и патогенетической терапии. Именно поэтому научные исследования, направленные на изучение дополнительных механизмов нарушения репродуктивной функции, представляются крайне актуальными.
Цель — оценить уровень маркеров антиоксидантной защиты у женщин с бесплодием неясного генеза в сравнении с женщинами, реализовавшими репродуктивную функцию.
Материал и методы. Проведено сравнительное когортное ретроспективное исследование. В исследование включены 85 женщин, не страдающих бесплодием (1-я группа, контрольная), и 52 женщины с бесплодием неясного генеза (2-я группа, основная). Исследование одобрено на заседании этического комитета ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, протокол № 6 от 17.06.2022, проведено в соответствии с этическими стандартами Хельсинской декларации Всемирной медицинской ассоциации 1964 г. и ее последующими изменениями. Все пациенты подписали добровольное информированное согласие на участие в научном исследовании.
Критериями включения в 1-ю группу: наличие в анамнезе не менее одной беременности, завершившейся родами здоровым ребенком, отсутствие бесплодия в настоящее время или в анамнезе.
Критерии включения во 2-ю группу: диагноз «Бесплодие неясного генеза» (отсутствие беременности в течение не менее 12 мес при регулярной половой жизни и отсутствии контрацепции), исключение основных причин бесплодия (овуляторный цикл, маточные трубы проходимы, при исследовании спермы супруга выявлена нормозооспермия), нормальный овуляторный резерв (уровень антимюллерового гормона не менее 1,2 нг/мл), при проведении ультразвукового исследования не менее пяти фолликулов в каждом яичнике, толщина эндометрия во вторую фазу менструального цикла не менее 7 мм.
Общие критерии включения: репродуктивный возраст (18–45 лет), отсутствие тяжелой соматической патологии.
Критериями невключения явились тяжелая соматическая патология, возраст менее 18 или старше 45 лет, бесплодие установленного генеза.
Критерии исключения: наступление беременности, отказ пациентки от участия в исследовании.
Лабораторные исследования проводили на биохимическом иммуноферментном (комби) анализаторе Chemwell (модель 2910, производитель Awareness Techonology, Inc, США). Для исследований использовали сыворотку крови пациентов, взятую утром натощак. Для определения биохимических показателей использовались наборы реагентов производства Spinreact (Испания). Общий антиоксидантный статус сыворотки крови пациентов исследовали колориметрическим методом с использованием набора реагентов «Общий антиоксидантный статус» производства АО «Вектор-Бэст» (Россия). Исследование пероксидазной активности (ПА) сыворотки крови пациентов проводили колориметрическим методом с использованием реактива тетраметилбензидина производства ООО «НПО «Диагностические системы»» (Россия). Принцип метода основан на том, что перекись водорода, получая электроны от прооксидантов сыворотки крови, окисляет тетраметилбен-зидин с образованием окрашенного в синий цвет продукта. Пероксидазы, разрушая перекись водорода, тормозят эту реакцию: ПА в биологическом образце обратно пропорциональна интенсивности окраски.
Для интегральной оценки субъективного состояния участниц исследования мы использовали анкету «Субъективная оценка здоровья», разработанную В. П. Войтенко, включающую 29 параметров и используемую для оценки биологического возраста у женщин, — подсчитывается общее число неблагоприятных ответов (максимальная оценка — 29 баллов) [10].
Статистические методы. Для проведения статистической обработки использовали открытую статистическую платформу Jamovi (извлечено из , версия 2.3.19.0 (2023, Австралия), программу IBM SPSS Statistics, версия 26.0.0.0 (2019, США). Для проверки нормальности распределения полученных данных применяли тест Шапиро — Уилка. В тех случаях, когда распределение соответствовало нормальному распределению, рассчитали среднее значение показателей (М) и среднеквадратичное отклонение (SD). Для оценки уровня статистической значимости различий в исследуемых группах использовался Т-критерий Уэлча, различия принимались за значимые при уровне р<0,05. В случае если распределение показателей существенно отличалось от нормального, данные представлены с указанием медианы с интерквартильным размахом (Ме [Q1; Q3]), для оценки значимости различий в этом случае использовался критерий Манна — Уитни. Для оценки корреляционной связи между исследуемыми показателями использовали r-критерий Пирсона, корреляции считались значимыми при уровне р<0,05. Для оценки диагностической ценности показателей использовался ROC-анализ. Значение AUC (площади под кривой) указано с 95%-м доверительным интервалом.
Результаты. Средний возраст пациенток в 1-й и 2-й группах составил соответственно 34,1±4,88 и 35±4,11 года ( р =0,28). Средний рост, вес и индекс массы тела в 1-й группе были 166±5,86 см, 60,7±8,62 кг, 21,9±3,05 кг/см2. Во 2-й группе данные параметры были соответственно 165±6,22 см, 62,1±12,6 кг и 22,8±5,02 кг/см2. Различия между группами статистически не значимы ( р >0,05). Показатель субъективной
Стандартные биохимические показатели в исследуемых группах
|
Показатель |
Группа, Ме [ Q 1; Q 3] |
р |
|
|
1 |
2 |
||
|
Триглицериды, ммоль/л |
0,57 [0,47; 0,81] |
0,6 [0,42; 1,15] |
0,316 |
|
Холестерин, ммоль/л |
4,24 [3,92; 4,76] |
4,53 [3,82; 4,84] |
0, 407 |
|
Общий белок, г/л |
83,3 [80,2; 86] |
82,3 [78,8; 87,1] |
0,912 |
|
Альбумин, г/л |
54,7 [52,4; 56,3] |
54,3 [52,6; 56,5] |
0,93 |
|
Мочевая кислота, мкмоль/л |
235 [210; 267] |
249 [225; 278] |
0,108 |
|
Мочевина, ммоль/л |
5,19 [4,58; 5,88] |
5,3 [4,45; 5,68] |
0,97 |
|
Глюкоза, ммоль/л |
5,17 [4,87; 5,6] |
4,96 [4,83; 5,7] |
0,14 |
|
Креатинин, мкмоль/л |
80 [67,7; 95,4] |
81,2 [71,2; 103] |
0,104 |
|
Аспартатаминотрансфераза, ЕД/л |
16,6 [14,7; 19,4] |
16 [14,5; 18,6] |
0,129 |
|
Аланинаминотрансфераза, ЕД/л |
11,3 [8,65; 14,5] |
10,9 [9,3; 12,8] |
0,265 |
|
Кальций, ммоль/л |
8,64 [8,18; 9,09] |
8,6 [8,01; 9,15] |
0,718 |
|
Магний, ммоль/л |
2,35 [2,19; 3,08] |
2,82 [2,13; 3,81] |
0,112 |
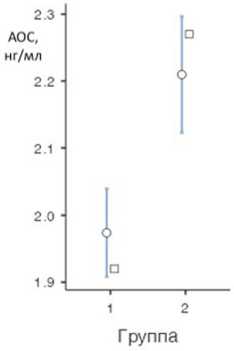
о Среднее (95% ДИ) о Медиана
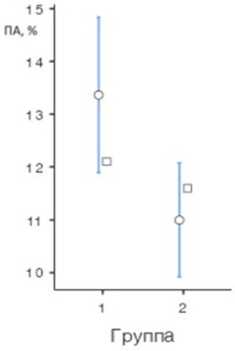
о Среднее (95% ДИ) о Медиана
б
Рис. 1. Показатели (а) общего антиоксидантного статуса в исследуемых группах, нг/мл, (б) пероксидазной активности в исследуемых группах, % оценки здоровья в исследуемых группах составил соответственно: 8,16±0,92 и 8,17±4,75 (р=0,991). Таким образом, группы клинически сопоставимы.
Первоначально мы оценили стандартные биохимические показатели в исследуемых группах, статистически значимых различий не получено (таблица).
Средний уровень общей антиоксидантной способности сыворотки (АОС) в исследуемых группах составил соответственно 1,97±0,312 и 2,21±0,312 нг/мл ( р <0,001). Таким образом, во 2-й группе АОС выше, чем в контрольной группе — различия статистически значимы (рис. 1, а ).
Далее мы оценили уровень ПА в исследуемых группах. Средний уровень составил в 1-й группе 13,4±6,67%, а во 2-й группе — 11,6±3,96% ( р <0,001). В отличие от АОС уровень ПА у женщин с бесплодием оказался ниже, чем в контрольной группе (рис. 1, б ).
Важно подчеркнуть, что клиническая ценность лабораторных параметров определяется не столько их количественными различиями между «нормой» и «патологией», сколько диагностической чувствительностью и диагностической специфичностью. Интегральным показателем является площадь под характеристической кривой (AUC) зависимости диагностической чувствительности и диагностической специфичности. Результаты проведенного
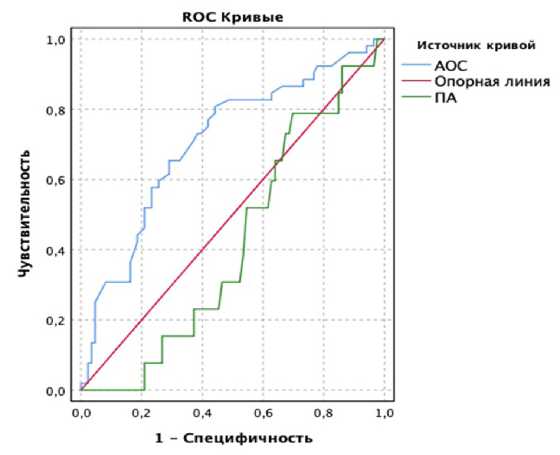
Рис. 2. Результаты ROC-анализа
ROC-анализа представлены на рис. 2. Из них следует, что величина AUC для уровня пероксидазной активности составила только 0,42 (0,325–0,514). Это не позволяет считать ее перспективным кандидатом на роль биомаркера бесплодия. Вместе
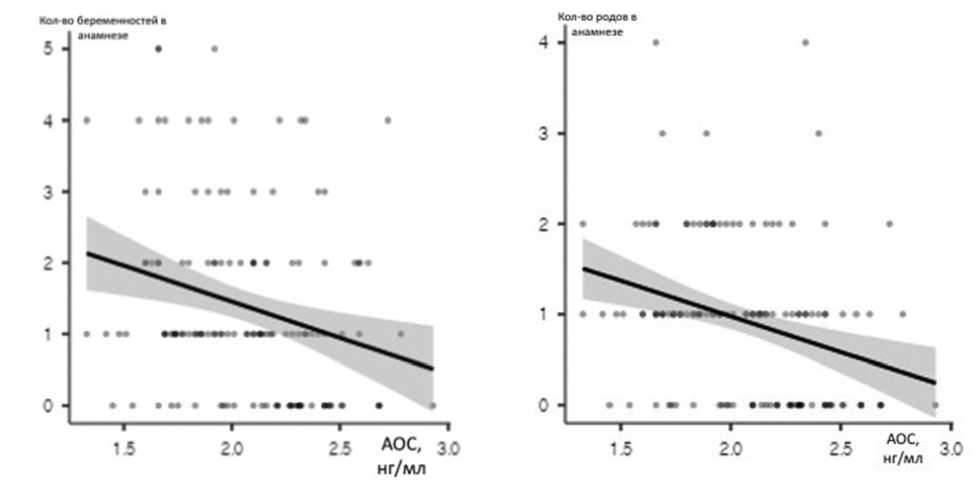
а б
Рис. 3. Зависимость между антиоксидантным статусом и числом беременностей (а) и родов (б) в анамнезе
с тем величина показателя антиоксидантной активности характеризовалась величиной AUC 0,707 (0,617– 0,798) при cut-off для данного показателя 1,99 нг/мл (диагностическая чувствительность — 77%, диагностическая специфичность — 58,1%). Данная величина AUC указывает на возможность использования АОС для прогнозирования риска бесплодия у женщин в перспективе.
Далее мы оценили взаимосвязь между показателями антиоксидантной активности и количеством беременностей и родов в анамнезе. Обнаружено, что имеется статистически значимая обратная корреляционная связь слабой силы между уровнем АОC и количеством беременностей и родов в анамнезе: значение r составило соответственно –0,257 ( p =0,002) и –0,304 ( р <0,001). Графически корреляционные связи представлены на рис. 3.
Оценены также корреляционные взаимосвязи между количеством беременностей и родов в анамнезе с уровнем ПА. Между уровнем пероксидазной активности и количеством беременностей связь статистически не значима — r =0,049 ( p =0,571). Статистически значимой взаимосвязи между ПА и количеством родов также не выявлено ( r =0,123, p =0,152).
Обсуждение. По биохимическим показателям существенных различий между здоровыми женщинами и пациентками с бесплодием неясного генеза не выявлено, в том числе по уровню мочевой кислоты, которая является антиоксидантом. Мы полагаем, это связано с тем, что наличие соматической патологии, которая могла бы повлиять на данные показатели, было критерием исключения из исследования. Наши данные несколько противоречат данным других авторов, например X. Hong и соавт. (2023 г.), в работе которых отмечено повышение уровня мочевой кислоты при бесплодии [11]. Это может быть объяснено влиянием различных факторов на содержание мочевой кислоты, таких как этническая принадлежность, характер диеты, курение, прием алкоголя и некоторых других, которые не могли полностью контролироваться при формировании когорт, обследованных в наших собственных и в других исследованиях.
В нашем исследовании установлено, что у женщин с бесплодием неясного генеза уровень АОС выше, чем у женщин, реализовавших свою репродуктивную функцию. Аналогичные результаты ранее получены Е. Isbilen и соавт. — в их исследовании 2021 г. также изучался АОС у женщин с бесплодием неясного генеза, и вопреки ожиданиям, он оказался выше, чем в контрольной группе. В исследовании S. Khodabandeh и соавт. также отмечено умеренное повышение уровня антиоксидантной защиты у женщин с бесплодием, имеющих сопутствующую патологию [12]. Уровень ОС при этом у инфер-тильных пациенток оказался ниже, по сравнению с женщинами, не имеющими проблем с реализацией репродуктивной функции [13]. Вероятно, это связано с тем, что беременности и роды в анамнезе приводят к снижению АОС — нами продемонстрирована значимая обратная взаимосвязь между уровнем АОС и количеством беременностей и родов в анамнезе. Ранее было показано, что сниженный уровень антиоксидантов может приводить к резистентности терапии кломифен цитратом, к усугублению ОС при использовании стимуляции овуляции гонадотропинами [4, 6]. У исследуемого нами контингента — женщин с бесплодием неясного генеза — уровень антиоксидантной активности был высоким, это позволяет рассчитывать на хороший ответ на стимуляцию овуляции у них, а также на достаточно высокое качество полученных ооцитов и эмбрионов.
В то же время нами показано, что чем больше беременностей и родов было у женщины в анамнезе, тем ниже уровень АОС, и тем, вероятно, выше риск ОС. Это нужно учитывать при использовании стимуляции овуляции у женщин со вторичным бесплодием, имеющих беременности в анамнезе (независимо от того, завершились ли они родами). Кроме того, в перспективе повышенный уровень АОС у женщины (выше 1,98 нг/мл) может использоваться как прогностический маркер нарушения репродуктивной функции, однако для определения эффективности использования данного показателя необходимо проведение проспективного исследования с включением в него нерожавших женщин, планирующих беременность.
Важным показателем антиоксидантного статуса является уровень пероксидазной активности. Интересно, что у женщин с бесплодием, несмотря на высокий уровень АОС (по сравнению с контрольной группой), уровень ПА оказался сниженным. Известно, что пероксидазы обладают антиапоптотическим эффектом, снижают уровень повреждения клеток [14]. Ранее в научной литературе было показано, что как при бесплодии, ассоциированном с эндометриозом, так и при бесплодии неясного генеза могут быть генетически детерминированные нарушения работы системы детоксикации, к которой относятся многие ферменты, обладающие пероксидазной активностью [1, 15–17].
Возможно, высокий уровень АОС при низком уровне ПА объясняется тем, что баланс оксидантов и антиоксидантов у женщин c идиопатическим бесплодием поддерживается за счет других механизмов, например неферментных антиоксидантов. При этом низкий уровень ПА может свидетельствовать о том, что эти пациентки находятся в группе риска по развитию ОС. Теоретически при выявлении дисбаланса между оксидантами и антиоксидантами, включение антиоксидантов в схемы лечения может быть патогенетически обосновано [13, 18]. Например, в экспериментальном исследовании, проведенном на крысах, показано, что окислительное повреждение яичников можно снизить с помощью α-липоевой кислоты [19]. Вместе с тем требуются дополнительные исследования для оценки влияния различных антиоксидантов на уровень ОС [20]. Кроме того, назначая женщинам с бесплодием неясного генеза антиоксиданты, необходимо контролировать у них уровень АОС, так как он может быть исходно повышен.
Мы полагаем, что выявленная нами взаимосвязь между количеством беременностей в анамнезе и уровнем АОС с практической точки зрения свидетельствует о том, насколько важно информировать женщин о том, что большое количество беременностей в анамнезе вне зависимости от того, как они завершились, может отрицательно повлиять на их здоровье, а также привести к преждевременному старению. Именно поэтому нужно стремиться к тому, чтобы каждая беременность заканчивалась родами. Крайне важно использовать эффективную контрацепцию, а при желании женщины забеременеть и родить ребенка — преконцепционную подготовку.
Заключение. У женщин с бесплодием неясного генеза общий антиоксидантный статус в норме, что, вероятно, позволяет рассчитывать на хороший ответ на стимуляцию овуляции, хорошее качество ооцитов и эмбрионов в программах ЭКО. При этом уровень пероксидазной активности у них низкий. Уровень АОС снижается по мере увеличения количества беременностей и родов в анамнезе; для ПА подобной взаимосвязи не выявлено.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Показатели антиоксидантной активности при идиопатическом бесплодии: когортное исследование
- Irimia Т, Puscasiu L, Mitranovici M-l, et al. Oxidative-stress related gene polymorphism in endometriosis-associated infertility. Medicina (Kaunas). 2022; 58 (8): 1105. DOI:10.3390/ medicina58081105
- Peker N, Turan G, Ege S, et al. The effect of clomiphene citrate on oxidative stress parameters in polycystic ovarian syndrome. J Obstet Gynaecol. 2021; 41 (1): 112-7. DOI: 1080/01443615.2020.1719052
- Rashidi M-RR, Eisa-Khaje J, Farzadi L, et al. Paraoxonase 3 activity and the ratio of antioxidantto peroxidation in the follicular fluid of infertile women. Int J Fertil Steril. 2014; 8 (1): 51-8. PMID: 24696769
- Singh AK, Chattopadhyay R, Chakravarty B, Cha-udhury K. Markers of oxidative stress in follicular fluid of women with endometriosis and tubal infertility undergoing IVF. Reprod Toxicol. 2013; (42): 116-24. DOI:10.1016/j.reprotox.2013.08.005
- Yildirim E, Derici MK. A case-control study on the oxidative status in women with polycystic ovary syndrome treated with clomiphene citrate. Med Sci Monit. 2019; (25): 3910-7. DOI:10.12659/MSM.914338
- Perez-Ruiz I, Meijide S, Ferrando M, et al. Ovarian stimulated cycles reduce protection of follicular fluid against free radicals. Free Radic Biol Med. 2019; (145): 330-5. DOI:10.1016/j. freeradbiomed.2019.10.004
- ilhan G, Bacanakgil BH, Vuruskan AK, et al. The effect of individual oocyte matched follicular fluid oxidant, antioxidant status, and pro- and anti-inflammatory cytokines on IVF outcomes of patients with diminished ovarian reserve. Medicine (Baltimore). 2023; 102 (4): e32757. DOI:10.1097/MD.0000000000032757
- Naigaonkar A, Dadachanji R, Hinduja I, Mukherjee S. Altered redox status may contribute to aberrant folliculogenesis and poor reproductive outcomes in women with polycystic ovary syndrome. J Assist Reprod Genet. 2021; 38 (10): 2609-23. DOI: 10.1007/sl 0815-021 -02241 -x
- Singh S, llyayeva S. Androgen insensitivity syndrome. In: StatPearls. Treasure Island (FL): StatPearls Publishing, 2023.
- Гаврилов И.В., Мещанинов В.Н., Ткаченко Е.Л. и др. Способ определения биологического возраста у женщин. Патент РФ 2617801. Опубл. 26.04.2017. Бюл. №12.
- HongX, Zhao F, Wang W, et al. Elevated serum uric acid is associated with infertility in women living in America. Sci Rep. 2023; 13 (1): 7687. DOI:10.1038/s41598-023-34702-x
- Khodabandeh S, Hosseini A, Khazali H, Azizi V Interplay between polycystic ovary syndrome and hypothyroidism on serum testosterone, oxidative stress and StAR gene expression in female rats. Endocrinol Diabetes Metab. 2022; 5 (5): e359. DOI:10.1002/edm2.359
- Isbilen E, Kulaksizoglu S, Kirmizioglu M, et al. Role of prolidase activity and oxidative stress biomarkers in unexplained infertility. Int J Gynaecol Obstet. 2022; 156 (3): 430-5. DOI:10.1002/ijgo.13899
- Krehel'ova A, Kovarikova V, Domorakova I, et al. Characterization of glutathione peroxidase 4 in rat oocytes, preimplantation embryos, and selected maternal tissues during early development and implantation. Int J Mol Sci. 2021; 22 (10): 5174. DOI:10.3390/ijms22105174
- Huang Y-Y, Wu C-H, Liu C-H, et al. Association between the genetic variants of glutathione peroxidase 4 and severity of endometriosis. Int J Environ Res Public Health. 2020; 17 (14): 5089. DOI: 10.3390/ijerph17145089
- Soria-Tiedemann M, Michel G, Urban I, etal. Unbalanced expression of glutathione peroxidase 4 and arachidonate 15-lip-oxygenase affects acrosome reaction and in vitro fertilization. Int J Mol Sci. 2022; 23 (17): 9907. DOI: 10.3390/ijms23179907
- Кудрявцева ЕВ. Роль генов детоксикации в формировании патологии репродуктивной системы. Вестник Уральской медицинской академической науки. 2013; 2 (44): 106-9.
- Tu A-S, Zhong Y, Мао X-G. [Changes of serum TOS and TAS levels and their association with apolipoprotein (a) in patients with polycystic ovary syndrome and infertility]. Nan Fang Yi Ke Da Xue Xue Bao. 2016; 36 (3): 405-9. PMID: 27063172
- Soylu Karapinar O, Pinar N, Ozcan O, et al. Protective effect of alpha-lipoic acid in methotrexate-induced ovarian oxidative injury and decreased ovarian reserve in rats. Gynecol Endocrinol. 2017; 33 (8): 653-9. DOI:10.1080/09513590.2017.1 306847
- Senturk R, Tola EN, Bozkurt M, Doguc DK The role of oxidant status on the etiopathogenesis of unexplained infertility and intracytoplasmic sperm injection — embryo transfer success: A case-control study. J Obstet Gynaecol. 2022; 42 (5): 1312-8. DOM 0.1080/01443615.2021.1960294


