Показатели деформации левого желудочка у пациентов пожилого и старческого возраста с аортальным стенозом после транскатетерной имплантации аортального клапана
Автор: Матвеева М.Г., Тер-акопян А.В., Алехин М.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Цель исследования: оценить показатели деформации миокарда левого желудочка (ЛЖ) (продольной, циркулярной и радиальной) у пациентов с симптоматически тяжелым аортальным стенозом (АС) с сохранной фракцией выброса левого желудочка (ФВ ЛЖ) после транскатетерной имплантации аортального клапана (ТИАК) в раннем послеоперационном периоде.Материал и методы. В исследование был включен 31 пациент из 69 с симптоматически тяжелым АС, которым выполнена ТИАК. Эхокардиография (ЭхоКГ) с использованием технологии двухмерной спекл-трекинг выполнялась до ТИАК и в раннем послеоперационном периоде (в течение 5 ± 1,7 дней).Результаты. Достоверно значимых различий при анализе показателей деформации ЛЖ до ТИАК и в раннем послеоперационном периоде не было получено. Наблюдалась тенденция к увеличению продольной деформации ЛЖ, в том числе продольной деформации базальных, средних и апикальных сегментов у отдельных пациентов. Продольная деформация левого предсердия (ЛП) после ТИАК не изменилась.Заключение. У пациентов пожилого и старческого возраста с тяжелым АС и сохранной ФВ ЛЖ, но со сниженными показателями деформации ЛЖ (продольного, циркулярного и радиального) после малоинвазивной ТИАК в раннем послеоперационном периоде достоверных изменений показателей деформации не было. Наблюдается тенденция к увеличению глобальной продольной деформации ЛЖ.
Аортальный стеноз, транскатетерная имплантация аортального клапана, деформация левого желудочка
Короткий адрес: https://sciup.org/149143654
IDR: 149143654 | УДК: 616.132-007.271:616.126.52-089.819.1.843:616.124.2-007.24] | DOI: 10.29001/2073-8552-2023-39-3-121-127
Текст научной статьи Показатели деформации левого желудочка у пациентов пожилого и старческого возраста с аортальным стенозом после транскатетерной имплантации аортального клапана
Стеноз аортального клапана (АК) является наиболее частой клапанной патологией сердца [1]. Основной причиной возникновения аортального стеноза (АС) являются дегенеративные изменения створок АК, которые со временем могут приводить к формированию тяжелого АС. Частота встречаемости тяжелого АС составляет 12,4% у людей старше 75 лет [2]. «Золотым стандартом» в лечении пациентов с симптоматически тяжелым АС или бессимптомный тяжелым АС со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) (класс I рекомендаций) является хирургическая замена АК [3]. Однако каждый год количество пациентов пожилого и старческого возраста, которым противопоказана открытая операция на сердце из-за сопутствующих заболеваний или высокого риска послеоперационных осложнений, увеличивается. Поэтому разумной альтернативой хирургической замене АК является малоинвазивная транскатетерная имплантация аортального клапана (ТИАК) [4].
Результаты исследований показывают, что малоинвазивная операция ТИАК у пациентов с тяжелым АС со сниженной и сохранной ФВ ЛЖ приводит к обратному ремоделированию левых камер сердца в среднесрочных и долгосрочных наблюдениях [5, 6]. Процесс обратного ремоделирования ЛЖ после ТИАК обусловлен снижением постнагрузки и заключается в уменьшении объема и массы миокарда ЛЖ [2]. Четких эхокардиографических (ЭхоКГ) параметров для определения раннего обратного ремоделирования ЛЖ после ТИАК не установлено. ФВ ЛЖ как основной показатель систолической функции ЛЖ, используемый в рутинной практике у пациентов с АС, обычно снижается на более поздних стадиях, когда по мере прогрессирования заболевания ремоделирование ЛЖ приводит к субэндокардиальной ишемии и фиброзу миокарда [7, 8]. Поэтому ФВ ЛЖ недостаточно информативна и не позволяет выявить ранние нарушения систолической функции ЛЖ.
Использование в практике двухмерной спекл-трекинг эхокардиографии (СТЭ) позволяет обнаружить доклиническую систолическую дисфункцию ЛЖ у пациентов с АС, а также оценить раннюю динамику восстановления миокардиальной механики у пациентов после замены клапана. Первыми у пациентов с АС снижаются показа- тели продольной деформации ЛЖ, что объясняется уязвимостью эндокарда к повышенному напряжению стенки вследствие ишемии и перегрузки ЛЖ давлением [9]. С увеличением выраженности АС наблюдается прогрессирующее ухудшение не только продольной, но и циркулярной и радиальной деформации ЛЖ. Эти изменения объясняются прогрессирующей дисфункцией миокарда, начинающейся в субэндокардиальном слое при легкой степени АС, до трансмуральной дисфункции при тяжелом АС [10, 11].
По данным литературы, основная масса исследований посвящена изучению динамики показателей деформации миокарда в среднесрочных и долгосрочных наблюдениях после ТИАК [5, 6, 12, 13].
Исследований, демонстрирующих раннее обратное ремоделирование ЛЖ после ТИАК, на сегодняшний день не много, и результаты их не однозначны [2, 14, 15].
Цель исследования: оценить показатели деформации миокарда ЛЖ (продольной, циркулярной и радиальной) у пациентов с симптоматически тяжелым АС с сохранной ФВ ЛЖ после ТИАК в раннем послеоперационном периоде.
Материал и методы
В исследование был включен 31 пациент из 69 с симптоматически тяжелым АС, которым через бедренную артерию была выполнена ТИАК. По доставляющему катетеру проводился и имплантировался эндопротез АК («Evolute R» или «Acurate neo») с последующей, при необходимости, дилатацией баллонным катетером. Затем выполнялась контрольная ангиографии с целью оценки положения импланта.
ЭхоКГ исследование выполнялось до ТИАК и в раннем послеоперационном периоде (в течение 5 ± 1,7 дней). Пациенты со сниженной акустической доступностью сердца и нарушениями ритма сердца (мерцательная аритмия, тахикардия и значительная вариабельность частоты сердечных сокращений (ЧСС) во время исследования) не вошли в данную работу из-за невозможности анализа СТЭ. Характеристика пациентов представлена в таблице 1.
Таблица 1. Характеристика пациентов
Table 1. Characteristics of patients
|
Возраст, лет Age, years |
75,2 (68–86) |
|
Пол (женский), n (%) Sex (women), n (%) |
19 (61,2) |
|
ИБС, n (%) CAD, n (%) |
27 (87,1) |
|
ИМ, n (%) MI, n (%) |
2 (6,4) |
|
ГБ, n (%) Hypertension, n (%) |
30 (96,8) |
|
ХОБЛ, n (%) COPD, n (%) |
1 (3,2) |
|
СД, n (%) Diabetes, n (%) |
6 (19,3) |
|
СН (NYHA) I, n (%) HF (NYHA) I, n (%) |
3 (9,6) |
|
CН (NYHA) II, n (%) HF (NYHA) II, n (%) |
16 (51,6) |
|
СН (NYHA) III, n (%) HF (NYHA) III, n (%) |
12 (38,7) |
Окончание табл. 1
End of table 1
Возраст, лет Age, years
ЭКС, n (%)
Pacemaker, n (%)
Площадь АК, см2
Area AV, sm2.
75,2 (68–86)
1 (3,2)
0,7 ± 0,2
Примечание: ИБС – ишемическая болезнь сердца, ИМ – инфаркт миокарда, ГБ – гипертоническая болезнь, ХОБЛ – хроническая обструктивная болезнь легких, СД – сахарный диабет, СН – сердечная недостаточность, СН (NYHA) I–III – классы сердечной недостаточности по системе Нью-Йоркской кардиологической ассоциации (NYHA), ЭКС – электрокардиостимулятор, АК – аортальный клапан.
Note: CAD – coronary artery disease, MI – myocardial infarction, COPD – chronic obstructive pulmonary disease, HF – heart failure, HF (NYHA) I– III – heart failure (New York Heart Association), AV – aortic valve.
АС расценивался как тяжелый, если средний систолический градиент давления через АК ≥ 40 мм рт. ст. и/ или площадь АК < 1,0 см2 [или индексированная площадь АК < 0,6 см2/м2], и/или пиковая систолическая скорость в восходящей аорте ≥ 4 м/с [4].
Трансторакальное ЭхоКГ исследование выполняли на ультразвуковом аппарате GE Vivid E9 с мультича-стотным фазированным датчиком 3S-RS (1,7–4,0 МГц) с одновременной записью электрокардиограммы. Основные позиции были получены из парастернального и апикального (2-, 4- и 5-камерные позиции) доступов. Все линейные и объемные измерения, оценку систолической и диастолической функций ЛЖ проводили в соответствии со стандартным ЭхоКГ протоколом, рекомендованным Американским обществом по эхокардиографии и Европейской ассоциации по сердечно-сосудистой визуализации [16, 17]. Индексы площади АК, объемов и массы миокарда ЛЖ рассчитывали путем деления на площадь поверхности тела.
Для оценки продольной, циркулярной и радиальной деформации ЛЖ применяли технологию отслеживания пятен серой шкалы двухмерного изображения (спекл-трекинг) с использованием программного обеспечения прибора Vivid E9 или рабочей станции EchoPAC GE с применением алгоритма Аutomated functional imaging (AFI). Для этого использовали клипы из парастернальной позиции по короткой оси ЛЖ на уровне верхушки, папиллярных мышц и митрального клапана, а также из верхушечных позиций по длинной оси ЛЖ, на 4 и 2 камеры с частотой кадров не менее 50 в секунду.
Статистический анализ полученных данных выполняли в пакетах программ MS Exсel и STATISTICA. Возраст пациентов описан медианой и межквартильным диапазоном. Остальные количественные показатели в рукописи представлены средними значениями и стандартными отклонениями (mean ± SD). Категориальные показатели представлены абсолютными и относительными (в %) частотами встречаемости. Нормальность распределения исследуемых количественных показателей установлена с помощью метода определения процентилей (84; 16) и метода определения медианы, а также определения количества значений в промежутке между средним ± одно стандартное отклонение (2/3). Это позволило использовать для сравнения показателей до и после ТИАК параметрический парный критерий Стьюдента. Гипотеза о различиях средних значений показателей до и после ТИАК принималась при достигнутом уровне значимости р < 0,05.
Результаты
Основные ЭхоКГ параметры приведены в таблице 2.
чено. Наблюдалась тенденция к увеличению продольной деформации ЛЖ, в том числе продольной деформации базальных, средних и апикальных сегментов у отдельных пациентов (рис. 1).
Таблица 3. Показатели деформации левого желудочка при помощи спекл-трекинг эхокардиографии
Таблица 2. Эхокардиографические параметры до транскатетерной имплантации аортального клапана и в раннем послеоперационном периоде
Table 2. Echocardiographic parameters before transcatheter aortic implantation valve and in the early postoperative period
|
Показатели Parameters |
Исходно Baseline |
После транскатетерной имплантации аортального клапана Follow up transcatheter aortic implantation valve |
p |
|
КДО ЛЖ, мл EDV LV, ml |
112,9 ± 30,8 |
112,8 ± 29,9 |
0,5 |
|
КСО ЛЖ, мл ESV LV, ml |
51,5 ± 25,6 |
50,7 ± 23,5 |
0,5 |
|
ФВ ЛЖ (%) EF LV (%) |
56 ± 9 |
57 ± 10 |
0,5 |
|
Объем ЛП, мл Volume LA, ml |
77,1 ± 21,5 |
71,3 ± 22,5 |
0,5 |
|
Объем ПП, мл Volume RV, ml |
49,4 ± 14,0 |
46,7 ± 17,1 |
0,5 |
|
Максимальный градиент давления, мм рт. ст. Maximum gradient, mm Hg |
73,9 ± 24,7 |
17,3 ± 9,9 |
0,001 |
|
Средний градиент давления, мм рт. ст. Mean gradient, mm Hg |
46,9 ± 17,1 |
9,3 ± 5,7 |
0,001 |
|
СДЛА, мм рт. ст. SPAP, mm Hg |
34,5 ± 17,8 |
32,7 ± 15,1 |
0,4 |
|
Е/е’ |
16,6 ± 9,5 |
16,2 ± 7,2 |
0,5 |
Примечание: КДО ЛЖ – конечно-диастолический объем левого же-лудочкa; КСО ЛЖ – конечно-систолический объем левого желудочка; ФВ ЛЖ – фракция выброса левого желудочка; ЛП – левое предсердие; ПП – правое предсердие; СДЛА – систолическое давление в легочной артерии; Е/е› – отношение пика Е трансмитрального кровотока к пику е›, скорости движение фиброзного кольца митрального клапана.
Note: EDV LV – left ventriculer end-diastolic volume, ESV LV – left ventricule end-sistolic volume, EF LV – left ventricular ejection fraction, LA – left atrium; RA – right atrium, SPAP – systolic pulmonary artery pressure, E/e’ – relation between early diastolic transmitral flow velocity and early diastolic mitral annular velocity.
Как представлено в таблице 2, достоверных различий в объемных показателях ЛЖ, систолической (ФВ ЛЖ) и диастолической (соотношение Е/е›) функции ЛЖ до и в раннем послеоперационном периоде после ТИАК получено не было. Достоверно значимо различались максимальный (73,9 ± 24,7 против 17,3 ± 9,9 при р < 0,001) и средний (46,9 ± 17,1 против 9,3 ± 5,7 при р < 0,001) градиенты на АК. Прослеживалась тенденция к снижению систолического давления в легочной артерии ( р < 0,4).
Данные анализа продольной, радиальной и циркулярной деформаций ЛЖ, а также скручивания ЛЖ приведены в таблице 3.
Как представлено в таблице 3, достоверно значимых различий при анализе показателей деформации до ТИАК и в раннем послеоперационном периоде не было полу-
Table 3. Parameters of left ventricular deformation using speckle-tracking echocardiography
|
Показатели Parameters |
Исходно Baseline |
После транскатетерной имплантации аортального клапана Follow-up transcatheter aortic implantation valve |
p |
|
Продольная деформация, % Global longitudinal strain, % |
14,6 ± 4,3 |
15,9 ± 4,7 |
0,3 |
|
Продольная деформация базальных сегментов, % Global longitudinal strain basal segments, % |
72,5 ± 21,6 |
77,9 ± 24,3 |
0,4 |
|
Продольная деформация средних сегментов, % Global longitudinal strain middle segments, % |
90,5 ± 25,1 |
95,4 ± 27,1 |
0,5 |
|
Продольная деформация верхушечных сегментов, % Global longitudinal strain apical segments, % |
87,5 ± 29,0 |
95,2 ± 34,3 |
0,4 |
|
Радиальная деформация, % Radial strain, % |
32,4 ± 15,7 |
31,9 ± 17,3 |
0,5 |
|
Циркулярная деформация, % Circumferential strain, % эндокардиального слоя endocardial layer миокардиального слоя myocardial layer эпикардиального слоя epicardial layer |
21,5 ± 8,8 13,2 ± 5,2 8,2 ± 3,6 |
21,5 ± 8,1 13,3 ± 5,9 8,5 ± 5,5 |
0,5 |
|
Скручивание, % Torsion, % |
1,4 ± 0,8 |
1,7 ± 1,1 |
0,3 |
|
Продольная деформация ЛП, % LA strain, % |
20,1 ± 9,9 |
22,1 ± 9,1 |
0,5 |
Примечание: ЛП – левое предсердие.
Note: LA – left atrium.
Продольная деформация ЛП после ТИАК не изменилась (рис. 2).
Обсуждение
Пациенты с АС имеют сниженные показатели деформации миокарда ЛЖ, по данным СТЭ, хотя ФВ ЛЖ долгое время может оставаться сохранной, что объяснятся постепенным развитием фиброза миокарда ЛЖ преимущественно в субэндокардиальном слое [9, 10]. Ремоделирование ЛЖ в виде изменения показателей деформации миокарда у пациентов после ТИАК в среднесрочной и долгосрочной перспективе на сегодняшний день изучены достаточно хорошо [5, 6, 12, 18, 19].
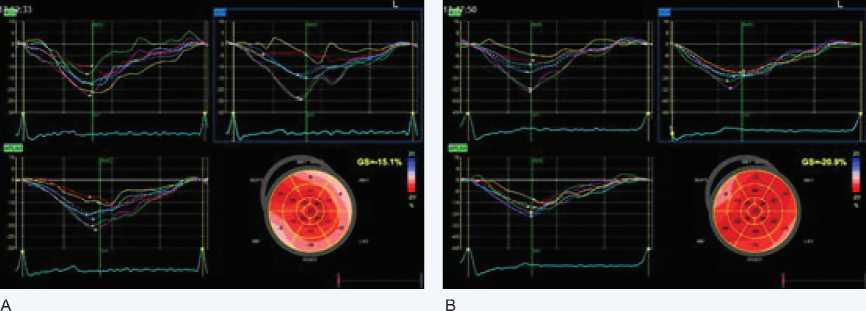
Рис. 1. Пациент с бессимптомным тяжелым аортальным стенозом с сохранной фракцией выброса левого желудочка до операции и на 4-е сутки после транскатетерной имплантации аортального клапана. А – показатель продольной систолической деформации до операции составлял 15,1%, B – показатель продольной систолической деформации после операции составил 20,9%
Fig. 1. Patient with asymptomatic severe aortic stenosis with preserved left ventricular ejection fraction before surgery and on the 4th day after transcatheter aortic implantation valve. A – the index of longitudinal systolic deformation before surgery was 15,1%, B – the index of longitudinal systolic deformation after surgery was 20,9%
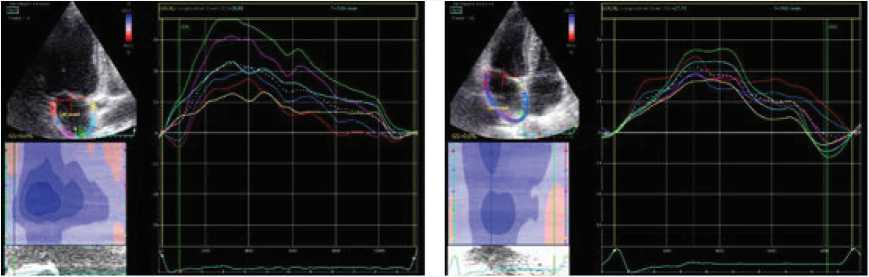
А
Рис. 2. Пациент с бессимптомным тяжелым аортальным стенозом с сохранной фракцией выброса левого желудочка до операции и на 4-е сутки после транскатетерной имплантации аортального клапана: А – показатель продольной деформации левого предсердия до операции составлял 28,8%, B – показатель продольной деформации левого предсердия после операции составил 27,75%
Fig. 2. Patient with asymptomatic severe aortic stenosis with preserved left ventricular ejection fraction before surgery and on the 4th day after transcatheter implantation of the aortic valve: A – the index of longitudinal deformation of the left atrium before surgery was 28,8%, B – the index of longitudinal deformation of the left atrium after surgery was 27,75%
У пациентов с тяжелым АС как с сохранной, так и со сниженной ФВ ЛЖ уже через 40 дней после ТИАК отмечается увеличение глобальной продольной систолической деформации ЛЖ. При этом в группе с сохранной ФВ ЛЖ не наблюдалось значительного изменения циркулярной и радиальной деформации. Исходно адаптивно увеличенные параметры скручивания и вращения после ТИАК вернулись к физиологическому уровню. Это может указывать на компенсаторный механизм изменений циркулярной и радиальной деформации миокарда в ответ на увеличенную постнагрузку. В группе со сниженной ФВ ЛЖ отмечалась иная ситуация – исходно сниженные показатели деформации увеличились до нормальных значений [12]. Значительное раннее (в течение месяца) улучшение продольной, циркулярной и радиальной деформаций у пациентов с тяжелым АС с сохранной ФВ ЛЖ отмечалось в работе M. Delgado и соавт. [14]. Анализ механики ЛЖ с оценкой глобальной продольной деформации отдельных слоев ЛЖ в работе K. Shiino и соавт. показал увеличение продольной деформации и непропорциональное увеличение продольной деформации в разных слоях с наименьшим улучшением в эндокардиальном слое через месяц после ТИАК [13].
В то же время работ, посвященных оценке ремоделирования ЛЖ в ранние сроки после ТИАК (в течение недели), значительно меньше, и они противоречивы [2, 15]. В нашей работе мы оценивали изменения показателей деформации ЛЖ в раннем послеоперационном периоде у пациентов пожилого и старческого возраста с симптоматически тяжелым АС с сохранной ФВ ЛЖ. При ЭхоКГ исследовании у всех пациентов исходно отмечалось снижение продольной деформации миокарда ЛЖ (15,5 ± 3,4%). Показатели радиальной и циркулярной деформации ЛЖ, скручивание также были снижены.
В нашем исследовании наблюдалось увеличение глобальной продольной деформации ЛЖ, в том числе базальных, средних и апикальных сегментов. Хотя изменения и не были достоверными, наши результаты сопоставимы с данными F. Al-Rashid и соавт., которые показали, что глобальная продольная деформация ЛЖ имеет лишь восходящую тенденцию через 1 нед. после ТИАК и значительное улучшение через 3 мес. после операции [2]. В работе S. Schattke и соавт. наблюдалось достоверное увеличение глобальной и региональной (базальных и средних сегментов) деформации ЛЖ через неделю после ТИАК. Авторы объясняют увеличение продольной глобальной деформации ЛЖ в ранние сроки после ТИАК резким чрезмерным снижение постнагрузки ЛЖ и улучшением коронарного кровотока в продольно ориентированном субэндокардиальном слое миокарда [15].
В нашем исследовании не было обнаружено достоверных изменений показателей циркулярной, радиальной деформации и скручивания ЛЖ в раннем послеоперационном периоде. Полученные нами результаты схожи с данными, представленными в ряде исследований, что подчеркивает более выраженную восприимчивость субэндокардиальных продольно ориентированных волокон к острым изменениям нагрузки давления ЛЖ [2, 15]. Тем не менее M. Delgado и соавт. продемонстрировали улучшение всех трех компонентов деформации (продольной, циркулярной и радикальной) при краткосрочном наблюдении в небольшой группе пациентов [14].
В работах S. Spethmann и соавт. и C. Sari и соавт. говорится о резком улучшении глобальной деформации ЛП в раннем послеоперационном периоде [20, 21]. Достоверное улучшение резервуарной и кондуитной функции ЛП наблюдалось в раннем послеоперационном периоде (8,2 ± 3,3 дня) в исследованиях S. Spethmann и соавт. и сопровождалось улучшением ранней диастолической функции ЛЖ, что указывает, по мнению авторов, на быстрое восстановление релаксации ЛЖ и функции ЛП в ранний сроки после ТИАК [19]. Однако в нашем исследовании таких результатов не получено.
Таким образом, исходя из полученных нами результатов, у пациентов пожилого и старческого возраста с тяжелым АС с сохранной ФВ ЛЖ после ТИАК в раннем послеоперационном периоде отмечается тенденция к улучшению показателей глобальной продольной деформации ЛЖ. Но, вероятно, малая выборка больных и короткий период восстановления эндокардиального слоя после ишемии и перегрузки ЛЖ давлением не позволяют достоверно говорить о том, что показатели деформации ЛЖ могут расцениваться как параметры раннего послеоперационного ремоделирования ЛЖ.
Ограничения
Ограничением исследования явилась небольшая выборка пациентов с тяжелым симптоматическим АС, что обусловлено сложностью анализа отслеживания спеклов в условиях сниженной акустической доступности у пациентов пожилого и старческого возраста с нарушениями ритма (мерцательная аритмия, тахикардии) или значительной вариабельностью ЧСС во время исследования.
Выводы
У пациентов пожилого и старческого возраста с тяжелым АС и сохранной ФВ ЛЖ, но со сниженными показателями деформации ЛЖ (продольного, циркулярного и радиального) после малоинвазивной ТИАК в раннем послеоперационном периоде достоверных изменений показателей деформации не было. Наблюдается тенденция к увеличению глобальной продольной деформации ЛЖ.
Список литературы Показатели деформации левого желудочка у пациентов пожилого и старческого возраста с аортальным стенозом после транскатетерной имплантации аортального клапана
- Baumgartner H. Aortic stenosis: medical and surgical management. Heart (British Cardiac Society). 2005;91(11):1483–1488. DOI: 10.1136/hrt.2004.056176.
- Al-Rashid F., Totzeck M., Saur N., Jánosi R.A., Lind A., Mahabadi A.A. et al. Global longitudinal strain is associated with better outcomes in transcatheter aortic valve replacement. BMC. Cardiovasc. Disord. 2020;20(1):267. DOI: 10.1186/s12872-020-01556-4.
- Nishimura R.A., Otto C.M., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Guyton R.A. et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines [published correction appears in Circulation. 2014;129(23):e650]. Circulation. 2014;129(23):2440–2492. DOI: 10.1161/CIR.0000000000000029.
- Nishimura R.A., Otto C.M., Bonow R.O., Carabello B.A., Erwin J.P. 3rd., Fleisher L.A. et al. AHA/ACC focused update of the 2014 AHA/ ACC guideline for the management of patients with valvular heart disease: A report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135(25):e1159–e1195. DOI: 10.1161/CIR.0000000000000503.
- D’Ascenzi F., Cameli M., Iadanza A., Lisi M., Zacà V., Reccia R. et al. Improvement of left ventricular longitudinal systolic function after transcatheter aortic valve implantation: a speckle-tracking prospective study. Int. J. Cardiovasc. Imaging. 2013;29(5):1007–1015. DOI: 10.1007/s10554-012-0175-5.
- D’Andrea A., Padalino R., Cocchia R., Di Palma E., Riegler L., Scarafi le R. et al. Eff ects of transcatheter aortic valve implantation on left ventricular and left atrial morphology and function. Echocardiography. 2015;32(6):928–936. DOI: 10.1111/echo.12808.
- Dusenbery S.M., Lunze F.I., Jerosch-Herold M., Geva T., Newburger J.W., Colan S.D. et al. Left ventricular strain and myocardial fi brosis in congenital aortic stenosis. Am. J. Cardiol. 2015;116(8):1257–1262. DOI: 10.1016/j.amjcard.2015.07.042.
- Weidemann F., Herrmann S., Störk S., Niemann M., Frantz S., Lange V. et al. Impact of myocardial fi brosis in patients with symptomatic severe aortic stenosis. Circulation. 2009;120(7):577–584. DOI: 10.1161/CIRCULATIONAHA.108.847772.
- Fung M.J., Thomas L., Leung D.Y. Alterations in layer-specifi c left ventricular global longitudinal and circumferential strain in patients with aortic stenosis: a comparison of aortic valve replacement versus conservative management over a 12-month period. J. Am. Soc. Echocardiogr. 2019;32(1):92–101. DOI: 10.1016/j.echo.2018.07.015.
- Ng A.C., Delgado V., Bertini M., Antoni M.L., van Bommel R.J., van Rijnsoever E.P. et al. Alterations in multidirectional myocardial functions in patients with aortic stenosis and preserved ejection fraction: a two-dimensional speckle tracking analysis. Eur. Heart J. 2011;32(12):1542–1550. DOI: 10.1093/eurheartj/ehr084.
- Galli E., Leguerrier A., Flecher E., Leclercq C., Donal E. Increased valvulo-arterial impedance diff erently impacts left ventricular longitudinal, circumferential, and radial function in patients with aortic stenosis: A speckle tracking echocardiography study. Echocardiography. 2017;34(1):37–43. DOI: 10.1111/echo.13407.
- Naeim H.A., Abuelatta R., Alatawi F.O., Khedr L. Assessment of left ventricular mechanics in patients with severe aortic stenosis after transcatheter aortic valve implantation: 2-D speckle tracking imaging study. J. Saudi Heart Assoc. 2020;32(2):248–255. DOI: 10.37616/2212-5043.1065.
- Shiino K., Yamada A., Scalia G.M., Putrino A., Chamberlain R., Poon K. et al. Early changes of myocardial function after transcatheter aortic valve implantation using multilayer strain speckle tracking echocardiography. Am. J. Cardiol. 2019;123(6):956–960. DOI: 10.1016/j.amjcard. 2018.12.008.
- Delgado M., Ruiz M., Mesa D., de Lezo Cruz Conde J.S., Pan M., López J. et al. Early improvement of the regional and global ventricle function estimated by two-dimensional speckle tracking echocardiography after percutaneous aortic valve implantation speckle tracking after CoreValve implantation. Echocardiography. 2013;30(1):37–44. DOI: 10.1111/j.1540-8175.2012.01808.x.
- Schattke S., Baldenhofer G., Prauka I., Zhang K., Laule M., Stangl V. et al. Acute regional improvement of myocardial function after interventional transfemoral aortic valve replacement in aortic stenosis: a speckle tracking echocardiography study. Cardiovasc. Ultrasound. 2012;10:15. DOI: 10.1186/1476-7120-10-15.
- Lang R.M., Badano L.P., Mor-Avi V., Afi lalo J., Armstrong A., Ernande L. et al. Recommendations for cardiac chamber quantifi cation by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 2015;28(1):1–39.t14. DOI: 10.1016/j.echo.2014.10.003.
- Nagueh S.F., Smiseth O.A., Appleton C.P., Byrd B.F. 3rd, Dokainish H., Edvardsen T. et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur. Heart J. Cardiovasc. Imaging. 2016;17(12):1321–1360. DOI: 10.1093/ehjci/jew082.
- Kempny A., Diller G.P., Kaleschke G., Orwat S., Funke A., Radke R. et al. Longitudinal left ventricular 2D strain is superior to ejection fraction in predicting myocardial recovery and symptomatic improvement after aortic valve implantation. Int. J. Cardiol. 2013;167(5):2239–2243. DOI: 10.1016/j.ijcard.2012.06.012.
- Osnabrugge R.L., Mylotte D., Head S.J., Van Mieghem N.M., Nkomo V.T., LeReun C.M. et al. Aortic stenosis in the elderly: disease prevalence and number of candidates for transcatheter aortic valve replacement: a meta-analysis and modeling study. J. Am. Coll. Cardiol. 2013;62(11):1002–1012. DOI: 10.1016/j.jacc.2013.05.015.
- Spethmann S., Dreger H., Baldenhofer G., Stüer K., Saghabalyan D., Müller E. et al. Short-term effects of transcatheter aortic valve implantation on left atrial mechanics and left ventricular diastolic function. J. Am. Soc. Echocardiogr. 2013;26(1):64–71.e2. DOI: 10.1016/j.echo.2012.10.002.
- Sarı C., Aslan A.N., Baştuğ S., Akçay M., Akar Bayram N., Bilen E. et al. Immediate recovery of the left atrial and left ventricular diastolic function after transcatheter aortic valve implantation: A transesophageal echocardiography study. Cardiol. J. 2016;23(4):449–455. DOI: 10.5603/CJ.a2016.0030.


