Показатели окислительного метаболизма в плазме крови и эритроцитах больных раком яичников после полихимиотерапии по схеме САР
Автор: Долгова Динара Ришатовна, Абакумова Татьяна Владимировна, Антонеева Инна Ивановна, Пирмамедова Сабина Саидмагомед Кызы, Тузеева Антонина Юрьевна, Насырова Елена Юрьевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Фундаментальная биология и медицина
Статья в выпуске: 3, 2014 года.
Бесплатный доступ
В плазме крови и эритроцитах больных раком яичников III стадии по FIGO после полихимиотерапии по схеме САР оценивали показатели окислительной модификации белков, параметры перекисного окисления липидов и ферментативное звено антиоксидантной системы. Было установлено повышение содержания в плазме крови и эритроцитах больных раком яичников после полихимиотерапии продуктов окислительной модификации белков и липидов. Одновременное повышение в плазме крови активности изу- чаемых антиоксидантных ферментов может свидетельствовать о переходе системы «ПОЛ - АОС» на более высокий уровень функционирования. Одновременное снижение активности антиоксидантных ферментов в эритроцитах свидетельствует о возможности развития в них оксидативного стресса. Подобная динамика редокс-зависимых процессов в крови больных раком яичников характеризует биологический портрет опухоли и диктует целесообразность использования дифференцированной многокомпонентной антиоксидантной терапии у этих больных.
Рак яичников, полихимиотерапия, редокс-зависимые процессы
Короткий адрес: https://sciup.org/14113015
IDR: 14113015 | УДК: 616-006.6:577
Текст научной статьи Показатели окислительного метаболизма в плазме крови и эритроцитах больных раком яичников после полихимиотерапии по схеме САР
Введение.*Процессы окислительного метаболизма включают генерацию активных форм кислорода (АФК), перекисное окисления липидов (ПОЛ), окислительную модификацию белков (ОМБ) и антиоксидантную защиту (АОЗ). Образующиеся АФК в норме выступают в качестве медиаторов редокс-регулируемых сигнальных путей [2]. Причины, вызывающие интенсификацию свободнорадикальных процессов, могут быть различными, однако изменения на молекулярном уровне носят однотипный характер. Общими являются разнонаправленные изменения свободнорадикальных процессов и буферной емкости антиоксидантной системы [10]. По- добная ситуация рассматривается как оксида-тивный стресс и является патогенетическим звеном онкозаболеваний [6, 9, 11].
Рак яичников (РЯ), диагностируемый в основном на III–IV стадии заболевания, представляет актуальную проблему современной онкогинекологии [5]. Разработка методов лечения РЯ остается приоритетной [1]. Злокачественные опухоли яичников чувствительны к проведению лекарственной полихимиотерапии (ПХТ). Однако у пациенток с III–IV стадией возможности ПХТ, обладающей выраженным токсическим воздействием, ограниченны в связи с уже имеющимися нарушениями метаболических функций в результате нарастания опухолевой массы в организме. В связи с вышеизложенным возникает необходимость разработки научно обос- нованных подходов к проведению ПХТ РЯ, основанных на использовании в схеме комплексного лечения антиоксидантов.
Цель исследования. Оценка редокс-зави-симых процессов в плазме крови и эритроцитах больных РЯ после ПХТ по схеме САР.
Материалы и методы. Обследуемая группа состояла из 96 первичных больных РЯ, находящихся на III стадии по FIGO. Больные были обследованы до начала лечения, через 3 и 14 дней после первого и через 3 и 14 дней после второго курса ПХТ по схеме САР (цисплатин 75 мг/м2, доксорубицин 40 мг/м2 и циклофосфамид 600 мг/м2). Интервал между курсами составил 21 день. В контрольную группу вошли 18 практически здоровых женщин.
В плазме и эритроцитах крови оценивали уровень ОМБ по Е.Е. Дубининой (2006). Результаты регистрировали при λ=346 нм и λ=370 нм (альдегидные и кетонные группы нейтрального характера), при λ=430 нм и λ=530 нм (соответственно альдегидные и ке-тонные группы основного характера) в единицах оптической плотности на миллиграмм белка. Для оценки ПОЛ в плазме и гемолизате эритроцитов определяли количество диеновых конъюгатов (ДК) при Е 232/220нм , кетодиенов (КД) при Е 278/220нм , шиффовых оснований (ШО) при Е 400/220нм по методу И.А. Волчегорского (1989). Содержание вторичных продуктов ПОЛ – малонового диальдегида (МДА) – определяли по Л.И. Андреевой (1988). Для оценки ферментативного звена антиоксидантной системы (АОС) в плазме крови и эритроцитах определяли активность каталазы, глутатион-S-трансферазы (ГТ) по А.И. Карпищенко (1999). В гемолизате эритроцитов также определяли активность супер-оксиддисмутазы (СОД). Значимость различий вариационных рядов в связанных попарно выборках оценивалась с помощью U-критерия Вилкоксона–Манна–Уитни. Анализ данных проводился с использованием пакета прикладных программ Statistica 6. Достоверными считали различия между сравниваемыми рядами с уровнем достоверной вероятности 95 % (р ≤ 0,05).
Результаты и обсуждение. Установлено, что усиление редокс-зависимой модификации белков имеет место при поражении различных органов. В отличие от продуктов ПОЛ, карбонильные производные белков плазмы и эритроцитов более стабильны и специфичны, что позволяет использовать их в качестве маркеров оксидативного стресса при патологических процессах [4]. В результате проведенных исследований нами установлено повышение содержания продуктов ОМБ в плазме крови и эритроцитах больных РЯ по сравнению с донорами. Так, содержание альдегидных и кетонных групп нейтрального характера в плазме крови составило 0,510±0,048 ед. опт. плот./мг белка против 0,418±0,034 ед. опт. плот./мг белка в контроле (р<0,05). Содержание карбонильных производных основного характера составило для альдегидных производных 0,303±0,019 ед. опт. плот./мг белка против 0,230±0,022 ед. опт. плот./мг белка в контроле (р<0,05) и для кетонных производных – 309±0,029 ед. опт. плот./мг белка против 0,082±0,012 ед. опт. плот./мг белка в контроле (р<0,05). Содержание в гемолизате эритроцитов больных РЯ альдегидных и кетонных групп нейтрального характера колебалось в пределах коридора нормы. Уровень карбонильных производных основного характера у больных РЯ значимо превышал таковой в эритроцитах доноров и составил для альдегидных групп 0,854± ±0,029 ед. опт. плот./мг белка против 0,706±0,048 ед. опт. плот./мг белка в контроле (р<0,05) и для кетонных групп – 0,501±0,035 ед. опт. плот./мг белка против 0,368±0,020 ед. опт. плот./мг белка в контроле (р<0,05). Результаты изучения уровня ОМБ в плазме крови на фоне ПХТ представлены на рис. 1.
Из данных рис. 1 следует, что прогрессивно и значимо на фоне ПХТ в плазме крови увеличивается содержание карбонильных производных основного характера, регистрируемых при λ=430 нм и λ=530 нм.
Результаты изучения уровня ОМБ в эритроцитах больных РЯ на фоне ПХТ представлены на рис. 2.
ед.опт.пл./мг белка ед.опт.пл./мг белка к ^»Х X X X X X М X
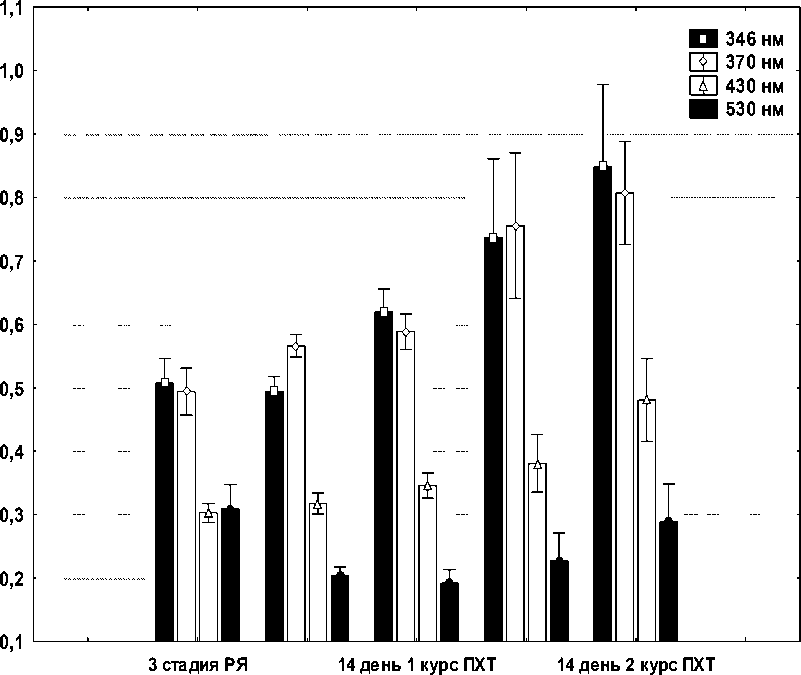
3 день 1 курс ПХТ 3 день 2 курс ПХТ
Рис. 1. Содержание продуктов ОМБ в плазме крови больных РЯ на 3-й и 14-й дни после первого и второго курсов ПХТ по схеме САР
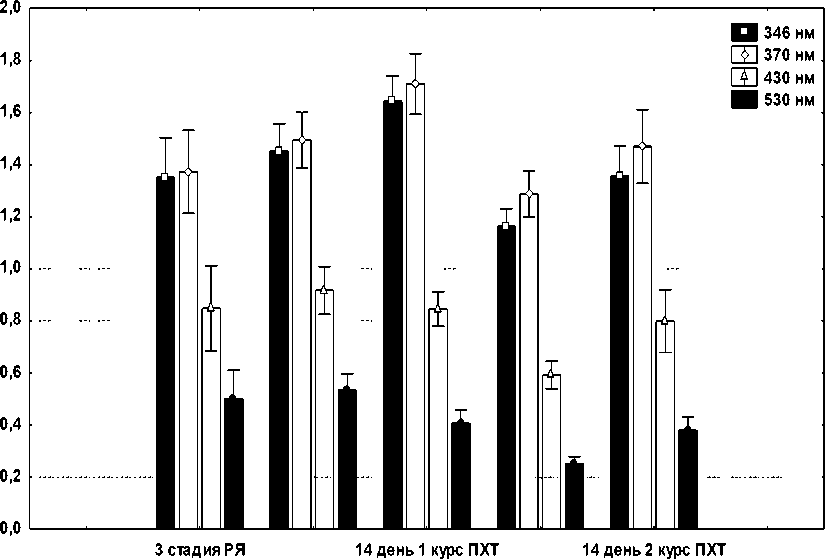
3 день 1 курс ПХТ 3 день 2 курс ПХТ
Рис. 2. Содержание продуктов ОМБ в эритроцитах больных РЯ на 3-й и 14-й дни после первого и второго курсов ПХТ по схеме САР
Из данных, представленных на рис. 2, следует, что содержание кетонных и альдегидных групп нейтрального характера, достоверно увеличенное уже после первого курса ПХТ, продолжало возрастать через 14 дней и оказывалось сниженным после второго курса ПХТ. Уровень карбонильных производных белка в эритроцитах на всех изученных сроках после обоих курсов ПХТ колебался в пределах показателей до введения химиопрепаратов по схеме САР. Колебания уровней различных продуктов ОМБ имеют свои особенности. Возможно, это связано с условиями их обра- зования. Однако образование карбонильных производных происходит в результате сильных повреждающих форм окислительной модификации как путем прямого окисления аминокислотных остатков, так и при взаимодействии с продуктами ПОЛ – МДА [8]. Их содержание является показателем общего окислительного стресса [12].
В результате проведенных исследований была установлена активация процессов ПОЛ в плазме крови и эритроцитах больных РЯ по сравнению с донорами (табл. 1).
Таблица 1
|
Группа обследуемых |
МДА, мкмоль/л |
ДК, ед.опт.плот./мл |
КД, ед.опт.плот./мл |
ШО, ед.опт.плот./мл |
ГТ, мкмоль/мин/л |
Каталаза, ммоль/мин/л |
СОД, у.е./л |
|
ПЛАЗМА КРОВИ |
|||||||
|
Доноры (n=18) |
3,020±0,103 |
0,451±0,026 |
0,089±0,007 |
0,015±0,002 |
0,031±0,004 |
4,330±0,710 |
- |
|
РЯ III стадии (n=96) |
4,810±0,190* |
0,510±0,064 |
0,150±0,080* |
0,030±0,009* |
0,110±0,008* |
0,100±0,020* |
- |
|
ЭРИТРОЦИТЫ |
|||||||
|
Доноры (n=18) |
305,40±10,36 |
0,547±0,031 |
0,121±0,011 |
0,032±0,005 |
0,341±0,038 |
8,796±0,875 |
0,827±0,136 |
|
РЯ III стадии (n=96) |
380,82±7,49* |
0,876±0,029* |
0,146±0,008* |
0,050±0,006* |
0,870±0,041* |
5,710±0,720* |
1,950±0,102* |
Примечание. * – данные, статистически значимо отличающиеся от показаний доноров (р≤ 0,05).
Показатели ПОЛ – АОС плазмы крови и эритроцитов больных РЯ на III клинической стадии заболевания
Одновременное повышение активности антиоксидантных ферментов: ГТ в плазме крови и ГТ и СОД в эритроцитах (табл. 1) – может свидетельствовать о переходе системы «ПОЛ – АОС» на более высокий уровень функционирования [3]. Снижение активности каталазы как в плазме крови, так в эритроцитах (табл. 1) может указывать на снижение генерации опухолевыми клетками Н 2 О 2 , ингибирующего размножение клеток. Полученные результаты могут находиться в противоречии с рядом других работ, в которых на клеточных культурах показано повышение продукции Н 2 О 2 опухолевыми клетками по сравнению с нормальными [7].
Следующим этапом работы было изучение особенностей протекания реакций ПОЛ и уровня ферментов АОЗ в плазме крови и эритроцитах при проведении курсов ПХТ по схеме САР. Было установлено, что уровень МДА в плазме крови повышался через 3 сут после первого курса ПХТ; сохранялся на этом уровне через 14 сут и через 3 сут после второго курса и снижался до уровня, регистрируемого до начала ПХТ через 14 дней после второго курса (рис. 3). Уровень КД значимо возрастал только через 14 дней после второго курса; уровень ШО возрастал через 3 и 14 дней после первого курса и затем снижался до исходных величин (рис. 4). Активность антиоксидантных ферментов (ГТ и каталазы) была снижена на всех изученных сроках после ПХТ по сравнению с ее уровнем до введения химиопрепаратов у больных РЯ (рис. 3).
нмоль/л
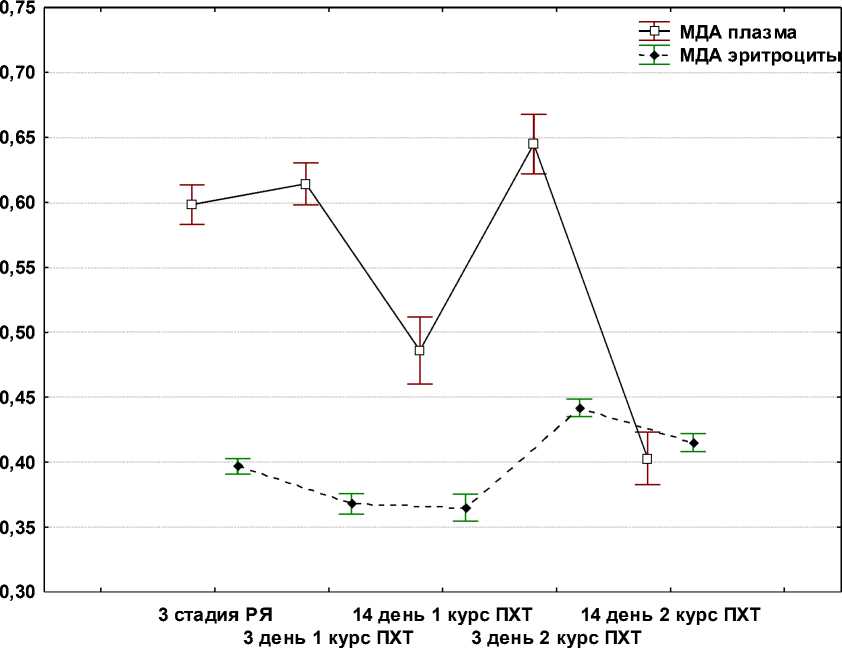
Рис. 3. Уровень МДА в плазме крови и эритроцитах больных РЯ до и после ПХТ по схеме САР
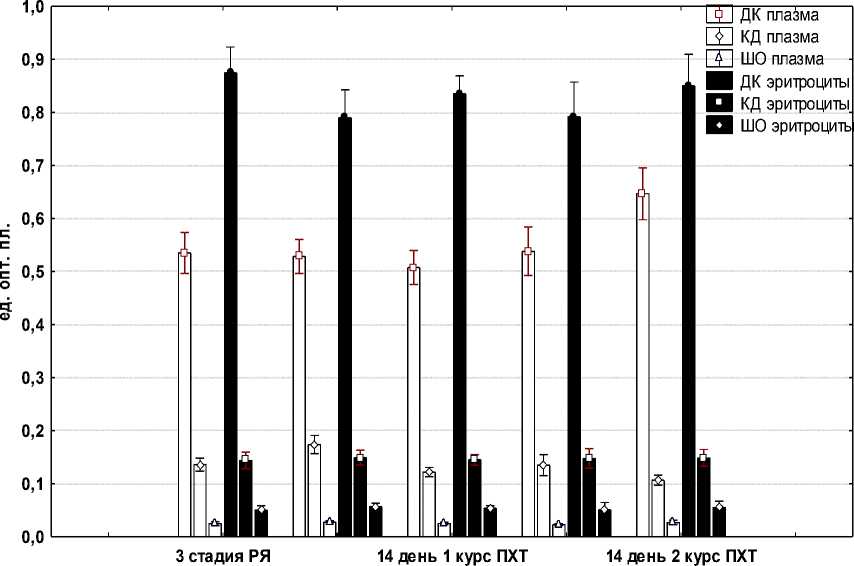
3 день 1 курс ПХТ 3 день 2 курс ПХТ
Рис. 4. Уровни продуктов ПОЛ (ДК, КД и ШО) в плазме крови и эритроцитах больных РЯ до и после ПХТ по схеме САР
Несколько иная картина возникает при анализе компонентов системы «ПОЛ – АОЗ» в эритроцитах больных РЯ после ПХТ по схеме САР (рис. 4). Повышенный по сравнению с эритроцитами доноров уровень МДА продолжает возрастать через 3 дня после первого курса ПХТ, несколько снижается через 14 дней и вновь возрастает после второго курса ПХТ (рис. 3). Уровни ДК, КД и ШО после ПХТ значимо не изменяются (рис. 4).
При оценке активности антиоксидантных ферментов в эритроцитах больных РЯ после ПХТ по схеме САР установлено достоверное снижение активности ГТ на всех сроках, резкое повышение через 3 сут после первого курса и затем достоверное снижение активности каталазы (рис. 5).
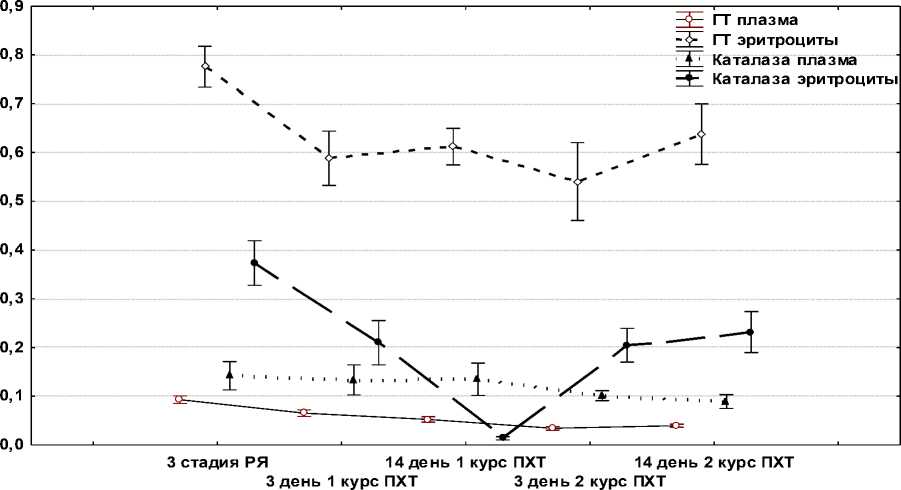
Обследуемая группа
Рис. 5. Активность каталазы и ГТ в плазме крови и эритроцитах больных РЯ до и после ПХТ по схеме САР
Активность СОД, значимо повышенная у больных РЯ (1,950±0,122 у.е./л против 0,827±0,136 у.е./л в контроле), резко снижалась после первого курса ПХТ (0,873±0,090 и 0,940±0,018 у.е./л через 3 и 14 дней соответственно) и значимо возрастала после второго курса ПХТ (2,240±0,274 и 1,750±0,230 у.е./л через 3 и 14 дней соответственно). Подобная динамика, свидетельствующая о большей, чем в плазме крови, антиоксидантной емкости эритроцитов, тем не менее позволяет предполагать в эритроцитах развитие оксида-тивного стресса.
Заключение. Таким образом, химиотерапия по схеме САР у больных РЯ на III клинической стадии по FIGO индуцирует ради-калообразование и изменяет уже нарушенный опухолевым процессом окислительновосстановительный гомеостаз больного. При этом система «ПОЛ – АОС» в плазме крови переходит на более высокий уровень функционирования, в эритроцитах развивается ок-сидативный стресс. Подобная динамика ре-докс-зависимых процессов в различных компонентах крови организма-опухоленосителя характеризует биологический портрет опухоли и диктует целесообразность использования дифференцированной многокомпонентной антиоксидантной терапии у больных РЯ.
-
1. Бохман Я. В. Руководство по онкогинекологии / Я. В. Бохман. – М. : Медицина, 2002. – 534 с.
-
2. Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические процессы / Е. Е. Дубинина. – СПб. : МедПресса, 2006. – 397 с.
-
3. Лю М. Б. Активные формы кислорода и пероксигенации в инвазии и метастазировании неоплазм / М. Б. Лю, И. С. Подобед, А. К. Едыге-нова // Успехи современной биологии. – 2004. – Т. 124, № 4. – С. 32–341.
-
4. Применение наночастиц железа в термохимиотерапии экспериментальных опухолей / И. А. Горошинская [и др.] // Онкохирургия. – 2013. – № 1. – С. 84.
-
5. Cancer statistics, 2001 / R. T. Greenlee [et al.] // CA Cancer J. Clin. – 2001. – Vol. 1. – Р. 15–36.
-
6. Chiarugi P. Redox regulation of protein tyrosine phosphatases during receptor tyrosine kinase signal transduction / P. Chiarugi, P. Cirri // Trends Biochem Sci. – 2003. – Vol. 8, № 9. – Р. 509–514.
-
7. Dorward A. Mitochondrial contributions to cancer cell physiology: redox balance, cell cycle, and drug resistance / A. Dorward, S. Sweet, R. Moorehead // J. Bioenerg. Biomembr. – 1997. – Vol. 29, № 4. – Р. 385–392.
-
8. Kemp M. Nonequilibrium thermodynamics of thiol/disulfide redox systems: a perspective on re-
dox systems biology / M. Kemp, Y. M. Go, D. P. Jones // Free Radic Biol Med. – 2008. – Vol. 44, № 6. – Р. 921 – 37.
-
9. Kinnula V. L. Superoxide dismutases in malignant cells and human tumors / V. L. Kinnula, J. D. Crapo // Free Radic Biol Med. – 2004. – Vol. 36, № 6. – Р. 718–744.
-
10. Linnane A. W. Cellular redox regulation and prooxidant signaling systems: a new perspective on the free radical theory of aging / A. W. Linnane, H. Eastwood // Ann. NY. Acad. Sci. – 2006. – Vol. 1067. – P. 47–55.
-
11. Zhang, Y. Reactive oxygen species (ROS), troublemakers between nuclear factor-kappaB (NF-kappaB) and c-Jun NH(2)-terminal kinase (JNK) / Y. Zhang, F. Chen // Cancer Res. – 2004. – Vol. 64, № 6. – Р. 1902–1905.
-
12. Zitnanová I. Protein carbonyls as a biomarker of foetal-neonatal hypoxic stress / I. Zitnanová, K. Sumegová, M. Simko // Clin Biochem. – 2007. – Vol. 40, № 8. – Р. 567–570.
INDICATORS OF OXIDATIVE METABOLISM IN PLASMAAND ERYTHROCYTES OF PATIENTS WITH OVARIAN CANCERAFTER CHEMOTHERAPY SCHEME CAP
D.R. Dolgova, T.V. Abakumova, I.I. Antoneeva, S.S. Pirmamedova, A.U. Tuzeeva, E.U. Nasyrova
Ulyanovsk State University
Список литературы Показатели окислительного метаболизма в плазме крови и эритроцитах больных раком яичников после полихимиотерапии по схеме САР
- Бохман Я. В. Руководство по онкогинекологии/Я. В. Бохман. -М.: Медицина, 2002. -534 с.
- Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические процессы/Е. Е. Дубинина. -СПб.: МедПресса, 2006. -397 с.
- Лю М. Б. Активные формы кислорода и пероксигенации в инвазии и метастазировании неоплазм/М. Б. Лю, И. С. Подобед, А. К. Едыгенова//Успехи современной биологии. -2004. -Т. 124, № 4. -С. 32-341.
- Применение наночастиц железа в термохимиотерапии экспериментальных опухолей/И. А. Горошинская //Онкохирургия. -2013. -№ 1. -С. 84.
- Cancer statistics, 2001/R. T. Greenlee //CA Cancer J. Clin. -2001. -Vol. 1. -Р. 15-36.
- Chiarugi P. Redox regulation of protein tyrosine phosphatases during receptor tyrosine kinase signal transduction/P. Chiarugi, P. Cirri//Trends Biochem Sci. -2003. -Vol. 8, № 9. -Р. 509-514.
- Dorward A. Mitochondrial contributions to cancer cell physiology: redox balance, cell cycle, and drug resistance/A. Dorward, S. Sweet, R. Moorehead//J. Bioenerg. Biomembr. -1997. -Vol. 29, № 4. -Р. 385-392.
- Kemp M. Nonequilibrium thermodynamics of thiol/disulfide redox systems: a perspective on redox systems biology/M. Kemp, Y. M. Go, D. P. Jones//Free Radic Biol Med. -2008. -Vol. 44, № 6. -Р. 921-37.
- Kinnula V. L. Superoxide dismutases in malignant cells and human tumors/V. L. Kinnula, J. D. Crapo//Free Radic Biol Med. -2004. -Vol. 36, № 6. -Р. 718-744.
- Linnane A. W. Cellular redox regulation and prooxidant signaling systems: a new perspective on the free radical theory of aging/A. W. Linnane, H. Eastwood//Ann. NY. Acad. Sci. -2006. -Vol. 1067. -P. 47-55.
- Zhang, Y. Reactive oxygen species (ROS), troublemakers between nuclear factor-kappaB (NF-kappaB) and c-Jun NH(2)-terminal kinase (JNK)/Y. Zhang, F. Chen//Cancer Res. -2004. -Vol. 64, № 6. -Р. 1902-1905.
- Zitnanová I. Protein carbonyls as a biomarker of foetal-neonatal hypoxic stress/I. Zitnanová, K. Sumegová, M. Simko//Clin Biochem. -2007. -Vol. 40, № 8. -Р. 567-570.


