Полезная сераорганическая химия
Автор: Рубцова Светлана Альбертовна, Родыгин К.С., Кучин Александр Васильевич
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Серосодержащие соединения широко распространены в природе и являются объектами многочисленных исследований синтетической химии. Областями применения как природных, так и синтетических сераорганических соедине- ний являются фармакология и медицина, органический синтез, техника, сель- ское хозяйство. В лаборатории химии окислительных процессов Института хи- мии Коми НЦ УрО РАН проведены многочисленные работы по химии сераор- ганических соединений: разработаны эффективные методы синтеза сульфидов, сульфоксидов, сульфонов, тиоланов. Подобраны оптимальные условия хемо- и энантиоселективного окисления сульфидов в соответствующие сульфоксиды. Показано, что диоксид хлора является селективным и универсальным окисли- телем сераорганических соединений. Обнаружена фармакологическая актив- ность у впервые синтезированных сераорганических соединений с терпеновыми фрагментами. Предложена технология переработки сульфатного скипидара.
Сераорганические соединения, сульфиды, сульфоксиды, сульфоны, тиолы, асимметрическое окисление, сульфатный скипидар, диоксид хлора
Короткий адрес: https://sciup.org/14992397
IDR: 14992397 | УДК: 547.333.1:544.122.2:661.8'051
Текст научной статьи Полезная сераорганическая химия
Серосодержащие соединения содержатся практически во всех организмах: растениях, животных, микроорганизмах. В органических соединениях атом серы может быть в нескольких валентных состояниях: сульфидном, сульфоксидном, сульфон-ном, сульфониевом. Сульфидная сера в живой природе образует три основные группы соединений: меркаптаны, сульфиды и полисульфиды. Меркаптаны немногочисленны, однако занимают главенствующее положение во всех живых организмах: например, аминокислота цистеин (рис.1а), кофермент А, кофермент М. 8-меркаптоментан содержится в грейпфруте (рис.1б). 2-фурфурилтиол, содержащийся в кофе, придает ему запах (рис.1в). Сульфиды – наиболее распространенные природ- ные соединения. Во всех живых организмах находится аминокислота метионин. S-метилметионин (рис. 1г) содержится во многих овощах: в листьях кочанной капусты, в кольраби, сельдерее, томатах. В настоящее время в Японии и России он исследуется в связи с широким спектром его медицинских свойств [1]. S-аденозил-L-метионин – кофермент, участвующий в реакциях биосинтеза, связанных с переносом метильной группы. Следует отметить, что природный изомер представлен только (-)-изоме-ром. Второй изомер, полученный синтетически, не обладает ферментативной активностью.
В чесноке содержится диаллилсульфид (рис.2а) с антиканцерогенной активностью (показана его способность к понижению уровня каталазы в
SH
H
O
H 2 N
OH
а

NH 3
O CH2SH Xэ S COOэ вг
Рис. 1.
тканях печени). Циклические сульфиды в природе нильных групп
ные функциональные серосодержащие соединения, такие как антибиотик спарсомицин (рис. 4б) или ядовитая лентиловая кислота (рис. 4в) [5].
Природные сульфоксиды участвуют в биологически важных трансформациях, поэтому изучение этих процессов может привести к новым интересным результатам. Так, на основании легкости протекания 1,7-миграции сульфи-по полиеновой системе высказано
представлены как насыщенными, так и ароматическими системами, например витамины-коферменты
биотин (рис.2б) и тиамин (рис.2в) и др.
предположение о роли такого процесса в биологической дезактивации ( SR - и SS )-лейкотриенов (схе-
ма 1) [6] .
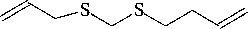
O
Рис. 2.
Приводятся данные о легком окислении метиониновых звеньев пептидов и белков с образованием сульфи-
аб
Сульфоксиды содержатся в таких растениях, как лук, чеснок, горчица, редис. В частности, из репчатого лука выделены (+)-S-метил- L -цистеин-сульфоксид (рис. 3а), (+)-S-пропил- L -цистеинсуль-фоксид (рис. 3б), из чеснока – S-аллил- L -цистеин-сульфоксид (рис. 3в) [2]. По-видимому, они обра-
зуются в результате окисления содержащихся в
в нильных группи ровок как in vitrо, так и in vivo, а также о сравнительно медленной регенерации неокисленной серы [4,7]. Накопление сульфинильных группировок блокирует ряд биологически важных процессов. Это наблюдается при старении организма или развитии некоторых заболеваний.
Сульфоксиды в оптически активной форме
растениях сульфидов. Показано, что при действии ферментов типа аллиназы (содержащихся в природных препаратах), 2-пропенилсульфоксид (производное (+)-( S )-цистеин-сульфоксида) превращается в айоен, ответственный за антитромбозное действие чесночных экстрактов [3]. Полагают, что выделенные из лука цвибелины образуются в его соке из 1-пропенилцистеинсульфоксида по сходно-
выделены из некоторых природных источников.
му механизму [4].
Так, редко встречающееся растение Dipthychjcarpus strictus (двоякоплодник прямой) продуцирует 10 алкалоидов с хиральньным атомом серы в метилсульфинильном фрагменте [8,9]. Аналогичную хиральную сульфоксидную группу содержит поли-функциональный антибиотик спарсомицин – продукт жизнедеятельности стрептомицетов Strepto-myces sparsogenes [10].
\ HSO
H 2 N COOH
а
Pr
HSO
H 2 N COOH
б
Allyl
HSO
H 2 N COOH
в
Многообразны по своей структуре и распространению в природе и биологической активности ди- и полисульфиды: аминокислота цистин (рис 5а), липоевая кислота (кофермент) (рис.5б), антибиотик эсперамицин А (рис.5в), диаллилдисульфид (рис.5г), выделенный из чеснока, лентионин – главный одорант съедобных грибов Shiitake Lentinus edodes , издавна культивируемый в Японии (рис.5д) [1]. Ва-рацины из дальневосточной асцидии Polycitor sp.
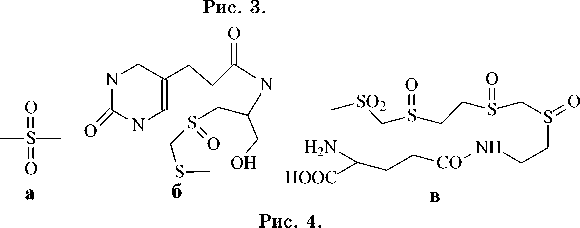
Диметилсульфон (рис. 4а) и другие сульфоны были выделены из морских организмов. В различных грибковых штаммах содержатся более слож-
тормозят деление опухолевых клеток, причем наиболее перспективным в этом отношении является варацин С (рис. 5д), превосходящий в 100 раз по своему цитотоксическому эффекту применяемые в медицине противоопухолевые препараты [11].
Одним из основных источников сераорганических соединений является нефть. Сера является важнейшим из гетероэлементов, присутствующих в
нефтях, концентрация ее изменяется от сотых долей до 6-8%, в редких случаях достигая 9,6%, а иногда даже 14% [12, 13]. Основная часть серы в
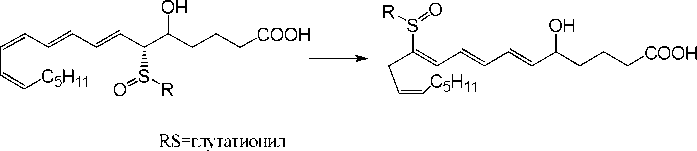
Схема 1.
н
CH3SCH2—c—NH--
О соон
HOOC
S - S
NH 2
H
H COOH
H2N а
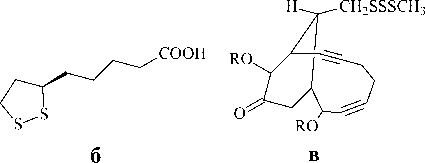
Рис. 5.
нефти представлена в виде ее сераорганических соединений: меркаптанов (RSH), сульфидов (RSR'), дисульфидов (RSSR'), циклических сульфидов (C n H 2n S). Доля сернистых и высокосернистых нефтей России в общем балансе добычи составляет две трети. Кроме того, сернистые соединения, присутствующие в нефтепродуктах, резко ухудшают эксплуатационные качества топлив и масел, вызывают коррозию аппаратуры, снижают активность антидетонаторов и антиокислительную стабильность топлива, повышают склонность к смолообразованию крекинг-бензинов. Между тем органические соединения серы можно извлечь из нефтепродуктов в виде концентратов, а также нефтяных сульфоксидов и сульфонов и использовать в различных отраслях народного хозяйства. Сульфоксиды являются высокоэффективными экстрагентами солей металлов, органических и неорганических кислот, фенолов, флотореагентами полиметаллических руд, пластификаторами полимерных материалов [12,14]. Технические смеси, главным образом циклоалифатические сульфоксиды, получаемые окислением высокосернистых нефтей, могут быть использованы в качестве дешевого экстрагента в гидрометаллургии для выделения солей благородных металлов [15]. Сульфоны являются препаратами для лечения грибковых заболеваний животных, а также используются как высокоэффективные репелленты. Среди сульфонов наиболее широкое применение находит сульфолан, получаемый в промышленном масштабе каталитическим дегидрированием 2,5-дигидротиофендиоксида (сульфолена-3). Сульфолан – прекрасный избирательный растворитель и экстрагент, позволяющий извлекать ароматические соединения из нефтяных фракций, производить очистку промышленных газов и др. Смеси нефтяных сульфонов предложено использовать в качестве гербицида ряда культур, репеллентов для защиты крупного рогатого скота от сосущих насекомых [4].
Широкое развитие получают исследования, посвященные серосодержащим модификациям для разработки лекарственных препаратов. При наличии биологически активного сульфида (например, цефалоспорина) или сульфона (различные сульфонамиды) предпринимаются попытки получения соединений с сульфоксидной функцией. При этом отмечается существенное изменение активности веществ в лучшую сторону. Например, при сравнении биологической активности сульфидов, сульфонов и сульфоксидов, цефалоспоринов третьего поколения установлено, что биоактивность сульфоксида выше прочих в несколько раз [17]. Синтезированные или выделенные из природного сырья сульфоксиды обладают ценными практическими свойствами. Они способны выступать в роли антиоксидантов и антидепрессантов [18], являются эффективными препаратами при лечении язвенной болезни [19], ингибиторами индуцированного тромбином биосинтеза [20]. Исследователи связывают повышение биологической активности в сульфоксидах с увеличением мембранотропных свойств молекулы. Кроме того, во многих случаях подчеркивается чрезвычайно большая гидрофильность молекулы сульфоксида при сохранении высокой липофильности [21]. Это качество крайне ценно, так как решает проблему поиска нетоксичного растворителя при биоиспытаниях и внедрении в медицинскую практику.
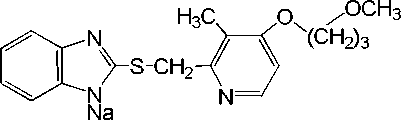
Успешно осуществлено селективное окисление сульфида (схема 2) с помощью штамма С. ech-inulata МК40 в присутствии глюкозы в соответствующий ( S )-сульфоксид с высоким химическим вы-ходом(92%) и ее >99 %, без образования побочных продуктов. Полученная в препаративных количествах натриевая соль 2-{[4-(3-метоксипропилок-си)-3-метилпиридил-2-ил]метилсульфинил}-1Н-бен-зимидазола составляет активное начало фармакологического противоязвенного препарата рабепра-зола [22] (схема 2).
Препаративный интерес представляет реакция окисления сульфидов (рис. 6) культурой Fusarium oxysporum СВS 24801 с целью получения хиральных винильных сульфоксидов, проявляющих антигипоксическую активность [23].
Холландом с соавторами [24] установлено, что такие штаммы, как В.Bassiana АТСС 7159 и B. Cale-donica АТСС 64970 осуществляют селективное прев-
f-BuOOH, DET
Ti(/-OPr)4
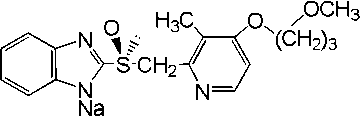
Схема 2.
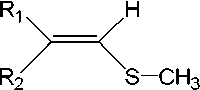
R —o l-l P —Г' l-l 1-идП5, К2-Ь6П5
R^CeHs Р2=3/-пиридил
R^CeHs Р2=4/-пиридил
Рис.6.
ращение сульфида 7а (рис. 7) в соответствующий ( S S )-сульфоксид 7б (химический выход >90%, >95% ее ). В результате химического гидролиза хирального сульфоксида 7б был синтезирован хондрин 7в – практически значимое соединение, являющееся предшественником душистых веществ лука и продуцируемое красной водорослью Chondria crassi-caulis [24].
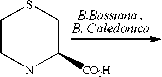
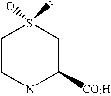
Рис. 7.
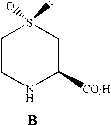
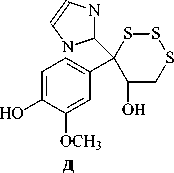
Одной из ключевых стадий в синтезе нестероидного жаропонижающего препарата сулиндак 8в (рис.8) стало асимметрическое окисление сульфида 8а в сульфоксид 8б [25]. Сулиндак 8в – эффективный препарат, главным образом, используемый тивоязвенной активностью, было получено с выходом 77% (95% ее) в промышленных масштабах окислением соответствующего сульфида гидроперекисью кумола в присутствии Ti(i-OPr)4, (-)-DET, молекулярных сит (4Ǻ) и N,N-диизопропилэтилами-на [50,127]. Коммерциализирован как LosecTM, он является всемирным препаратом в продаже с 1997 г., хотя препарат в течение долгого времени был продаваем как рацемат. В настоящее время доступен (S)-энантиомер омепразола – эзомепразол, в продаже под названием NexiumTM. В 2003 г. NexiumTM был седьмым, наиболее востребованным по продаже препаратом [25, 28].
В лаборатории химии окислительных процессов Института химии Коми НЦ УрО РАН разработаны методы асимметрического окисления азотсодержащих полифунциональных сульфидов (рис. 10). Получены энантиомерно обогащенные сульфоксиды с энантиомерным избытком до 97%. Синтезированные соединения переданы для испытаний на противовоспалительную и противовирусную активность. Осуществлен синтез новых терпеновых тиоланов и проведено их асимметрическое окисление [48-51] (рис. 1112). Некоторые полученные впервые сульфинил- и сульфонилпроизводные терпеновых тиоланов продемонстрировали противогрибковую активность.
В Институте химии Коми НЦ УрО РАН разработан новый метод селективного окисления сульфидов в сульфоксиды диоксидом хлора (рис. 13).
в лечении ревматического артрита, артрозов, острого подагрического артрита. За прошлые десять лет применение сулинда-ка 8в в лечении рака стала областью большого интереса. До настоящего времени сулиндак 8в использовался терапевтически как рацемическая смесь. Первый асимметрический синтез энан-тиочистого сулиндака 8в был описан Р.Магьюре [26].
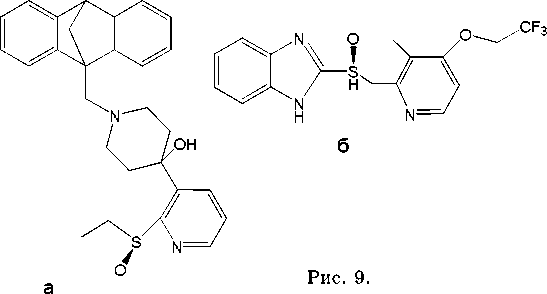
Сульфоксид 9а (рис. 9), апробированный в качестве лекарственного средства против шизофрении, был синтезирован асимметрическим окислением соответствующего сульфида с 93% ее и образованием менее чем 1% сульфона [25]. Позднее он был назван как препарат ZD3638 – энантиомерно чистый сульфоксид 9а S конфигурации, антипсихотический агент [26].
Соединение 9б, получившее название «омепразол» и обладающее выдающейся про-
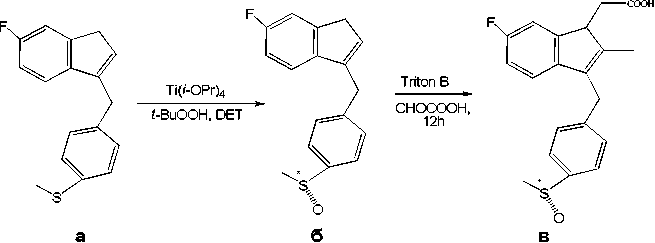
Рис. 8.
N
N
S
N
Реагент Шарплесса
N SO
97-98% ee
N
N
N
S
Реагент Шарплесса
N
S
W
O
97-98% ee
N
N
S
Реагент Шарплесса
S \\
O
97-98% ee
NN
NN
Ph
NS
Реагент Шарплесса
Ph
N
S
Ph
Ph
O
80% ee
Рис. 10.
субстрат:окислитель ' 1:1,1:2
смесь стереоизомеров
субстрат: окислитель ' 1:4
Рис.
О
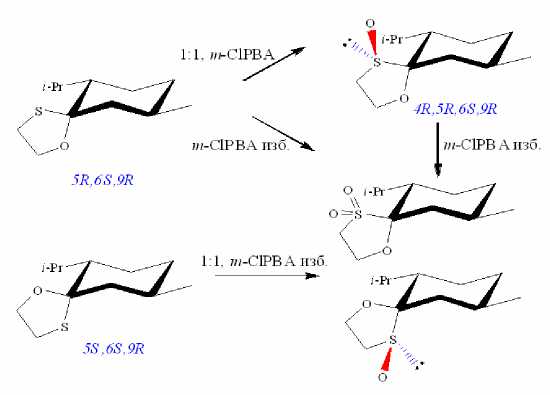
Рис. 12.
Для проведения реакции окисления сульфидов, меркаптанов, дисульфидов предлагается использовать диоксид хлора (ClO 2 ). Нами установлено, что ClO 2 является хемосе-лективным окислителем, позволяющий получить сульфоксиды с высоким выходом (9599%) [35-36, 43-47].
Нами предложена новая реакция получения сульфонилхлори-дов взаимодействием меркаптанов и дисульфидов с диоксидом хлора (рис. 14) [41].
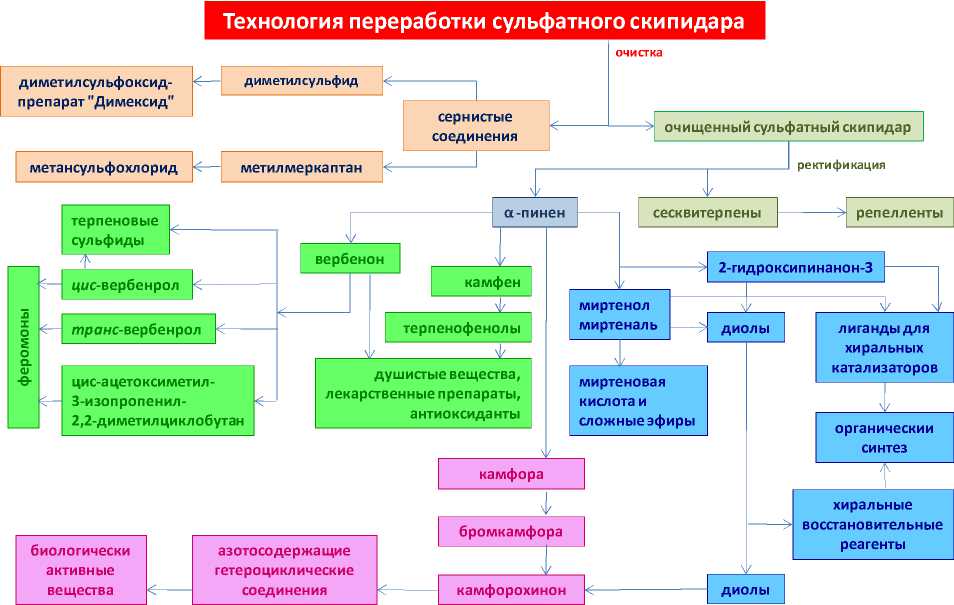
Одним из источников сераорганичес-ких соединений является сульфатный скипидар – побочный продукт сульфатно-целлю-лозного производства. Сульфатный скипидар содержит легкокипя-щие имеющие неприятный запах сернистые соединения – ме-тилмеркаптан, диме-тилсульфид и диметилдисульфид. Соединения серы придают скипидару неприятный запах, снижают его ценность; их присутствие является основной причиной того, что сульфатный скипидар в сыром виде не применяется в промышленности без дополнительной очистки [29,
30]. В то же время, смесь сернистых соединений сульфатного скипидара применяется для получения одоранта сульфана – одоранта природного и сжиженного газа (добавляют в природный газ для придания ему характерного предупреждающего запаха). В результате окисления диметилсульфида получают диметилсульфоксид, являющийся универсальным растворителем, экстрагентом ароматических углеводородов из нефтепродуктов, лекарственного препарата «димексид» с широким спектром физиологического действия [31] .
В Институте химии Коми НЦ УрО РАН разработана технология комплексной переработки сульфатного скипидара, включающая его очистку от сернистых соеди-
O
ClO ClO
R 1 S R 2 2 R 1 S R 2 2 R 1 S R 2
OO
-
(1) R i = R 2 = Pr (7) R i = R 2 = п -ВгС б Н 4 (10) R i = Me; R 2 = Bu
-
(2) R 1 = R 2 = i-Bu (8) R 1 = R 2 = Me (11) R 1 = Me; R 2 = Et
-
(3) R 1 = R 2 = Bu (9) R 1 = R 2 = Bn (12) R 1 = Me; R 2 = Ph
-
(4) R 1 = R 2 = С 8 Н 17 (13) R 1 = Ph; R 2 = C 6 H 13
-
(5) R i = R 2 = p- Tol (14) R i = C 6 H 13 ; R 2 = Pr
Рис. 13.
смолы, эластомеры, красители, гербициды [32-42]. Технология переработки сульфатного скипидара представлена на рис. 15.
Диметилсульфоксид – продукт селективного окисления диметилсульфида, полученного после отделения от метилмеркаптана и диметилдисульфида головной фракции ректификации сульфатного скипидара. Область применения диметилсульфоксида : селективный растворитель, компонент косметических и лекарственных средств, медицинский препарат "ди-мексид".
Последнее десятилетие отмеча-
RSH
ClO2
RSSR
ClO2
O
RSSR
ClO2
II
RSSR
II
ClO2
R S Cl
ClO2
O
ется интенсивным развитием производства различных органических соединений серы. На мировом рынке химических товаров появились в больших количествах меркаптаны, сульфиды, тиофены, сульфоксиды и сульфоны. Они находят свое применение в качестве экстрагентов, растворителей,
R = n-CH 3 C 6 H 4 , C 6 H 5 CH 2 , C 6 H 13 , C 16 H 33 , C 2 H 5 OH, C 2 H 5 , C 4 H 9 , n-NO 2 C 6 H 4
флотореагентов и исходных соединений для синтеза различных биологиче-
Рис. 14.
ски активных веществ, в частности нений и получения на основе компонентов скипидара продуктов, применяемых в различных областях жизнедеятельности человека: репелленты, феромоны насекомых, полупродукты для синтеза ценных душистых и лекарственных веществ; экстрагенты металлов; моющие средства, ионообменные пестицидов, лекарственных препаратов, специфических пластификаторов. Отдельно необходимо отметить, что окисление атома серы, в том числе асимметрическое, – наиболее распространенная реакция окисления в синтезе потенциальных лекарственных препаратов. Таким образом, исследования, проводимые в Институте химии Коми НЦ УрО РАН по разработке методов
Патент РФ № 2061722 (1992). Способ очистки сульфатного скипидара. Кучин А.В. и др 7.
Патент РФ № 2126433 (1999). Способ очистки высокосернистого скипидара. Кучин А.В. и др. 8.
Патент РФ № 2084148 (1994). Репеллент. Кучин А.В. и др 9.
Патент РФ № 2127258 (1999). Способ получения сульфоксидов. Рубцова С.А. и др 10.
Патент РФ № 2139275 (1999). Способ получения сульфоксидов Кучин А.В. и др. 11.
Патент РФ № 2289574 (2005). Способ получения сульфонилхлоридов. Лсзина О.М. и др
Патент РФ № 2176994 (2001). Способ получения миртенола. Кучин А.В. и др.
Патент РФ № 2189967 (2002). Способ получения цис-вербенола. Фролова Л.Л. и др.
Патент РФ № 2233262 (2004). Способ получения орто-терпенофенолов. Чукичева И.Ю. и др.
Патент РФ №2250208 (2005). Способ получения вербенона. Фролова Л.Л. и др.
Патент РФ № 2260580 (2005). Способ получения миртеновой кислоты или миртеновой кислоты и ее сложного эфира. Фролова Л.Л. и др.
Положительное решение на выдачу патента. Способ получения сульфидов из цис-вербснола. Никитина Л.Е. и др.
Рис. 15.
синтеза новых сераорганических соединений (меркаптанов, сульфидов) и их успешного хемо- и энан-тиоселективного окисления в соответствующие сульфоксиды и сульфоны, являются актуальными.
Список литературы Полезная сераорганическая химия
- Племенков В.В. Введение в химию природ ных соединений. Казань, 2001. 376 с.
- Оаэ С. Химия органических соединений се ры. Пер. с яп./Под ред. Е.Н.Прилежаевой. М.: Химия, 1975. 512 с.
- The chemistry of alkyl thiosul-finate esters. 9. Antithrombotic organosulfur compounds from garlic: structural, mechanis-tic, and synthetic studies/E.Block, S.Ahmad, J.L.Catalfamo, M.K.Jain, R.Apitz-Castro//J. Amer. Chem. Soc., 1986. Vol. 108. No.22. Р. 7045-7055.
- Получение и свойства органических соеди нений/Под ред. Беленького Л.И. М.: Хи мия, 1988. 560 с.
- Jogia M.K., Andersen R.J., Mantus E.K., Clardy J. Dysoxysulfone, a sulfur rich metabolite from the Fijian medicinal plant dysoxylum richii//Tetrahedron Lett., 1989. Vol. 30. No 37. P. 4919-4920.
- Corey E.J., Oh H., Barton A.E. Pathways for migration and cleavage of the S-peptide unit of the leukotrienes//Tetrahedron Lett., 1982. Vol. 23. No 34. P. 3467-3470.
- Modulation of human 5-lipoxygenase activity by membrane lipids/A.H.Pande, D.Moe, K.N.Nemec, S.Qin, S.Tan, S.A.Tatulian//Biochem., 2004. Vol.43. No. 46. Р. 14653-14666.
- Юнусов C.Ю. Алкалоиды/ФАН. Ташкент, 1981. 418 с.
- Полный синтез рацемического алкалоида диптокарпамина/О.В.Толстикова, А.Г.Толстиков, В.С.Шмаков, В.Н.Одиноков, С.Ф.Арипова//Химия природных соединений, 1989. №2. С. 232-236.
- Jogia M.K., Andersen R.J., Mantus E.K., Clardy J. Dysoxysulfone, a sulfur rich metabolite from the Fijian medicinal plant dysoxylum richii//Tetrahedron Lett., 1989. Vol. 30. No 37. P. 4919-4920.
- Еляков Г.Б., Стоник В.А. Морская биоорганическая химия -основа морской биотехнологии//Известия Академии наук. Серия химическая, 2003. №1. С.1-18.
- Харлампиди Х.Э., Мустафин Х.В., Чиркунов Э.В. Интенсификация нефтедобычи. Очистка и переработка нефти//Вестник Казанского технологического университета, 1998. №1. С.76-86.
- Большаков Г.Ф. Сераорганические соединения нефти. Новосибирск: Наука, 1986. 243 с.
- Ляпина Н.К. Химия и физикохимия сераорганических соединений нефтяных дистиллятов. М.: Наука, 1984. 120 с.
- Шарипов А.Х. Получение концентратов сульфоксидов и сульфонов из нефтяного сырья (обзор)//Нефтехимия, 1988. Т.28. № 6. С. 723-725.
- Беликов В.Г. Синтетические и природные лекарственные средства/Краткий справочник. М.: Высш. шк., 1993. 720 с.
- Singh R., Singh M.P., Micetich R.G. Synthesis and in vitro antibacterial activity of sodium 6 -[2-(2-aminothiazol-4-yl)-(Z)-2-met//J. Antibiot., 1989. Vol.42. No. 4. Р. 637-639.
- Kee M-L., Irwin B. The synthesis of sulfinyl chlorides//Organic preparations and procedures, 1970. Vol.2. No. 3. Р. 235-244.
- Minoru U. Studies on proton pump inhibitors II. Synthesis and anticulcer activity of 8-[(2-benzimidaz olyl)sulfinylmethil-1,2,3,4]-tetrahydroqinolines//Chem. Farm. Bull., 1989. Vol.37. Р. 210-212.
- Bayer T., Wagner H., Blok E., Grisoni S. Zwiebelanes: novel biologically active 2,3-dimethyl-5,6-dithiabicyclo [2.1.1] hexane 5-oxides from onion//J. Amer. Chem. Soc., 1989. Vol.111. No. 8. Р. 3085-3086.
- Eugene L.W. A simple preparation of S-alkil Homocysteine derivatives//Tetrahedron Lett., 1988. Vol. 29. No. 47. P. 6055-6058.
- Yoshida T., Kito M., Tsujii M., Nagasavara T. Microbial synthesis of a proton pump inhibitor by enantioselective oxidation of a sulfide into its corresponding sulfoxide by Cunninghamella echinulata MK40//Biotechnol. Lett., 2001. Vol. 23. Р. 1217-1222.
- Microbiological and chemical methods in the asymmetric oxidation of sulfides: A comparative study for the preparation of (S)-vinyl sulfoxides/C.Rossi, A.Fauve, M.Madesclaire, D.Roche, F.A.Davis, R.T.Reddy//Tetrahedron: Asymmetry, 1992. Vol.3. P. 629-639.
- Biocatalytic oxidation of S-alkylcysteine derivatives by chloroperoxidase and Beauveria species/H.L.Holland, F.M.Brown, D.V.Johnson, A.Kerridge, B.Mayne, C.D.Turner, A.J. van Vliet//J. Mol. Catal. B: Enzym., 2002. Vol.17. No. 6. Р. 249-256.
- Applications of catalytic asymmetric sulfide oxidations to the syntheses of biologically active sulfoxides/J.Lergos, J.R.Dehli, C.Bolm//Adv. Synth. Catal., 2005. Vol. 347. Р. 19-31.
- Enantioselective Synthesis of Sulindac/R.Maguire, S.Papot, A.Ford, S.Touhey, R.O'Connor, M.Clynes//Synlett, 2001. P. 41-44.
- Asymmetric Sulfoxidation of an Aryl Ethyl Sulfide: Modification of Kagan Procedure to Provide a Viable Manufacturing Process/P.J.Hogan, P.A.Hopes, W.O.Moss, G.E.Robinson, I.Patel//Org. Process Res. Dev., 2002. Vol. 6. P. 225-229.
- Catalytic Asymmetric Oxidation of sulfide with titanium-mandelic acid complex: practical synthesis of (S)-3-[1-(2-methylphenyl)imidazol-2-ylsulfinul]propan-1-ol, the key intermediate of OPC-29030/M.Matsugi, N.Fukuda, Y.Muguruma, T.Yamaguchi, J.Minamikawa, S.Otsuka//Tetrahedron, 2001. Vol.57. P. 2739-2744.
- Богомолов Б.Д., Соколова А.А. Побочные продукты сульфатноцеллюлозного производства. М.: Гослесбумиздат, 1962. С.341-350.
- Переработка сульфатного и сульфитного щелоков/Б.Д.Богомолов, С.А.Сапотницкий, О.М.Соколов и др. М.: Лесная промышленность, 1989. 360 с.
- Технология органических соединений серы/А.Х.Шарипов, В.Р.Нигматуллин, И.Р.Нигматуллин, А.С.Меджибовский. М.: ООО «Издательский центр «Техинформ» МАИ», 2001. 76 с.
- Патент 2061722 Россия. Способ очистки сульфатного скипидара/А.В.Кучин, Л.П.Карманова, С.А.Рубцова, Р.И.Дорошева; Заявл. 10.09.92; Опубл. 10.06.96; Бюл. № 16.
- Патент 2084148 Россия. Репеллент/А.В.Кучин, Л.П.Карманова, С.А.Рубцова, Р.И.Дорошева, И.Н.Ишмуратов; Заявл. 04.10.94; Опубл. 20.07.97; Бюл. № 20.
- Патент 2126433 Россия. Способ очистки высокосернистого сульфатного скипидара/А.В.Кучин, Л.П.Карманова, Г.Н.Попова, С.А.Рубцова, Г.А.Толстиков; Заявл. 28.04.98; Опубл. 20.02.99; Бюл. № 5.
- Патент 2127258 Россия. Способ получения сульфоксидов/А.В.Кучин, Л.П.Карманова, С.А.Рубцова, И.В.Логинова; Заявл. 14.07.97; Опубл. 10.03.99; Бюл. № 7.
- Патент 2139275 Россия. Способ получения сульфоксидов/А.В. Кучин, С.А. Рубцова, Л.П. Карманова, С.Н. Субботина, И.В. Логи-нова; Заявл. 29.06.98; Опубл. 10.10.99; Бюл. № 28.
- Патент 2176994 Россия. Способ получения миртенола/А.В. Кучин, Л.Л. Фролова, И.В. Древаль, М.В. Пантелеева, И.Н. Алексеев; Заявл. 26.07.2000; Опубл. 20.12.2001; Бюл. № 35.
- Патент 2189967 Россия. Способ получения цис-вербенола/Л.Л. Фролова, А.В. Кучин, И.В. Древаль, М.В. Пантелеева, И.Н. Алексеев; Заявл. 14.05.2001; Опубл. 27.09.2002; Бюл. № 27.
- Патент 2250208 Россия. Способ получения вербенола/Л.Л.Фролова, А.В.Кучин, И.В.Древаль, М.В. Пантелеева, И.Н. Алексеев; Заявл.14.07.2003; Опубл. 20.04.2005; Бюл. № 11.
- Патент 2260580 Россия. Способ получения миртеновой кислоты или миртеновой кислоты и ее сложного эфира/Л.Л.Фролова, А.В.Ку-чин; Заявл. 06.04.2004; Опубл. 20.09.2005; Бюл. № 26.
- Патент 2289574 Россия. Способ получения сульфонилхлоридов/О.М. Лезина, С.А. Рубцова, А.В. Кучин; Заявл. 18.04.2005; Опубл. 20.12.2006; Бюл. № 35.
- Патент 2302407 Россия. Способ получения тиолсульфонатов/О.М. Лезина, С.А. Рубцова, А.В. Кучин; Заявл. 05.04.2006; Опубл. 10.07.2007; Бюл. № 19.
- Селективное окисление диалкилсульфидов в диалкилсульфоксиды диоксидом хлора/А.В.Кучин, С.А.Рубцова, Л.П.Карманова, С.Н.Субботина, И.В.Логинова//Изв. АН. Сер. хим., 1998. №10. С. 2110.
- Кучин А.В., Рубцова С.А., Логинова И.В., Субботина С.Н. Диоксид хлора -новый окислитель сульфидов и сульфоксидов//Ж. орг. химии, 2000. № 12. С. 1873-1874.
- Кучин А.В., Рубцова С.А., Логинова И.В. Реакции диоксида хлора с органическими соединениями. Хемоселективное окисление сульфидов в сульфоксиды диоксидом хлора//Изв. АН. Сер. хим., 2001. № 3. С. 813-816.
- Окисление -кетосульфидов диоксидом хлора/И.В.Логинова, Е.В.Ашихмина, С.А.Рубцова, Ю.В.Крымская, А.В.Кучин//Ж. орг. химии, 2008. Т. 44. № 12. С. 1799-1801.
- Логинова И.В., Рубцова С.А., Кучин А.В. Окисление метионина и производных цистеина диоксидом хлора до сульфоксидов//Химия природных соединений, 2008. №6. С. 608-610.
- Асимметрическое окисление дитиолана мен-тона/А.В.Тимшина, С.А.Рубцова, М.И.Кодесс, Е.Г.Маточкина, П.А.Слепухин, А.В.Кучин//Ж. орг. химии, 2008. Т. 44. № 7. С. 1053-1058.
- Окисление оксотиолана ментона/А.В.Тимшина, С.А.Рубцова, И.Н.Алексеев, М.И.Кодесс, Е.Г.Маточкина, П.А.Слепухин, А.В.Кучин//Химия природных соединений, 2008. №6. С. 588-590.
- Асимметрическое окисление дитиолана вербенона/А.В.Тимшина С.А.Рубцова, Л.Л.Фролова, И.Н.Алексеев, ПА.Слепухин, А.В.Кучин//Ж. орг. химии, 2009. Т. 45. № 4. С. 595-600.
- Окисление этилендитиоацеталя камфоры/А.В.Тимшина, С.А.Рубцова, И.Н.Алексеев, П.А.Слепухин, А.В.Кучин//Ж. орг. химии, 2010. Т. 46. № 3. С. 370-374.


