Полиморфизм генов ферментов биотрансформации ксенобиотиков: взаимосвязь с риском развития рака гортани
Автор: Шилова О.Ю., Уразова Л.Н., Гервас П.А., Мухамедов М.Р., Черемисина О.В., Евтушенко В.А., Чойнзонов Е.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 (26), 2008 года.
Бесплатный доступ
Вклад полиморфизма генов ферментов детоксикации в формирование повышенного риска рака гортани остается предметом дискуссий. В работе изучена взаимосвязь полиморфизма генов ферментов биотрансформации ксенобиотиков GSTT1 и GSTM1 и их сочетаний с риском формирования рака гортани. Установлена ассоциация «нулевого» генотипа гена GSTT1 с раком гортани.
Полиморфизм генов, глютатион-s-трансферазы, рак гортани
Короткий адрес: https://sciup.org/14054846
IDR: 14054846 | УДК: 616.22-006.6:575.113
Текст научной статьи Полиморфизм генов ферментов биотрансформации ксенобиотиков: взаимосвязь с риском развития рака гортани
Злокачественные новообразования (ЗНО) гортани и гортаноглотки занимают лидирующие позиции среди опухолей головы и шеи [8, 16]. Среди этиологических факторов, приводящих к развитию ЗНО гортани, решающую роль играют факторы внешней среды, канцерогенный потенциал которых во многом зависит от функциональной активности ферментов глутатион-S-трансфераз [17]. Глутатион-S-трансферазы (GST) метаболизируют чужеродные вещества либо контролируют поступление канцерогенов в клетки. Генетический полиморфизм, обусловливающий вариабельность функции этих ферментов у разных индивидуумов, широко распространен в человеческой популяции. В частности, установлено, что протяженные делеции (потеря нуклеотидов) генов GSTT1 и GSTM1 фенотипически проявляются отсутствием соответствующих белковых продуктов, следовательно, потерей способности инактивировать определенные группы ксенобиотиков. Таким образом, гомозиготность по «нулевому» (функционально неактивному) аллелю этих генов может быть связана с высокой восприимчивостью организма к вредным воздействиям, повышением канцерогенной нагрузки и, как следствие, увеличением риска возникновения ЗНО. Так, согласно литературным данным, нулевые аллели генов GSTT1 и GSTM1 являются факторами риска возникновения рака пищевода, легкого, молочной железы, мочевого пузыря, шейки матки и других локализаций среди различных популяций и рас [1, 4, 11, 12]. Однако данные литературы о вкладе полиморфизма генов GSTT1 и GSTM1 в риск ЗНО гортани немногочисленны и противоречивы [3, 5, 13–15].
Целью настоящей работы было исследовать распределение генотипов генов GSTT1 и GSTM1 и их комбинаций среди больных раком гортани региона Западной Сибири.
Материалы и методы
В исследование включено 103 больных в возрасте 57,1 ± 0,94 года с диагнозом плоскоклеточный рак гортани. Пациенты находились на стационарном и амбулаторном лечении в отделении опухолей головы и шеи ГУ «НИИ онкологии ТНЦ СО РАМН» в 2004–2007 гг. В качестве группы сравнения были обследованы 23 больных с предопухолевыми заболеваниями гортани (папилломатоз – 7 %, хронический ги- перпластический ларингит – 83 %), в возрасте 51,3 ± 1,93 года. Диагноз верифицирован по результатам клинического, рентгенологического, эндоскопического и морфологического обследования. В качестве популяционного контроля использовали выборку 100 здоровых лиц, в возрасте 57,1 ± 0,94 года, не имеющих морфологических изменений слизистой оболочки гортани, проживающих в г. Томске (по данным Н.В. Севостьяновой, 2004).
Работа соответствует стандартам биоэти-ческого комитета, разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.03 № 266.
ДНК была выделена из цельной венозной крови с использованием протеиназы К с последующей фенольно-хлороформной экстракцией. Оценка полиморфизма генов GSTT1 и GSTM1 проводилась методом мультиплексной ПЦР с использованием трех пар олигонуклеотидных праймеров, включая специфичный участок (183 п.н.о.) к региону гена рецептора эстрогенов, применяемого в качестве внутреннего контроля амплификации (рис. 1).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ «STATISTICA for Windows 6.0». При сравнении частот генотипов применяли стандартный критерий χ2 Пирсона. При условии,
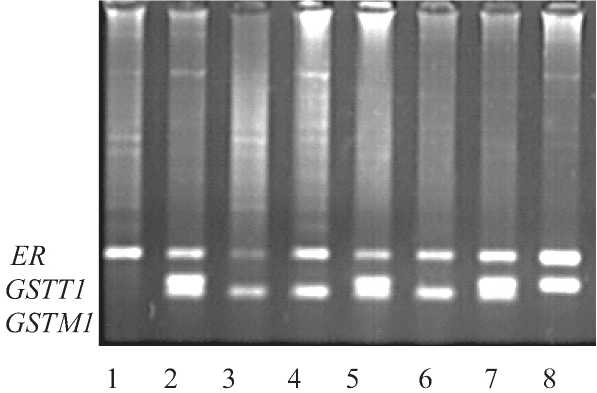
Рис. 1. Примеры идентификации GSTT1 и GSTM1 0/0 и +/- генотипов: ER – контроль амплификации (183 п.н.);
1 – GSTT1 0/0 / GSTM1 0/0;
2, 5, 7 – GSTT1 +/- / GSTM1 +/- (131 и 114 п.н. соответственно);
3, 4, 6 – GSTT1 0/0 / GSTM1 +/-; 8 – GSTT1 +/- / GSTM1 0/0
когда объем выборки не превышал 10 случаев, использовали критерий χ2 с поправкой Йетса (Y), когда объем выборки не превышал 5 случаев – критерий Фишера (F). Различия статистически значимы при р<0,05. Подсчитывали отношение шансов (OR – odds ratio) для оценки ассоциации изучаемых генотипов генов с риском развития заболевания. OR указан с 95 % доверительным интервалом (Confidence Interval – CI) [7, 9].
Результаты и обсуждение
На первом этапе мы изучили распределение генотипов генов GSTT1 и GSTM1 в группах наблюдения и здоровых лиц для выяснения их взаимосвязи с риском развития рака гортани (табл. 1).
Таблица 1
Распределение генотипов генов GSTT1 и GSTM1 в обследованных группах
|
Генотип |
Здоровые лица (n=100) |
Больные с предопухолевыми заболеваниями гортани (n=23) |
Больные раком гортани (n=103) |
|||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
|
|
GSTT1 |
||||||
|
0/0 |
15 |
15 |
10 |
43,5 * p=0,005 |
60 |
58,2 * p=0,0001 |
|
+/- |
85 |
85 |
13 |
56,5 |
43 |
41,7 |
|
GSTM1 |
||||||
|
0/0 |
43 |
43 |
6 |
26,1 |
30 |
29,1 * p=0,039 |
|
+/- |
57 |
57 |
17 |
73,9 |
73 |
70,9 |
Примечание: * – различия статистически значимы по сравнению с аналогичными показателями группы контроля.
О.Ю. ШИЛОВА, Л.Н. УРАЗОВА, П.А. ГЕРВАС, М.Р. МУХАМЕДОВ И ДР.
Частота нулевого генотипа гена GSTT1 у больных раком легкого составила 58,2 %, что статистически значимо превышает показатели (15 %) в группе контроля (p=0,0001, χ 2=38,9). Значения OR свидетельствуют об ассоциации нуль-генотипа гена GSTТ1 с риском развития рака гортани (OR =7,91, CI 95 % 3,84–16,48). По данным литературы, GSTТ1 отвечает за детоксификацию различных субстратов, следовательно, одновременное поступление их в организм может привести к накоплению большого количества активированных канцерогенов, в результате чего образуются ДНК-аддукты, которые вызывают повреждения ДНК и тем самым многократно увеличивают риск развития ЗНО, в частности рака гортани [2]. При стратификации групп больных по курению ассоциация нулевых генотипов GSTТ1 с раком гортани установлена и для курящих, и для некурящих индивидуумов, то есть курение не является модифицирующим фактором риска (данные не представлены).
Как видно из табл. 1, в группе больных пре-допухолевыми заболеваниями гортани частота GSTТ1 0/0 составила 43,5 %, что значимо выше, чем в контроле (p=0,005, χ 2=7,69, OR=4,36 CI 95 % 1,45–13,16). Это свидетельствует о том, что носительство нулевого генотипа гена GSTТ1 является фактором риска развития предопухо-левых состояний гортани. У больных раком гортани частота гомозигот GSTM1 0/0 составила 29,1 %, что статистически значимо ниже, чем в группе здоровых лиц, – 43 % (p=0,039, χ 2=4,24, OR =0,54 Cl 95 % 0,29-1,01), что свидетельствует об отсутствии положительной взаимосвязи GSTM1 0/0 гомозиготного генотипа с риском развития рака гортани.
Очевидно, для оценки того или иного генотипа как фактора риска необходимы также знания о спектре канцерогенов, воздействию которых подвергается население той или иной территории, а также условиях жизни отдельных людей, входящих в исследуемые группы (вредность на производстве, курение, диета). В зависимости от природы химических соединений, входящих в состав загрязнителей конкретной территории, может меняться степень риска возникновения опухоли, связанная с геном и его продуктом. Так, основным субстратом фермента гена GSTM1 являются эпоксиды полиароматических углеводородов (ПАУ), содержащиеся в табаке и в атмосферном воздухе. Так, по данным N. Jourenkova at al. [11], GSTM1 0/0 генотип ассоциирован с риском развития рака гортани среди курящих. Однако спектр факторов внешней среды, вовлеченных в канцерогенез рака гортани, гораздо шире и включает в себя не только продукты неполного сгорания, но и химические, радиоактивные канцерогены, за метаболизм которых отвечают другие ферменты, кодируемые генами-модификаторами. В частности, в литературе было показано, что рисковая значимость нулевых аллелей гена GSTM1 для рака гортани возрастает при сочетании с нулевым генотипом гена GSTM3 [12].
Следующим этапом явилось изучение взаимосвязи сочетания нулевых генотипов генов GSTT1 и GSTM1 с риском развития рака гортани (табл. 2). Частота сочетанных 0/0 генотипов генов GSTT1 и GSTМ1 в группе больных раком гортани и больных с предопухолевыми заболеваниями составила 6,8 % и 13,0 % соответственно, что не имело статистически значимых различий с группой контроля, в которой данный показатель равнялся 5 %. Полученные данные указывают, что сочетанное носительство 0/0 генотипов генов GSTT1 и GSTМ1 не взаимо-
Таблица 2
Частота распределения генотипов генов GSTT1 и GSTМ1 в группах больных и здоровых
Таким образом, в исследовании впервые установлена ассоциация 0/0 генотипа гена GSTT1 с риском развития рака гортани среди лиц Западно-Сибирского региона. Наши данные не согласуются с работами авторов, изучавших полиморфизм гена GSTT1 на других популяциях. Так, по данным E. Peters et al. [16], N. Jourenkova et al. [11], 0/0 генотип гена GSTT1 не ассоциирован с риском ЗНО головы и шеи. Можно полагать, что в основе противоречий могут лежать особенности спектра генетического полиморфизма изучаемых генов в зависимости от географических условий, диеты, расовой принадлежности и др. Следует также принимать во внимание, что одним из важных этиологических факторов рака гортани в настоящее время рассматриваются вирусы папилломы человека (ВПЧ), проканцерогенная роль которых не связана с системой детоксификации ксенобиотиков. В частности, нами показано существенное повышение носительства ВПЧ у больных раком гортани [10]. Также нами получены предварительные данные о возможной роли нефункционального (нулевого) генотипа GSTT1 в развитии предопухолевых заболеваний гортани, которые свидетельствуют о целесообразности продолжения исследований на более представительной выборке пациентов с предопухолевыми изменениями гортани. Не исключена возможность выявления роли носительства нулевого генотипа у больных с предопухолевыми заболеваниями в определении прогноза малигнизации процесса.


