Полиморфизм генов фолатного цикла как фактор риска формирования гипергомоцистеинемии
Автор: Иванов А.М., Гильманов А.Ж., Малютина Н.Н., Ховаева Я.Б., Ненашева О.Ю., Элькин Г.И., Соснин Д.Ю.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 4 (32), 2020 года.
Бесплатный доступ
Гипергомоцистеинемия (ГГц) рассматривается как новый фактор поражения сосудистой стенки. Ее формирование зависит от генетических особенностей организма. Оценена частота распространения генетических полиморфизмов генов (SNP) фолатного цикла среди населения Пермского края и их влияние на концентрацию гомоцистеина в сыворотке крови (Гц). Обследованы 189 женщин (32,2 ± 5,25 г.). Концентрацию Гц в сыворотке крови определяли иммунохемилюминесцентным методом. Методом пиросеквенирования исследовали частоту SNP генов фолатного цикла. Гомозиготное состояние по минорным аллелям гена метилентетрагидрофолатредуктазы (MTHFR) (rs 1801133 и rs 1801131) и и гена метионин-синтазы (MTR) (rs 1805087) регистрировалось в 7,5; 5,4 и в 13,75 раза реже, чем гомозиготное состояние по нейтральным аллелям. Для генов фермента метионин-синтазы редуктазы и белка-транспортера фолатов по изученным SNP преобладало гетерозиготное состояние генотипа. У гомозигот по минорному аллелю SNP гена MTHFR (Ala222Val; rs 1801133) установлено увеличение концентрации Гц в сыворотке крови, составившее 8,476 ± 3,193 ммоль/л и в 1,276 раза превышающее показатель гомозигот по нейтральному аллелю (р = 0,0036). Для остальных 4 SNP генов фолатного цикла не установлено влияния на содержание Гц в сыворотке крови (р > 0,1). Для исследованных SNP генов MTHFR и MTR характерно преобладание частоты нейтрального аллея по сравнению с минорным. Для SNP генов других исследованных белков фолатного цикла не установлено различий в частоте исследованных аллелей. Не обнаружено сочетания в геноме гомозиготных состояний по двум SNP гена MTHFR или гомозиготного состояния по одному SNP и гетерозиготного - по другому. Из исследованных SNP генов ферментов и белков фолатного цикла достоверное увеличение концентрации гомоцистеина вызывает лишь SNP в гене MTHFR (Ala222Val, rs 1801133).
Гомоцистеин, гипергомоцистеинемия, однонуклеотидные полиморфизмы, гены фолатного цикла, метилентетрагидрофолатредуктаза, метионин-синтаза, метионин-синтаза редуктаза, белок-транспортер фолатов
Короткий адрес: https://sciup.org/142226399
IDR: 142226399 | УДК: 616.153.478.6-008.61-02-07 | DOI: 10.21668/health.risk/2020.4.16
Текст научной статьи Полиморфизм генов фолатного цикла как фактор риска формирования гипергомоцистеинемии
Малютина Наталья Николаевна – доктор медицинских наук, профессор, заведующий кафедрой факультетской терапии № 2, профпатологии и клинической лабораторной диагностики (e-mail: ; тел.: 8 (342) 230-42-01; ORCID: .
Ховаева Ярослава Борисовна – доктор медицинских наук, профессор, заведующий кафедрой терапии и семейной медицины (e-mail: ; тел.: 8 (342) 236-86-21; ORCID: .
Ненашева Ольга Юрьевна – кандидат медицинских наук, заведующий клинико-диагностической лабораторией; доцент кафедры клинической лабораторной диагностики (e-mail: ; тел.: 8 (342) 240-40-40; ORCID: .
Элькин Григорий Игоревич – кандидат медицинских наук, доцент кафедры клинической биохимии и лабораторной диагностики (e-mail: ; тел.: 8 (812) 292-32-25; ORCID: .
Соснин Дмитрий Юрьевич – доктор медицинских наук, профессор кафедры факультетской терапии № 2, проф-патологии и клинической лабораторной диагностики (e-mail: ; тел.: 8 (342) 230-22-37; ORCID: .
Гомоцистеин (Гц) представляет собой непротеиногенную аминокислоту, которая не используется для синтеза белков, а образуется в реакциях промежуточного обмена аминокислот и их производных [1, 2]. У здоровых людей концентрация Гц в сыворотке крови поддерживается на низком уровне [3–5]. Ее повышенная концентрация в сыворотке крови (ги-пергомоцистеинемия, ГГц) является одним из факторов риска повреждения эндотелия сосудистой стенки и развития эндотелиальной дисфункции, увеличивает риск тромбозов, ведущих к нарушению кровоснабжения различных органов и тканей [4–7]. На сегодняшний день ГГц рассматривается как один из факторов, участвующих в патогенезе множества заболеваний [8–10]. Показана роль ГГц в дефектах имплантации и развития оплодотворенной яйцеклетки, что может быть причиной бесплодия, невынашивания беременности и формирования патологии развития плода [11, 12]. В ряде работ описана связь ГГц с атеросклеротическим поражением артерий, нарушением кровоснабжения головного мозга и развитием нейродегенеративных заболеваний [13–17]. Кроме того, продемонстрирована связь повышения содержания Гц в сыворотке крови с заболеваниями других органов [18–20].
Формирование ГГц наблюдается при заболеваниях печени вследствие нарушения процессов промежуточного обмена аминокислот, при дефиците витаминов В 6 , В с (фолиевой кислоты) и В 12 . Наиболее высокие значения исследования содержания гомоцистеина в сыворотке крови наблюдаются при наследственной гипергомоцистеинемии – заболевании, обусловленном врожденным дефектом синтеза ферментов, участвующих в обмене Гц [21].
На сегодняшний день гипергомоцистеинемия расценивается как состояние с наследственной предрасположенностью, реализация которой определяется многими другими факторами. Значительный интерес вызывает исследование влияния замены единичных нуклеотидов, так называемых однонуклеотидных полиморфизмов ( single nucleotide polymorphism – SNP ) генов фолатного цикла, и их влияния на обмен гомоцистеина [22, 23]. Фолатный цикл представляет собой сложный каскадный процесс, контролируемый̆ ферментами, использующими в качестве коферментов производные фолиевой кислоты. Полиморфизм генов, возникающий в результате SNP, в ряде случаев ведет к замене одной аминокислоты на другую. В результате этого структура белка, являющегося продуктом мутантного гена, претерпевает небольшие изменения. В ряде случаев эти изменения могут быть неблагоприятными в одних условиях, и обеспечивать преимущества обладателю такого гена в других. Именно такие мутации обеспечивают материал для естественного отбора, так как неблагоприятные в одних условиях мутации могут обеспечить конкурентные преимущества в других изменившихся условиях обитания организма.
Интерес к генетическим вариантам генов, кодирующих ферменты фолатного цикла, связан с множеством публикаций, описывающих связь различных SNP с частотой самых различных заболеваний. Так, в литературе приведены публикации о связи SNP генов фолатного цикла с риском развития сосудистых заболеваний, онкологических заболеваний, акушерско-гинекологической патологии и бесплодия [16, 17, 24–31].
В связи с этим закономерный интерес представляет исследование SNP генов фолатного цикла среди различных групп населения и его связь с формированием гипергомоцистеинемии. В последние годы в Российской Федерации опубликованы работы по исследованию SNP генов фолатного цикла у населения Пензенской области, у жителей Алтайского края [32, 33]. Однако мы не обнаружили исследований по частоте SNP генов фолатного цикла среди населения Пермского края, что делает результаты подобных исследований актуальными и представляющими закономерный интерес.
Цель исследования – оценить частоту распространения SNP генов фолатного цикла среди населения Пермского края, проанализировать влияние SNP генов фолатного цикла как факторов риска формирования повышенной концентрации Гц в сыворотке крови.
Материалы и методы. Исследование выполнено с соблюдением этических принципов проведения медицинских исследований с участием людей в качестве субъектов, изложенных в Хельсинкской декларации Всемирной организации здравоохранения. На его проведение получено одобрение этического комитета ФГБОУ ВО «Пермский государственный медицинский университет имени академика Е.А. Вагнера» МЗ РФ.
В исследование были включены 189 женщин детородного возраста (32,2 ± 5,25 г.; медиана 31 и интерквартильный диапазон 28–36 лет), работающих на предприятиях г. Перми.
Критерии включения:
– женский пол;
– наличие в анамнезе беременностей;
– все обследованные являются жительницами Пермского края как минимум во втором поколении.
Критерии исключения:
– наличие беременности на момент обследования;
– наличие патологии печени по результатам исследования активности ферментов сыворотки крови (аланинаминотрансферазы; аспартатаминотрансферазы; гамма-глутамилтрансферазы; щелочной фосфатазы) и концентрации билирубина;
– прием сульфаниламидных препаратов, поливитаминов или фолиевой кислоты;
– сахарный диабет, артериальная гипертензия, курение, алкоголизм.
Образцы крови были собраны утром натощак после 12-часового голодания. Концентрацию Гц в сыворотке крови определяли иммунохемилюминес-
Таблица 1
Распределение относительной частоты (%) изученных генетических полиморфизмов генов фолатного цикла у женщин Пермского края ( n = 189)
|
Вид SNP генов фолатного цикла |
Сочетание аллелей, абс. (%) |
||
|
гомозиготное по нейтральной аллели |
гетерозиготное |
гомозиготное по минорной аллели |
|
|
Метилентетрагидрофолатредуктаза (MTHFR) (Ala222Val C > T, rs 1801133) |
105 (55,6) |
70 (37,0) |
14 (7,4) |
|
Метилентетрагидрофолатредуктаза (MTHFR) (Glu429Ala A > C, rs 1801131) |
81 (42,9) |
93 (49,3) |
15 (8,0) |
|
Метионин-синтаза (MTR) (Asp919Gly A > G, rs 1805087) |
110 (58,2) |
71 (37,6) |
8 (4,2) |
|
Метионин-синтаза редуктаза (MTRR) (Ile22Мet, A > G, rs 1801394) |
43 (22,8) |
84 (44,4) |
62 (32,8) |
|
Транспортер фолатов (SLC19A1) (His27Arg, A > G, rs 1051266) |
46 (24,3) |
97 (51,4) |
46 (24,3) |
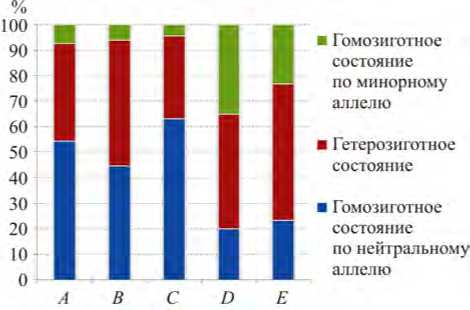
Рис. Распределение частоты (%) генотипов генов белков фолатного цикла: A – метилентетрагидрофолатредуктаза;
B – метилентетрагидрофолатредуктаза;
C – метионин-синтаза; D – метионин-синтаза редуктаза; E – транспортер фолатов центным методом на автоматическом иммунохеми-люминесцентном анализаторе Immulite-2000 (Siemens, Германия) с использованием оригинальных реактивов. Генетический полиморфизм генов фолатного цикла исследовали методом пиросеквенирования с использованием системы для генетического анализа «АмплиСенс® Пироскрин» «ФОЛАТ – скрин» (ФБУН «Центральный научно-исследовательский институт эпидемиологии»).
Исследовали частоту следующих SNP:
-
– мутация гена метилентетрагидрофолатредук-тазы (MTHFR) (Ala222Val C > T, rs 1801133);
-
– мутация гена метилентетрагидрофолатредук-тазы (MTHFR) (Glu429Ala A > C, rs 1801131);
-
– мутация гена метионин-синтазы (MTR) (Asp919Gly, A > G, rs 1805087);
-
– мутация гена метионин-синтазы редуктазы (MTRR) (Ile22Мet, A > G, rs 1801394);
-
– мутация гена транспортера фолатов (SLC19A1) (His27Arg, A > G, rs 1051266).
Частоту аллелей рассчитывали по уравнению Харди – Вайнберга [34].
Статистическую обработку полученных результатов проводили с помощью пакета программ Statistica v. 7 (StatSoft Inc., США). Для каждого массива данных рассчитывали параметры описательной статистики: среднюю арифметическую ( М ), стандартное отклонение ( SD ), медиану ( Me ) и интерквартильный диапазон ( LQ ; UQ ), а также минимальное ( min ) и максимальное ( max ) значения. Полученные результаты оценивались с использованием критерия Шапиро – Уилка. Использование критерия Шапиро – Уилка позволило отвергнуть нулевую гипотезу о нормальном распределении всех полученных результатов. Исходя из этого, для их сравнения использовали непараметрический критерий H – Краскела – Уоллиса.
За максимально приемлемую вероятность ошибки первого рода ( р ) принималась величина уровня статистической значимости, равная или меньшая 0,05.
Результаты и их обсуждение. Анализ распределения генотипов для SNP различных белков и ферментов фолатного цикла в исследуемой группе выявил существенное различие. Результаты представлены в таблице и проиллюстрированы на рисунке (табл. 1, рисунок).
Большинство исследованных SNP у гена MTHFR (rs 1801133 и rs 1801131) и гена MTR (rs 1805087) характеризовались гомозиготным состоянием по вариантам аллелей, преобладающим в популяции. Гомозиготное состояние генотипа по минорным аллелям регистрировалось в 7,5; 5,4 и 13,75 раза реже, чем гомозиготное состояние по нейтральным аллелям (табл. 1).
Для фермента метионин-синтазы редуктазы и белка-транспортера фолатов преобладало гетерозиготное состояние генотипа по изученным SNP при примерно одинаковом числе случаев гомозиготного состояния как для традиционного аллеля, так и для минорного (см. рисунок). Частота гомозиготного состояния по минорному и нейтральному (дикому) аллелю для транспортера фолатов была практически одинаковой, а для метионин-синтазы редуктазы частота гомозиготного состояния минорного аллеля в 1,44 раза превосходила таковую нейтрального (дикого) аллеля.
Результаты расчета частот нейтральных и минорных аллелей, рассчитанных по формуле Харди – Вайнберга, представлены в таблице (табл. 2).
Частота различных вариантов аллелей в изученной популяции существенно различалась для SNP гена MTHFR (rs 1801133 и rs 1801131) и гена MTR (rs 1805087) (табл. 3). Указанные SNP характеризовались значительным преобладанием частоты нейтрального аллеля над минорным. Так, для SNP гена MTHFR (rs 1801133) различие составило 2,86 раза, для SNP гена MTHFR (rs 1801131) – 2,07 раза. Наибольшие различия установлены для SNP гена MTR (rs 1805087): присутствие минорного аллеля регистрировалось в 3,34 раза реже, чем варианта, преобладающего в популяции.
В отличие от резко асимметричного распределения частоты аллелей для SNP ферментов MTHFR и MTR для белка-транспортера фолатов (SLC19A1) и фермента MTRR различия в частотном распределении вариантов аллелей выражены значительно меньше (см. табл. 2). Так, для белка-транспортера фолатов обнаружена практически равная частота нейтрального и минорного аллелей, а для метио-нин-синтазы редуктазы частота минорного аллеля даже превосходила в 1,22 раза частоту нейтрального аллеля.
При анализе 189 обследованных нами не обнаружено ни одного случая сочетания в генотипе обследованных гомозиготного состояния по SNP для двух минорных аллелей в гене MTHFR (табл. 3).
Результаты исследований концентрации Гц в сыворотке крови в зависимости от вариантов генетического полиморфизма изученных генов представлены в таблице (табл. 4).
Анализ зависимости концентрации Гц в сыворотке крови от SNP фолатного цикла показал статистически значимые различия лишь для SNP гена метитилентетрагидрофолатредуктазы (MTHFR) (Ala222Val C > T, rs 1801133). Уровень Гц в сыворотке крови гомозигот по минорному аллелю был в 1,276 раза выше, чем у гомозигот по нейтральному аллелю ( H = 11,27; р = 0,0036); средняя концентрация Гц в сыворотке крови у гетерозиготных носителей являлась промежуточной от значений лиц с гомозиготным состоянием (по традиционному и минорному аллелю) исследованного генетического полиморфизма.
Для остальных четырех исследованных однонуклеотидных полиморфизмов генов фолатного цикла не установлено статистически значимого их влияния на уровень Гц сыворотки крови ( р > 0,1).
Обнаруженные нами закономерности распределения частот аллелей генов фолатного цикла характеризуют популяционный состав населения, проживающего на исследуемой территории. Анализ сравнительной частоты исследуемых аллелей продемонстрировал в целом типичное распределение для населения европейской части Российской Федерации.
Анализ различий в частоте аллелей генов, обусловленных SNP, вероятно, определяет их влияние на приспособляемость (преимущества) носителей. Так, более высокая частота нейтральных аллелей, вероятно, обусловливает наличие ряда преимуществ у их носителей в конкретных условиях по сравнению с носителями минорных аллелей. В то же время практически одинаковая частота аллелей свидетельствует об отсутствии каких-либо преимуществ их носителей. Данный вывод наиболее вероятен для исследованных SNP гена белка – транспортера фолатов и SNP гена фермента метионин-синтазы редуктазы.
Таблица 2
Распределение относительной частоты нейтральных и минорных аллелей генов фолатного цикла у женщин Пермского края, n = 189
|
Вид однонуклеотидного полиморфизма генов фолатного цикла |
Частота аллелей |
|
|
нейтральный |
минорный |
|
|
Метилентетрагидрофолатредуктаза (MTHFR) (Ala222Val C > T, rs 1801133) |
0,7408 |
0,2592 |
|
Метилентетрагидрофолатредуктаза (MTHFR) (Glu429Ala A > C, rs 1801131) |
0,6746 |
0,3254 |
|
Метионин-синтаза (MTR) (Asp919Gly A > G, rs 1805087) |
0,7698 |
0,2302 |
|
Метионин-синтаза редуктаза (MTRR) (Ile22Мet, A > G, rs 1801394) |
0,4497 |
0,5503 |
|
Транспортер фолатов (SLC19A1) (His27Arg, A > G, rs 1051266) |
0,5 |
0,5 |
Таблица 3
Частота распределения SNP гена MTHFR среди всех обследованных
|
Параметр |
SNP MTHFR (Glu429Ala A > C, rs 1801131) |
|||
|
гомозиготы по нейтральному аллелю |
гетерозиготы |
гомозиготы по минорному аллелю |
||
|
SNP MTHFR (Ala222Val С > T, rs 1801133 ) |
Гомозиготы по нейтральному аллелю, % |
17,07 |
30,84 |
6,29 |
|
Гетерозиготы, % |
20,06 |
18,26 |
– |
|
|
Гомозиготы по минорному аллелю, % |
7,48 |
– |
– |
|
Таблица 4
Концентрация гомоцистеина (мкмоль/л) в сыворотке крови здоровых женщин ( n = 189) с различными вариантами однонуклеотидных полиморфизмов генов фолатного цикла
|
Вид однонуклеотидного полиморфизма |
Состояние генотипа по однонуклеотидному полиморфизму (SNP) |
p |
||
|
Гомозигота по нейтральному аллелю |
Гетерозигота |
Гомозигота по минорному аллелю |
||
|
Метилентетрагидрофолатредуктаза (MTHFR) (Ala222Val C > T, rs 1801133) |
6,642 ± 2,242 6,21 (5,09–7,54) 2,57–16,8 |
7,656 ± 2,885 6,915 (6,05–8,47) 3,6–21,2 |
8,476 ± 3,193 7,095 (6,74–9,46) 5,03–15,5 |
0,0036 ( Н = 11,27) |
|
Метилентетрагидрофолатредуктаза (MTHFR) (Glu429Ala A > C, rs 1801131) |
7,271 ± 2,576 6,85 (5,57–8,2) 2,57 – 16,8 |
6,998 ± 2,745 6,33 (5,24–7,63) 3,84 – 21,2 |
7,479 ± 2,245 6,86 (5,61–9,24) 4,43 – 11,6 |
0,27 (Н = 2,64) |
|
Метионин-синтаза (MTR) (Asp919Gly A > G, rs 1805087) |
7,275 ± 3,009 6,435 (5,37–8,03) 2,57 – 21,2 |
6,916 ± 1,901 6,79 (5,45–7,76) 3,6 – 12,9 |
7,59 ± 2,745 6,985 (5,745–8,745) 4,67 – 13,1 |
0,85 (Н = 0,32) |
|
Метионин-синтаза редуктаза (MTRR) (Ile22Мet, A > G, rs 1801394) |
7,019 ± 2,395 6,38 (5,1–8,24) 4,14 – 14,7 |
6,802 ± 2,281 6,585 (5,325–7,595) 2,57 – 16,7 |
7,723 ± 3,125 7,14 (5,61–8,77) 3,6 – 21,2 |
0,16 (Н = 3,72) |
|
Транспортер фолатов (SLC19A1) (His27Arg, A > G, rs 1051266) |
7,009 ± 1,996 6,825 (5,37–7,83) 3,84–12,4 |
7,171 ± 2,989 6,37 (5,43–7,6) 2,57–21,2 |
7,261 ± 2,41 6,905 (5,61–9,15) 3,6–13,1 |
0,66 (Н = 0,84) |
П р и м е ч а н и е :
в числителе дроби M ± SD , в знаменателе Me ( LQ – UQ ), под дробью минимальное и максимальное значение; р – по значению H критерия Краскела – Уолллиса.
Особый интерес представляет отсутствие гомозиготного сочетания двух SNP в геноме одного и того же белка. При анализе 189 обследованных нами не обнаружено ни одного случая сочетания в генотипе обследованных гомозиготного состояния по SNP для двух минорных аллелей в гене MTHFR. Вероятно, замена одного нуклеотида в геноме сопровождается заменой одной аминокислоты, что незначительно сказывается на функции кодируемого белка. Возможно, сочетание двух SNP, каждый из которых в отдельности незначительно влияет на функциональную активность белковой молекулы, приводит к синтезу дефектного белка с резким нарушением его свойств. В гомозиготном состоянии такое сочетание, вероятно, ведет к нарушению жизнеспособности организма. Также нами не обнаружено состояний генотипов гена MTHFR, при которых наблюдалось бы сочетание гомозиготного состояния SNP с гетерозиготным состоянием по другому SNP.
Концентрация Гц в сыворотке крови зависит от множества факторов, которые в зависимости от влияния на повреждение сосудистой стенки с определенной долей условности можно разделить на немодифицируемые и модифицируемые.
К модифицируемым факторам, способствующим развитию гипергомоцистеинемии, относят факторы, поддающиеся коррекции. Например, дефицит витаминов группы В (В 6 , В с и В 12 ), нарушения обмена веществ при заболеваниях почек и печени, характер питания, гормональный фон.
К немодифицируемым факторам риска формирования гипергомоцистеинемии относят пол, возраст, особенности генотипа.
Референтный диапазон для Гц в сыворотке крови составляет 5–15 мкмоль/л. Содержание Гц в сыворотке крови в диапазоне 15–30 мкмоль/л трактуется как умеренное повышение гомоцистеина, значения в диапазоне 30–100 мкмоль/л – как гипергомоцистеи-немия средней степени выраженности. Цифры концентрации Гц в сыворотке крови выше 100 мкмоль/л трактуются как тяжелая гипергомоцитеинемия.
Приведенный нами анализ SNP генов фолатно-го цикла позволил выявить ассоциацию некоторых из них с увеличением концентрации гомоцистеине-мии и риском формирования гипергомоцистеине-мии. В частности, гомозиготное состояние однонуклеотидной замены в гене метилен-тетрагидрофолат-редуктазы (MTHFR) (Ala222Val C > T, rs 1801133) следует расценить как независимый фактор риска формирования ГГц.
Несмотря на незначительное повышение Гц сыворотки крови (на 26,7 % от значений в группе с гомозиготным состоянием по нейтральному аллелю), данный эффект может вести к формированию клинических проявлений различных заболеваний и расцениваться как независимый фактор риска гипергомо-цистеинеми. В литературе последних лет приводятся данные о том, что значения концентрации Гц в сыворотке крови в диапазоне 12–15 мкмоль/л, что соответствует верхнему квартилю референсного диапазо- на, для лиц старше 50 лет следует расценивать не как норму, а как легкую ГГц [35].
Несмотря на то что в выполненном исследовании не обследовались пациенты старшей возрастной категории, полученные данные позволяют предположить формирование статистически значимой ГГц у пациентов с гомозиготным состоянием по наличию однонуклеотидной замены в гене метилентет-рагидрофолатредуктазы (MTHFR) (Ala222Val C > T, rs 1801133).
Другие исследованные полиморфизмы генов фолатного цикла не ассоциированы со статистически значимым увеличением концентрации гомоцистеина в сыворотке крови и не могут рассматриваться как факторы риска формирования гипергомоци-стеинеми.
Учитывая, что генетические форматоры являются немодифицируемыми факторами риска для пациентов с гомозиготным состоянием минорного аллеля гена метилентетрагидрофолатредуктазы (MTHFR) (Ala222Val C > T, rs 1801133), необходимо уделять большее внимание контролю модифицируемых факторов развития гипергомоцистеинемии.
Фолатный цикл является сложным метаболическим путем превращения серосодержащей аминокислоты гомоцистеина в метионин, катализируемый ферментами, коферментами которых являются производные витамина Bc – фолиевой кислоты. Ключевую роль в фолатном цикле играет фермент 5,10-метилен-тетрагидрофолатредуктаза (MTHFR) [36]. Наиболее частым ферментным дефектом, связанным с умеренным повышением уровня гомоцистеина, является мутация в гене, кодирующем MTHFR. В настоящее время описано несколько мутаций гена MTHFR, расположенного в локусе 1р36.3. Самой частой из них является замена нуклеотидов С677Т (в белке MTHFR – замещение аланина на валин), которая проявляется термолабильностью и снижением активности фермента MTHFR на 60 % [35, 36]. Другим вариантом полиморфизма гена MTHFR является замена нуклеотида аденина на цитозин в позиции 1298. Это приводит к замене остатка глутаминовой кислоты на остаток аланина в регуляторном домене фермента, что сопровождается небольшим снижением ферментативной активности. У лиц, гомозиготных по мутации А1298С, отмечается снижение активности гена MTHGR примерно до 35 % от нормы. Вероятно, такое снижение активности хоть и может вести к увеличению концентрации гомоцистеина, но на практике значимых изменений концентрации Гц не зарегистрировано.
Выводы. Женское население Пермского края характеризуется различной частотой распределения аллелей SNP генов фолатного цикла. Для исследованных SNP генов MTHFR и MTR характерно преобладание частоты нейтрального аллеля по сравнению с минорным. Для SNP генов метионин-синтазы редуктазы и гена белка транспортера фолатов не обнаружено существенных различий в частоте распределения исследованных аллелей.
Ни у одного из обследуемых лиц не обнаружено сочетания в геноме гомозиготных состояний по двум SNP гена MTHFR или гомозиготного состояния по одному SNP и гетерозиготного по другому.
Анализ исследованных SNP генов ферментов и белков фолатного цикла установил, что достоверное снижение концентрации гомоцистеина вызывает лишь SNP в гене MTHFR, наличие которого может рассматриваться как независимый фактор риска формирования гипергомоцистеинемии. У лиц, гомозиготных по SNP MTHFR (Ala222Val C > T, rs 1801133), отмечается увеличение среднего содержания гомоцистеина на 27,6 % по сравнению с гомозиготами по нейтральному аллелю. Другие исследованные полиморфизмы не сопровождались увеличением содержания гомоцистеина в сыворотке крови и не являются факторами риска увеличения концентрации Гц в сыворотке крови.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Полиморфизм генов фолатного цикла как фактор риска формирования гипергомоцистеинемии
- Reddy V.S., Trinath J., Reddy G.B. Implication of homocysteine in protein quality control processes // Biochimie. - 2019. - № 165. - Р. 19-31. DOI: 10.1016/j.biochi.2019.06.017
- Jakubowski H. Homocysteine Modification in Protein Structure/Function and Human Disease // Physiol. Rev. - 2019. - Vol. 99, № 1. - P. 555-604. DOI: 10.1152/physrev.00003.2018
- Alam S.F., Kumar S., Ganguly P. Measurement of homocysteine: a historical perspective // J. Clin. Biochem. Nutr. - 2019. - Vol. 65, № 3. - P. 171-177. DOI: 10.3164/jcbn.19-49
- Цыбиков Н.Н., Цыбикова Н.М. Роль гомоцистеина в патологии человека // Успехи современной биологии. - 2007. - Т. 127, № 5. - С. 471-481.
- Ubbink J.B. Assay methods for the measurement of total homocyst (e) ine in plasma // Semin. Thromb. Hemost. - 2000. - Vol. 26, № 3. - P. 233-241. DOI: 10.1055/s-2000-8468
- Ganguly P., Alam S.F. Role of homocysteine in the development of cardiovascular disease // Nutr. J. - 2015. - Vol. 14, № 6. - P. 10.
- DOI: 10.1186/1475-2891-14-6
- Маркеры эндотелиальной дисфункции: патогенетическая роль и диагностическое значение (обзор литературы) / Т.В. Степанова, А.Н. Иванов, Н.Е. Терешкина, Э.Б. Попыхова, Д.Д. Лагутина // Клиническая лабораторная диагностика. - 2019. - Т. 64, № 1. - С. 34-41.
- Yang Q., He G.W. Imbalance of Homocysteine and H2S: Significance, Mechanisms, and Therapeutic Promise in Vascular Injury // Oxid. Med. Cell. Longev. - 2019. - Vol. 2019. - P. 7629673.
- DOI: 10.1155/2019/7629673
- Болдырев А.А. Молекулярные механизмы токсичности гомоцистеина // Биохимия. - 2009. - T. 74, № 6. - C. 725-736.
- Clinical use and rational management of homocysteine, folic acid, and B vitamins in cardiovascular and thrombotic diseases / O. Stanger, W. Herrmann, K. Pietrzik, B. Fowler, J. Geisel, J. Dierkes, M. Weger // Z. Kardiol. - 2004. - Vol. 93, № 6. - P. 439-453.
- DOI: 10.1007/s00392-004-0075-3
- Changes of serum homocysteine levels during pregnancy and the establishment of reference intervals in pregnant Chinese women / Y. Yang, H. Jiang, A. Tang, Z. Xiang // Clin. Chim. Acta. - 2019. - № 489. - P. 1-4.
- DOI: 10.1016/j.cca.2018.11.026
- Biomarkers in pre-eclampsia: a novel approach to early detection of the disease / S. Masoura, I.A. Kalogiannidis, G. Gitas, A. Goutsioulis, E. Koiou, A. Athanasiadis, N. Vavatsi // J. Obstet. Gynaecol. - 2012. - Vol. 32, № 7. - P. 609-616.
- DOI: 10.3109/01443615.2012.709290
- Hyperhomocysteinemia is an independent risk factor of atherosclerosis in patients with metabolic syndrome / G. Piazzolla, M. Candigliota, M. Fanelli, A. Castrovilli, E. Berardi, G. Antonica, S. Battaglia, V. Solfrizzi, C. Sabbà, C. Tortorella // Diabetol Metab Syndr. - 2019. - Vol. 26, № 11. - P. 87.
- DOI: 10.1186/s13098-019-0484-0
- A relation of serum homocysteine, uric acid and C-reactive protein level in patients with acute myocardial infarction / M. Marković Boras, A. Čaušević, I. Brizić, I. Mikulić, M. Vasilj, N. Jelić Knezović // Med. Glas (Zenica). - 2018. - Vol. 15, № 2. - P. 101-108.
- DOI: 10.17392/956-18
- Tang Y., Geng D. Associations of plasma LP (a), Hcy and D-D levels with the subtype of ischemic cerebrovascular disease // Medicine (Baltimore). - 2019. - Vol. 98, № 11. - P. e14910.
- DOI: 10.1097/MD.0000000000014910
- Детский ишемический инсульт: вклад полиморфизма генов фолатного цикла и гипергомоцистеинемии / О.А. Львова, В.В. Гусев, О.П. Ковтун, И.В. Гаврилов, А.Н. Решетова, А.Э. Степанова, Е.С. Ворошилина // Сибирский медицинский журнал. - 2013. - Т. 28, № 3. - C. 34-40.
- Лобзин В.Ю., Литвиненко И.В., Емелин А.Ю. Гипергомоцистеинемия - фактор риска цереброваскулярного повреждения, нейродегенерации и прогрессирования нарушений когнитивных функций при деменциях // Вестник Российской военно-медицинской академии. - 2015. - Т. 52, № 4. - C. 100-105.
- Homocysteine metabolism in children with idiopathic nephrotic syndrome / M. Kundal, A. Saha, N.K. Dubey, K. Kapoor, T. Basak, G. Bhardwaj, V.S. Tanwar, S. Sengupta [et al.] // Clin. Transl. Sci. - 2014. - Vol. 7, № 2. - P. 132-136.
- DOI: 10.1111/cts.12145
- Тадтаева З.Г., Кацадзе Ю.Л. Полиморфизм гена метилентетрагидрофолатредуктазы, гипергомоцистеинемия и возможность медикаментозной коррекции при мигрени // Казанский медицинский журнал. - 2007. - Т. 88, № 1. - С. 16-20.
- Шевчук В.В., Малютина Н.Н. Ассоциация гомоцистеинемии с функциональным состоянием щитовидной железы у подростков в йоддефицитном регионе // Современные проблемы науки и образования. - 2012. - № 2. - С. 105.
- Al-Sadeq D.W., Nasrallah G.K. The Spectrum of Mutations of Homocystinuria in the MENA Region // Genes (Basel). - 2020. - Vol. 11, № 3. - P. 330.
- DOI: 10.3390/genes11030330
- Polymorphisms C677T and A1298C of MTHFR Gene: Homocysteine Levels and Prothrombotic Biomarkers in Coronary and Pulmonary Thromboembolic Disease / E. Lupi-Herrera, M.E. Soto-López, A.J. Lugo-Dimas, M.E. Núñez-Martínez, R. Gamboa, C. Huesca-Gómez, L.M. Sierra-Galán, V. Guarner-Lans // Clin. Appl. Thromb. Hemost. - 2019. - Vol. 25. - P. 1076029618780344.
- DOI: 10.1177/1076029618780344
- Homocysteine and Hyperhomocysteinaemia / B.L. Zaric, M. Obradovic, V. Bajic, M.A. Haidara, M. Jovanovic, E.R. Isenovic // Curr. Med. Chem. - 2019. - Vol. 26, № 16. - P. 2948-2961.
- DOI: 10.2174/0929867325666180313105949
- Sadiq W., Subhan M. Isolated Homocysteinemia Leading to Thromboembolism in Young Male with Normal Vitamin B12 and Folate Levels // Cureus. - 2017. - Vol. 9, № 12. - P. e1978.
- DOI: 10.7759/cureus.1978
- Inferior vena cava thrombus due to hyperhomocysteinemia / M. Tanaka, T. Taniguchi, N. Saito, T. Kimura // J. Cardiol. Cases. - 2018. - Vol. 18, № 5. - P. 168-170.
- DOI: 10.1016/j.jccase.2018.07.003
- Polymorphism in folate-metabolizing genes and risk of non-Hodgkin's lymphoma / A.S. Weiner, O.V. Beresina, E.N. Voronina, E.N. Voropaeva, U.A. Boyarskih, T.I. Pospelova, M.L. Filipenko // Leuk. Res. - 2011. - Vol. 35, № 4. - P. 509-515.
- DOI: 10.1016/j.leukres.2010.10.004
- A single-nucleotide polymorphism (rs1805087) in the methionine synthase (METH) gene increases the risk of prostate cancer / X. Zhang, J. Tang, N. Shen, K. Ren // Aging (Albany NY). - 2018. - Vol. 10, № 10. - P. 2741-2754.
- DOI: 10.18632/aging.101584
- Association between SNPs in genes involved in folate metabolism and preterm birth risk / B.J. Wang, M.J. Liu, Y. Wang, J.R. Dai, J.Y. Tao, S.N. Wang, N. Zhong, Y. Chen // Genet. Mol Res. - 2015. - Vol. 14, № 1. - P. 850-859.
- DOI: 10.4238/2015.February.2.9
- Polymorphisms in genes involved in folate metabolism as maternal risk factors for Down syndrome / C.A. Hobbs, S.L. Sherman, P. Yi, S.E. Hopkins, C.P. Torfs, R.J. Hine, M. Pogribna, R. Rozen, S.J. James // Am. J. Hum. Genet. - 2000. - Vol. 67, № 3. - P. 623-630.
- DOI: 10.1086/303055
- Association study of four polymorphisms in three folate-related enzyme genes with non-obstructive male infertility / H.C. Lee, Y.M. Jeong, S.H. Lee, K.Y. Cha, S.H. Song, N.K. Kim, K.W. Lee, S. Lee // Hum. Reprod. - 2006. - Vol. 21, № 12. - P. 3162-3170.
- DOI: 10.1093/humrep/del280
- Polymorphisms in folate-related enzyme genes in idiopathic infertile Brazilian men / M.M. Gava, E.A. Kayaki, B. Bianco, J.S. Teles, D.M. Christofolini, A.C. Pompeo, S. Glina, C.P. Barbosa // Reprod. Sci. - 2011. - Vol. 18, № 12. - P. 1267-1272.
- DOI: 10.1177/1933719111411729
- Гипергомоцистеинемия и полиморфизм генов фолатного обмена у здорового населения Пензенской области / Е.Р. Кулюцина, О.А. Левашова, А.Г. Денисова, Е.А. Дружинина // Здоровье и образование в XXI веке: журнал научных статей. - 2016. - Т. 18, № 2. - C. 640-645.
- Распределение генов фолатного цикла в популяции подростков г. Барнаула Алтайского края / Л.А. Строзенко, В.В. Гордеев, Ю.Ф. Лобанов, А.П. Момот, Е.Н. Воронина // Мать и дитя в Кузбассе. - 2015. - Т. 60, № 1. - С. 29-34.
- Айала Ф. Введение в популяционную и эволюционную генетику. - М.: Мир, 1984. - 232 с.
- The Hordaland Homocysteine Study: a community / H. Refsum, E. Nurk, A.D. Smith, P.M. Ueland, C.G. Gjesdal, I. Bjelland, A. Tverdal, G.S. Tell, O. Nygård, S.E. Vollset // J. Nutr. - 2006. -Vol. 136, № 6. - P. 1731-1740.
- DOI: 10.1093/jn/136.6.1731S
- Association of Two Methylenetetrahydrofolate Reductase Polymorphisms (rs1801133, rs1801131) with the Risk of Type 2 Diabetes in South-East of Iran / M. Poodineh, R. Saravani, M. Mirhosseini, S. Sargazi // Rep Biochem Mol Biol. - 2019. - Vol. 8, № 2. - P. 178-183.
- Reddy V.S., Trinath J., Reddy G.B. Implication of homocysteine in protein quality control processes. Biochimie, 2019, no. 165, pp. 19-31.
- DOI: 10.1016/j.biochi.2019.06.017
- Jakubowski H. Homocysteine Modification in Protein Structure/Function and Human Disease. Physiol. Rev., 2019, vol. 99, no. 1, pp. 555-604.
- DOI: 10.1152/physrev.00003.2018
- Alam S.F., Kumar S., Ganguly P. Measurement of homocysteine: a historical perspective. J. Clin. Biochem. Nutr., 2019, vol. 65, no. 3, pp. 171-177.
- DOI: 10.3164/jcbn.19-49
- Tsybikov N.N., Tsybikova N.M. A role homocysteine plays in human pathology. Uspekhi sovremennoi biologii, 2007, vol. 127, no. 5, pp. 471-481 (in Russian).
- Ubbink J.B. Assay methods for the measurement of total homocyst(e)ine in plasma. Semin. Thromb. Hemost., 2000, vol. 26, no. 3, pp. 233-241.
- DOI: 10.1055/s-2000-8468
- Ganguly P., Alam S.F. Role ofhomocysteine in the development of cardiovascular disease. Nutr. J., 2015, vol. 14, no. 6, p. 10.
- DOI: 10.1186/1475-2891-14-6
- Stepanova T.V., Ivanov A.N., Tereshkina N.E., Popykhova E.B., Lagutina D.D. Markers of endothelial dysfunction: pathogenetic role and diagnostic significance. Klinicheskaya laboratornaya diagnostika, 2019, vol. 64, no. 1, pp. 34-41 (in Russian).
- Yang Q., He G.W. Imbalance of Homocysteine and H2S: Significance, Mechanisms, and Therapeutic Promise in Vascular Injury. Oxid. Med. Cell. Longev., 2019, vol. 2019, pp. 7629673.
- DOI: 10.1155/2019/7629673
- Boldyrev A.A. Molecular mechanisms of homocysteine toxicity. Biokhimiya, 2009, vol. 74, no. 6, pp. 725-736 (in Russian).
- Stanger O., Herrmann W., Pietrzik K., Fowler B., Geisel J., Dierkes J., Weger M. Clinical use and rational management of homocysteine, folic acid, and B vitamins in cardiovascular and thrombotic diseases. Z. Kardiol., 2004, vol. 93, no. 6, pp. 439-453.
- DOI: 10.1007/s00392-004-0075-3
- Yang Y., Jiang H., Tang A., Xiang Z. Changes of serum homocysteine levels during pregnancy and the establishment of reference intervals in pregnant Chinese women. Clin. Chim. Acta., 2019, no. 489, pp. 1-4.
- DOI: 10.1016/j.cca.2018.11.026
- Masoura S., Kalogiannidis I.A., Gitas G., Goutsioulis A., Koiou E., Athanasiadis A., Vavatsi N. Biomarkers in pre-eclampsia: a novel approach to early detection of the disease. J. Obstet. Gynaecol., 2012, vol. 32, no. 7, pp. 609-616.
- DOI: 10.3109/01443615.2012.709290
- Piazzolla G., Candigliota M., Fanelli M., Castrovilli A., Berardi E., Antonica G., Battaglia S., Solfrizzi V., Sabbà C., Tortorella C. Hyperhomocysteinemia is an independent risk factor of atherosclerosis in patients with metabolic syndrome. Diabetol. Metab. Syndr., 2019, vol. 26, no. 11, pp. 87.
- DOI: 10.1186/s13098-019-0484-0
- Marković Boras M., Čaušević A., Brizić I., Mikulić I., Vasilj M., Jelić Knezović N. A relation of serum homocysteine, uric acid and C-reactive protein level in patients with acute myocardial infarction. Med. Glas. (Zenica), 2018, vol. 15, no. 2, pp. 101-108.
- DOI: 10.17392/956-18
- Tang Y., Geng D. Associations of plasma LP(a), Hcy and D-D levels with the subtype of ischemic cerebrovascular disease. Medicine (Baltimore), 2019, vol. 98, no. 11, pp. e14910.
- DOI: 10.1097/MD.0000000000014910
- L'vova O.A., Gusev V.V., Kovtun O.P., Gavrilov I.V., Reshetova A.N., Stepanova A.E., Voroshilina E.S. Ischemic stroke in children: the role of folate pathway genetic polymorphisms and hyperhomocysteinemia. Sibirskii meditsinskii zhurnal, 2013, vol. 28, no. 3, pp. 34-40 (in Russian).
- Lobzin V.Yu., Litvinenko I.V., Emelin A.Yu. Hyperhomocysteinemia - vascular damage, neurodegeneration and cognitive impairment progression risk factor. Vestnik Rossiiskoi voenno-meditsinskoi akademii, 2015, vol. 52, no. 4, pp. 100-105 (in Russian).
- Kundal M., Saha A., Dubey N.K., Kapoor K., Basak T., Bhardwaj G., Tanwar V.S., Sengupta S. [et al.]. Homocysteine metabolism in children with idiopathic nephrotic syndrome. Clin. Transl. Sci., 2014, vol. 7, no. 2, pp. 132-136.
- DOI: 10.1111/cts.12145
- Tadtaeva Z.G., Katsadze Yu.L. Gene polymorphism of methylene-tetrahydrofolatreductase, hyperhomocysteinaemia and possibilities of its correction in children with migraine. Kazanskii meditsinskii zhurnal, 2007, vol. 88, no. 1, pp. 16-20 (in Russian).
- Shevchuk V.V., Malyutina N.N. Gomotsisteinemya association with a functional condition of a thyroid gland at teenagers in the goiter region. Sovremennye problem nauki i obrazovaniya, 2012, no. 2, pp. 105 (in Russian).
- Al-Sadeq D.W., Nasrallah G.K. The Spectrum of Mutations of Homocystinuria in the MENA Region. Genes (Basel), 2020, vol. 11, no. 3, pp. 330.
- DOI: 10.3390/genes11030330
- Lupi-Herrera E., Soto-López M.E., Lugo-Dimas A.J., Núñez-Martínez M.E., Gamboa R., Huesca-Gómez C., Sierra-Galán L.M., Guarner-Lans V. Polymorphisms C677T and A1298C of MTHFR Gene: Homocysteine Levels and Prothrombotic Biomarkers in Coronary and Pulmonary Thromboembolic Disease. Clin. Appl. Thromb. Hemost., 2019, vol. 25, pp. 1076029618780344.
- DOI: 10.1177/1076029618780344
- Zaric B.L., Obradovic M., Bajic V., Haidara M.A., Jovanovic M., Isenovic E.R. Homocysteine and Hyperhomocysteinaemia. Curr. Med. Chem., 2019, vol. 26, no. 16, pp. 2948-2961.
- DOI: 10.2174/0929867325666180313105949
- Sadiq W., Subhan M. Isolated Homocysteinemia Leading to Thromboembolism in Young Male with Normal Vitamin B12 and Folate Levels. Cureus, 2017, vol. 9, no. 12, pp. e1978.
- DOI: 10.7759/cureus.1978
- Tanaka M., Taniguchi T., Saito N., T. Kimura Inferior vena cava thrombus due to hyperhomocysteinemia. J. Cardiol. Cases, 2018, vol. 18, no. 5, pp. 168-170.
- DOI: 10.1016/j.jccase.2018.07.003
- Weiner A.S., Beresina O.V., Voronina E.N., Voropaeva E.N., Boyarskih U.A., Pospelova T.I., Filipenko M.L. Polymorphism in folate-metabolizing genes and risk of non-Hodgkin's lymphoma. Leuk. Res., 2011, vol. 35, no. 4, pp. 509-515.
- DOI: 10.1016/j.leukres.2010.10.004
- Zhang X., Tang J., Shen N., Ren K. A single-nucleotide polymorphism (rs1805087) in the methionine synthase (METH) gene increases the risk of prostate cancer. Aging (Albany NY), 2018, vol. 10, no. 10, pp. 2741-2754.
- DOI: 10.18632/aging.101584
- Wang B.J., Liu M.J., Wang Y., Dai J.R., Tao J.Y., Wang S.N., Zhong N., Chen Y. Association between SNPs in genes involved in folate metabolism and preterm birth risk. Genet. Mol. Res., 2015, vol. 14, no. 1, pp. 850-859.
- DOI: 10.4238/2015.February.2.9
- Hobbs C.A., Sherman S.L., Yi P., Hopkins S.E., Torfs C.P., Hine R.J., Pogribna M., Rozen R., James S.J. Polymorphisms in genes involved in folate metabolism as maternal risk factors for Down syndrome. Am. J. Hum. Genet., 2000, vol. 67, no. 3, pp. 623-630.
- DOI: 10.1086/303055
- Lee H.C., Jeong Y.M., Lee S.H., Cha K.Y., Song S.H., Kim N.K., Lee K.W., Lee S. Association study of four polymorphisms in three folate-related enzyme genes with non-obstructive male in fertility. Hum. Reprod., 2006, vol. 21, no. 12, pp. 3162-3170.
- DOI: 10.1093/humrep/del280
- Gava M.M., Kayaki E.A., Bianco B., Teles J.S., Christofolini D.M., Pompeo A.C., Glina S., Barbosa C.P. Polymorphisms infolate-related enzyme genes in idiopathic infertile Brazilian men. Reprod Sci, 2011, vol. 18, no. 12, pp. 1267-1272.
- DOI: 10.1177/1933719111411729
- Kulyutsina E.R., Levashova O.A., Denisova A.G., Druzhinina E.A. Hyperhomocysteinemia and polymorphysm of folate metabolism genes in healthy population of Penza region. Zhurnal nauchnykh statei Zdorov'e i obrazovanie v XXI veke, 2016, vol. 18, no. 2, pp. 640-645 (in Russian).
- Strozenko L.A., Gordeev V.V., Lobanov Yu.F., Momot A.P., Voronina E.N. Distribution of genes in the folate cycle adolescent population of Barnaul, Altai region. Mat' i ditya v Kuzbasse, 2015, vol. 60, no. 1, pp. 29-34 (in Russian).
- Aiala F. Introduction to population and evolution genetics. Moscow, Mir Publ., 1984, 232 p. (in Russian).
- Refsum H., Nurk E., Smith A.D., Ueland P.M., Gjesdal C.G., Bjelland I., Tverdal A., Tell G.S., Nygård O., Vollset S.E. The Hordal and Homocysteine Study: a community. J. Nutr., 2006, vol. 136, no. 6, pp. 1731-1740.
- DOI: 10.1093/jn/136.6.1731S
- Poodineh M., Saravani R., Mirhosseini M., Sargazi S. Association of Two Methylenetetrahydrofolate Reductase Polymorphisms (rs1801133, rs1801131) with the Risk of Type 2 Diabetes in South-East of Iran. Rep. Biochem. Mol. Biol., 2019, vol. 8, no. 2, pp. 178-183.


