Полиморфизм генов фолатного обмена и тромботические осложнения у пациентов с функционально единственным желудочком сердца
Автор: Лугачева Ю.Г., Суслова Т.Е., Кулагина И.В., Кривощеков Е.В., Янулевич О.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.36, 2021 года.
Бесплатный доступ
Цель исследования: проанализировать связь носительства полиморфных вариантов генов фолатного обмена с развитием тромботических осложнений у пациентов с функционально единственным желудочком сердца (ФЕЖС) в ходе хирургического лечения.Материал и методы. В проведенной работе были обследованы 102 ребенка с ФЕЖС. Всем пациентам выполнялась хирургическая гемодинамическая коррекция (ГК) врожденного порока сердца (ВПС). При ретроспективном анализе историй болезни у обследованных пациентов с ФЕЖС тромбоз диагностирован в 12,7% случаев. При анализе полиморфизма гена фермента MTR А2756G выявлены значимые различия в группе пациентов с тромбозом в анамнезе и без него.Результаты. Нами установлено, что риск развития тромбоза связан с носительством гомозиготного генотипа 2756АА гена фермента MTR (отношение шансов - ОШ = 11,21; 95% доверительный интервал - ДИ: 1,39-89,96; p = 0,023).
Полиморфизм генов фолатного обмена, гомоцистеин, тромбоз, функционально единственный желудочек сердца
Короткий адрес: https://sciup.org/149139372
IDR: 149139372 | УДК: 575.174.015.3:616.124-008.63-06:616-005.6 | DOI: 10.29001/2073-8552-2021-36-4-86-91
Текст научной статьи Полиморфизм генов фолатного обмена и тромботические осложнения у пациентов с функционально единственным желудочком сердца
УДК 575.174.015.3:616.124-008.63-06:616-005.6
Lugacheva J.G., Suslova T.E., Kulagina I.V., Krivoshchekov E.V., Yanulevich O.S. Polymorphism of folate metabolism genes and thrombotic complications in patients with functionally single ventricle. The Siberian Journal of Clinical and Experimental Medicine. 2021;36(4):86–91.
Функционально единственный желудочек сердца (ФЕЖС) – это врожденный порок сердца (ВПС), который включает совокупность анатомических нарушений, требующих проведения последовательных этапов гемодинамической коррекции (ГК). Риск возникновения послеоперационного тромбоза ассоциируется с летальностью пациентов, что в свою очередь приводит хирургическое и терапевтическое лечение к неблагоприятным исходам. Новые возможности прогнозирования, оценки риска маркеров нарушения гомеостаза, в том числе генетических, приводящих к развитию тромбообразования, могут способствовать значительному снижению числа осложнений в послеоперационном периоде.
В формировании тромботических осложнений самостоятельное значение имеют нарушения в обмене фо-латного цикла, вызывающие гипергомоцистеинемию. Одной из причин повышения содержания гомоцистеина в плазме крови являются генетические изменения, обусловливающие снижение функциональной активности ферментов фолатного обмена [1].
Согласно данным литературы, исследования о распространенности генетических полиморфизмов ферментов фолатного обмена, сопряженных с риском развития тромботических состояний, и особенностях их фенотипического проявления у детей освещены недостаточно [2–4], особенно это касается пациентов с сердечно-сосудистыми заболеваниями [5, 6].
Целесообразность назначения молекулярно-генетического тестирования фолатного обмена в клинической практике остается спорной, что в большинстве случаев объясняется недостаточным числом исследований риска развития тромботического процесса с наличием определенных маркеров в генотипе пациента.
Цель исследования: проанализировать связь носительства полиморфных вариантов генов фолатного обмена с развитием тромботических осложнений у пациентов с ФЕЖС в ходе хирургического лечения.
Материал и методы
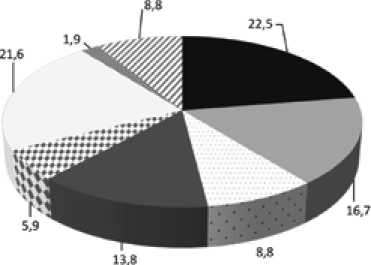
Были обследованы 102 пациента с ФЕЖС (47 девочек, 55 мальчиков), которые находились на госпитализации в отделении детской кардиологии НИИ кардиологии Томского НИМЦ. На рисунке 1 представлено распределение ВПС среди пациентов с различными видами порока. Медиана и интерквартильный интервал данных о возрасте детей с ВПС составляли 3,3 (0,6; 5,0) года.
। Двуниточный ясный желудочек Double mid left ventricle
-
■ ArpeЭМ 1рнкус«ида;п.1нно клапана Tricuspid valve atresia
Агрезим митрального клапана Mitral valve atresia
-
■ Нссиалансиронанках форма а1рмоес1Г1р«кулжр|Н)й коммуникации
Unbalanced alrio\enlncular cammunKation
* Двойное отхождение сосудов от правого желудочка Ikmblc outlet right ventricle
Сшыром 1И1юнлат|||| .к-вых отделов сердил HypopbMic кП-ЬеяП xyndrome
-
• Атрезна легочной артерии с шпактной м<жжелу;1очко1юй iK’pei«роджой Pulmniiary аиема with an пи ас I iiMenetiUicular septum
/ Другие вярнаиты Ф1ЖС (Nber SV variants
Рис. 1. Виды врожденного порока сердца у пациентов с функционально единственным желудочком сердца, %
Fig. 1. Types of congenital heart diseases in patients with a single ventricl, %e
Всем пациентам проводилась хирургическая ГК ВПС. На первом этапе выполнялась оптимизация легочного и системного кровотока, на втором этапе наложение двунаправленного кавопульмонального соединения (ДКПС). Третьим этапом коррекции ВПС являлось создание тотального кавопульмонального соединения (ТКПС).
Материалом исследования являлась цельная стабилизированная венозная кровь и данные ретроспективного анализа историй болезни пациентов с ФЕЖС. Образцы ДНК пациентов исследованы на наличие однонуклеотидных полиморфизмов генов ферментов фолатного цикла: MTHFR: 677C>T (метилентетрагидрофолатредуктаза), MTHFR: 1298A>C (метилентетрагидрофолатредуктаза), MTR: 2756А>G (В12-зависимая метионинсинтаза), MTRR: 66A>G (метионинсинтазаредуктаза). Проведение молекулярно-генетического тестирования осуществлялось однократно на разных этапах хирургической коррекции ВПС ( n = 102). Генотип определяли методом полимеразной цепной реакции с использованием амплификатора DT-96 и реагентов компании ДНК-Технология (Россия).
Статистическая обработка результатов исследования проводилась с помощью пакетов программ SPSS v.20.0, MedCalc v.17.9.7. Сравнение частот однонуклеотидных полиморфизмов генов ферментов фолатного цикла осуществлялось с помощью χ²-критерия Пирсона с поправкой Йейтса на непрерывность при условии, что все значения частот анализируемых признаков больше 5; точного критерия Фишера – при частотах больше или равных 5. При выявлении статистически значимых различий в группах детей вычислялось отношение шансов (ОШ) и его 95% доверительный интервал (ДИ). Для всех видов анализа статистически значимыми считались различия при уровне p < 0,05.
Результаты
Пациенты с ФЕЖС проходят многоэтапный и сложный путь хирургической коррекции ВПС. Риск развития тромботических осложнений высок на каждом этапе оперативного вмешательства, в послеоперационном периоде, а также при проведении инвазивных диагностических процедур, сопровождающихся катетеризацией сосудов.
При ретроспективном анализе историй болезни у обследованных пациентов с ФЕЖС было установлено, что за весь период проведения хирургической коррекции порока у 89 детей не отмечалось тромботических осложнений. Тромбоз был выявлен на разных этапах ГК в 12,7% случаев (13 из 102 детей). На первом этапе лечения тромбоз диагностирован у 3 пациентов (23,1%) с ФЕЖС, на втором этапе – у 8 (61,5%), на третьем этапе – у 2 пациентов (15,4%).
Локализация тромбоза была различной. У 9 из 12 пациентов с ФЕЖС диагностирован венозный тромбоз. Тромбоз подключичной вены выявлен у 3 пациентов с ФЕЖС, верхней полой вены – у 2, бедренной вены – у 3, подвздошной вены – у 1 ребенка. После оперативного вмешательства (наложение модифицированного Бле-лок – Тауссинг шунта – МБТШ) у 2 пациентов произошел тромбоз данного анастомоза. У 2 пациентов с ФЕЖС диагностирован тромбоз легочной артерии.
Распределение генотипов генов ферментов фолат-ного цикла было проанализировано в группе пациентов с тромбозом и без него. Результаты проведенного молекулярно-генетического тестирования представлены в таблице 1.
Частоты генотипов генов ферментов фолатного обмена MTHFR: 677C>T, MTHFR: 1298A>C, MTRR: 66A>G в анализируемых группах были сопоставимы. В группе пациентов с тромбозом гомозиготный генотип 2756АА гена фермента MTR встречался у 92,3% пациентов, без тромбоза – у 51,7% ( p = 0,006). Носителями гетерозиготного генотипа 2756AG являлись 7,7% пациентов с тромбозом, 43,8% – без тромбоза ( p = 0,014). Гомозиготный генотип 2756GG гена фермента MTR у пациентов с тромбозом не выявлен, тогда как у пациентов без тромбоза он диагностирован в 4,5% случаев ( p = 0,653).
Таблица 1. Частота генотипов генов ферментов фолатного обмена у пациентов с функционально единственным желудочком сердца, %
Table 1. Genotype frequencies of genes of folate metabolism enzymes in patients with single ventricle, %
|
Гены Gene |
Генотип Genotype |
Пациенты с ФЕЖС Patients with SV |
p |
|
|
С тромбозом, n = 13 With thrombosis, n = 13 |
Без тромбоза, n = 89 Without thrombosis, n = 89 |
|||
|
MTHFR |
677CC |
10 (76,9) |
48 (53,9) |
0,143 |
|
677CT |
2 (15,4) |
35 (39,3) |
0,126 |
|
|
677TT |
1 (7,7) |
6 (6,7) |
0,899 |
|
|
MTHFR |
1298AA |
4 (30,8) |
41 (46,1) |
0,378 |
|
1298AC |
8 (61,5) |
45 (50,6) |
0,559 |
|
|
1298CC |
1 (7,7) |
3 (3,4) |
0,460 |
|
|
MTR |
2756AA |
12 (92,3) |
46 (51,7) |
0,006 |
|
2756AG |
1 (7,7) |
39 (43,8) |
0,014 |
|
|
2756GG |
0 |
4 (4,5) |
0,653 |
|
|
MTRR |
66AA |
2 (15,4) |
17 (19,1) |
0,748 |
|
66AG |
8 (61,5) |
50 (56,2) |
0,773 |
|
|
66GG |
3 (23,1) |
22 (24,7) |
0,898 |
|
Примечание: n – количество обследованных пациентов, p – статистическая значимость различий. Note: n – number of examined patients, p – statistical significance of differences.
При анализе связи носительства полиморфных вариантов генов фолатного обмена с риском развития тромбоза получены результаты, представленные в таблице 2. У пациентов с ФЕЖС как в случае гомозиготного носительства генотипа 677TT гена фермента MTHFR (ОШ = 1,15; 95% ДИ: 0,13–10,42; p = 0,899), так и в случае полиморфной замены генов ферментов MTHFR: 1298A>C, MTRR: 66A>G у пациентов с ФЕЖС не связано с риском развития тромботических осложнений. При этом нами установлено, что у пациентов с ФЕЖС риск развития тромбоза связан с носительством гомозиготного генотипа 2756АА MTR (ОШ = 11,21; 95% ДИ: 1,39–89,96; p = 0,023).
Таблица 2. Связь носительства полиморфных вариантов генов фо-латного обмена с риском развития тромбоза у пациентов с функционально единственным желудочком сердца
Table 2. Associations of polymorphic variants in the folate metabolism genes carriage with the risk of thrombosis in patients with single ventricle
|
Гены Genes |
Генотип Genotype |
Отношение шансов Odds ratio |
p |
|
MTHFR |
677CC |
2,84 (0,7311,05) |
0,130 |
|
677CT |
0,28 (0,061,34) |
0,111 |
|
|
677TT |
1,15 (0,1310,42) |
0,899 |
|
|
MTHFR |
1298AA |
0,52 (0,151,81) |
0,305 |
|
1298AC |
1,56 (0,475,15) |
0,462 |
|
|
1298CC |
2,38 (0,2324,85) |
0,466 |
|
|
MTR |
2756AA |
11,21 (1,3989,96) |
0,023 |
|
2756АG |
0,11 (0,010,85) |
0,035 |
|
|
2756GG |
0,70 (0,0313,82) |
0,817 |
|
|
MTRR |
66AA |
0,77 (0,163,80) |
0,748 |
|
66AG |
1,25 (0,384,12) |
0,716 |
|
|
66GG |
0,91 (0,233,62) |
0,898 |
Примечание: p – статистическая значимость. В скобках (95% ДИ) – 95% доверительный интервал.
Note: p – statistical significance. In brackets (95% CI) – 95% confidence interval
Обсуждение
У пациентов с ВПС факторами, обусловливающими повышенное тромбообразование, могут быть повторные хирургические вмешательства, многократные катетерные процедуры, изменения в профиле кровотока из-за пассивного кровообращения. Применение синтетических материалов, таких как сосудистые протезы, клапаны, также приводит к активации механизмов свертывающей системы крови. Нельзя оставить без внимания и такие факторы, как генетически обусловленные нарушения со стороны системы гемостаза, снижение функциональной активности антикоагулянтного звена или фибринолитической системы. Большинство исследователей считают необходимым дальнейшее изучение факторов риска развития тромботических осложнений, в первую очередь, генетических [5, 7].
Носительство генетических полиморфизмов, ассоциированных с изменениями функциональной активности ферментов фолатного обмена, рассматривают как одну из причин развития тромбоза. Наиболее часто обсуждаемым ферментным дефектом, который связан с повышенным уровнем гомоцистеина в плазме крови, является полиморфизм гена, кодирующего метилентетрагидрофо-латредуктазу, В12-зависимую метионинсинтазу и метио-нинсинтазуредуктазу, которые участвуют в фолатном обмене. Повышение уровня гомоцистеина в плазме крови сопровождается как повреждением эндотелия сосудов, так и угнетающим действием на естественные биологические антикоагулянты, выделяемые сосудистой стенкой, – тромбомодулин, антитромбин III, гепарин, простациклин. Подавление синтеза тромбомодулина приводит к нарушению процесса активации тромбином естественных антикоагулянтов (протеинов C и S), в норме оказывающих прессорное воздействие на активность факторов Va и VIIIa. В результате V фактор свертывания крови становится нечувствительным к действию протеина С. Описанные процессы способствуют дополнительному повышению коагуляционных свойств крови, увеличивая тем самым риск развития тромботических осложнений.
Полиморфизм гена фермента фолатного цикла MTHFR в позиции C677T наследуется по аутосомно-рецессивному типу. Изменения активности данного фермента наиболее выражены у носителей гомозиготного генотипа 677 ТТ метилентетрагидрофолатредуктазы. Активность фермента снижена на 70% у гомозигот 677TT гена фермента MTHFR , а у носителей гетерозиготного 677CT генотипа – на 35% [1]. Снижение активности фермента метилентетрагидрофолатредуктазы приводит к легкой или умеренной гипергомоцистеине-мии, которая может запускать нарушения в свертывающей системе крови. Ранее в нашей работе у пациентов с ФЕЖС было показано, что содержание гомоцистеина в плазме крови у носителей 677ТТ генотипа гена фермента MTHFR был значимо выше по сравнению с носителями генотипа 677СС – 9,0 мкмоль/л ( p = 0,020) [8]. Мы сделали вывод, что носительство гомозиготного генотипа 677TT у пациентов с ФЕЖС ассоциировано с повышенным содержанием гомоцистеина в плазме крови. У детей содержание гомоцистеина в плазме крови значительно ниже, чем у взрослых. Физиологической нормой у детей до 12 лет независимо от пола считается уровень до 5 мкмоль/л [9].
П олиморфная замена А1298 C гена фермента фолат-ного цикла MTHFR снижает его активность, хотя и не так значительно, как при полиморфизме С677Т MTHFR . Сочетания гетерозиготных компаундов гена MTHFR СТ677 и гена MTHFR АС1298 снижают активность фермента и повышают содержание гомоцистеина в плазме крови [1].
В литературе обращается внимание на снижение функциональной активности фермента В12-зависимой метионинсинтазы MTR А2756G , сопровождающееся повышением уровня гомоцистеина в плазме крови. Значимость полиморфной замены А2756G гена фермента MTR описана в группе пациентов и связана с патологией развития плода, а именно с повышением риска развития синдрома Дауна, незаращением нервной трубки. Ранее в нашей работе мы установили, что у носителей гомозиготного генотипа 2756АА гена фермента MTR и 677CT/ ТT гена фермента MTHFR содержание гомоцистеина в плазме крови составило 8,2 мкмоль/л [8]. Комбинация данных полиморфизмов является факторами риска ги-пергомоцистеинемии у пациентов с ишемическим инсультом в корейской популяции [12].
Полиморфизм A66G гена фермента фолатного цикла MTRR в 4 раза снижает активность данного фермента. Влияние полиморфной замены увеличивается на фоне дефицита витамина В12. Полиморфизм A66G гена фермента фолатного цикла MTRR также усиливает гипер-гомоцистеинемию, вызываемую полиморфной заменой C677T MTHFR [1].
Мы проанализировали риск развития тромботических осложнений у пациентов с ФЕЖС с тромбозами в анамнезе и без него. Многими авторами описывается связь гомозиготного генотипа 677ТТ MTHFR с риском развития венозных и артериальных тромбозов [1, 10]. U. Nowak-Gottl и соавт. продемонстрировали, что носительство только 677TT гена фермента MTHFR повышает риск развития ишемического инсульта у детей в 2,6 раз (ОШ = 2,6; 95% ДИ: 1,5–4,5) [11]. В работах отдельных авторов у детей носительство гомозиготного генотипа 677TT гена фермента MTHFR не влияло на риск развития церебральных венозных тромбозов (ОШ = 1,2; 95% ДИ: 0,2–6,9) [12] и (ОШ = 1,0; 95% ДИ: 0,3–3,6) [13]. В нашем исследовании носительство гомозиготного генотипа TT гена фермента MTHFR у пациентов с ФЕЖС не связано с риском развития тромботических осложнений (ОШ = 1,15; 95% ДИ: 0,13–10,42; p = 0,899).
В представленной нами ранее работе анализ частоты генотипов генов ферментов фолатного цикла у пациентов с ФЕЖС был сопоставим с группой практически здоровых детей [8]. Распределение частоты генотипов гена фермента MTR А 2756G в группе пациентов с ФЕЖС без тромбоза соответствовало группе практически здоровых детей. В результате проведенного анализа частота генотипов гена фермента MTR А 2756G статистически значимо различалась у пациентов с тромбозом в анамнезе и без него. Мы установили, что риск развития тромбоза связан с носительством гомозиготного генотипа 2756АА гена фермента MTR (ОШ = 11,21; 95% ДИ: 1,39–89,96; p = 0,023). В литературе мы не нашли подтверждающих данных, связывающих носительство генотипа 2756АА гена фермента MTR с риском развития тромботических осложнений.
Список литературы Полиморфизм генов фолатного обмена и тромботические осложнения у пациентов с функционально единственным желудочком сердца
- Azzini E., Ruggeri S., Polito A. Homocysteine: Its possible emerging role in at-risk population groups. Int. J. Mol. Sciences. 2020;21(4):1421. DOI: 10.3390/ijms21041421.
- Строзенко Л.А., Лобанов Ю.Ф., Черепанова Л.А., Колесникова М.А., Снигирь O.A., Королева Е.А. и др. Качество жизни подростков - носителей полиморфизмов генов фолатного цикла. Российский педиатрический журнал. 2017;20(l):11-18. DOI: 10.18821/1560-95612017-20-1-11-18.
- Klaassen I.L.M., van Ommen C.H., Middeldorp S. Manifestations and clinical impact of pediatric inherited thrombophilia Irene. Blood. 2015;125(7):1073-1077. DOI: 10.1182/blood-2014-05-536060.
- Yang J.Y.K., Chan A.K.C. Pediatric thrombophilia. Pediatr. Clin. North. Am. 2013;60(6):1443-1462. DOI: 10.1016/j.pcl.2013.09.004.
- Alioglu B., Avci Z., Tokel K., Atac F.B., Ozbek N. Thrombosis in children with cardiac pathology: analysis of acquired and inherited risk factors. Blood Coagul. Fibrinolysis. 2008;19(4):294-304. DOI: 10.1097/ MBC.0b013e3282fe73b1.
- Malbora B., Ozbek N., Avci Z., Verdi H., Alioglu B., Varan B. et al. Role of thrombophilic mutations in childhood cardiac and great vessel thrombosis. Journal of Pediatric Sciences. 2014;6:e218.
- De Leval M.R., Deanfield J.E. Four decades of Fontan palliation. Nat. Rev. Cardiol. 2010;7(9):520-527. DOI: 10.1038/nrcardio.2010.99.
- Лугачева Ю.Г., Кулагина И.В., Ковалев Л.А., Кривощеков Е.В., Яну-левич О.С., Плотникова И.В. и др. Распределение аллельных вариантов генов ферментов фолатного цикла и уровень гомоцистеина у пациентов с врожденными пороками сердца с функционально единственным желудочком. Российский вестник перинатологии и педиатрии. 2015;60(6):55-59.
- Березовская Т.С., Мироманова Н.А. Диагностическое значение определение гомоцистеина в сыворотке крови у детей при ней-роинфекциях. Журнал инфектологии. 2018;10(1):42-46. DOI: 10.22625/2072-6732-2018-10-1-42-46.
- Kenet G., Lutkhoff L.K., Albisetti M., Bernard T., Bonduel M., Brandao L. et al. Impact of thrombophilia on risk of arterial ischemic stroke or cerebral si-nonenosus thrombosis in neonates and children: A systematic review and meta-analysis of observational studies. Circulation. 2010;121(16):1838-1847. DOI: 10.1161/CIRCULATIONAHA.109.913673.
- Nowak-Gottl U., Janssen V., Manner D. Venous thromboembolism in neonates and children—update 2013. Thromb. Res. 2013;131(1):S39-S41. DOI: 10.1016/S0049-3848(13)70019-7.
- Kim O.J., Hong S.P., Ahn J.Y., Hong S.H., Hwang T.S., Kim S.O. et al. Influence of combined methionine synthase (MTR 2756A>G) and meth-ylentetrahydrofolate reductase (MTHFR 677 C>T) polymorphisms to plasma homocysteine levels in Korean patients with ischemic stroke. Yonsei Med. J. 2007;48(2):201-209. DOI: 10.3349/ymj.2007.48.2.201.
- Miller S.P., Wu Y.W., Lee J., Lammer E.J., Iovannisci D.M., Glidden D.V. et al. Candidate gene polymorphisms do not differ between newborns with stroke and normal controls. Stroke. 2006;37(11):2678-2683. DOI: 10.1161/01.STR.0000244810.91105.c9.
- Лугачева Ю.Г., Кулагина И.В., Ковалев И.А., Кривощеков Е.В., Януле-вич О.С., Суслова Т.Е. Факторы риска тромботических осложнений у пациентов с функционально единственным желудочком сердца. Российский вестник перинатологии и педиатрии. 2019;64(2):68-74. DOI: 10.21508/1027-4065-2019-64-2-68-74.


