Полиморфизм генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина в связи с яичной продуктивностью у кур породы полтавская глинистая
Автор: Кулибаба Р.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетическая структура популяций
Статья в выпуске: 2 т.50, 2015 года.
Бесплатный доступ
В основе геномной селекции лежит изучение полиморфизма целевых генов, аллельные варианты которых связаны с продуктивными качествами животных. Аллельные варианты функциональных генов возникают в результате различных модификаций нуклеотидного состава, таких как точечные мутации (однонуклеотидный полиморфизм, single nucleotide polymorphism - SNP), инсерции/делеции (indel) и т.д. В любом случае выявление полиморфизма и последующее изучение его корреляции с продуктивными признаками служат основой дальнейшей направленной селекции. Наиболее интересен поиск полиморфизма в генах, которые кодируют регуляторные белки, участвующие в контроле роста и дифференцировки, в частности гормоны. В свою очередь, физиологический эффект любого гормона напрямую зависит от его рецептора, что определяет целесообразность изучения полиморфизма генов, кодирующих как сами гормоны, так и их рецепторы. В Украине не проводилось исследований связи между полиморфизмом перечисленных генов и продуктивными качествами кур отечественной селекции, что во многом определяет актуальность и новизну выполненной работы. Популяцию кур яично-мясной породы полтавская глинистая (линия 14, n = 98, лабораторный виварий Государственной опытной станции птицеводства Национальной академии аграрных наук Украины, Харьковская обл.) изучили по распределению частот аллелей и генотипов по локусам GH (гормон роста), GHR (рецептор гормона роста), PRL (пролактин) и PRLR (рецептор пролактина). Полиморфизм генов определяли с использованием ПЦР-ПДРФ анализа (полиморфизм длин рестрикционных фрагментов - PCR-RFLP, restriction fragment length polymorphism) и посредством сравнительного анализа длин амплифицированных фрагментов при изучении инсерции в локусе пролактина. Показано, что гены гормона роста, рецептора гормона роста и пролактина в опытной популяции кур являются полиморфными. По гену пролактина ( PRL -AluI) частота аллеля C составила 0,372; аллеля T - 0,628; по гену гормона роста ( GH -MspI, 1-й интрон) частота аллеля A - 0,908; B - 0,020; C - 0,072; по гену гормона роста ( GH -SacI, 4-й интрон) частота аллеля A - 0,036; B - 0,964; по гену рецептора гормона роста ( GHR -NspI) частота аллеля A - 0,280; B - 0,720. По всем изученным полиморфным локусам популяция кур породы полтавская глинистая находилась в состоянии генетического равновесия по Харди-Вайнбергу. Гены пролактина (по наличию инсерции в промоторном участке) и рецептора пролактина оказались мономорфными. Также была изучена связь различных генотипов по пролактину, гормону роста и рецептору гормона роста с показателями яичной продуктивности. Выявлены достоверные различия в показателях продуктивности у особей с разными генотипами по локусам пролактина ( PRL -AluI) и гормона роста ( GH -SacI). Так, у кур с генотипом CC - PRL яичная продуктивность за 12 нед превышала таковую у особей с генотипом TT - PRL и равнялась соответственно 75,38±2,33 и 67,82±1,21 шт. (P
Пцр, полиморфизм, яичная продуктивность, гормон роста, пролактин, куры
Короткий адрес: https://sciup.org/142133580
IDR: 142133580 | УДК: 636.52/.58:575.17 | DOI: 10.15389/agrobiology.2015.2.198rus
Текст научной статьи Полиморфизм генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина в связи с яичной продуктивностью у кур породы полтавская глинистая
В современной генетике домашней птицы все большее распространение получают молекулярно-генетические методы. Будучи до недавнего времени своеобразной экзотикой, молекулярно-генетические маркеры стали обыденным инструментом при генетико-селекционных исследованиях (1). Повсеместное распространение ДНК-технологий позволило создать предпосылки для проведения селекции птицы на принципиально новом 198
уровне, учитывая все возможности, которые создаются при непосредственной работе с наследственным материалом.
В основе геномной селекции лежит изучение полиморфизма целевых генов, аллельные варианты которых связаны с продуктивными качествами животных. Аллельные варианты функциональных генов возникают в результате различных модификаций нуклеотидного состава, таких как точечные мутации (однонуклеотидный полиморфизм, single nucleotide polymorphism — SNP), инсерции/делеции (indel) и т.д. В любом случае выявление полиморфизма и последующее изучение его связи с продуктивными признаками служат основой дальнейшей направленной селекции. Все вышеизложенное в полной мере относится и к птицеводству (1).
Наиболее интересен поиск полиморфизма в генах, продукты которых участвуют в регуляции различных функций, прежде всего связанных с обеспечением роста и дифференцировки (2). К таким объектам относятся гены, кодирующие регуляторные белки, в частности гормоны. В свою очередь, физиологический эффект любого гормона напрямую зависит от его рецептора, что определяет целесообразность изучения полиморфизма генов, кодирующих как сами гормоны, так и их рецепторы.
С этой точки зрения в генетике птицы в качестве одних из наиболее перспективных генов-кандидатов для изучения полиморфизма и связи аллельных вариантов с продуктивными качествами птицы рассматриваются гены гормона роста, пролактина, а также их рецепторов (3, 4).
Гормон роста и пролактин относятся к классу пептидных гормонов с широким спектром регулируемых функций (5). Так, гормон роста принимает непосредственное участие в регуляции роста и дифференцировки различных типов тканей организма. Наряду с этим пролактин у птиц принимает участие в регуляции репродуктивного цикла, будучи своеобразным инициатором проявления насиживания (увеличение концентрации плазматического пролактина приводит к постепенному снижению интенсивности, а затем и к полному прекращению яйцекладки) (6, 7).
Ген гормона роста ( GH ) , расположенный в 27-й хромосоме, содержит 5 экзонов, 4 интрона при общей длине ~ 4,35 т.п.н. Показано наличие различных SNP (G662A, T3094C, C3199T и т.д.) в разных участках гена (интроны, экзоны и т.д.) (8). Выявлена связь аллельных вариантов с продуктивными признаками (яичная и мясная продуктивность) (9). Отмечена позитивная корреляция SacI+ аллеля (4-й интрон) с показателями резистентности к болезни Марека, в свою очередь MspI-полиморфизм в 1-м интроне связан с яичной продуктивностью птицы (10, 11).
Ген рецептора гормона роста ( GHR ) содержит 10 экзонов и 9 интронов, общая длина — ~ 130,33 т.п.н., расположен в Z-хромосоме, что определяет его гемизиготное состояние у самок птицы. Показано наличие нескольких различных типов SNP (G565A, A1512T и т.д.), затрагивающих интронную и экзонную части, а также нетранслируемые 5‘- и 3‘-участки гена (8, 12, 13). Выявлена связь аллельных вариантов гена GHR с показателями качества скорлупы, живой массы, а также с карликовостью кур.
Ген пролактина (PRL) включает 5 экзонов и 4 интрона, общая длина --6,14 т.п.н., находится во 2-й хромосоме. Показан полиморфизм по наличию инсерции в промоторном участке гена, а также несколько SNP (14, 15). Выявлена связь различных аллельных вариантов гена пролактина с показателями яичной продуктивности у кур разных пород, с проявлением насиживания и т.д. Например, наличие инсерции размером 24 п.н. положительно коррелирует с повышенной яйценоскостью и отрицательно — с проявлением насиживания (16). В гене пролактина описана транзиция цитозина в тимин в положении -2402, установлена положительная связь яйценоскости с CC-генотипом (17). В целом, принимая во внимание важную роль пролактина в регуляции репродуктивного цикла птицы, можно отметить особые перспективы изучения полиморфизма этого гена, в первую очередь в связи с яичной продуктивностью (18).
Ген рецептора пролактина ( PRLR ) содержит 12 экзонов, 11 интронов, общая длина составляет ~ 20,89 т.п.н., расположен, как и ген рецептора гормона роста, в Z-хромосоме. Показано наличие SNP в различных участках гена и их связь с продуктивными признаками кур. Так, аллельный вариант BamHI+ по 5-му экзону гена положительно коррелирует с яичной продуктивностью (3).
В Украине не проводилось исследований связи между полиморфизмом перечисленных генов и продуктивными качествами кур отечественной селекции, что во многом определяет актуальность и новизну выполненной работы.
Исходя из вышеизложенного, цель представляемой работы заключалась в изучении генетической структуры популяции у кур породы полтавская глинистая по локусам гормона роста, рецептора гормона роста, пролактина, рецептора пролактина, а также в выявлении связи между аллельными вариантами перечисленных генов и яичной продуктивностью.
Методика. Для проведения исследований была использована птица украинской селекции — куры яично-мясные породы полтавская глинистая, линия 14 ( n = 98), содержащиеся в лабораторном виварии опытной станции. ДНК выделяли из образцов крови, которые отбирали из гребня с помощью скарификатора на стерильную фильтровальную бумагу. Каждый образец подсушивали, маркировали и индивидуально упаковывали для предотвращения контаминации. При выделении ДНК пользовались коммерческим набором реагентов «ДНК-сорб-В» («АмплиСенс», Россия). Успешное выделение необходимой для анализа ДНК оценивали с помощью электрофореза в 0,7 % агарозном геле (CSL-AG100, «Cleaver Scientific», Великобритания) при 200 V в течение 5 мин.
Ген пролактина изучали по двум показателям — наличию инсер-ции размером 24 п.н. в промоторном участке гена (24 indel) и однонуклеотидному полиморфизму (транзиция цитозина в тимин) в положении -2402 (C-2402T) (эндонуклеаза рестрикции AluI). В гене рецептора пролактина оценивали BamHI-полиморфизм в 5-м экзоне. Ген гормона роста, как и в случае пролактина, исследовали по двум показателям — MspI-полиморфизму в 1-м интроне и SacI-полиморфизму в 4-м интроне. В гене рецептора гормона роста определяли транзицию цитозина в тимин в 5-м интроне (эндонуклеаза рестрикции NspI).
При амплификации были использованы следующие нуклеотидные последовательности праймеров: для PRL (24 indel) — 5 ‘ -TTTAA-TATTGGTGGGTGAAGAGACA-3 ’ и 5 ‘ -ATGCCACTGATCCTCGAAAACTC-3 ‘ (14); для PRL (C-2402T) — 5 ‘ -AGAGGCAGCCCAGGCATTTTAC-3 ‘ и 5 ‘ -CCTGGGTCTGGTTTGGAAATT-3 ’ (14); для GH (1-й интрон) — 5 ‘ -ATCC-CCAGGCAAACATCCTC-3 ’ и 5 ‘ -CCTCGACATCCAGCTCACAT-3 ‘ (19); для GH (4-й интрон) — 5 ‘ -CTAAAGGACCTGGAAGAAGGG-3 ‘ и 5 ‘ -AACTTGTC-GTAGGTGGGTCTG-3 ’ (11); для PRLR (5-й экзон) — 5 ‘ -TTGTCTGCTTTGA-TTCATTTCC-3 ’ и 5 ‘ -TGCATTTCATTCTTCCCTTTTT-3 ‘ (3); для GHR (5-й интрон) — 5 ‘ -ACGAAAAGTGTTTCAGTGTTGA-3 ‘ и 5 ‘ -TTTATCCCGTGTTCT-CTTGACA-3 ’ (20).
ПЦР проводили с использованием реагентов DreamTaq PCR Master Mix («Thermo Scientific», США) с помощью программируемого термо-200
циклера Терцик («ДНК-технология», Россия) по соответствующим программам: один цикл — денатурация 5 мин при 94 °C; 35 циклов — денатурация 45 с при 94 °C, отжиг 45 с при 54 °C для PRL (24 indel), 62 °C для PRL (C-2402T), 56 °C для PRLR (5-й экзон) и GH (4-й интрон), 55 °C для GH (1-й интрон) и 60 °C для GHR (5-й интрон), элонгация 60 с при 72 °C; один цикл — финальная элонгация 10 мин при 72 °C. Объем реакционной смеси составлял 20 мкл, концентрация праймеров для каждого локуса — 0,2 мкМ.
Обработку амплифицированных фрагментов эндонуклеазами рестрикции проводили согласно прилагаемым инструкциям (FastDigest, «Thermo Scientific», C0A). Продукты рестрикции разделяли в 1,5 % агарозном геле (CSL-AG100, «Cleaver Scientific», Великобритания) при напряжении 150 V в течение 40 мин. Визуализацию проводили с использованием бромистого этидия в ультрафиолетовом свете. Размер рестрикционных фрагментов определяли с использованием маркеров молекулярных масс М-50 и М-100 («ИзоГен», Россия).
Для генотипирования особей по каждому из локусов сопоставляли длины рестрикционных фрагментов на электрофореграммах.
На основе полученных данных рассчитывали фактическое (O) и теоретическое (E) распределение генотипов, частоты генотипов и аллелей, соответствие генетическому равновесию популяции по Харди-Вайнбергу методом х 2, фактическую (Ho) и теоретическую (He) гетерозиготность, общее число аллелей (Na), эффективное число аллелей (ne), индекс фиксации Райта (Fis) согласно общепринятым методикам (21). Также проводили учет показателей яичной продуктивности кур: En12 и Ещ0 (egg number) — число яиц соответственно за 12 и 40 нед продуктивного периода; Ew30 и Ew52 (egg weight) — масса яйца соответственно на 30-й и 52-й нед жизни.
Достоверность различий определяли с использованием t -критерия Cтьюдента (22).
Резуёътаты. Известно, что в локусе PRL (24 indel) аллель I содержит инсерцию размером 24 п.н., в то время как аллель D ее не содержит. Генотип II представлен на электрофореграмме фрагментом размером 154 п.н., DD — 130 п.н., ID — 130 и 154 п.н. В случае PRL (C-2402T) аллель C имеет три сайта рестрикции для AluI (два мономорфных и один полиморфный), аллель T — два. Cледовательно, генотип CC представлен на электрофореграмме набором фрагментов размером 160, 144, 81 и 54 п.н.; TT — 304, 81 и 54 п.н.; CT — 304, 160, 144, 81 и 54 п.н. Наличие того или иного аллеля определяется присутствием цитозина или тимина в сайте рестрикции. У гена GH (1-й интрон) возможны три аллеля. Для аллеля A характерно наличие одного сайта рестрикции, для аллеля B — двух, C — трех. Генотип AA представлен на электрофореграмме фрагментами размером 539 и 237 п.н., BB — 392, 237 и 147 п.н., CC — 267, 237, 147 и 125 п.н., AB — 539, 392, 237 и 147 п.н., AC — 539, 267, 237, 147 и 125 п.н., BC — 392, 267, 237, 147 и 125 п.н. Ген GH (4-й интрон) существует в виде двух аллелей — A и B. Аллель A несет два сайта рестрикции для SacI (полиморфный и мономорфный сайты), аллель B — один (мономорфный сайт). Генотип AA представлен фрагментами рестрикции размером 584, 440 и 144 п.н.; BB — 1024 и 144 п.н., AB — 1024, 584, 440 и 144 п.н. У PRLR (5-й экзон) имеется аллель A, который содержит один сайт рестрикции для BamHI, и аллель B, который его не содержит. Генотип A0 представлен на электрофореграмме фрагментами размером 195 и 55 п.н., B0 — 250 п.н. У гена GHR (5-й интрон) имеется аллель B с одним сайтом рестрикции для NspI и аллель A, у которого он отсутствует. Генотип A0 представлен на электрофореграмме фрагментом размером 750 п.н., B0 — фрагментами 200 и 550 п.н.
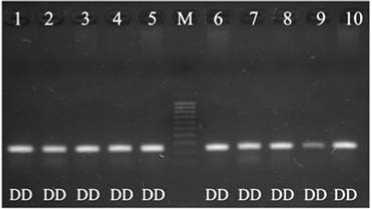
Проведенные исследования показали, что в популяции кур породы полтавская глинистая локусы гена гормона роста (по 1-му и 4-му интронам), рецептора гормона роста и пролактина (C-2402T) поли- морфны, в то время как 24 indel и морфны (рис.).
ген рецептора пролактина — моно-
PRL (24 indel)
PRL (С-2402Т)
GH (1-й интрон)
GH (4-й интрон)
PLRR
GHR
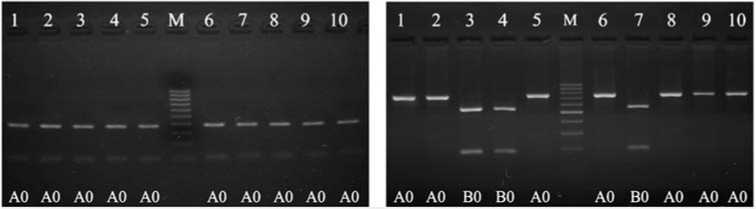
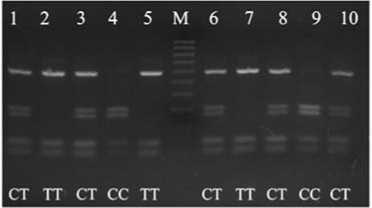
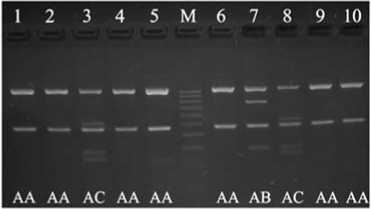
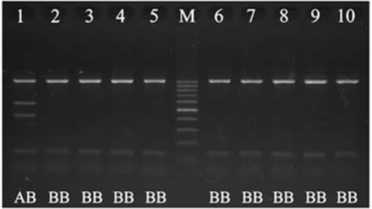
Электрофореграмма продуктов амплификации премоторного участка гена пролактина PRL 24 indel, продуктов рестрикции фрагмента гена пролактина PRL C-2402T, 1-го интрона гена гормона роста GH , 4-го интрона гена гормона роста GH , 5-го экзона гена рецептора пролактина PRLR и 5-го интрона гена рецептора гормона роста GHR в популяции кур породы полтавская глинистая : 1-10 — номера лунок; М — маркер молекулярных масс (M-50, M-100, «ИзоГен», Россия); II , ID , DD , CC , CT , TT , AA , AB , AC , BB , A0 , B0 — соответствующие генотипы (виварий Государственной опытной станции птицеводства Национальной академии аграрных наук Украины, Харьковская обл., 2013 год).
В случае с 24 indel в популяции кур породы полтавская глинистая наблюдали наличие особей только одного генотипа DD (то есть по наличию инсерции в промоторном участке гена локус пролактина мономорфен). Мономорфный характер этого локуса резко отличает кур анализируемой линии от ранее изученных особей из популяций пород борковская барви-стая и белый плимутрок (23).
По наличию однонуклеотидного полиморфизма в положении -2402 гена пролактина в популяции были обнаружены особи всех трех возможных генотипов (см. рис.).
По результатам оценки MspI-полиморфизма в 1-м интроне гена гормона роста в изученной популяции кур имелись особи трех (из шести возможных) генотипов — AA, AB и AC. Гомозиготных по аллелям B и C особей не обнаружили. Также в изученной популяции отсутствовали особи с генотипом BC.
В свою очередь, по SacI-полиморфизму в 4-м интроне гена гормона роста были выявлены особи двух генотипов — AB (SacI+/SacI-) и BB (SacI-/SacI-). Особей с генотипом AA (SacI+/SacI+) в исследуемой популяции мы не обнаружили.
У изученных кур ген, кодирующий рецептор пролактина, был представлен одним вариантом ( A0 ) (BamHI-полиморфизм в 5-м экзоне). Как и в случае с геном пролактина (24 indel), он оказался мономорфным.
По гену GHR в популяции имелись особи двух генотипов — A0 и B0 . Вследствие гемизиготности локусов по генам PRLR и GHR у самок птицы гетерозиготы в популяции в обоих случаях отсутствовали (см. рис.).
Анализ фактического и теоретического распределений особей разных генотипов (по всем изученным локусам) в опытной популяции кур не выявил нарушения генетического равновесия, что свидетельствует об отсутствии давления отбора.
По сравнению с популяциями других пород кур украинской селекции (белый плимутрок, борковская барвистая) (23) в изученной нами популяции имелся ряд существенных особенностей. Так, для кур яичного направления продуктивности (борковская барвистая) по локусу PRL характерна высокая частота аллеля I (содержит инсерцию), для кур мясояичного направления продуктивности (белый плимутрок) — аллеля D (не содержащего инсерции), в то время как в популяции кур породы полтавская глинистая указанный локус вообще был мономорфен (табл. 1).
1. Частота генотипов и аллелей генов пролактина ( PRL ) , рецептора пролактина ( PRLR ) , гормона роста ( GH) и рецептора гормона роста ( GHR ) в популяции кур породы полтавская глинистая (виварий Государственной опытной станции птицеводства Национальной академии аграрных наук Украины, Харьковская обл., 2013 год)
|
Локус | Генотип, его частота |
| Частота аллелей |
|
PRL (24 indel) DD — 1 PRL (C-2402T) CC — 0,110; CT — 0,520; TT — 0,370 PRLR (5-й экзон) A0 — 1 GH (1-й интрон) AA — 0,820; AB — 0,040; AC — 0,140 GH (4-й интрон) AB — 0,070; BB — 0,930 GHR (5-й интрон) A0 — 0,280; B0 - 0,720 |
D — 1 C — 0,372; T — 0,628 A —1 A — 0,908; B — 0,020; C — 0,072 A — 0,036; B — 0,964 A — 0,280; B — 0,720 |
Примечание. Результаты получены с использованием ПЦР-ПДРФ анализа (полиморфизм длин рестрикционных фрагментов — PCR-RFLP, restriction fragment length polymorphism) и посредством сравни тельного анализа длин амплифицированных фрагментов при изучении инсерции в локусе пролактина. Описание аллелей и генотипов см. в тексте.
При анализе MspI-полиморфизма в 1-м интроне гена гормона роста в исследуемой популяции кур был найден аллель C в гетерозиготном состоянии ( AC ), при этом его частота составила 0,072. Следует отметить тот интересный факт, что как таковой аллель C , согласно данным специальной литературы, практически полностью отсутствует в популяциях коммерческих линий, однако присутствует у некоторых аборигенных пород (19). При этом аллель C , как и в представляемой работе, найден в популяциях кур других пород украинской селекции (борковская барвистая и белый плимутрок), в которых его частота составляла 0,17 (23).
Анализ наблюдаемых и ожидаемых распределений генотипов в выборке в целом показал наличие некоторого эксцесса гетерозигот по локусам PRL (C-2402T) и GH (1-й интрон) (табл. 2). В то же время по локусу GH (4-й интрон) показатели, отражающие фактическую и теоретическую гетерозиготность, практически совпадали (соответственно 0,071 и 0,069).
-
2. Популяционно-генетическая характеристика кур породы полтавская глинистая по изученным локусам (виварий Государственной опытной станции птицеводства Национальной академии аграрных наук Украины, Харьковская обл., 2013 год)
-
3. Продуктивные признаки у кур породы полтавская глинистая с разными аллельными вариантами генов пролактина ( PRL ) , гормона роста ( GH) и рецептора гормона роста ( GHR ) (виварий Государственной опытной станции птицеводства Национальной академии аграрных наук Украины, Харьковская обл., 2013 год)
|
Локус гена |
| Na |
1 Ho | |
1 He | |
1 Fis | |
n e |
|
PRL (24 indel) |
1 |
- |
|||
|
PRL (C-2402T, AluI) |
2 |
0,520 |
0,467 |
- 0,113 |
1,876 |
|
GH (1-й интрон, MspI) |
3 |
0,184 |
0,170 |
- 0,082 |
1,205 |
|
GH (4-й интрон, SacI) |
2 |
0,071 |
0,069 |
- 0,029 |
1,074 |
|
PRLR (5-й экзон, BamHI) |
1 |
- |
- |
- |
- |
|
GHR (NspI) |
2 |
- |
- |
- |
- |
Примечание. Na — общее число аллелей; Но — фактическая гетерозиготность; H e — теоретическая гетерозиготность; Fis — индекс фиксации Райта; П е — эффективное число аллелей. Прочерк означает, что показатель не может быть рассчитан из-за мономорфности локусов ( PRL 24 indel и PRLR ) и гемизиготности ( GHR ). Результаты получены с использованием ПЦР-ПДРФ анализа (полиморфизм длин рестрикционных фрагментов — PCR-RFLP, restriction fragment length polymorphism) и посредством сравнительного анализа длин амплифицированных фрагментов при изучении инсерции в локусе пролактина.
Среди полиморфных локусов наибольшее значение эффективного числа аллелей наблюдалось по гену пролактина (C-2402T) (ne = 1,876); наименьшее (n e = 1,074) — гормона роста (SacI-полиморфизм). Таким образом, среди всех изученных генов локус пролактина (C-2402T) характеризовался самым высоким уровнем полиморфизма.
Наряду с генетико-популяционными исследованиями мы оценили яичную продуктивность у кур разных генотипов.
|
Генотип |
Продуктивный признак |
|||
|
En 12 , шт. |
| En 40 , шт. |
1 EW 30 , г |
EW 52 , г |
|
|
CC |
75,38±2,33 ** |
PRL 201,50±8,43 |
54,80±1,44 * |
58,57±1,86 |
|
CT |
67,04±1,34 ** |
192,29±3,09 |
50,95±0,54* |
57,46±0,60 |
|
TT |
67,82±1,21** |
188,32±3,45 |
52,25±0,65 |
59,50±0,82 |
|
AA |
67,53±1,05 |
GH (MspI) 191,01±2,65 |
51,63±0,42 |
58,34±0,57 |
|
AB |
66,50±3,62 |
181,79±8,57 |
51,08±2,81 |
58,93±2,91 |
|
AC |
63,00±4,40 |
171,50±26,05 |
51,27±2,34 |
58,94±1,33 |
|
AB |
72,00±1,67* |
GH (SacI) 199,00±10,13 |
55,02±1,52 * |
58,80±1,13 |
|
BB |
66,98±1,05* |
187,56±2,83 |
51,40±0,42 * |
58,42±0,53 |
|
A0 |
65,58±2,38 |
GHR 186,91±6,36 |
52,28±0,99 |
58,35±0,76 |
|
B0 |
68,67±0,87 |
189,67±2,99 |
51,46±0,48 |
57,48±1,21 |
Примечание. En 12 и En 40 — число яиц соответственно за 12 и 40 нед продуктивного периода; EW 30 и EW 52 — масса яйца соответственно на 30-ю и 52-ю нед жизни; MspI, SacI — эндонуклеазы рестрикции. Описание генотипов по аллельным вариантам см. в тексте.
*, ** Достоверность различий соответственно Р < 0,05 и Р < 0,01.
В связи с мономорфным характером гена пролактина по наличию инсерции в промоторном участке изучение связи аллельных вариантов с продуктивными признаками у кур породы полтавская глинистая было невозможно. При этом благодаря наличию однонуклеотидного полиморфизма в локусе PRL (C-2402T) показано, что яичная продуктивность за 12 нед у особей с генотипом CC-PRL превышала таковую у особей с генотипом TT-PRL и составила соответственно 75,38±2,33 и 67,82±1,21 шт. (P < 0,01) (табл. 3). Яичная продуктивность за 40 нед у кур с генотипом CC-PRL равнялась 201,50±8,43; TT-PRL — 188,32±3,45 шт.; эти различия были недостоверными, что во многом обусловлено небольшим числом особей с генотипом CC-PRL (11 кур) по сравнению с TT-PRL (36 кур). Данные о положительной связи генотипа CC-PRL с яичной продуктивностью у кур породы полтавская глинистая соответствуют результатам, полученным на породах кур зарубежной селекции (14, 17).
Также отмечались различия по массе яйца на 30-ю нед жизни — 54,80±1,44 г у особей с генотипом CC - PRL против 50,95±0,54 г у кур с генотипом CT-PRL (P < 0,05) (см. табл. 3).
По локусу GH (MspI-полиморфизм в 1-м интроне) значительных различий по показателям продуктивности между особями разных генотипов выявлено не было, что, вероятно, связано с отсутствием в популяции кур с генотипами BB - GH и CC - GH (мы сравнивали продуктивность особей, гомозиготных и гетерозиготных по аллелю A ) (см. табл. 3).
В то же время были показаны различия по яичной продуктивности между особями с разным генотипом вследствие SacI-полиморфизма гена GH . Так, гетерозиготные особи AB (SacI+/SacI-) характеризовались большей яичной продуктивностью, чем куры с генотипом BB (SacI-/SacI-). Тенденция к превышению показателей у гетерозиготных особей над таковыми у гомозиготных сохранялась и в случае с массой яйца на 30-ю нед жизни (см. табл. 3). По локусу GHR мы не выявили достоверных различий в показателях яичной продуктивности. Локус PRLR , как и пролактина (по наличию инсерции в промоторном участке), оказался мономорфным, что исключило возможность изучения связи между генотипом и продуктивными признаками у кур.
Итак, изучена генетическая структура популяции кур породы полтавская глинистая по локусам генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина. Показано, что гены гормона роста, рецептора гормона роста и пролактина в опытной популяции кур полиморфны. По всем изученным полиморфным локусам популяция кур породы полтавская глинистая находится в состоянии генетического равновесия по Харди-Вайнбергу. Гены пролактина (по наличию инсерции в промоторном участке) и рецептора пролактина мономорфны. Показана положительная связь генотипов по пролактину CC - PRL и гормону роста AB - GH (SacI+/SacI-) с числом яиц за 12 нед продуктивного периода и массой яйца на 30-ю нед жизни. Полученные данные можно в дальнейшем использовать для направленной селекции кур породы полтавская глинистая с целью получения потомства от желательных генотипов, что в сочетании с классическими селекционными методами позволит максимально эффективно раскрыть продуктивный потенциал птицы.
Список литературы Полиморфизм генов гормона роста, рецептора гормона роста, пролактина и рецептора пролактина в связи с яичной продуктивностью у кур породы полтавская глинистая
- Fulton J.E. Molecular genetics in a modern poultry breeding organization. World’s Poultry Sci. J., 2008, 64: 171-176 ( ) DOI: 10.1017/S0043933907001778
- Enayati B., Rahimi-Mianji G. Genomic growth hormone, growth hormone receptor and transforming growth factor β-3 gene polymorphism in breeder hens of Mazandaran native fowls. African J. Biotechnol., 2009, 8(14): 3154-3159.
- Rashidi H., Rahimi-Mianji G., Farhadi A., Gholizadeh M. Association of prolactin and prolactin receptor gene polymorphisms with economic traits in breeder hens of indigenous chickens of Mazandaran province. Iranian J. Biotechnol., 2012, 10(2): 129-135.
- Nie Q., Sun B., Zhang D., Luo C., Ishag N.A., Lei M., Yang G., Zhang X. High diversity of the chicken growth hormone gene and effects on growth and carcass traits. J. Hered., 2005, 96(6): 698-703 ( ) DOI: 10.1093/jhered/esi114
- Kansaku N., Hiyama G., Sasanami T., Zadworny D. Prolactin and growth hormone in birds: protein structure, gene structure and genetic variation. The Journal of Poultry Science, 2008, 45: 1-6 ( ) DOI: 10.2141/jpsa.45.1
- El Halawani M.E., Silsby J.L., Behnke E.J. Fehrer S.C. Hormonal induction of incubation behavior in ovarioectomized female turkeys (Meleagris gallopavo). Biol. Reprod., 1986, 35: 59-67 ( ) DOI: 10.1095/biolreprod35.1.59
- Reddy I.J., David C.G., Raju S.S. Chemical control of prolactin secretion and it’s effect on pause days, egg production and steroid hormone concentration in Girirani birds. Int. J. Poult. Sci., 2006, 5(7): 685-692 ( ) DOI: 10.3923/ijps.2006.685.692
- Nie Q., Lei M., Ouyang J., Zeng H., Yang G., Zhang X. Identification and characterization of single nucleotide polymorphisms in 12 chicken growth-correlated genes by denaturing high performance liquid chromatography. Genet. Sel. Evol., 2005, 37: 339-360 ( ) DOI: 10.1051/gse:2005005
- Nie Q., Ip S.C.Y., Zhang X., Leung F.C., Yang G. New variations in intron 4 of growth hormone gene in Chinese native chickens. J. Hered., 2002, 93(4): 277-279 ( ) DOI: 10.1093/jhered/93.4.277
- Liu H., Kung H., Fulton J., Morgan R.W., Cheng H.H. Growth hormone interacts with the Marek's disease virus SORF2 protein and is associated with disease resistance in chicken. PNAS USA, 2001, 98(16): 9203-9208 ( ) DOI: 10.1073/pnas.161466898
- Feng X.P., Kuhnlein U., Aggrey S.E., Gavora J.S., Zadworny D. Trait association of genetic markers in the growth hormone and the growth hormone receptor gene in a white leghorn strain. Poult. Sci., 1997, 76: 1770-1775 ( ) DOI: 10.1093/ps/76.12.1770
- Khoa D., Khang N., Ngu N., Matey J., Loan H.T.P., Thuy N.T.D. Single nucleotide polymorphisms in GH, GHR, GHSR and insulin candidate genes in chicken breeds of Vietnam. Greener Journal of Agricultural Science, 2013, 3(10): 716-724.
- Ouyang J.H., Xie L., Nie Q., Luo C., Liang Y., Zeng H., Zhang X. Single nucleotide polymorphism (SNP) at the GHR gene and its associations with chicken growth and deposition traits. Br. Poultry Sci., 2008, 49(2): 87-95 ( ) DOI: 10.1080/00071660801938817
- Cui J.-X., Du H.-L., Liang Y., Deng X.-M., Li N., Zhang X.-Q. Association of polymorphisms in the promoter region of chicken prolactin with egg production. Poult. Sci., 2006, 85: 26-31 ( ) DOI: 10.1093/ps/85.1.26
- Jiang R.-S., Xu G.-Y., Zhang X.-Q., Leung F.C.C., Zhang X. Polymorphisms of 5¢ flanking region of chicken prolactin gene. Domestic Animal Endocrinology, 2006, 30: 1-16 ( ) DOI: 10.1016/j.domaniend.2005.05.006
- Jiang R.-S., Xu G.-Y., Zhang X.-Q., Yang N. Association of polymorphisms for prolactin and prolactin receptor genes with broody traits in chickens. Poultry Sci., 2005, 84: 839-845 ( ) DOI: 10.1093/ps/84.6.839
- Bagheri Sarvestani A.S., Niazi A., Zamiri M.J., Dadpasand Taromsari M. Polymorphisms of prolactin gene in a native chicken population and its association with egg production. Iranian J. Vet. Res., 2013, 14(2): 113-119.
- Alipanah M., Shojaian K., Bandani H.K. The polymorphism of prolactin gene native chicken Zabol region. J. Anim. Vet. Adv., 2010, 9(24): 3005-3007 ( ) DOI: 10.3923/javaa.2011.619.621
- Ip S.C.Y., Zhang X., Leung F.C. Genomic growth hormone gene polymorphisms in native Chinese chickens. Exp. Biol. Med., 2001, 226(5): 458-462.
- Li H., Zhu W., Chen K., Wu X., Tang Q., Gao Y. Associations between GHR and IGF-1 gene polymorphisms, and reproductive traits in Wenchang chickens. Turk. J. Vet. Anim. Sci., 2008, 32(4): 281-285 ( ) DOI: 10.3923/rjpscience.2010.19.22
- Меркурьева Е.К. Генетические основы селекции в скотоводстве. М., 1977.
- Меркурьева Е.К. Биометрия в селекции и генетике сельскохозяйственных животных. М., 1970.
- Кулибаба Р.А., Подстрешный А.П. Полиморфизм генов пролактина и гормона роста в линиях кур украинской селекции. Цитология и генетика, 2012, 6: 75-82 ( ) DOI: 10.3103/S0095452712060060


