Полиморфизмы генов глутаматергической системы при лекарственно-индуцированных дискинезиях у больных шизофренией и болезнью Паркинсона
Автор: Бойко Анастасия Сергеевна, Миронова Юлия Сергеевна, Османова Диана Закировна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (98), 2018 года.
Бесплатный доступ
Патогенез развития лекарственно-индуцированных расстройств на фоне приема антипсихотических и антипаркинсонических средств изучен недостаточно. В настоящее время широкую распространенность в литературе получили исследования глутаматергической системы и её роли в развитии дискинезий. Целью работы является изучение полиморфных вариантов генов NMDA-рецептора и транспортера глутамата SLC1A2 при лекарственно-индуцированных дискинезиях у больных шизофренией и болезнью Паркинсона. Было проведено комплексное клинико-биологическое обследование 180 больных шизофренией и 187 пациентов с болезнью Паркинсона. Выявлены ассоциации полиморфизма гена SLC1A2 с развитием тардивной дискинезии у больных шизофренией и полиморфизма rs 2650427 гена GRIN2A с развитием левадопа-индуцированной дискинезии при болезни Паркинсона. В отношении полиморфизма rs 1969060 гена GRIN2A наблюдается снижение частоты встречаемости генотипа GG у больных шизофренией с тардивной дискинезией по сравнению с показателями пациентов без двигательных расстройств, в то время как при болезни Паркинсона выявлено повышение частоты встречаемости генотипа GG, что может свидетельствовать о различных фармакогенетических особенностях развития двигательных расстройств при данных патологиях. Полученные результаты исследований показывают, что полиморфные особенности генов глутаматергической системы являются важным звеном патогенеза двигательных побочных эффектов, наблюдаемых на фоне антипсихотической терапии у больных шизофренией и при применении препаратов, содержащих леводопу, при болезни Паркинсона.
Шизофрения, болезнь паркинсона, тардивная дискинезия, леводопа-индуцированная дискинезия, глутаматергическая система, полиморфизмы генов
Короткий адрес: https://sciup.org/142212918
IDR: 142212918 | УДК: 616.895.8:616.858:575.174.015.3 | DOI: 10.2661V/1810-3111-2018-1(98)-5-10
Текст научной статьи Полиморфизмы генов глутаматергической системы при лекарственно-индуцированных дискинезиях у больных шизофренией и болезнью Паркинсона
Психические и нейродегенеративные расстройства представляют собой серьезную медикосоциальную проблему во всех странах мира в связи с высокой распространённостью, хроническим течением и высоким процентом инвалидизации пациентов [1, 2]. Основными средствами лечения шизофрении и болезни Паркинсона (БП) являются, соответственно, антипсихотические [3] и противопар-кинсонические средства [4], которые улучшают долгосрочный прогноз заболевания и способствуют его переходу в состояние ремиссии. Кроме основного клинического действия препараты данных групп обладают широким спектром побочных эффектов, которые, в свою очередь, осложняют течение основного заболевания, усиливая выраженность негативных и когнитивных расстройств, приводя к дополнительной социальной стигматизации больных, ухудшая качество жизни и являясь причиной отказа пациентов от терапии [5, 6, 7, 8, 9, 10].
Патогенез развития лекарственно-индуцированных расстройств на фоне приема антипсихотических и антипаркинсонических средств изучен недостаточно. В настоящее время широкую распространенность в отечественной и зарубежной литературе получили исследования глутаматергиче-ской системы и её роли в развитии дискинезий [11, 12]. Существует предположение, что дискинезии связаны с повышенной чувствительностью к эксай-тотоксичности срединных шиповатых нейронов стриатума, которая вызывается усилением процессов окислительного стресса [13, 14]. Повреждающее действие оказывает и избыточная активность глута-матергических субталамических нейронов, которая является причиной нейрональной дегенерации. Нарушения регуляции глутаматергической системы могут быть вызваны воздействием как внешних факторов, так и быть генетически детерминированы.
Выяснение роли полиморфных вариантов генов нейромедиаторных систем в патогенезе развития лекарственно-индуцированных дискинезий (ЛИД) у больных шизофренией и болезнью Паркинсона представляется важной задачей для оптимизации генотипически-специфического подхода к оценке риска развития побочных эффектов фармакотерапии и разработки подходов к персонализированной терапии этих заболеваний [15, 16].
Цель – изучение полиморфных вариантов генов NMDA-рецептора и транспортера глутамата SLC1A2 при лекарственно-индуцированных дискинезиях у больных шизофренией и болезнью Паркинсона.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в соответствии с требованиями Хельсинкской декларации Всемирной медицинской ассоциации об этических принципах проведения медицинских исследований с участием людей в качестве субъектов (2000 г.). У всех обследуемых лиц получено информированное согласие на проведение исследования.
Было проведено комплексное клиникобиологическое обследование 180 больных шизофренией и 187 пациентов с болезнью Паркинсона.
Критериями включения больных в исследуемую группу являлись: установленный диагноз шизофрении (F20) и болезни Паркинсона (G20), длительное применение медикаментозной терапии (антипсихотические средства и препараты, содержащие леводопу), возраст старше 18 лет. Критериями исключения из исследования являлись: наличие коморбид-ных неврологических и соматических заболеваний, затрудняющих объективную оценку клинического состояния, вызванного основным заболеванием; отказ больного от участия в исследовании. Проводилась стандартизация группы по полу, возрасту, стадии и длительности заболевания, тяжести актуального состояния и коморбидной патологии.
Для исследования дискинезий у пациентов клиническое обследование проводилось по стандартной международной шкале патологических непреднамеренных движений (Abnormal Involuntary Movement Scale – AIMS), позволяющих диагностировать наличие дискинезии и степень ее выраженности.
В исследование были включены больные шизофренией, находившиеся на лечении в психиатрическом стационаре и длительно (более 6 месяцев) получающие терапию традиционными антипсихотиками. В исследуемую группу вошли 128 мужчин (71,1%) и 52 женщины (28,9%). Средний возраст пациентов составил 39,2±12,1 года (возрастной диапазон – от 18 до 65 лет).
В зависимости от наличия антипсихотически-индуцированной тардивной дискинезии (ТД) больные были разделены на две группы: 71 пациент с тардивной дискинезией и 109 пациентов без двигательных расстройств.
Вторая группа лиц, включенных в исследование, состояла из 187 пациентов с болезнью Паркинсона, находившихся на стационарном лечении в неврологической клинике СибГМУ. Из них 111 женщин (59,4%) и 76 мужчин (40,6%) в возрасте от 40 до 89
лет. Средний возраст пациентов составил 68,4±9,2 года. По наличию осложнения противопаркинсони-ческой терапии больные с болезнью Паркинсона были разделены на 2 группы: с леводопа-индуцированной дискинезией (40 пациентов) и без двигательных расстройств (147 пациентов).
В качестве материала для исследования была использована венозная кровь. Кровь брали из локтевой вены, утром, натощак в пробирки фирмы BD Vacutainer с антикоагулянтом ЭДТА. ДНК выделяли из лейкоцитов цельной периферической крови стандартным фенол-хлороформным методом. Определение полиморфных вариантов генов GRIN2A (rs1969060 и rs2650427) и SLC1A2 (rs4354668) проводили методом полимеразной цепной реакции в режиме реального времени (Real-time PCR) с использованием наборов TaqMan® SNP Genotyping Assay (Applied Biosystems, США). Амплификация и анализ результатов были осуществлены с помощью прибора StepOnePlus (Applied Biosystems, США).
Статистическая обработка результатов проводилась при помощи программы SPSS 23.0. Распределение частот генотипов по исследованным полиморфным вариантам генов проверяли на соответствие равновесию Харди–Вайнберга. Сравнение частот генотипов и аллелей в исследуемых группах проводили по критерию χ2. Критичный уровень статистической значимости различий составил 0,05. Проводили расчет отношения шансов и 95% доверительного интервала (OR, 95% СI).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для изучения возможной роли генов глутаматер-гической системы в развитии лекарственно-индуцированных побочных двигательных расстройств проведено генотипирование полиморфизмов гена глутаматного транспортера второго типа SLC1A2 и гена NMDA-рецептора (субъединица GRIN2A) и статистический анализ распределения частот генотипов и аллелей.
Анализ частот полиморфизмов генов GRIN2A и SLC1A2 показал, что наблюдаемое распределение генотипов соответствует ожидаемому при равновесии Харди–Вайнберга в группе пациентов с шизофренией и болезнью Паркинсона, за исключением распределения частот генотипов для одного полиморфного варианта rs1969060 гена GRIN2A при БП.
В результате разделения пациентов с шизофренией на группы в зависимости от наличия двигательных расстройств не было выявлено статистически значимых различий в распределении генотипов и аллелей полиморфизма rs2650427 гена GRIN2A . Статистически значимые результаты были получены для полиморфного варианта rs1969060 гена GRIN2A (χ2=5,72; р=0,05) (рис. 1). Гомозиготный генотип GG полиморфного варианта rs1969060 чаще встречается в группе пациентов без тардивной дискинезии (4,4% при сравнении с 1,8% в группе пациентов с ТД). Так же можно говорить о тенденции к снижению частоты встречаемости аллеля G у этих же больных (р=0,07).
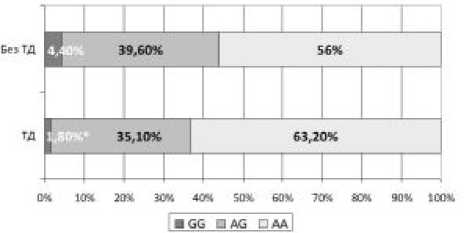
Рисунок 1. Распределение генотипов полиморфизма rs1969060 гена GRIN2A у больных шизофренией с тардивной дискинезией и без двигательных расстройств
Пр и м е ч а н и е. * – Уровень статистически значимых различий при сравнении групп между собой (р=0,05).
Носительство генотипов и аллелей полиморфизма rs2650427 гена GRIN2A не обладает статистически значимым влиянием на риск развития тардивной дискинезии у больных шизофренией. При вычислении OR для второго полиморфизма этого же гена получено низкое значение для генотипа GG (OR=0,012, 95% CI: 0,01–0,93), что свидетельствует о вероятном про-тективном эффекте этого генотипа относительно больных без двигательных расстройств.
У пациентов с ТД выявлены более низкая частота встречаемости генотипа TT и более частое носи- тельство гетерозиготного генотипа гена переносчика глутамата SLC1A2 по сравнению с больными без гиперкинеза (χ2=5,89; р=0,05) (рис. 2).
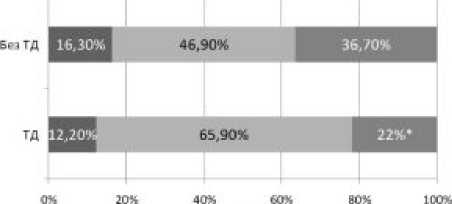
GG a GT
Рисунок 2. Распределение генотипов полиморфизма rs4354668 гена SLC1A2 у больных шизофренией с тардивной дискинезией и без двигательных расстройств
Пр и м е ч а н и е. * – Уровень статистически значимых различий при сравнении групп между собой (р=0,05).
Исходя из рассчитанных отношений шансов, можно сделать вывод, что генотипы TT и GT полиморфизма гена SLC1A2 обладают предиспонирую-щим (OR=2,79, 95% CI: 1,18–6,59) и протективным (OR=0,37, 95% CI: 0,15–0,94) эффектами соответственно.
Таблица 1
Распределение генотипов и аллелей полиморфизмов генов GRIN2A и SLC1A2 у пациентов с болезнью Паркинсона в зависимости от наличия леводопа-индуцированной дискинезии (частота, %)
|
Ген |
Полиморфизм |
Генотип Аллель |
Пациенты без ЛИД (n, %) |
Пациенты с ЛИД (n, %) |
χ2 |
p |
|
GRIN2A |
rs1969060 |
GG |
5 (3,7) |
4 (11,1) |
6,12 |
0,05* |
|
AG |
19 (14,0) |
1 (2,8) |
||||
|
AA |
112 (82,4) |
31 (86,1) |
||||
|
G |
29 (10,7) |
9 (12,5) |
0,20 |
0,66 |
||
|
A |
243 (89,3) |
63 (87,5) |
||||
|
rs2650427 |
CC |
44 (33,8) |
8 (22,9) |
5,83 |
0,05* |
|
|
CT |
60 (46,2) |
24 (68,6) |
||||
|
TT |
26 (20,0) |
3 (8,6) |
||||
|
C |
148 (56,9) |
40 (57,1) |
0,01 |
0,97 |
||
|
T |
112 (43,1) |
30 (42,9) |
||||
|
SLC1A2 |
rs4354668 |
GG |
27 (19,0) |
8 (22,2) |
1,09 |
0,58 |
|
GT |
69 (48,6) |
14 (38,9) |
||||
|
TT |
46 (32,4) |
14 (38,9) |
||||
|
G |
123 (43,3) |
30 (41,7) |
0,06 |
0,80 |
||
|
T |
161 (56,7) |
42 (58,3) |
П р и м е ч а н и е. р – Уровень статистически значимых различий при сравнении групп между собой; ЛИД – леводопа- индуцированные дискинезии.
При анализе распределения частот генотипов и аллелей полиморфизмов гена GRIN2A у пациентов с болезнью Паркинсона были выявлены статистически значимые различия (табл. 1). В случае полиморфизма rs1969060 у исследуемых с ЛИД наблюдается более высокая частота встречаемости генотипа GG (11,1%) и низкая – генотипа AG (2,8%) по сравнению с распределением в выборке без двигательных расстройств (3,7% и 14,0% соответственно) (χ2=6,12, р=0,05). Так же в группе пациентов с леводопа-индуцированными дискинезиями наблюдаются низкая частота встречаемости генотипа TT (8,6%) и высокая частота генотипа CT (68,6%) полимор- физма rs2650427 при сравнении с показателями пациентов без нее (20,0% и 46,2% соответственно) (χ2=5,83, р=0,05). В результате анализа распределения частот генотипов и аллелей между группами по полиморфизму rs4354668 гена SLC1A2 не было получено статистически значимых различий. Для всех генотипов и аллелей исследуемых полиморфизмов было рассчитано значение «отношение шансов». Выявлено, что генотип CT полиморфизма rs2650427 гена глутаматергического рецептора обладает пре-диспонирующим эффектом в отношении развития леводопа-индуцированной дискинезии у пациентов с болезнью Паркинсона (OR=2,55, 95% CI: 1,15–
5,62).
Ген SLC1A2 регулирует активность белка EAAT2 (excitatory aminoacid transporter), ответственного за транспорт глутамата в астроциты для превращения в глутамин и тем самым за осуществление энергетического обмена в мозге. Наиболее изученный полиморфный сайт промоторного региона гена SLC1A2 расположен в позиции (-181) с заменой T→G. Показано, что аллель G приводит к более низкой активности транспортера. Некоторыми исследователями было обнаружено, что наличие аллеля G ассоциируется у пациентов с шизофренией с неблагоприятным воздействием на основные когнитивные функции [17].
Согласно литературным данным, при исследовании тардивной дискинезии у больных шизофренией были выявлены ассоциации полиморфизмов rs7192557 и rs8057394 гена GRIN2A с развитием дискинезии у пациентов с болезнью Паркинсона, которые входили в группу сравнения [18]. В других исследованиях обнаружили ассоциации полиморфизмов rs1969060 (ген GRIN2A ), rs1806201 и rs890 (ген GRIN2B ) с возрастом начала болезни Гентингтона [19]. В последующих исследованиях авторы обнаружили, что два других полиморфизма (rs8057394, rs2650427) гена GRIN2A имеют более выраженную ассоциацию [20]. Не вызывает сомнения тот факт, что генетические особенности различны в разных этнических популяциях. Согласно литературным данным, при проведении аналогичного исследования в венесуэльской выборке были получены другие результаты. Не было выявлено ассоциаций полиморфизмов гена GRIN2B , однако была обнаружена слабовыраженная зависимость относительно GRIN2A (rs1969060) [21].
Длительная фармакотерапия нейролептиками у больных шизофренией и препаратами, содержащими леводопу, при болезни Паркинсона приводит к повышению концентрации глутамата в структурах мозга и в периферической крови [22, 23]. В высоких концентрациях глутамат приобретает свойства эксай-тотоксина в результате чего поражаются нейроны базальных ганглиев, в частности ГАМК-ергические стриарные нейроны, что, в свою очередь, может привести развитию экстрапирамидных нарушений [24].
ЗАКЛЮЧЕНИЕ
Полученные результаты исследований показывают, что полиморфные особенности генов глутама-тергической системы являются важным звеном патогенеза двигательных побочных эффектов (дискинезий), наблюдаемых на фоне антипсихотической терапии у больных шизофренией и применения препаратов, содержащих леводопу, у пациентов с болезнью Паркинсона.
Лекарственно-индуцированные двигательные расстройства обладают широкой вариабельностью и разнообразием клинических проявлений. Дискинезии влияют на качество жизни пациентов, уровень их адаптации и зачастую являются причиной отказа от препаратов, что усугубляет процессы социальной стигматизации. В связи с этим представляются необходимыми дальнейшие исследования генетических особенностей, ассоциированных с развитием дискинезии. В перспективе это позволит прогнозировать риск развития побочных эффектов терапевтической интервенции и корректировать назначаемое лечение, что поможет улучшить качество оказания специализированной помощи и применять тактику персонализированной терапии.
Список литературы Полиморфизмы генов глутаматергической системы при лекарственно-индуцированных дискинезиях у больных шизофренией и болезнью Паркинсона
- Van Hasselt F.M. Improving the physical health of people with severe mental illness: the need for tailor made care and uniform evaluation of interventions . : University of Groningen; 2013: 195.
- Meyer J.M. Forgotten but not gone: new developments in the understanding and treatment of tardive dyskinesia. CNS Spectr. 2016; 21(S1): 13-24 DOI: 10.1017/S1092852916000730
- Lieberman J.A, Stroup T.S., McEvoy J.P., Swartz M.S., Rosenheck R.A., Perkins D.O., Keefe R.S., Davis S.M., Davis C.E., Lebowitz B.D., Severe J., Hsiao J.K. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. New England Journal of Medicine. 2005; 353(12): 1209-1223 DOI: 10.1056/nejmoa051688
- Yoo H.S., Chung S.J., Chung S.J., Moon H., Oh J.S., Kim J.S., Hong J.Y., Ye B.S., Sohn Y.H., Lee P.H. Presynaptic dopamine depletion determines the timing of levodopa-induced dyskinesia onset in Parkinson's disease. European Journal of Nuclear Medicine and Molecular Imaging. 2018; 45(3): 423-431 DOI: 10.1007/s00259-017-3844-8
- Семке А.В, Ветлугина Т.П., Иванова С.А., Рахмазова Л.Д., Гуткевич Е.В., Лобачева О.А., Корнетова Е.Г. Биопсихосоциальные основы и адаптационно-компенсаторные механизмы шизофрении в регионе Сибири. Сибирский вестник психиатрии и наркологии. 2009; 5 (56): 15-20.
- Macaluso M., Flynn A., Preskorn S.H. Tardive Dyskinesia: A Historical Perspective. Journal of Psychiatric Practice. 2017; 23(2): 121-129 DOI: 10.1097/PRA.0000000000000224
- Pechevis M., Clarke C., Vieregge P., Khoshnood B., Deschaseaux Voinet C., Berdeaux G., Ziegler M. Effects of dyskinesias in Parkinson's disease on quality of life and healthDrelated costs: a prospective European study. European Journal of Neurology. 2005; 12(12): 956-963. 1331.2005.01096.x DOI: 10.1111/j.1468-
- Корнетова Е.Г., Бойко А.С., Бородюк Ю.Н., Семке А.В. Тардивная дискинезия у больных шизофренией: клиника и факторы риска. Томск: Изд-во ООО «Новые печатные технологии». 2014: 106.
- Жукова И.А., Жукова Н.Г., Алифирова В.М., Гашилова Ф.Ф. Когнитивные расстройства и качество жизни пациентов с болезнью Паркинсона. Бюллетень сибирской медицины. 2008; 5 (1): 145-150.
- Левин О.С. Леводопа-индуцированные дискинезии при болезни Паркинсона: возможности предупреждения и терапии. Современная терапия в психиатрии и неврологии. 2015; 3: 15-25.
- Ivanova S., Loonen A., Pechlivanoglou P., Freidin M., Al Hadithy A., Rudikov E., Zhukova I., Govorin N., Sorokina V., Fedorenko O.Y. NMDA receptor genotypes associated with the vulnerability to develop dyskinesia. Translational Psychiatry. 2012; 2(1): e67-e67 DOI: 10.1038/tp.2011.66
- Morin N., Morissette M., Grégoire L., Di Paolo T. mGlu5, dopamine D2 and adenosine A2A receptors in L-DOPA-induced Dyskinesias. Current Neuropharmacology. 2016; 14(5): 481493 DOI: 10.2174/1570159x14666151201185652
- Ivanova, S.A., Loonen A.J. Levodopa-Induced Dyskinesia Is Related to Indirect Pathway Medium Spiny Neuron Excitotoxicity: A Hypothesis Based on an Unexpected Finding. Parkinson 's Disease. 2016; 2016: 1-5 DOI: 10.1155/2016/6461907
- Tsai G., Goff D.C., Chang R.W., Flood J., Baer L., Coyle J.T. Markers of glutamatergic neurotransmission and oxidative stress associated with tardive dyskinesia. American Journal of Psychiatry. 1998; 155(9): 1207-1213 DOI: 10.1176/ajp.155.9.1207
- Иванова С.А., Федоренко О.Ю., Бохан Н.А., Лунен А. Фармакогенетика тардивной дискинезии. Томск: Изд-во «Новые печатные технологии», 2015: 120.
- Федоренко О.Ю., Иванова С.А., Семке А.В., Бохан Н.А. Тардивная дискинезия: успехи современной фармакогенетики. Современная терапия психических расстройств. 2017; 1: 22-28.
- Spangaro M., Bosia M., Zanoletti A., Bechi M., Cocchi F., Pirovano A., Lorenzi C., Bramanti P., Benedetti F., Smeraldi E., Cavallaro R. Cognitive dysfunction and glutamate reuptake: effect of EAAT2 polymorphism in schizophrenia. Neuroscience Letters. 2012; 522(2): 151-155 DOI: 10.1016/j.neulet.2012.06.030
- Loonen A.J., Ivanova S.A. New insights into the mechanism of drug-induced dyskinesia. CNS Spectrums. 2012; 18(01): 15-20 DOI: 10.1017/s1092852912000752
- Arning L., Kraus P.H., Valentin S., Saft C., Andrich J., Epplen J.T. NR2A and NR2B receptor gene variations modify age at onset in Huntington disease. Neurogenetics. 2004; 6(1): 25-28 DOI: 10.1007/s10048-004-0198-8
- Arning L., Saft C., Wieczorek S., Andrich J., Kraus P.H., Epplen J.T. NR2A and NR2B receptor gene variations modify age at onset in Huntington disease in a sex-specific manner. Human Genetics. 2007; 122(2): 175-182 DOI: 10.1007/s00439-007-0393-4
- Andresen J.M., Gayan J., Cherny S.S., Brocklebank D., Alkorta Aranburu G., Addis E.A., Group T.U.C.R., Cardon L.R., Housman D.E., Wexler N.S. Replication of twelve association studies for Huntington's disease residual age of onset in large Venezuelan kindreds. J. Med. Genet. 2007; 44: 44-50 DOI: 10.1136/jmg.2006.045153
- Ivanova S.A., Boyko A.S., Fedorenko O.Yu., Krotenko N.M., Semke A.V., Bokhan N.A. Glutamate Concentration in the Serum of Patients with Schizophrenia. Procedia Chemistry. 2014; 10: 80-85 DOI: 10.1016/j.proche.2014.10.015
- Бойко А.С. Окислительный стресс и глутаматергическая эксайтотоксичность в развитии лекарственно-индуцированной тардивной дискинезии. Фундаментальные исследования. 2014; 10(6): 1220-1226.
- Blandini F., Armentero MT. New pharmacological avenues for the treatment of L-DOPA-induced dyskinesias in Parkinson's disease: targeting glutamate and adenosine receptors. Expert Opinion on Investigational Drugs. 2012; 21(2): 153-68 DOI: 10.1517/13543784.2012.651457


