Полиморфные варианты генов фолатного цикла у больных раком легкого
Автор: Баканова Марина Леонидовна, Минина Варвара Ивановна, Савченко Яна Александровна, Глушков Андрей Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 2 т.18, 2019 года.
Бесплатный доступ
Рак легкого (РЛ) - распространенное онкологическое заболевание и ведущая причина смертности от рака во всем мире. Особенности метаболизма фолатов в организме могут влиять на процессы метилирования и репарации ДНК и играть важную роль в процессах канцерогенеза. Целью исследования стало обобщение имеющихся данных об ассоциации между полиморфными вариантами генов фолатного цикла ( MTHFR С677Т (rs1801133), MTR A2756G (rs1805087), MTRR А66G (rs1801394) ) и риском РЛ у человека. Материал и методы. Поиск исследований проводился в базе данных pubmed, elibrary.ru. В обзор включали оригинальные, рандомизированные исследования за период с 2003 по 2018 г. Результаты. Накоплено большое количество работ о роли гена MTHFR С677Т у больных РЛ. Данные же по полиморфным вариантам MTR A2756G и MTRR A66G у больных РЛ весьма ограничены. Полиморфизмы MTHFR C677T и MTRR А66G значительно связаны с РЛ во многих исследованиях. Ассоциаций между геном MTR A2756G и РЛ пока получено не было, однако в злокачественной трансформации легкого зафиксирована значимость совместного действия MTR 2756A > G and MTRR 66A > G . Ряд факторов, таких как национальность, курение, пол, точный диагноз, могут оказывать влияние на результаты и выводы исследований о роли генов фолатного цикла у больных РЛ. Заключение. Дальнейшее изучение генетических полиморфизмов MTHFR С677Т (rs1801133), MTR A2756G (rs1805087), MTRR А66G (rs1801394) с учетом генсредовых и генгенных взаимодействий может объяснить индивидуальные различия риска РЛ.
Рак легкого, полиморфизм генов фолатного цикла, днк, метаболизм, онкогенез
Короткий адрес: https://sciup.org/140254254
IDR: 140254254 | УДК: 616.24-006:577.212.3 | DOI: 10.21294/1814-4861-2019-18-2-70-77
Текст обзорной статьи Полиморфные варианты генов фолатного цикла у больных раком легкого
Рак легкого (РЛ) – распространенное онкологическое заболевание и ведущая причина смертности от рака во всем мире [1]. Несмотря на то, что курение является ведущей причиной РЛ, только у 20 % курильщиков развивается данное онкологическое заболевание [2], некурящие с семейной историей рака также имеют повышенный риск РЛ [3].
Широко распространенный полногеномный анализ ассоциаций (GWAS) представляет собой мощный инструмент для исследования генетических особенностей онкологических заболеваний. В течение последних десяти лет GWAS определил общие локусы восприимчивости к РЛ, такие как, например, 5p15,33 ( TERT / CLPTM1L ), 6p21.33 ( BAT3 / MSH5 ), 15q25.1 ( CHRNA5 / CHRNA3 / CHRNB4 ) [4–9].
Кроме того, по-прежнему активно используется «ген-кандидатный» подход для оценки вклада известных однонуклеотидных полиморфизмов (SNP) в формирование риска РЛ. Исследования довольно многочисленны, противоречивы, своеобразны для каждой популяции. Обобщенные метаанализы подтверждают большое значение полиморфных вариантов генов, участвующих в системах репарации ДНК (APEX1 rs1130409 , rs1760944 , ATM rs664677, ERCC1 rs11615 , ERCC2 rs13181, hOGG1 rs1052133), биотрансформации ксенобиотиков (CYP1A1 rs4646903 , CYP2E1 rs6413432), осуществляющих контроль клеточного цикла и апоптоза (FGFR4 rs351855 , TERT rs2736098 , TP53 rs1042522) [10].
В настоящее время активно ведется поиск новых значимых генетических маркеров, потенциально способных (исходя из их биологических функций) модифицировать индивидуальный риск рака легкого. Ряд авторов полагают перспективным проведение изучения генов фолатного цикла [11–19].
Многие эпидемиологические исследования свидетельствуют, что высокое потребление овощей и фруктов связано со снижением риска РЛ [20–23]. Фолат – один из элементов этих продуктов, особенности метаболизма которого в организме могут влиять на процессы репарации ДНК [24] и тем самым способствовать канцерогенезу легкого [25].
Ключевую роль в метаболизме фолатов играет ген метилентетрагидрофолатредуктазы ( MTHFR ), локализованный на хромосоме 1p36.3. Хорошо изученный полиморфный вариант MTHFR С677Т (rs1801133 ) вызывает замену аланина на валин ( Ala222Val ) и снижает активность фермента на 65 % в гомозиготном варианте гена ( Т/Т ) и на 30 % в гетерозиготном ( С/Т ) [26].
Вовлеченность MTHFR в процессы канцерогенеза может быть вызвана его участием в двух путях клеточного метаболизма. Один связан с многочисленными процессами метилирования, зависящими от S-аденозилметионина (SAM), а другой – через тимидилатсинтазу (thymidylate synthase (TS)), осуществляя синтез ДНК (рис. 1).
Низкая ферментативная активность MTHFR С677Т может приводить к снижению метилирования гомоцистеина в метионин и, в свою очередь, уровня SAM, вызывая гипометилирование ДНК [26]. Избыточное накопление гомоцистеина нарушает деятельность клетки [28], а аберрантное метилирование ДНК является важным эпигенетическим механизмом подавления экспрессии генов в широком спектре опухолей человека [29]. Другой путь влияния MTHFR на онкогенез осуществляется через нарушение процесса синтеза ДНК. Низкий уровень субстрата MTHFR снижает уровень TS, приводя к ошибочной встройки dUMP вместо dTMP. Этот процесс может приводить к разрывам ДНК, снижает процессы репарации и повышает частоту хромосомных аберраций. В литературе имеются работы по оценке уровня хромосомных повреждений у здоровых индивидуумов, имеющих низкоактивные генотипы MTHFR С677Т . Зафиксировано статистически значимое превышение уровня дицентрических хромосом, хроматидных разрывов в клетках крови индивидуумов с вариантом MTHFR 677Т [30–31].
На этапе метилирования гомоцистеина в метионин большую роль играют ферменты генов метионин-синтазы ( MTR) и метионин-синтазы-редуктазы ( MTRR ) . Полиморфные варианты данных генов также потенциально способны вносить свой вклад в риск формирования рака. Полиморфный вариант гена MTR A2756G (rs1805087 ), локализованного в хромосоме 1q43, вызывает замену
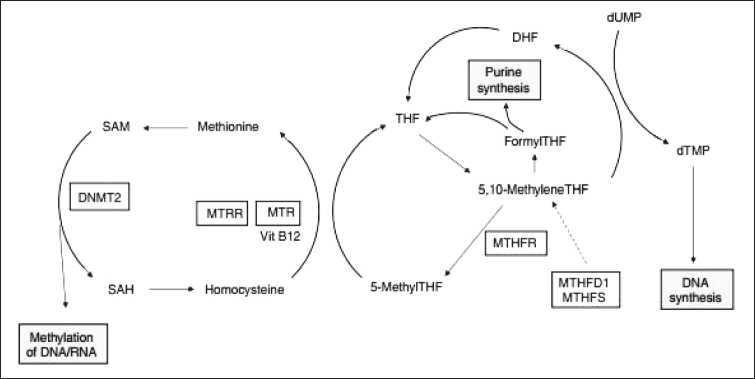
Рис. 1. Схематическое изображение одноуглеродного метаболизма [27]
аспарагиновой кислоты на глицин в 919 кодоне ( Asp919Gly ) . Установлено, что аллель 2756G повышает уровень метилирования ДНК и связан со снижением концентрации гомоцистеина в плазме [32]. Причем повышение уровня метилирования было установлено и для комбинации MTR 2756GG/ MTHFR 677СC против MTR 2756AA/MTHFR 677TT (р=0,0026) [32]. Были обнаружены статистически значимые ассоциации между вариантами MTR 2756A> G и повышением риска колоректального рака [33], рака мочевого пузыря [34] и неходжкин-ской лимфомы [35]. Генетический полиморфизм гена MTRR А66G (rs1801394), расположенного на хромосоме 5p15.2-15.3, связан с заменой изолейцина на метионин в 22 кодоне ( Ile22Met ). MTRR 66G способствует менее эффективному восстановлению активности MTR в процессах реметиляции гомоцистеина [36].
Таким образом, установлена значимая роль генов MTRR, MTR и MTHFR в процессах метилирования и синтеза ДНК, доказано их влияние на эффективность репарации ДНК и накопление повреждений хромосом, в связи с чем они потенциально способны модифицировать индивидуальную чувствительность организма человека к действию канцерогенов и увеличивать риск рака.
В связи с этим целью исследования явился анализ данных литературы, посвященных изучению роли генов фолатного цикла MTHFR, MTRR и MTR в формировании и риске РЛ.
Материал и методы
В обзор включали оригинальные, рандомизированные исследования за период с 2003 по 2018 г., работы, в которых объектом исследования стали мужчины и женщины, больные РЛ различных форм, принадлежащие к различным популяциям и этносам мира, а также статьи, посвященные анализу следующих полиморфных маркеров: С677Т – гена MTHFR, A2756G – гена MTR , А66G – гена MTRR .
Поиск исследований проводился в базе данных PubMed с использованием стратегии поиска, принятой в организации Кокрановского Сотрудничества с использованием запросов по темам: lung cancer, MTHFR and lung cancer, MTR and lung cancer, MTRR and lung cancer, polymorphism in folate metabolic genes and lung cancer. Кроме того, проводился поиск с использованием данных научной электронной библиотеки elibrary.ru.
В результате поиска по ключевым словам в базе данных было найдено 131 исследование, в базе данных научной электронной библиотеки elibrary. ru было найдено 153 исследования. Работы, которые не соответствовали критериям включения в обзор, исключались. Из обзора были также исключены зарубежные работы, полный текст которых был опубликован не на английском языке. После проведенного отбора в обзор были включены 35 работ: 24 экспериментальных (в том числе 22 зарубежных и 2 отечественных) и проанализировано 11 зарубежных обзоров.
Результаты и обсуждение
Взаимосвязь полиморфизма гена MTHFR С677Т и риска РЛ широко изучается. Исследователи выявляют повышенный [11–12, 14–18] или пониженный [26, 37–40] риск развития РЛ у носителей минорных вариантов гена MTHFR С677Т , есть работы, где ассоциации не обнаруживаются [41–47]. Проведенные метаанализы обобщили полученные ранее результаты и установили риски РЛ для низкоактивных генотипов независимо от популяции (таблица) [48–51]. Ряд авторов, отмечают риск для азиатов, но не для европеоидов [52–55]. В то же время X. Wang et al. не обнаружили ассоциации MTHFR 677ТТ и РЛ у жителей Северного Китая [57].
Интересно также то, что повышенный риск для генотипа Т/Т отмечен у больных РЛ из Центральной Европы моложе 50 лет (OR=1,92, 95 % CI=1,12–3,29) [14] и пониженный риск у больных жителей Китая моложе 60 лет (OR=0,53, 95 %
Таблица
Показатели риска (oR) РЛ для гомозиготной модели гена MTHFR Ñ677Ò ( Ò/ Т против Ñ/Ñ ) в различных популяциях по результатам проведенных метаанализов
|
Автор, год |
Популяция |
Кол-во человек |
OR (95 % CI), р |
|
|
РЛ |
Контроль |
|||
|
Mao, 2008 |
Все Asian |
5 111 |
6 415 |
1,16 (1,03–1,31), р=0,0009 1,27 (1,02–1,58), р=0,005 |
|
Boccia et al., 2009 |
European Все Asian |
5 274 |
7 435 |
1,12 (0,96–1,29), р=0,01 1,22 (0,95–1,55), р=0,003 1,26 (0,70–2,50), р=0,005 |
|
Hou et al., 2012 |
European Все Asian |
10 453 |
10 843 |
1,15 (0,88–1,52), р=0,03 1,12 (0,93–1,35), р=0,000 1,10 (0,85–1,43), р=0,000 |
|
Zhang et al., 2012 |
European Все Asian |
10 753 |
11 275 |
1,16 (0,86–1,57), р=0,021 1,17 (0,97–1,42), р=0,000 1,20 (0,92–1,57), р=0,000 |
|
Zhang et al., 2013 |
European East Asian |
7 409 |
6 331 |
1,13 (0,83–1,55), р=0,030 1,44 (0,86–2,39), р=0,00001 |
|
Liu et al., 2013 |
Все Asian |
11 653 |
12 032 |
1,26 (1,05–1,50), р=0,011 1,31 (1,01–1,71), р=0,045 |
|
Liu et al., 2014 |
European North China |
2 487 |
3 228 |
1,16 (0,91–1,49), р=0,224 1,67 (1,33–2,10), p=0,000 |
|
Rai et al., 2014 |
Asian |
9 468 |
9 078 |
1,25 (1,01–1,30), р=0,03 |
|
Wang et al., 2015 |
Все Han China South China |
2 487 |
3 228 |
1,35 (0,99–1,83), p=0,002 1,43 (0,77–2,67), p=0,004 1,20 (0,77–1,89), p=0.007 |
|
Xie et al., 2015 |
North China Все Asian |
150 086 |
200 699 |
1,67 (1,33–2,10), p=0,615 1,20 (1,04–1,39), p<0,001 |
|
Yang et al., 2016 |
European Все Asian |
12 324 |
12 522 |
1,14 (0,95–1,38), p=0,053 1,518 (1,220–1,890), p<0,001 1,722 (1,271–2,334), p<0,001 |
|
European |
1,170 (0,859–1,593), p=0,319 |
|||
CI=0,28–1,00) [40]. При анализе РЛ с учетом гистологического типа опухоли легкого была найдена положительная ассоциация генотипа Т/Т с немелкоклеточным РЛ (НМРЛ) у обследованных из Турции (OR=3,00, 95 % CI=0,31–70,96; χ2=4,001) [17]; в метаанализе европеоидов и азиатов (OR=1,24, 95 % CI=1,09–1,41) [50], а в восточноазиатской популяции установлен риск генотипа Т/Т против С/С+С/Т для плоскоклеточного РЛ (OR=1,53, 95 % CI=1,09–2,14, р=0,01) [58].
В литературе имеются несколько исследований, оценивающих связь MTHFR С677Т и РЛ с учетом полового диморфизма. Выявили отрицательную ассоциацию Т/Т генотипа с риском РЛ у белых нелатиноамериканских (non-Hispanic Whites) женщин США (OR=0,60, 95 % CI=0,40–0,92) [59], у китайских женщин (OR=0,53, 95 % CI=0,30–0,94) [40]. S. Arslan et al. установили OR=3,05, 95 % CI=0,52–10,68 для этого же генотипа у турецких больных РЛ мужчин [17]. Y. Zhang et al., обобщив результаты, получили OR=0,63, 95 % CI=0,41–0,95; р=0,03 для Т/Т у европейских женщин, а у европейских мужчин значимых ассоциаций получено не было [51].
Курение является важным фактором риска РЛ, и некоторые работы по изучению взаимосвязи
MTHFR С677Т и РЛ учитывают статус курения. Не было выявлено влияния курения на ассоциацию между вариантами MTHFR С677Т и РЛ в метаанализе восточноазиатской популяции [58], у больных РЛ жителей Турции [43], Иордании [44]. Метаанализ, объединивший исследования больных РЛ Турции, Тайваня, Китая, белых США (nonHispanic Whites), установил снижение риска РЛ для генотипа Т/Т у когда-либо куривших (OR=0,74, 95 % CI=0,55–0,99; р=0,04) [51]. Исследование C. Kiyohara et al. показало существование высоких рисков для генотипа Т/Т у курящих японцев, больных РЛ (OR=6,16, 95 % CI=3,48–10,9) [18].
Наиболее точно оценить взаимосвязь между активным курением у больных РЛ и MTHFR С677Т поможет такой показатель, как индекс курения. Уже есть работы, где влияния MTHFR С677Т у курящих оценивается с учетом индекса курения. Так, значительное снижение риска пло-скоклеточной/мелкоклеточной карциномы легкого было обнаружено у курящих с индексом курения 40≥pack-years для аллеля MTHFR 677T (р=0,035), а у носителей Т/Т генотипа гена MTHFR (OR=0,50 95 % CI=0,20–1,29, р=0,179) [38].
Употребление алкоголя – другая привычка, которая может оказывать влияние на риск РЛ. Об- наружены ассоциации между MTHFR 677ТТ и РЛ у чрезмерно употребляющих алкоголь (OR=3,09, 95 % CI=1,64–5,81) [18]. По данным T. Suzuki et al., MTHFR 677TT был связан с уменьшением риска плоскоклеточной/мелкоклеточной карциномы легкого среди чрезмерно употребляющих алкоголь (OR=0,17, 95 % CI=0,03–0,98, р=0,041) [38].
Известна возможность влияния нарушений фолатного цикла на структурную целостность хромосом и возрастание частоты аберраций хромосом в условиях канцерогенных воздействий среды [30]. Нашими пилотными исследованиями было установлено, что у больных РЛ, обладающих MTHFR Т/Т и MTHFR С/Т вариантами гена, регистрировалась наиболее высокая частота аберраций хромосомного типа [31].
Исследования, проведённые ранее о связи между геном MTR A2756G и РЛ, немногочисленны и пока не показали статистически значимых ассоциаций [13, 14, 19, 26, 27, 38, 42, 45, 46, 47]. Исследования полиморфных вариантов генов MTHFR 677C>T ( Ala222Val ); MTR: 2756 A>G ( Asp919Glu ); MTRR: 66 A>G ( Ile22Met ) у больных РЛ из России не выявили различий в частоте встречаемости всех изученных генетических полиморфизмов [45]. Очень мало информации и о влиянии MTRR A66G на риск РЛ [13, 19, 38, 45, 46, 60]. Повышенный риск для GG генотипа против AA генотипа был установлен у больных РЛ белых США (OR=1,39, 95 % CI=1,08–1,78) [13] и у жителей Турции (OR=2,284, 95 % CI=1,013–5,151, p=0,042) [19]. Кроме того, риск РЛ выше среди бывших курильщиков с MTRR66AG/GG, чем с MTRR66AA генотип [13], и у курильщиков, несущих аллель MTRR 66G [17].
Поскольку гены MTR и MTRR участвуют в реметилировании гомоцистеина в тандеме, то можно предположить значимость совместного действия этих двух генов в злокачественной трансформации
Список литературы Полиморфные варианты генов фолатного цикла у больных раком легкого
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer. 2015; 136 (5): 359-386. DOI: 10.1002/ijc.29210
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Tobacco smoke and involuntary smoking. IARC Monogr Eval Carcinog Risks Hum. 2004; 83: 166-167.
- Brownson R.C., Alavanja M.C., Caporaso N., Berger E., Chang J.C. Family history of cancer and risk of lung cancer in lifetime non-smokers and long-term ex-smokers. Int J Epidemiol. 1997; 26: 256-263.
- Wang Y., Broderick P., Webb E., Wu X., Vijayakrishnan J., Matakidou A., Qureshi M., Dong Q., Gu X., Chen W.V., Spitz M.R., Eisen T., Amos C.I., Houlston R.S. Common 5p15.33 and 6p21.33 variants influence lung cancer risk. Nat Genet. 2008 Dec; 40 (12): 1407-9. DOI: 10.1038/ng.273
- Broderick P., Wang Y., Vijayakrishnan J., Matakidou A., Spitz M.R., Eisen T., Amos C.I., Houlston R.S. Deciphering the impact of common genetic variation on lung cancer risk: a genome-wide association study. Cancer Res. 2009 Aug 15; 69 (16): 6633-41. DOI: 10.1158/0008-5472.CAN-09-0680


