Полинеоплазия, ассоциированная с GIST: обзор литературы и редкий случай из практики
Автор: Васильев Николаи Вольтович, Маркович Виталий Александрович, Фролова Ирина Георгиевна, Ермоленко Роман Владимирович, Мальцева Анастасия Алексеевна, Ковалев Олег Игоревич, Лютикова Полина Олеговна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Цель исследования - демонстрация редкого клинического случая полинеоплазии, ассоциированной с GIST, объединяющей 3 злокачественных новообразования различной локализации и тканевого происхождения. Научный интерес вызван необходимостью изучения полинеоплазий, ассоциированных с GIST, которые возможно объяснить концепцией M.G. Rodriquenz et al. (2016), предполагающей особую роль солитарной GIST в потенциальном развитии полинеоплазии. Материал и методы. Поиск соответствующих источников производился в системах Medline, Cochrane Library, Elibrary, включались публикации с января 2009 г. по октябрь 2019 г. Из 507 найденных исследований 21 были использованы для написания систематического обзора. Результаты. На сегодняшний день феномен полинеоплазии достаточно широко распространен. В большинстве случаи полинеоплазии представлены двумя опухолями, и относительно редки наблюдения, включающие большее число новообразований. Среди всех первично-множественных опухолей наше внимание привлекла полинеоплазия, содержащая GIST. Обычно новообразования, сочетающиеся с GIST, локализуются в желудочно-кишечном тракте, а также они встречаются в органах мочевыделительной системы, женской половой сферы, в щитовидной железе, молочной железе, легких, яичках. Заключение. Представленный клинический случай демонстрирует достаточно редкое явление полинеоплазии, которое объединяет 3 злокачественных новообразования, в том числе GIST прямой кишки. Примечателен тот факт, что первичная GIST в прямой кишке развивается в 4 % случаев.
Первично-множественные злокачественные опухоли толстой и прямой кишки, потенциал злокачественности
Короткий адрес: https://sciup.org/140254332
IDR: 140254332 | УДК: 616-006.62:616.33/.34 | DOI: 10.21294/1814-4861-2020-19-2-140-146
Текст научной статьи Полинеоплазия, ассоциированная с GIST: обзор литературы и редкий случай из практики
Явление полинеоплазии впервые описано в литературе T. Billroth в 1889 г. [1]. Природа опухолей, формирующих полинеоплазию, чаще эпителиальная, однако наряду с эпителиальными процессами ее могут формировать мезенхимальные, нейроэктодермальные опухоли, новообразования кроветворной ткани. Опухоли, образующие полинеоплазию, как правило, имеют различную локализацию и хронологически развиваются си-мультанно (одновременно), синхронно (в период времени, охватывающий 6 мес) или метахронно (вторая опухоль возникает спустя 6 мес). Анализ литературы показывает, что данный феномен достаточно широко распространен. В большинстве случаев полинеоплазии представлены 2 опухолями и довольно редки наблюдения, включающие большее число новообразований [1].
Среди всех первично-множественных злокачественных опухолей (ПМЗО) наше внимание привлекла полинеоплазия, содержащая GIST. Такой интерес объяснен следующим обстоятельством: согласно концепции M.G. Rodriquenz et al., наличие GIST является фактором, обусловливающим высокий риск возникновения второй опухоли [2]. Особая роль GIST, по мнению M.G. Rodriquenz et al. (2016), позволяет рассматривать ее как «сторожевую» опухоль («sentinel tumor»), сигнализирующую о потенциальном формировании полинеоплазии [1].
Целью исследования явилась демонстрация редкого клинического случая полинеоплазии, ассоциированной с GIST-опухолью, объединяющей три злокачественных новообразования различной локализации и тканевого происхождения.
Клиническое наблюдение
Пациентка Б., 60 лет, обратилась в НИИ онкологии Томского НИМЦ в июле 2016 г. с жалобами на склонность к запорам, метеоризм, ложные болезненные позывы к дефекации, дискомфорт в области прямой кишки, кровянистые выделения из прямой кишки и половых путей.
При УЗИ органов малого таза (6.07.16): матка, размерами 48×42×54 мм, расположена высоко, отклонена кпереди и вправо. Контуры четкие, ровные. Миометрий диффузно-разнородный. Срединное М-эхо составило 3 мм, что соответствует постменопаузе. Шейка матки нормальных размеров. Свободной жидкости в малом тазу не выявлено. В проекции задней стенки влагалища определяется солидное объемное образование, размерами 98×78×85 мм, с неровными контурами, средней эхогенности, с хорошо выраженным кровотоком, неоднородной структуры.
По данным МРТ органов малого таза с контрастированием (7.07.16): в проекции задней стенки влагалища визуализируется мягкотканое опухолевое образование, размерами 79×77×96 мм, верхний полюс которого оттесняет шейку матки вверх и кпереди, наружный зев сдавлен опухолью (рис. 1). Опухоль распространяется на ретрова-гинальную и параректальную клетчатку, оттесняет средне- и нижнеампулярный отделы прямой кишки кзади, при этом не визуализируется граница между новообразованием и наружными слоями стенки кишки на протяжении 53 мм (рис. 2). В центре структура опухоли неоднородная, за счет участков с интенсивностью сигнала, соответствующего наличию жидкости (вероятно, полости распада). При контрастном усилении опухоль интенсивно накапливает контраст. В режиме DWI образование имеет гиперинтенсивный сигнал. В области ректосигмоидного отдела толстой кишки определяется второе объемное образование, суживающее просвет органа на протяжении 60 мм. Заполненный мочевой пузырь имеет четкие контуры и нормальную толщину стенок. Заключение: опухоль стенки влагалища с вовлечением прямой кишки; подозрение на опухоль ректосигмоидного отдела толстой кишки.
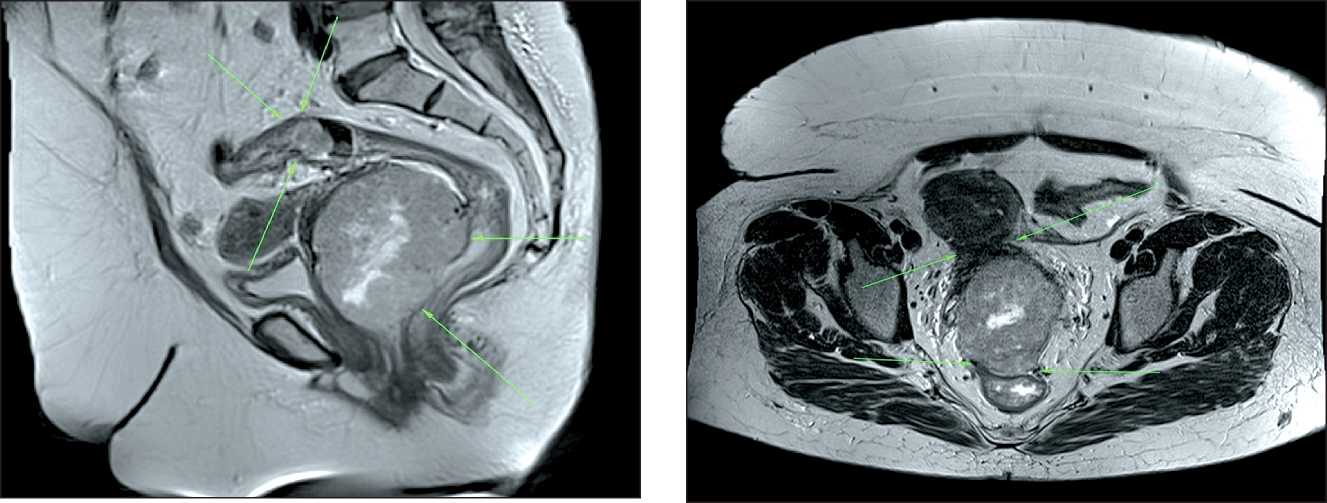
Рис. 1. МР-томограмма больной Б. в сагиттальной проекции. Визуализируется опухоль (2 стрелки) в проекции задней стенки влагалища. В просвете сигмовидной кишки определяется второе новообразование (3 стрелки)
Fig. 1. MRI of the patient B in the sagittal projection. The tumor is visualized in the projection of the vagina posterior wall (2 arrows). Second tumor is observed in the sigmoid opening (3 arrows)
Рис. 2. МР-томограмма больной Б. в аксиальной проекции. Визуализируется опухоль, инфильтрирующая ретровагиналь-ную и параректальную клетчатку и оттесняющая прямую кишку кзади, на этом фоне не прослеживается граница между опухолью и наружной стенкой кишки
При видеоколоноскопии (11.07.16): в нижнеампулярном отделе прямой кишки по передней стенке определяется сдавление извне, протяженностью до 60 мм, слизистая не изменена. В ректосигмоидном отделе, на 20 см от ануса, по левой стенке определяется блюдцеобразная опухоль, диаметром до 50 мм. На 27 см от ануса – полиповидное образование, диаметром до 20 мм, на длинной толстой ножке. Заключение: опухоль ректосигмоидного отдела толстой кишки; малигнизированное полиповидное образование сигмовидной кишки; сдавление прямой кишки извне.
По результатам обследования установлен следующий диагноз: ПМЗО: опухоль ректосигмоидного отдела толстой кишки, полиповидное образование сигмовидной кишки; сдавление прямой кишки извне опухолью, исходящей из стенки влагалища. 18.07.16 выполнено оперативное вмешательство. При интраоперационной ревизии в области ректосигмоидного отдела толстой кишки была выявлена первая опухоль, вторая – из брюшной полости не определяется. В связи с наличием ПМЗО решено выполнить мультивисцеральную резекцию органов малого таза. В едином блоке с брыжейкой мобилизованы сигмовидная кишка, которая пересечена в пределах здоровых тканей, матка с придатками и прямая кишка в пределах параректальной фасции до уровня тазовой диафрагмы. На промежностном этапе операции, в пределах здоровых тканей мобилизованы анальный отдел прямой кишки в едином блоке с задней и проксимальным отделами передней стенки влагалища. В левой подвздошной области сформирована конечная колостома.
Макропрепарат: в ректосигмоидном отделе толстой кишки, по левой стенсе имеется блюдцеобразная опухоль, диаметром 5 см, макроскопически с инвазией в мышечный слой. На 8 см проксимальнее первой опухоли, на слизистой оболочке сигмовидной кишки расположено полиповидное образование, длиной 6 см, с шириной основания – 1,5 см. В нижнеампулярном отделе прямой кишки имеется опухоль, диаметром 11 см, исходящая из подслизистых слоев, с сужением просвета кишки на протяжении 6 см, с распространением на заднюю стенку влагалища на участке площадью 2,1×3 см, но без инвазии слизистой оболочки как кишки, так и влагалища.
При гистологическом исследовании опухоль ректосигмоидного отдела толстой кишки построена слабополиморфными клетками, образующими многочисленные псевдожелезистые, криброзные, сосочковые структуры, лежащие в умеренной волокнистой соединительнотканой строме (рис. 3). Заключение: умереннодифференцированная аденокарцинома с инвазией в мышечный слой. Опухоль сигмовидной кишки расположена в пределах слизистой оболочки и представлена слабополиморфными клетками, образующими преимущественно псевдожелезистые структуры (рис. 4). Заключение: высокодифференцированная аденокарцинома сигмовидной кишки (в пределах слизистой оболочки) на фоне тубулярно-ворсинчатой аденомы с дисплазией II–III степени. Опухоль прямой кишки построена слабополиморфными веретеновидными клетками с узкими и овально-вытянутыми нормохромными ядрами. Клетки образуют пучки,
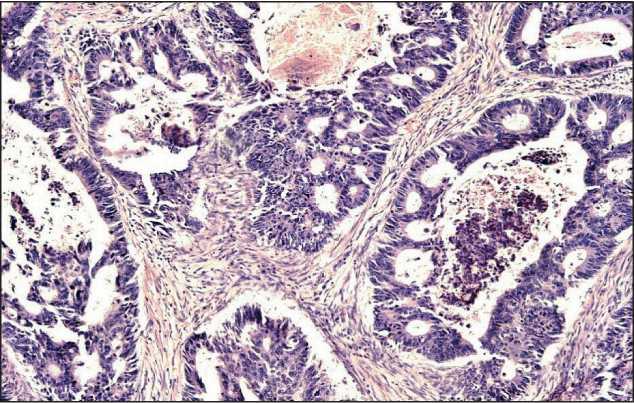
Рис. 3. Микрофото. Умереннодифференцированная аденокарцинома ректосигмоидного отдела толстой кишки. Слабо полиморфные клетки образуют псевдожелезистые, кри-брозные, сосочковые структуры. Окраска гематоксилином и эозином, ×10
Fig. 3. Microphoto. The moderately differentiated adenocarcinoma of rectosigmoid colon. Mild pleomorphic cells form pseudoglandular, cribriform, papillary patterns. H×E (hematoxylin and eosin staining of the pathology slide), ×10
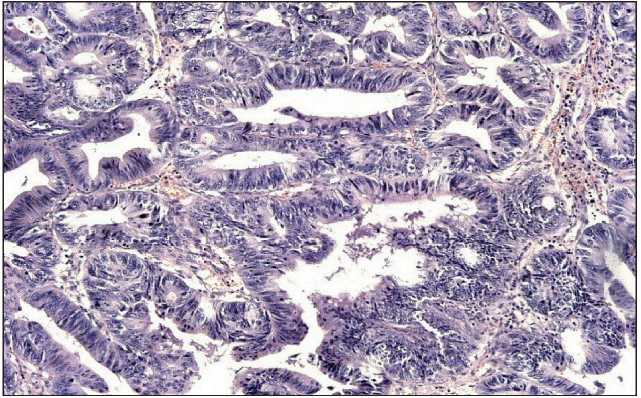
Рис. 4. Микрофото. Высокодифференцированная аденокарцинома сигмовидной кишки. Слабо полиморфные клетки образуют псевдожелезистые структуры. Окраска гематоксилином и эозином, ×10
Fig. 4. Microphoto. The high differentiated adenocarcinoma of sigmoid colon. Mild pleomorphic cells form pseudoglandular patterns. H×E (hematoxylin and eosin staining of the pathology slide), ×10
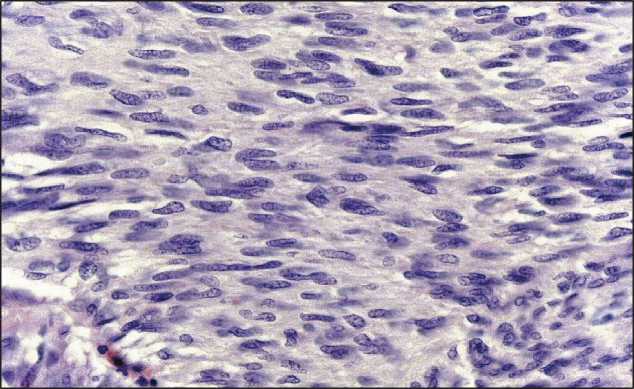
Рис. 5. Микрофото. GIST-опухоль прямой кишки. Слабо полиморфные веретеновидные клетки образуют пучки, вихревые структуры. Окраска гематоксилином и эозином, ×20
Fig. 5. Microphoto. GIST tumour of rectum. Mild pleomorphic spindle cells form the fascicular and storiform patterns. H×E (hematoxylin and eosin staining of the pathology slide), ×20
вихревые структуры, дольки, немногочисленные палисады, лежащие в скудном рыхлом матриксе (рис. 5). Наблюдаются обширные очаги некроза. Отмечается высокая митотическая активность (МИ 4/50). При иммуногистохимическом исследовании опухолевые клетки диффузно экспрессируют DOG-1 (clone SP31, Spring Bioscience), CD34 (clone QBEnd 10, Dako). Ki 67 (clone MIB-1, Dako) – экспрессия в ~8 % опухолевых клеток. Отсутствует экспрессия S-100 (поликлональное, Dako), Desmin (clone DE-R-11, Novocastra), SMA (clone 1A4, Dako), Cytokeratine АЕ1/АЕ3 (clone АЕ1/АЕ3, Dako), CD117 (c-kit) (Polyclonal, Dako). Заключение: GIST прямой кишки 6b прогностической группы (максимальный размер опухоли – 11 см; МИ – 4/50) с инвазией в стенку влагалища.
Окончательный диагноз: первично-множественная злокачественная опухоль: 1) GIST прямой кишки 6b прогностической группы, с прорастанием в стенку влагалища IIIВ стадии (T4N0M0); 2) умереннодифференцированная аденокарцинома ректосигмоидного отдела толстой кишки с инвазией в мышечный слой I стадии (T2N0M0); 3) высокодифференцированная аденокарцинома сигмовидной кишки (в пределах слизистой оболочки стенки кишки) I стадии (T1N0M0) на фоне тубулярно-ворсинчатой аденомы с дисплазией II–III степени.
Послеоперационный период протекал без осложнений, 31.07.16, на 13-е сут после операции больная выписана из стационара. Рекомендовано проведение таргетной терапии (Иматиниб) по месту жительства.
Обсуждение
Гастроинтестинальная стромальная опухоль (GIST) – наиболее частая мягкотканая опухоль, развивающаяся в желудочно-кишечном тракте (ЖКТ) [3]. Среди злокачественных новообразований пищеварительного тракта GIST встречается в 0,1–3 % случаев, чаще всего поражая желудок (60–70 %), реже тонкую кишку (30 %) и менее чем в 5 % случаев – сигмовидную и прямую кишку [3–7]. Описаны случаи экстра-гастроинтестинальных GIST, которые составляют менее 10 % [8].
Для определения степени биологической агрессивности GIST существует множество схем. В 2013 г. для использования в повседневной практике ВОЗ рекомендована схема M. Miettinen, J. Lasota (2006), базирующаяся на оценке 2 параметров (размер опухолевого узла и митотическая активность) и подразделяющая GIST на 8 прогностических групп, соответствующих разным потенциалам злокачественности: 1, 2, 3a группы – доброкачественный потенциал; 4 группа – неопределенный потенциал; 3b, 5, 6a, 6b прогностические группы – злокачественный потенциал [9]. Метастазирует GIST преимущественно в печень (78 %), забрюшинное пространство (56 %) и реже в лимфатиче- ские узлы (22 %) [2]. Чаще GIST встречается как солитарное образование, но эта опухоль может быть и компонентом полинеоплазии. По данным M.G. Rodriquenz et al. [2], такое сочетание наблюдается в достаточно широком интервале – в 4,5–43 % случаев; другие авторы описывают это явление существенно реже – в 9–27 % [10–14]. Полинеоплазия, ассоциированная с GIST (ПАГ), реже представлена сугубо GIST, при ее первичномножественной форме – до 2,5 % [2], в большинстве случаев – это комплекс опухолей разного гистотипа [2, 14, 17]. ПМЗО с GIST чаще встречается среди женщин (61 %). В возрастном аспекте ПАГ развивается преимущественно у пожилых людей (6–7 декада жизни), средний возраст при этом составляет 68 лет [2, 15].
Характеризуя новообразования, сочетающиеся с GIST-опухолью, целесообразно осветить следующие характеристики синхронной или метахронной опухоли – потенциал злокачественности, нозологическую форму, органную принадлежность. В большинстве случаев вторая опухоль имеет эпителиальное происхождение, в 10–35 % случаев она является злокачественной [5, 17]. Преимущественно новообразования, сочетающееся с GIST, локализуются в желудочно-кишечном тракте, а также в органах мочевыделительной системы, женской половой сферы, в щитовидной железе, молочной железе, легких, яичках [17]. В 83 % случаев гистотип сочетающейся опухоли представлен аденокарциномой [5].
Среди мезенхимальных новообразований, формирующих ПАГ, присутствуют опухоли, поражающие скелет, мягкие ткани, забрюшинное пространство. Они могут быть различного гистотипа: злокачественные новообразования – эндометриальная стромальная саркома, эпителиоидная лейомиосаркома, остеосаркома, выбухающая дерматофибросаркома, синовиальная саркома, дедифференцированная липосаркома, атипическая
Список литературы Полинеоплазия, ассоциированная с GIST: обзор литературы и редкий случай из практики
- Renda A. Multiple Primary Malignancies. Springer Science & Business Media, 2009. 287 p.
- Rodriquenz M.G., Rossi S., Ricci R., Martini M., Larocca M., Dipasquale A., Quirino M., Schinzari G., Basso M., D'Argento E., Strippoli A., Barone C., Cassano A. Gastrointestinal stromal tumors (GISTs) and second malignancies A novel "sentinel tumor"? A monoinstitutional, STROBE-compliant observational analysis. Medicine (Baltimore). 2016 Sep; 95(38): e4718. DOI: 10.1097/MD.0000000000004718
- Yamamoto D., Hamada Y., Tsubota Y., Kawakami K., Yamamoto C., Yamamoto M. Simultaneous development of adenocarcinoma and gastrointestinal stromal tumor (GIST) in the stomach: case report. World J Surg Oncol. 2012. 10: 6. DOI: 10.1186/1477-7819-10-6
- Kumar K., Rowsell C., Law C., Ko Y.-J. Coexistence of gastrointestinal stromal tumour and colorectal adenocarcinoma: Two case reports. J Gastrointest Oncol. 2011; 2: 50-54. DOI: 10.3978/j.issn.2078-6891.2010.029
- Ferreira S.S., Werutsky G., Toneto M.G., Alves J.M., Piantá C.D., Breunig R.C., da Rocha A.B., Grivicich I., Garicochea B. Synchronous gastrointestinal stromal tumors (GIST) and other primary cancers: Case series of a single institution experience. Int J Surg. 2010; 8: 314-317. DOI: 10.1016/j.ijsu.2010.03.008


