Полипептидная нейропротекция для профилактики когнитивной дисфункции после кардиохирургических вмешательств: пилотное проспективное плацебо- контролируемое рандомизированное исследование
Автор: Путанов Максим Андреевич, Соколова М.М., Ленькин П.И., Сластилин В.Ю., Баскакова И.Г., Кирилюк А.Н., Казаринов Д.Н., Чецкая К.М., Исакова Т.С., Румянцева М.А., Киров М.Ю.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 4 т.21, 2017 года.
Бесплатный доступ
Цель Оценка эффективности полипептидной нейропротекции с помощью препарата «Целлекс» для профилактики когнитивной дисфункции после кардиохирургических вмешательств. Методы В исследование включено 60 плановых кардиохирургических пациентов, рандомизированных в контрольную группу (плацебо) и группу «Целлекс», получавшую данный препарат по 1,0 мл подкожно в течение 8 сут. начиная с предоперационного дня. Проводилась оценка когнитивной функции за сутки до операции и на 3-и и 7-е сут. раннего послеоперационного периода при помощи Монреальской шкалы оценки когнитивной функции. Тяжесть нейронального повреждения определяли с помощью белка S100b. Интраопера- ционно оценивались показатели газообмена, гемодинамики и церебральной оксигенации. Дополнительно проведен анализ зависимости уровня когнитивного дефицита от применения искусственного кровообращения. Результаты Время вмешательства, продолжительность искусственной вентиляции легких, показатели гемодинамики и церебральной оксигенации достоверно не различались между группами. В обеих группах наблюдали преходящее снижение когнитивных функций к 3-м сут. после вмешательства и увеличение концентрации белка S100b в плазме крови, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Послеоперационная когнитивная дисфункция, искусственное кровообращение
Короткий адрес: https://sciup.org/142230640
IDR: 142230640
Текст научной статьи Полипептидная нейропротекция для профилактики когнитивной дисфункции после кардиохирургических вмешательств: пилотное проспективное плацебо- контролируемое рандомизированное исследование
Как цитировать: Путанов М.А., Соколова М.М., Ленькин П.И., Сластилин В.Ю., Баскакова И.Г., Кирилюк А.Н., Казаринов Д.Н., Чецкая К.М., Исакова Т.С., Румянцева М.А., Киров М.Ю. Полипептидная нейропротекции для профилактики когнитивной дисфункции после кардиохирургических вмешательств: пилотное проспективное плацебо-контролируемое рандомизированное исследование. Патология кровообращения и кардиохирургия. 2017;21(4):69-78.
Связь между операциями на сердце и увеличением частоты церебральных осложнений стала очевидной с развитием кардиохирургии. Тенденцией последних лет стало изучение так называемых минимальных неврологических дисфункций, включающих нарушение когнитивных способностей (краткосрочная и долговременная память, концентрация внимания, мыслительная функция) и изменение психики (нарушение сна, депрессии, галлюцинации) [1]. Нет полного понимания этиологии поражения мозга при операциях на сердце, не выработан единый подход к профилактике, использованию нейромониторинга, ранней диагностике и лечению неврологических осложнений вмешательств с искусственным кровообращением (ИК) и на работающем сердце [2, 3]. Основная проблема заключается в многофакторной этиологии таких неврологических осложнений [4].
В связи с этим представляет интерес применение препаратов, обладающих нейротрофическими эффектами и способных активизировать репаративные процессы в нервной системе. К данной группе относится «Целлекс» — органоспецифический средне- и высокомолекулярный белково-пептидный комплекс с массой протеинов от 10 до 250 кДа, полученный из эмбриональной мозговой ткани свиней. Результаты клинического рандомизированного двойного слепого исследования применения «Целлекс» у больных с острым нарушением мозгового кровообращения по ишемическому типу показали, что применение препарата в острейшем периоде инсульта способствует более полному восстановлению двигательных и сенсорных функций вне зависимости от локализации очага инфаркта [5]. Одновременно у этих больных было отмечено улучшение состояния когнитивных функций.
Тем не менее у кардиохирургических пациентов применение препарата «Целлекс» не изучено и остается предметом дискуссий. В связи с этим целью исследования является оценка эффективности препарата «Целлекс» для профилактики когнитивной дисфункции после кардиохирургических вмешательств.
Методы
Исследование проведено на базе Первой городской клинической больницы им. Е.Е. Волосевич и кафедры анестезиологии и реаниматологии Северного государственного медицинского университета (г. Архангельск) и одобрено больничным этическим комитетом (28.10.2016, протокол № 10). После подписания информированного согласия в проспективном порядке в исследование было включено 60 пациентов, которым выполнялось плановое кардиохирургическое вмешательство. Критериями исключения служили отказ больного от участия в исследовании, морбидное ожирение (индекс массы тела более 40 кг/м2), симультанные вмешательства с эндартерэктомией в бассейне сонной артерии, перенесенный инсульт (в течение последних 6 мес.), беременность, участие в другом клиническом исследовании в течение прошедших 30 дней.
В периоперационном периоде все пациенты были обследованы по стандартному протоколу, включающему общий клинический анализ крови, биохимическое исследование крови, коагулограмму, рентгенографию органов грудной клетки, электро-, эхо- и коронарографии при симптомах ишемической болезни сердца и/или возрасте более 50 лет. Тяжесть сердечной недостаточности оценивали на основании функционального класса по классификации Нью-Йоркской ассоциации сердца (англ. New York Heart Association). Риск предстоящего хирургического вмешательства рассчитывали с помощью шкалы EuroSCORE II.
За день до операции с использованием метода закрытых конвертов пациенты были разделены на две группы: «Целлекс» (n = 30) и контрольная (n = 30). В группе «Цел-лекс» пациенты получали данный препарат (АО «Фарм-Синтез», Россия) по 1,0 мл (0,1 мг) подкожно в течение 8 сут. начиная со дня перед операцией. В контрольной группе пациенты получали эквивалентный объем 0,9% NaCl. Пациенты не были информированы о результатах рандомизации.
Индукция в анестезию осуществлялась пропофолом 1–1,5 мг/кг и фентанилом 5–7 мкг/кг. Миорелаксацию проводили пипекурония бромидом в дозировке 0,1 мг/кг с дальнейшим болюсным введением 0,015 мг/кг каждые 60 мин. Поддержание анестезии осуществляли севофлюра-ном 0,5–3,0 об%, ориентируясь на поддержание глубины анестезии по биспектральному индексу 40–60. Измерение церебральной оксигенации проводилось с помощью церебрального оксиметра Fore-Sight (CasMed Systems, США), отмечали церебральную оксигенацию в начале операции, после вводной анестезии и в конце операции. Кроме того, фиксировали минимальное значение церебральной оксигенации и продолжительность эпизодов церебральной десатурации в ходе операции. После вводной анестезии, в конце операции и через 24 ч после операции оценивали частоту сердечных сокращений, среднее артериальное давление, сердечный индекс, центральное венозное давление. Частота сердечных сокращений и артериальное давление оценивали также на 3-и и 7-е сут. после
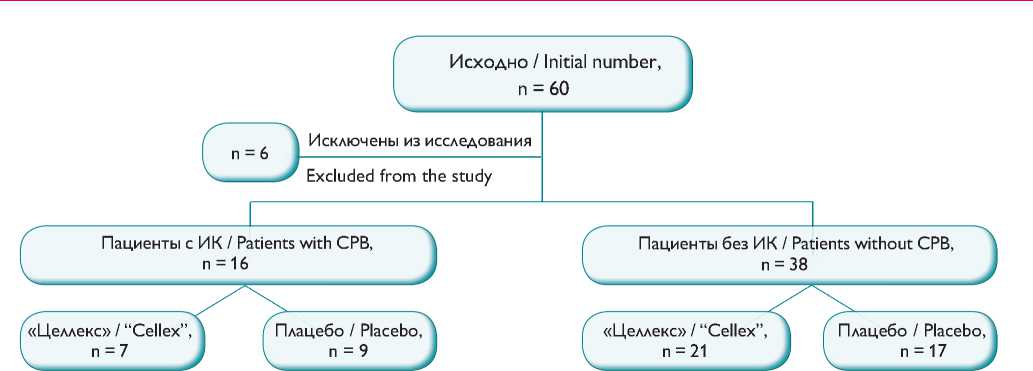
Рис. 1. Распределение пациентов, включенных в исследование
Примечание. ИК — искусственное кровообращение, n — объем выборки
Fig. 1. Randomization of patients included in the study.
CPB , cardiopulmonary bypass; n , sample size
операции. Анализ газов артериальной и венозной крови проводили с помощью аппаратов ABL80 и ABL800Flex (Radiometer, Дания) после вводной анестезии, в конце операции и через 24 ч после операции.
Искусственное кровообращение осуществляли аппаратом Jostra HL 20 (Maquet, Швеция) или Sorin C5 (Sorin Group, Италия). Скорость перфузии рассчитывали исходя из индекса перфузии 2,5 л/мин/м2. Для кардиоплегии использовали холодный раствор Бретшнайдера (Кустодиол, Др. Франц Келер Хеми ГмбХ, Германия), который доставляли антеградно, однократно, в объеме 2 л после наложения зажима на аорту. Прекращение ИК осуществляли плавно, поэтапно, с применением электрокардиостимуляции в асинхронном режиме. При развитии сердечной недостаточности (сердечный индекс менее 2,0 л/мин/м2) использовали постоянную внутривенную инфузию добутамина в дозе 3–10 мкг/кг/мин и/или адреналина в дозе 0,05–0,2 мкг/кг/мин и/или норадреналина в дозе 0,05–0,2 мкг/кг/мин.
В послеоперационном периоде все больные получали комплекс мер интенсивной терапии, включавший инфузионную терапию, респираторную, вазопрессорную и инотропную поддержку, анальгезию, антибио-тикопрофилактику, дезагреганты, антикоагулянты, кардиотропные препараты, диуретики, профилактику стрессовых язв желудочно-кишечного тракта. Гипергликемию корригировали подкожным или внутривенным введением инсулина с ориентиром на уровень глюкозы крови в пределах 4–10 ммоль/л.
Первичной точкой исследования являлся уровень когнитивных функций, оцениваемый с помощью Монреальской шкалы оценки когнитивной функции (англ.
Montreal Cognitive Assessment, МоСА) за 12 ч до хирургического вмешательства. Данную шкалу рекомендуют эксперты в области когнитивных нарушений для широкого применения в клинической практике [6]. С помощью Монреальской шкалы оценивают различные когнитивные сферы: внимание и концентрацию, исполнительные функции, память, язык, зрительно-конструктивные навыки, абстрактное мышление, счет и ориентацию. Время проведения теста составляет 10 мин, максимально возможное количество баллов — 30. Об отсутствии когнитивной дисфункции свидетельствуют 26 и более баллов. Проведение теста обеспечивалось специально обученным сотрудником, который не знал, в какую группу рандомизировали больных. Повторно состояние больного по шкале МоСА оценивали на 3-и и 7-е сут. после операции. Послеоперационный когнитивный дефицит определяли как снижение MoCA к 7-м сут. послеоперационного периода, по сравнению с до-операционным уровнем, на 2 балла и более.
Перед операцией, после оценки по МоСА у 27 пациентов исследовали сывороточную концентрацию белка S100b. Забор образца крови осуществлялся из периферической вены. Концентрацию S100b определяли с использованием полностью автоматизированного иммунолюминесцентного анализа (Сobas e 411, Roche Diagnostic). Повторные заборы образцов сыворотки крови для определения концентрации белка S100b проводили через 3 и 7 сут. после операции.
У всех пациентов регистрировали расход препаратов для анестезии, продолжительность операции и послеоперационной искусственной вентиляции легких, длительность послеоперационного пребывания в от-
Таблица 1 Общие характеристики обследованных пациентов
|
Показатель |
Группа |
||
|
«Целлекс», n = 28 |
контрольная, n = 26 |
р |
|
|
Возраст, лет |
65 (60–71) |
64 (55–69) |
0,32 |
|
Пол, женский/мужской, n |
14/14 |
12/14 |
0,78 |
|
EuroSCORE II, % |
1,6 (1,0–2,8) |
1,3 (0,8–2,4) |
0,23 |
|
Продолжительность вмешательства, мин |
251 (175–250) |
198 (168–254) |
0,66 |
|
Продолжительность искусственной вентиляции легких, ч |
7,48 (5,8–9,68) |
6,8 (5,43– 8,16) |
0,35 |
|
Операции с искусственным кровообращением, n (%) |
7 (25) |
9 (35) |
0,62 |
Примечание. EuroSCORE (European System for Cardiac Operative Risk Evaluation) — Европейская система оценки риска кардиохирургического вмешательства; n — объем выборки, р — вероятность ошибки при отклонении нулевой гипотезы (тест Манна – Уитни)
делении реанимации и интенсивной терапии и общую продолжительность госпитализации, смертность на 28-й день. Длительность послеоперационной интенсивной терапии фиксировали при достижении больным критериев для перевода из отделения реанимации и интенсивной терапии в профильное отделение, а именно наличие ясного сознания, SpO2 более 90% при фракции кислорода во вдыхаемом воздухе менее 0,5, отсутствие желудочковой аритмии и признаков ишемии миокарда по данным электрокардиографии, отсутствие потребности в инотропной и вазопрессорной поддержке, темп дренажных потерь менее 50 мл/ч, темп диуреза более 0,5 мл/кг/ч.
Выписка пациентов из стационара осуществлялась при достижении следующих критериев: гемодинамическая стабильность, независимость в передвижении и кормлении, отсутствие гипертермии более 38 °С, отсутствие очевидных признаков инфекции, нормальные мочеиспускание и дефекация, купирование болевого синдрома оральными препаратами и толерантность к физической нагрузке. Врач, ответственный за выписку из стационара, не знал о группе распределения пациентов.
Статистический анализ
Статистический анализ проводили, используя пакет программ SPSS (версия 17.0; SPSS Inc., Чикаго). Данные представлены как медиана (25–75-го процентилей). Межгрупповые сравнения производили с использованием критерия Манна – Уитни. Внутригрупповые сравнения проводили при помощи теста Фридмана и post hoc критерия Уилкоксона. Анализ дискретных данных выполняли путем оценки критерия χ 2 или точного критерия Фишера (при количестве наблюдений менее 5). Корреляционный анализ проводили с использованием коэффициента корреляции Спирмена (rho) . Статистически достоверными считали различия при p<0,05.
Результаты
Мы не выявили исходных различий групп по возрасту и полу, риску вмешательства по шкале EuroSCORE II, а также когнитивной функции. Начальная оценка по MoCA в общей выборке составила 26 (22–27) баллов. Из дальнейшего исследования исключены 6 пациентов, у которых не удалось оценить когнитивную функцию на 3-и и 7-е сут. после оперативного вмешательства
Таблица 2 Показатели гемодинамики и транспорта кислорода
|
Группа |
||||||
|
Показатель |
«Целлекс», n |
= 28 |
контрольная, n = 26 |
|||
|
начало |
после индук- |
конец |
начало |
после индук- |
конец |
|
|
операции |
ции в анестезию операции |
операции |
ции в анестезию |
операции |
||
|
Среднее артериальное давление, мм рт. ст. |
97 (88–110) |
75 (65–82)* |
74 (69–64)* |
90 (85–91) |
70 (64–80)* |
74 (70–83)* |
|
Церебральная оксигенация, % |
68 (65–71) |
69 (66–73) |
68 (63–76) |
67 (65–69) |
69 (65–72) |
69 (65–72) |
|
Частота сердечных сокращений, уд./мин |
75 (65–80) |
55 (50–64)* |
62 (55–80) |
72 (69–80) |
57 (49–70)* |
70 (56–80) |
|
Таблица 3 Концентрация белка S100b в плазме крови |
|||||
|
Группа |
|||||
|
Показатель |
«Целлекс», n = 28 |
контрольная, n = 26 |
|||
|
до операции |
на 3-и сут. |
на 7-е сут. до операции |
на 3-и сут. |
на 7-е сут. |
|
|
S100b, мкг/л |
0,06 (0,044– 0,094) |
0,104 (0,065–0,207)* |
0,058 (0,052– 0,055 (0,043–0,07) ,) |
0,085 (0,059– 0,104)* |
0,06 (0,050– 0,113) |
Примечание. * p<0,05 при внутригрупповом сравнении со значениями в начале операции
(рис. 1). Общая длительность вмешательства составила 205 (173–250) мин, продолжительность искусственной вентиляции легких — 423 (343–569) мин, при межгрупповом сравнении эти показатели, а также количество больных, прооперированных с использованием ИК, и время ИК достоверно не различались (табл. 1).
Периоперационные показатели гемодинамики, церебральной оксигенации и концентрация S100b в плазме крови достоверно не различались между группами (табл. 2, 3). В обеих группах в ходе операции отмечали снижение среднего артериального давления и частоты сердечных сокращений. Концентрация белка S100b на 3-и сут. после операции повышалась на 30–40% от исходных значений обеих групп, p<0,05.
До операции когнитивная дисфункция (менее 26 баллов по шкале МоСА) отмечалась у 13 (46%) больных в группе «Целлекс» и у 11 (42%) больных в контрольной группе, p = 0,761. В обеих группах наблюдали преходящее снижение когнитивных функций по шкале МоСА к 3-м сут. после вмешательства (табл. 4) по сравнению с предоперационными значениями, p<0,01. К 7-м сут. в контрольной группе сохранялась когнитивная дисфункция по сравнению с исходом, p = 0,003, в то время как в группе «Целлекс» количество баллов по МоСА не отличалось от предоперационных значений, p = 0,466. При этом в контрольной группе было в 3 раза больше пациентов, имеющих когнитивный дефицит (снижение MoCA к 7-м сут. раннего послеоперационного периода на 2 и более балла), по сравнению с группой «Целлекс», p = 0,001. Кроме того, в группе «Целлекс» наблюдалась тенденция к уменьшению выраженности когнитивной дисфункции по шкале MoCA через 7 сут. после оперативного вмешательства по сравнению с контрольной группой, p = 0,063.
После применения ИК количество баллов по MoCA cнижалось к 3-м сут. на 22%, а к 7-м сут. — на 11% по сравнению с исходными значениями, p<0,01 (табл. 5), что свидетельствует о когнитивном дефиците, в то время как в группе без использования ИК количество баллов по МоСА достоверно уменьшалось лишь на 3-и сут., а на 7-е сут. не отличалось от предоперационных значений, p = 0,807.
Кроме того, пациенты, оперированные с применением ИК, имели более высокую оценку риска по шкале EuroSCORE — 2,5 (1,2–3,0) % по сравнению с вмешательствами без ИК — 1,3 (0,9–2,0) %, р = 0,01. В группе пациентов c аортокоронарным шунтированием на работающем сердце (n = 38) не выявлено достоверных различий по МоСА между теми, кто получал «Целлекс» и плацебо. У больных, оперированных с ИК, отмечали достоверное снижение количества баллов по МоСА к 3-м сут. как в группе «Целлекс», так и в контрольной группе. Однако при назначении препарата «Целлекс» оценка по MoCА к 7-м сут. не отличалась от предоперационных значений, p = 0,339, в контрольной же группе когнитивная дисфункция сохранялась, p = 0,011 (рис. 2). Межгрупповой разницы на 7-е сут. не обнаружено.
Таблица 4 Показатели когнитивной функции по Монреальской шкале
|
Показатель до операции |
Группа |
|||
|
«Целлекс», n = 28 |
контрольная, n = 26 |
|||
|
на 3-и сут. |
на 7-е сут. |
до операции на 3-и сут. |
на 7-е сут. |
|
|
MoCA, балл 25 (22–24) Периоперационный когнитивный дефицит к 7-м сут., чел. (%) |
23 (19–26)* 5 (18)** |
25 (24–27) |
25 (22–28) 24 (21–24)* 16 (62) |
24 (22–26)* |
Примечание. MoCA — Монреальская шкала оценки когнитивной функции; * p<0,05 при внутригрупповом сравнении со значениями в начале операции; ** p<0,05 при сравнении с контрольной группой
Таблица 5 Количество баллов по Монреальской шкале у пациентов с искусственным кровообращением и без искусственного кровообращения
|
Операции |
||||
|
Показатель |
с искусственным кровообращением |
без искусственного кровообращения |
||
|
до операции на 3-и сут. |
на 7-е сут. |
до операции на 3-и сут. |
на 7-е сут. |
|
|
MoCA, балл |
27 (25–28) 21 (22–28)* |
24 (22–28)* |
25 (22–27) 23 (20–24)* |
25 (23–27) |
Примечание. MoCA — Монреальская шкала оценки когнитивной функции; * p<0,05 при внутригрупповом сравнении со значениями в начале операции
Примечательно, что в ходе работы выявлена корреляционная связь между показателем церебральной оксигенации от обоих полушарий головного мозга и уровнем парциального давления углекислого газа в крови на начало и конец оперативного вмешательства, rho = 0,305, p = 0,033, n = 49 и rho = 0,533, p<0,001, n = 48 соответственно (рис. 3).
Обсуждение
В нашем исследовании показано, что применение препарата «Целлекс» может способствовать более полному восстановлению когнитивных функций после операции на сердце.
Дисфункция центральной нервной системы увеличивает сроки госпитализации и стоимость лечения, приводит к возникновению осложнений со стороны других органов и систем и ухудшает качество жизни больного [7, 8]. По классическому определению L.S. Rasmussen [9], послеоперационная когнитивная дисфункция (ПОКД) — это когнитивное расстройство, развивающееся в ранний и сохраняющееся в поздний послеоперационный период, клинически проявляющееся в виде нарушений памяти и других высших корковых функций и подтвержденное данными нейропсихологического тестирования в виде снижения показателей в послеоперационный период не менее чем на
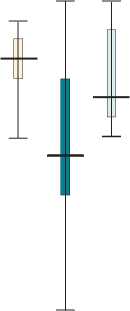
*
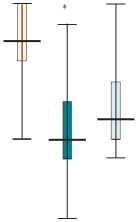
До операции / Before surgery z 3-и сут. после операции / 3 days after surgery z 7-е сут. после операции / 7 days after surgery
«Целлекс» / “Cellex”
Плацебо / Placebo
Рис. 2. Динамика количества баллов по Монреальской шкале оценки когнитивной функции (MoCA) в обследованных группах при операциях с искусственным кровообращением
Примечание. * p<0,05 при внутригрупповом сравнении со значениями в начале операции
Fig. 2. Montreal Cognitive Assessment (MoCa) score dynamics in groups under study when performing on-pump surgery. * p<0.05 when performing intergroup comparison with baseline values
A
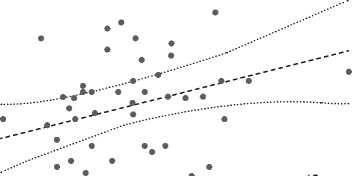
n = 49 rho = 0,30 p = 0,03
B
О
60 .

n = 48 rho = 0,53 p<0,001
55 Н । । । i iг
25 30 35 40 45 5055
I I I Iг
30 35 40 45 5055
PaCO2, мм рт. ст. / PaCO2, mm Hg
PaCO2, мм рт. ст. / PaCO2, mm Hg
Рис. 3. Взаимосвязь между показателями церебральной оксигенации (SctO2) и уровнем парциального давления углекислого газа в крови (PaCO2) на начало ( А ) и конец ( B ) оперативного вмешательства
Fig. 3. Interrelationship between the cerebral oxygenation variables and the level of CO2 partial pressure in blood by the beginning ( А ) and at the end ( B ) of intervention. SctO2 , cerebral oxygenation; PaCO2 , CO2 partial pressure in blood
10% от дооперационного уровня. Результаты крупных исследований показали, что ПОКД чаще развивается при кардиохирургических вмешательствах, что связано с потенциально большим риском периоперационных осложнений [10].
При операциях без использования ИК повреждающими факторами могут служить гипотензия, анемия, гипоксемия, генетические факторы, воздействие препаратов для анестезии, наличие предшествующей неврологической патологии [11]. Операции с применением ИК дополнительно могут сопровождаться более выраженной системной воспалительной реакцией, реперфузионными осложнениями, а также эмболизацией пузырьками воздуха и твердыми (артериальная атеросклеротическая бляшка) частицами как из места операции, так и при наложении или снятии зажима с аорты [12].
Несмотря на большое количество публикаций в области изучения причин проблемы ПОКД, факторы риска и предикторы развития до сих пор остаются до конца не выявленными. Тем не менее установлены отдаленные последствия данных нарушений, доказано, что они ассоциируются с ранней утратой трудоспособности и повышением зависимости от общества. Это является значимой проблемой для пациентов, их родственников и медицинских работников и ведет к увеличению потребности в медицинской помощи и росту расходов системы здравоохранения. Более того,
ПОКД ассоциируется с повышенной смертностью в течение 10 лет после операции [13].
В нашем исследовании мы наблюдали преходящее снижение когнитивных способностей к 3-м сут. у 100% больных в обеих группах, с последующей регрессией когнитивного дефицита к 7-м сут. в группе «Целлекс». Динамика развития когнитивного дефицита к 3-м сут. согласуется с другими работами, в которых изучали выраженность ПОКД в кардиохирургии [14]. В литературе появляется все больше данных о роли нейровоспаления как универсального механизма, лежащего в основе многих заболеваний нервной системы [15, 16]. Помимо этого, установлено, что общая анестезия вызывает повышение проницаемости мембран митохондрий, приводя к их дисфункции, нарушает кальциевый гомеостаз в нейронах, угнетает энергетические процессы, запуская в итоге апоптоз нейрона [17]. Это подтверждается повышением белка S100b, характеризующего тяжесть нейронального повреждения, в нашей работе и согласуется с результатами исследований других авторов по этой проблеме [18, 19].
С учетом мультифакторного генеза ПОКД и участия в ее развитии таких механизмов, как нейровоспаление и апоптоз, представляется перспективным исследование у этой категории больных препаратов с нейропротек-торными эффектами. Вместе с тем в опубликованном обзоре результатов 24 рандомизированных клиничес- ких исследований, в которых изучали влияние различных фармакологических агентов (лидокаин, сульфат магнезии, эритропоэтин, аторвастатин, пирацетам, ри-вастигмин, 17β-эстрадиол и др.), отмечено значительное методологическое несоответствие ряда исследований и, как следствие, противоречивость полученных результатов [20]. Отсутствие большого количества клинических работ при возрастающей потребности практического здравоохранения в методах защиты головного мозга во время анестезии делает актуальным дальнейшее изучение методов фармакологической профилактики и коррекции послеоперационной когнитивной дисфункции.
Одним из препаратов, обладающих нейрорепара-тивным действием за счет стимуляции концентрации пула нейротрансмиттеров, является «Целлекс». Прямое репаративное действие «Целлекс» на нейрональный и глиальный клеточные пулы нервной ткани доказано в экспериментах на лабораторных животных в моделях острого ишемического повреждения мозга и глутаматной токсичности [21]. Установлено, что первичное нейропротективное действие «Целлекс» обусловлено прерыванием апоптоза в зоне пенумбры с уменьшением перифокального отека и увеличением реперфузии, стимуляцией нейрогенеза с направленной миграцией нейрональных стволовых клеток и нейробластов к области повреждения. Следует отметить, что контролируемых исследований по применению «Целлекс» в периопера-ционном периоде у кардиохирургических пациентов до настоящего времени не выполняли.
В проведенном исследовании установлено, что пе-риоперационное применение «Целлекс» в дозе 0,1 мг в сутки уменьшало выраженность ПОКД, согласно шкале MoCA, на 7-е сут. послеоперационного периода, что, на наш взгляд, связано с тканеспецифичным репаративным действием препарата. Схожие результаты были получены при использовании «Целлекс» у больных после острого нарушения мозгового кровообращения [5].
При дополнительном анализе пациентов, которым проводились операции с применением ИК и без него, обнаружена разница между количеством баллов по MoCA до операции и на 7-е сут. послеоперационного периода, p = 0,011. Более того, в отличие от операций на работающем сердце, в группе с ИК когнитивные функции у пациентов, получавших «Целлекс», были ближе к предоперационным значениям по сравнению с контрольной группой. Данные результаты объясняются агрессивным влиянием ИК на центральную нервную систему, а также более тяжелой степенью сердечной недостаточности у пациентов, которым требуется применение ИК. Ускоренное восстановление центральной нервной системы с комплексным воздействием факторов роста и дифференцировки сигнальных молекул является одним из эффектов «Целлекс». В связи с этим, кардиохирургические больные, оперированные с ИК, могут представлять интерес для продолжения исследования данного препарата.
Кроме того, нами отмечена корреляционная связь между показателем церебральной оксигенации от обоих полушарий головного мозга и уровнем парциального давления углекислого газа в крови на начало и конец оперативного вмешательства. Это объясняется естественным физиологическим влиянием уровня парциального давления углекислого газа в крови на реактивность сосудов головного мозга. Взаимосвязь интраоперационной гипокапнии с ухудшением церебральной оксигенации подтверждается и другими исследованиями [22, 23].
Заключение
Применение препарата «Целлекс» в периопераци-онном периоде кардиохирургических вмешательств может способствовать более раннему регрессу послеоперационной когнитивной дисфункции; этот эффект наиболее выражен у пациентов, которым требовалось искусственное кровообращение.
Финансирование
Исследование проводилось при грантовой поддержке АО «Фарм-Синтез». Грант использован на приобретение препарата, гонорар авторскому коллективу и покупку набора для определения концентрации белка S100b. Спонсорская поддержка не оказывала влияния на дизайн исследования, сбор, анализ и интерпретацию данных. Написание и публикация статьи также проводились без участия представителей АО «Фарм-Синтез».
Список литературы Полипептидная нейропротекция для профилактики когнитивной дисфункции после кардиохирургических вмешательств: пилотное проспективное плацебо- контролируемое рандомизированное исследование
- Alston R.P. Brain damage and cardiopulmonary bypass: is there really an association? Perfus/on. 2011;26 Suppl 1:20-6. PMID: 21933818. DOI: 10.1177/0267659111408756
- Tanaka H., Katura T. Classification of change detection and change blindness from near-infrared spectroscopy signals. J B/omed Opt. 2011;16(8):087001. PMID: 21895328. https://doi. org/ DOI: 10.1117/1.3606494
- Ghanayem N.S., Mitchell M.E., Tweddell J.S., Hoffman G.M. Monitoring the brain before, during and after Cardiac surgery to improve longterm neurodevelopmental outcomes. Card/oi Young. 2006;16 Suppl 3:103-9. PMID: 17378048.
- Послеоперационная когнитивная дисфункция и принципы церебропротекции в современной анестезиологии: Учебное пособие для врачей. Под ред. А.М. Овезова. М.: тактик-студио, 2015. 56 с.
- Пизова Н.В., соколов М.А., Измайлов И.А. Целлекс в лечении больных с острым нарушением мозгового кровообращения: результаты российского многоцентрового сравнительного открытого клинического исследования. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(5):22-26. Режим доступа: https://www.mediasphera.ru/issues/zhurnal-nevrologii-i-psikhiatrii- im-s-s-korsakova/2014/5/031997-7298201454


