Полный патоморфологический регресс местнораспространенного трижды негативного рака молочной железы после неоадъювантной химиотерапии: клинический случай
Автор: Константинова В.В., Дашян Г.А., Ахмедов Р.М., Белоусов А.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Актуальность. Трижды негативный рак молочной железы является наиболее агрессивным молекулярным подтипом среди злокачественных опухолей молочной железы. Из-за высокой пролиферативной активности опухолевых клеток и отсутствия мишеней для таргетной терапии основным методом в комплексном лечении данного подтипа является своевременное и обоснованное назначение неоадъювантной химиотерапии. Оптимальное время начала неоадъювантной химиотерапии определяется как менее 8 нед, превышение этого периода может влиять на эффективность лечения, а также приводить к местному или системному прогрессированию опухолевого процесса. Достижение полного патоморфологического регресса на фоне неоадъювантной химиотерапии обеспечивает снижение относительного риска рецидива более чем на 70 %, что, в свою очередь, ведет к значимому улучшению долгосрочной выживаемости данной когорты пациентов. Описание клинического случая. Пациентка 32 лет обратилась в клинику спустя 15 мес после постановки диагноза трижды негативного рака молочной железы. На протяжении 15 мес пациентка лечилась методами альтернативной медицины, и на момент обращения зарегистрирован выраженный местный рост опухоли с массивным распадом, симптомами опухолевой интоксикации и нутритивных нарушений. На фоне симптоматической и поддерживающей терапии проведена неоадъювантная химиотерапия: 12 циклов паклитаксел + карбоплатин в еженедельном режиме с последующими 4 циклами доксорубицин + циклофосфамид в дозоуплотненном режиме. На фоне лечения отмечается выраженная положительная динамика в виде значительного уменьшения размера опухоли, улучшения общего состояния больной. Клинически значимых побочных эффектов, потребовавших госпитализации или редукции дозы препарата, не наблюдалось. По завершении неоадъювантного этапа лечения пациентке выполнена радикальная мастэктомия по Madden слева. По результатам гистологического исследования послеоперационного материала достигнут полный патоморфологический регресс первичной опухоли и регионарных лимфоузлов. В адъювантном режиме назначена дистанционная лучевая терапия. Спустя 3 года после постановки диагноза и 1,5 года после завершения комплексного лечения пациентка продолжает жить полноценной жизнью и планирует отсроченную реконструкцию удаленной левой молочной железы с аугментационной маммопластикой справа.
Трижды негативный рак молочной железы, полный патоморфологический регресс, неоадъювантная химиотерапия, дозоуплотненный режим
Короткий адрес: https://sciup.org/140307084
IDR: 140307084 | УДК: 618.19-006.6-08-091.8:615.28 | DOI: 10.21294/1814-4861-2024-23-4-186-193
Текст научной статьи Полный патоморфологический регресс местнораспространенного трижды негативного рака молочной железы после неоадъювантной химиотерапии: клинический случай
Рак молочной железы (РМЖ) на протяжении многих десятилетий занимает лидирующие позиции в заболеваемости женщин по всему миру и до сих пор остается одной из главных причин смертности от онкологических заболеваний [1]. Столкнувшись с онкологическим диагнозом, многие пациенты впадают в отчаяние и ищут дополнительные методы лечения вместо стандартной терапии рака. Специалисты альтернативной медицины зачастую предлагают полное излечение от болезни и отсутствие побочных эффектов, что подталкивает пациентов отказаться от общепринятых методов лечения. L.M. Kempppainen et al. [2] проанализировали использование комплементарной и альтернативной медицины в Европе за 2018 г. и сделали вывод, что более 25 % населения Европы регулярно прибегают к неофициальной медицине для лечения менее серьезных заболеваний, таких как боль в шее и аллергия, которую некоторые врачи назначают в качестве плацебо с небольшим количеством побочных эффектов.
В большинстве случаев пациенты обращаются к альтернативной медицине в дополнение к стандартному противоопухолевому лечению, например, для коррекции психоэмоционального состояния, депрессии и болевого синдрома, несмотря на слабую доказательную базу и отсутствие стандартизированных подходов в этой области [3]. Однако нередки случаи полного отказа от официального лечения в пользу альтернативных методов, что приводит к местному или системному прогрессированию основного заболевания и представляет угрозу жизни пациента.
Время до лечения (time-to-treatment, TTT) в последние годы все больше привлекает внимание исследователей и становится важным прогностическим фактором в лечении рака молочной железы. Этот показатель определяется как период от постановки диагноза или первичной консультации до начала специфического лечения. Известно, что увеличение времени до лечения достоверно ассоциировано со снижением общей и безрецидивной выживаемости [4]. В ретроспективном исследовании A.C. Polverini et al. (2016), включающем 420 792 пациентки, пролеченных хирургическим путем на первом этапе, показано увеличение времени от постановки диагноза до хирургического лечения в зависимости от стадии РМЖ. Увеличение времени до хирургического лечения >12 нед связано со снижением общей выживаемости (отношение рисков (hazard ratio, HR) 1,14, 95 % доверительный интервал (ДИ) 1,09–1,20). При стратификации по стадиям у пациенток с РМЖ I стадии, получавших лечение в течение 8–12 нед (HR 1,07, 95 % ДИ 1,02–1,13) и >12 нед (HR 1,19, 95 % ДИ 1,11–1,28), а также у пациенток с РМЖ II стадии, получавших лечение через >12 нед (HR 1,16, 95 % ДИ 1,08–1,25), наблюдалось снижение общей выживаемости по сравнению с больными, пролеченными менее чем через 4 нед после постановки диагноза [5].
В настоящее время системному лечению более агрессивных молекулярных подтипов РМЖ, таких как трижды негативный и HER2-позитивный, отводится первостепенная роль, поэтому оптимальная тактика лечения в таких случаях включает в себя проведение неоадъювантной системной терапии. Влияние времени от постановки диагноза до начала неоадъювантной химиотерапии (НАХТ) изучалось D. Livingston-Rosanoff et al. [6]. В анализ включено 12 806 пациенток с РМЖ I–III стадии; среднее время от первоначального диагноза до начала НАХТ составило 4 нед, более 90 % пациенток начали лечение в течение 8 нед после постановки диагноза, независимо от молекулярного подтипа. Авторы не обнаружили связи между временем начала НАХТ и выживаемостью при HER2-положительном раке (HR 0,91; 95 % ДИ 0,74–1,12) и трижды негативном РМЖ (HR1,10; 95 % ДИ 0,97–1,24), однако отмечается, что исследование имеет определенные ограничения: большинство пациенток начали НАХТ в течение 8 нед после постановки диагноза, поэтому невозможно оценить различия в выживаемости, связанные с более длительными задержками (>8 нед). На данный момент большинство исследователей сходятся во мнении, что оптимальное начало неоадъювантного лечения РМЖ составляет менее 8 нед.
Представленный клинический случай демонстрирует успешное применение НАХТ в лечении распадающейся опухоли молочной железы спустя 15 мес с момента постановки диагноза. Сложность в выборе оптимальной тактики лечения обусловлена запущенностью опухолевого процесса, агрессивностью молекулярного подтипа первичной опухоли, наличием выраженной опухолевой интоксикации и тяжестью общего состояния больной. Клиническая и социальная значимость представленного случая заключается в важности своевременной диагностики и лечения злокачественных опухолей, а также в опасности применения недоказательных методов терапии в отношении РМЖ. Клинический случай публикуется в соответствии с критериями CARE для представления клинических случаев, разработанными D.S. Riley et al. в 2017 г. [7].
Клинический случай
Пациентка О., 32 лет, впервые обратилась в Клинику высоких медицинских технологий им. Н.И. Пирогова СПБГУ в октябре 2021 г. с жалобами на общую слабость, увеличение левой молочной железы в размерах и отделяемое из нее. Из анамнеза: в июле 2020 г. самостоятельно обнаружила образование в левой молочной железе, в связи с чем обратилась к онкологу по месту жительства, выполнено УЗИ молочных желез: в левой молочной железе в верхне-наружном квадранте в 2 см от соска определялось гипоэхогенное очаговое образование с нечеткими неровными контурами, размерами 24×15×16мм, BI-RADS MS 4c. Выполнена core-биопсия этого образования. Гистологическое заключение (№ 20537–2020, 21.08.20): инвазивная карцинома неспецифического типа, G3. Заключение иммуногистохимического исследования № 553.20: ER – 0, PR – 0, HER2 – 0, Ki67 – 90 %. Трижды негативный подтип. Установлен диагноз: Рак левой молочной железы cT2N0M0 G3 (трижды негативный подтип), IIb стадия. Решением онкологического консилиума назначена неоадъювантная химиотерапия по схеме: 4 цикла AC с последующими 4 циклами препаратом Доцетаксел. 28.08.20 проведен 1-й цикл НАХТ по схеме АС. От второго введения и дальнейшего специального лечения пациентка отказалась, выбрав методы альтернативной и гомеопатической медицины. Спустя несколько месяцев альтернативного лечения отмечен продолженный рост опухоли с образованием свищевого отверстия на коже молочной железы. Летом 2021 г. в связи с развившейся опухолевой интоксикацией, кровотечением из язвенного дефекта молочной железы, синдромом нутритивных нарушений и анемией тяжелой степени экстренно доставлена в стационар, где проведена первичная хирургическая обработка язвенного дефекта молочной железы, гемостатическая терапия, а также коррекция нутритивных нарушений и гематологических показателей. В проведении специального противоопухолевого лечения отказано ввиду распространенности процесса и тяжести общего состояния, в связи с чем пациентка обратилась в Клинику высоких медицинских технологий им. Н.И. Пирогова СПБГУ.
При осмотре на момент обращения: состояние средней степени тяжести, обусловленное распространением и осложнениями опухолевого процесса, ECOG – 2, индекс Карновского – 60 %. Локальный статус: левая молочная железа резко увеличена в размерах, отечна, с участками распада, занимающими большую часть железы, поверхность контактно кровоточива (рис. 1). Выполнено УЗИ молочных желез (03.09.20): левая молочная железа асимметрично увеличена в размерах, осмотрена на отдельных фрагментах, где нет язвенных дефектов на коже. Структура молочной железы представлена бесформенной тканью, где не прослеживаются ни жировые дольки, ни железистая ткань. В структуре этой ткани, особенно в глубоких отделах, множественные кальцинаты в виде россыпи. Отдельного узла как такого нет. На всю толщу выполнить УЗ-исследование не представляется возможным из-за больших размеров увеличенной железы. Кожа изменена за счет язвенных дефектов. В подмышечной впадине слева лоцируются множественные лимфоузлы, сливающиеся друг с другом, округлой формы, размерами до 2,0 см, кора узлов утолщена до 6,3 мм, кровоток усилен в области ворот и в коре. Отдельные лимфоузлы представлены гипоэхогенными образованиями, без сердцевины. КТ органов грудной клетки с внутривенным контрастированием (22.09.21): образование левой молочной железы с ровными, четкими контурами, размерами 12,5×17,8 см, неоднородного характера за счет разнокалиберных фрагментов газа. Отмечается выпот в подкожно-жировой клетчатке левой молочной железы толщиной слоя до 11 мм. Подмышечные лимфоузлы слева представлены в большом количестве, увеличены до 16 мм. По данным комплексного обследования отдаленных метастазов не выявлено. Молекулярно-генетическое исследование на наличие наследственных мутаций, ассоциированных с риском развития рака молочной железы, методом NGS (15.11.21): мутаций не обнаружено. Заключение онкологической комиссия (21.10.21): с учетом гистологического подтипа опухоли (инвазивная карцинома неспецифического типа G3, трижды негативный молекулярный подтип, Ki67 – 90 %), незавершенной полихимиотерапии (ПХТ) принято решение о проведении химиотерапии по схеме паклитаксел + карбоплатин.
21.10.21 пациентка госпитализирована для проведения химиотерапии по схеме паклитаксел + карбоплатин. С учетом язвенного дефекта, распада опухоли и инфицирования раны выполнялись ежедневные перевязки, сделан бактериологический посев с раневой поверхности для подбора антибактериальной терапии, по данным которого (1.11.21) выявлен обильный рост условно-патогенной микрофлоры (Escherichia coli, Enterococcus faecalis, Enterococcus faecium, Corynebacterium striatum). На основании антибиотикограммы, учитывая последующую цитостатическую терапию, подобрана антибиотикотерапия: линезолид + меропенем. C 21.10.21 по 20.01.22 проведено 12 циклов ПХТ по схеме паклитаксел + карбоплатин в еженедельном режиме: паклитаксел 80 мг/м2 + карбоплатин AUC 2, цикл – 7 дней. При оценке эффекта химиотерапии отмечается выраженная положительная динамика в виде значительного уменьшения размера опухоли (рис. 2), улучшения общего состояния больной.
На фоне проводимой химиотерапии клинически значимых побочных эффектов, потребовавших госпитализации или редукции дозы препарата, не наблюдалось. С 7.02.22 по 28.03.22 проведено 4 цикла ПХТ по схеме АС в дозоуплотненном режиме: доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2, цикл 14 дней. В качестве профилактики фебрильной нейтропении и гематологической токсичности III и IV степени использован рекомбинантный гранулоцитарный колониестимулирующий фактор – эмпэгфилграстим 7,5 мг через 24 ч после окончания введения химиопрепаратов. По окончании запланированных циклов химиотерапии отмечалась выраженная клиническая регрессия первичной опухоли (рис. 3). При контрольной КТ
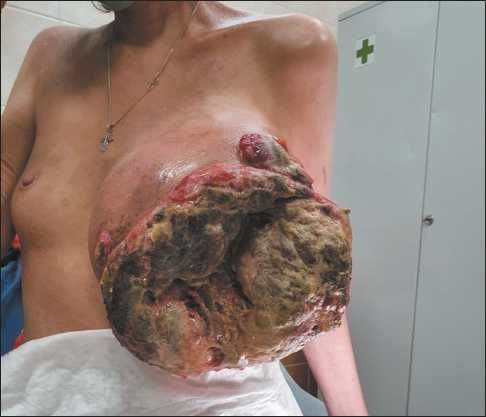
Рис. 1. Локальный статус на момент обращения. Примечание: фотография выполнена авторами Fig. 1. First visit examination.
Note: created by the authors
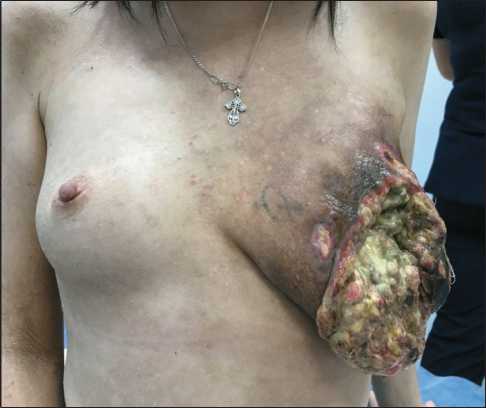
Рис. 2. Локальный статус после 12 введений 1-го блока химиотерапии по схеме паклитаксел + карбоплатин.
Примечание: фотография выполнена авторами
Fig. 2. Examination after 12 cycles of weekly paclitaxel-carbopla-tine chemotherapy. Note: created by the authors
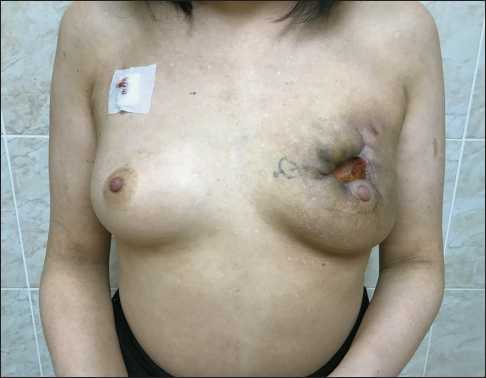
Рис. 3. Локальный статус по завершении последнего цикла химиотерапии. Примечание: фотография выполнена авторами
Fig. 3. Examination after completion of neoadjuvant chemotherapy. Note: created by the authors
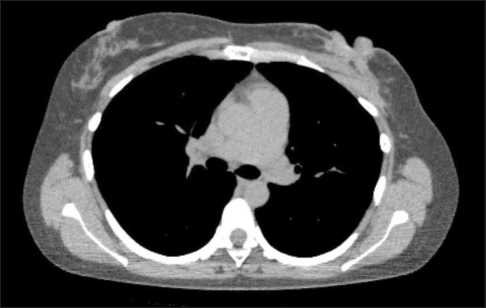
Рис. 4. Компьютерная томография органов грудной клетки после завершения всех запланированных циклов химиотерапии. Примечание: снимок выполнен авторами
Fig. 4. Computed tomography scan after completion of neoadjuvant chemotherapy. Note: created by the authors органов грудной клетки с внутривенным контрастированием по окончании НАХТ (25.04.23): в левой молочной железе, преимущественно в верхних квадрантах, определяется патологическое образование с втяжением и дефектом кожи, размерами 44×14 мм с неравномерным накоплением контрастного вещества. Частичная регрессия аксиллярной лимфаденопатии слева (рис. 4).
27.04.22 выполнена радикальная мастэктомия по Madden слева. По данным гистологического исследования послеоперационного материала (№ 44468 от 5.05.22): в левой молочной железе в проекции предсуществующей опухоли определяется лимфогистиоцитарная инфильтрация с обилием ксантомных клеток, гемосидерофагов, микрокальцинозом, гранулемами по типу инородных тел, фиброзом и гиалинозом стромы. Морфологическая картина может соответствовать V степени лечебного патоморфоза по Miller–
Payne. В 16 лимфатических узлах (0,1–1,5 см) реактивные изменения, очаговый липоматоз, без признаков метастатического поражения. С учетом полного патоморфологического ответа по первичной опухоли и регионарным лимфатическим узлам адъювантная химиотерапия не показана, рекомендована дистанционная лучевая терапия на область удаленной молочной железы и зоны регионарного лимфооттока. С июня 2022 г. по июль 2022 г. проведено 25 сеансов дистанционной лучевой терапии, клинически значимых побочных эффектов не наблюдалось. По данным контрольного обследования в сентябре 2023 г. не выявлено признаков местного или отдаленного прогрессирования. Спустя 3 года с момента постановки диагноза и 1,5 года после радикального лечения пациентка продолжает жить полноценной жизнью и планирует отсроченную реконструкцию удаленной левой молочной железы с аугментаци-онной маммопластикой справа.
Обсуждение
Трижды негативный РМЖ составляет 10–20 % всех случаев рака молочной железы и является наиболее агрессивным молекулярным подтипом, характеризующимся стремительным ростом, частым прогрессированием и отсутствием мишеней для таргетной терапии [8]. Современный стандарт лечения больных трижды негативным РМЖ включает неоадъювантную химиотерапию, хирургическое вмешательство и лучевую терапию, из которых системное лечение является основным. Ввиду высокой гетерогенности и агрессивности трижды негативного РМЖ неоадъювантная химиотерапия позволяет добиться полного патоморфологическо-го регресса (pCR) примерно у 30–40 % пациенток [9]. Больные, достигшие pCR после НАХТ, демонстрируют улучшение долгосрочных показателей выживаемости, что соответствует снижению относительного риска рецидива более чем на 70 % по сравнению с пациентками с частичным регрессом [10]. Подобно стандартному адъювантному режиму лечения, традиционная неоадъювантная химиотерапия основана на антрациклинах и таксанах [11]. Исторически сложилось так, что блок химиотерапии, включающий антрациклины, обычно назначают до введения таксанов, поскольку лечение антрациклиновыми антибиотиками было введено в клиническую практику раньше. В исследовании M. Zaheed et al. [12] значимых различий в показателях общей и безрецидивной выживаемости, а также в частоте полного патоморфологического регресса в зависимости от очередности введения таксанов до или после лечения антрациклинами не выявлено. В представленном клиническом случае мы выбрали нестандартную очередность введения химиопрепаратов, ожидая более выраженный клинический эффект от таксан-содержащей схемы перед антрациклинами на основании исследования
NeoSAMBA, опубликованного в 2020 г. [13]. В исследовании изучалось влияние очередности введения таксанов и антрациклинов на частоту полного патоморфологического регресса, а также общую и безрецидивную выживаемость у пациенток с местнораспространенным РМЖ (IIB–IIIB ст.). Полученные результаты продемонстрировали улучшение показателей общей и безрецидивной выживаемости при проведении таксан-содержащей схемы первым этапом (75,7 vs 48,2 % и 89,7 vs 64,7 % соответственно), а также небольшое увеличение частоты полного патоморфологического ответа (7 vs 3 %) при трижды негативном молекулярном подтипе. Профиль токсичности и степень тяжести побочных эффектов в исследуемых группах были сопоставимы.
Режим введения паклитаксела (еженедельный или 1 раз в 3 нед) значимо не влияет на общую и безрецидивную выживаемость, однако ввиду лучшей переносимости еженедельного режима и, следовательно, меньшей вероятности редукции дозы препарата у ослабленных пациентов такой режим введения предпочтителен [14]. Согласно рекомендациям Американского общества клинической онкологии (ASCO), добавление карбоплатина в схему неоадъювантной химиотерапии при трижды негативном РМЖ должно рассматриваться индивидуально [15]. Метаанализ, проведенный J.G.P Pandy et al. [16], показал, что комбинация паклитаксела с карбоплатином в неоадъювантном режиме увеличивает частоту полного пато-морфологического регресса у больных трижды негативным РМЖ (44,6 vs 27,8 %, p<0,0001) вне зависимости от наличия мутаций в генах BRCA . Опубликованные данные позволили предположить более значимый клинический эффект от химиотерапии при добавлении карбоплатина.
С учетом массивного распространения опухоли, агрессивности молекулярного подтипа, а также наличия пораженных регионарных лимфатических узлов было решено неоадъювантную химиотерапию проводить в дозоуплотненном режиме. По данным метаанализа Y. Ding et al. [17], дозоуплотненный режим введения химиопрепаратов в неоадъювантном режиме значимо увеличивает частоту полного патоморфологического регресса (на 35 % по сравнению со стандартным режимом
Список литературы Полный патоморфологический регресс местнораспространенного трижды негативного рака молочной железы после неоадъювантной химиотерапии: клинический случай
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Kemppainen L.M., Kemppainen T.T., Reippainen J.A., Salmenniemi S.T., Vuolanto P.H. Use of complementary and alternative medicine in Europe: Health-related and sociodemographic determinants. Scand J Public Health. 2018; 46(4): 448-55. https://doi.org/10.1177/1403494817733869.
- Sasaki Y., Cheon C., Motoo Y., Jang S., Park S., Ko S.G., Jang B.H., Hwang D.S. [Complementary and Alternative Medicine for Breast Cancer Patients: An Overview of Systematic Reviews]. Yakugaku Zasshi. 2019; 139(7): 1027-46. Japanese. https://doi.org/10.1248/yakushi.18-00215.
- Guay E., Cordeiro E., Roberts A. Young Women with Breast Cancer: Chemotherapy or Surgery First? An Evaluation of Time to Treatment for Invasive Breast Cancer. Ann Surg Oncol. 2022; 29(4): 2254-60. https://doi.org/10.1245/s10434-021-11102-x.
- Polverini A.C., Nelson R.A., Marcinkowski E., Jones V.C., Lai L., Mortimer J.E., Taylor L., Vito C., Yim J., Kruper L. Time to Treatment: Measuring Quality Breast Cancer Care. Ann Surg Oncol. 2016; 23(10): 3392-402. https://doi.org/10.1245/s10434-016-5486-7.
- Livingston-Rosanoff D., Hanlon B., Marka N., Vande Walle K., Stankowski-Drengler T., Schumacher J., Greenberg C.C., Neuman H., Wilke L.G. Time to initiation of neo-adjuvant chemotherapy for breast cancer treatment does not influence patient survival: A study of US breast cancer patients. Breast J. 2020; 26(4): 625-9. https://doi.org/10.1111/tbj.13625.
- Riley D.S., Barber M.S., Kienle G.S., Aronson J.K., von Schoen-Angerer T., Tugwell P., Kiene H., Helfand M., Altman D.G., Sox H., Werthmann P.G., Moher D., Rison R.A., Shamseer L., Koch C.A., Sun G.H., Hanaway P., Sudak N.L., Kaszkin-Bettag M., Carpenter J.E., Gagnier J.J. CARE guidelines for case reports: explanation and elaboration document. J Clin Epidemiol. 2017; 89: 218-35. https://doi.org/10.1016/j.jclinepi.2017.04.026.
- MacDonald I., Nixon N.A., Khan O.F. Triple-Negative Breast Cancer: A Review of Current Curative Intent Therapies. Curr Oncol. 2022; 29(7): 4768-78. https://doi.org/10.3390/curroncol29070378.
- Liedtke C., Mazouni C., Hess K.R., André F., Tordai A., Mejia J.A., Symmans W.F., Gonzalez-Angulo A.M., Hennessy B., Green M., Cristofanilli M., Hortobagyi G.N., Pusztai L. Response to Neoadjuvant Therapy and Long-Term Survival in Patients With Triple-Negative Breast Cancer. J Clin Oncol. 2023; 41(10): 1809-15. https://doi.org/10.1200/JCO.22.02572.
- Cortazar P., Zhang L., Untch M., Mehta K., Costantino J.P., Wolmark N., Bonnefoi H., Cameron D., Gianni L., Valagussa P., Swain S.M., Prowell T., Loibl S., Wickerham D.L., Bogaerts J., Baselga J., Perou C., Blumenthal G., Blohmer J., Mamounas E.P., Bergh J., Semiglazov V., Justice R., Eidtmann H., Paik S., Piccart M., Sridhara R., Fasching P.A., Slaets L., Tang S., Gerber B., Geyer C.E. Jr, Pazdur R., Ditsch N., Rastogi P., Eiermann W., von Minckwitz G. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014; 384(9938): 164-72. https://doi.org/10.1016/S0140-6736(13)62422-8. Erratum in: Lancet. 2019; 393(10175): 986. https://doi.org/10.1016/S0140-6736-(18)32772-7.
- Berry D.A., Cirrincione C., Henderson I.C., Citron M.L., Budman D.R., Goldstein L.J., Martino S., Perez E.A., Muss H.B., Norton L., Hudis C., Winer E.P. Estrogen-receptor status and outcomes of modern chemotherapy for patients with node-positive breast cancer. JAMA. 2006; 295(14): 1658-67. https://doi.org/10.1001/jama.295.14.1658. Erratum in: JAMA. 2006; 295(20): 2356.
- Zaheed M., Wilcken N., Willson M.L., O’Connell D.L., Goodwin A. Sequencing of anthracyclines and taxanes in neoadjuvant and adjuvant therapy for early breast cancer. Cochrane Database Syst Rev. 2019; 2(2). https://doi.org/10.1002/14651858.CD012873.pub2.
- Bines J., Small I.A., Sarmento R., Kestelman F., Silva S., Rodrigues F.R., Faroni L., Gonçalves A., Ebecken E., Maroun P., Millen E., Bonamino M. Does the Sequence of Anthracycline and Taxane Matter? The NeoSAMBA Trial. Oncologist. 2020; 25(9): 758-64. https://doi.org/10.1634/theoncologist.2019-0805.
- Bacinschi X.E., Anghel R.M., Toma P.I., Safta I., Ilie A., Ilie S.M. Pathologic Response After Weekly Paclitaxel versus Docetaxel in Operable Breast Cancer. Cancer Manag Res. 2020; 12: 1419-26. https://doi.org/10.2147/CMAR.S234527.
- Korde L.A., Somerfield M.R., Carey L.A., Crews J.R., Denduluri N., Hwang E.S., Khan S.A., Loibl S., Morris E.A., Perez A., Regan M.M., Spears P.A., Sudheendra P.K., Symmans W.F., Yung R.L., Harvey B.E., Hershman D.L. Neoadjuvant Chemotherapy, Endocrine Therapy, and Targeted Therapy for Breast Cancer: ASCO Guideline. J Clin Oncol. 2021; 39(13): 1485-505. https://doi.org/10.1200/JCO.20.03399.
- Pandy J.G.P., Balolong-Garcia J.C., Cruz-Ordinario M.V.B., Que F.V.F. Triple negative breast cancer and platinum-based systemic treatment: a meta-analysis and systematic review. BMC Cancer. 2019; 19(1): 1065. https://doi.org/10.1186/s12885-019-6253-5.
- Ding Y., Ding K., Yang H., He X., Mo W., Ding X. Does dose-dense neoadjuvant chemotherapy have clinically significant prognostic value in breast cancer?: A meta-analysis of 3,724 patients. PLoS One. 2020; 15(5). https://doi.org/10.1371/journal.pone.0234058.
- Wang X., He Y., Wang T., Xie Y., Li J., Ouyang T., Fan Z. Efficacy of pegfilgrastim to support neoadjuvant dose-dense epirubicin and cyclophosphamide chemotherapy in breast cancer. Support Care Cancer. 2019; 27(8): 3019-25. https://doi.org/10.1007/s00520-018-4572-8.


