Половые морфологические различия слизистой оболочки ободочной кишки у половозрелых мышей C57Bl/6
Автор: Гао Юань
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.23, 2015 года.
Бесплатный доступ
Половые структурно-функциональные различия толстой кишки недостаточно изучены. Цель исследования - изучение половых различий структурных компонентов слизистой оболочки разных отделов ободочной кишки у половозрелых мышей С57ВL/6. Проводили измерения массы тела, длины ободочной кишки, морфологическое и морфометрическое исследование слизистой оболочки ободочной кишки у половозрелых самцов и самок мышей С57ВL/6. По сравнению с половозрелыми самками у самцов мышей больше показатели массы тела и длины ободочной кишки. По сравнению с самками у самцов в слизистой оболочке ободочной кишки и, особенно в её дистальном отделе, выше объемная доля бокаловидных клеток и клеточных элементов, что отражает большую выраженность компартментов слизистого и иммунологического барьеров. Выявленные половые гистофизиологические различия ободочной кишки и её отделов, очевидно, предопределяют особенности течения патологических процессов в зависимости от пола и отдела толстой кишки.
Половые различия, ободочная кишка, мыши c57bl/6, морфология
Короткий адрес: https://sciup.org/143177024
IDR: 143177024
Текст научной статьи Половые морфологические различия слизистой оболочки ободочной кишки у половозрелых мышей C57Bl/6
Введение. Половые гистофизиологические особенности желудочно-кишечного тракта и, в частности, толстой кишки в норме у человека и экспериментальных животных изучены недостаточно. J.W. Lampe и соавт.[1] выявили у человека половые функциональные различия толстой кишки, которые характеризуются тем, что у мужчин по сравнению с женщинами время прохождения кала по толстой кишке более длительное, а содержание желчных кислот более высокое. Эстрогены и прогестерон оказывают влияние на желудочно-кишечный тракт, снижают тонус сфинктера пищевода, замедляют прохождение содержимого по толстой кишке, повышают двигательную активность гладкой мускулатуры желчного пузыря и тонус сфинктера Одди, уменьшают ток желчи через выводное отверстие желчевыводящего протока [2]. Влияние циклических изменений женских половых стероидных гормонов на функцию кишечника представлены в работе M. Heitkemper et al. [3]. По сравнению с фолликулярной в лютеиновую фазу менструального цикла у женщин чаще наблюдаются запоры. Полагают, что физиологические эффекты половых стероидов опосредованы простагландинами, уровень которых в эту фазу менструального цикла увеличивается, что вызывает повышение секреторной активности и тонуса гладкой мускулатуры толстой кишки [4]. M.A. Kamm и соавт. [5], оценивая у женщин время прохождения пищи по желудочно-кишечному тракту и массу кала, также выявили зависимость этих показателей от фазы менструального цикла. Кроме простагландинов, на моторику толстой кишки влияет также уровень серотонина, 95% которого образуется EC-клетками желудочнокишечного тракта [6, 7].
Данные литературы о половых гистофизио-логических различиях толстой кишки у человека и экспериментальных животных отсутствуют.
Цель исследования - изучить половые различия структурных компонентов слизистой оболочки разных отделов ободочной кишки у половозрелых мышей С57ВL/6.
Материал и методы исследования. Работа выполнена на половозрелых мышах линии С57ВL/6 - самках (n=10) и самцах (n=10), полученных из питомника «Столбовая». Возраст мышей составлял 6-8 недель. При работе с экспериментальными животными руководствовались приказом Минздрава СССР №755 от 12.08.1977 г. На проведение эксперимента получено разрешение биоэтической комиссии ФГБУ «НИИ морфологии человека» РАМН.
Животных содержали по 10 особей в клетке на подстилке из древесных стружек в условиях искусственного освещения (по 12 часов светлого и темного времени суток), принудительной вентиляции (12-кратной в час), при температуре 18-22° и относительной влажности 50-65%. Животные имели свободный доступ к питьевой воде и брикетированному корму ПК-120-1 (ООО «Лабораторснаб»).
Фазу эстрального цикла определяли по влагалищным мазкам [8] ежедневно в течение 12 дней до начала эксперимента. По клеточному составу окрашенных методом Романовского-Гимзе мазков влагалищного содержимого определяли наличие эстрального цикла и его фазу. Нормальный цикл выявлен из 17 мышей у 10 (60%), и эти животные были использованы в эксперименте.
Мышей выводили из эксперимента путем цервикальной дислокации под эфирным наркозом. Ободочную кишку выделяли из брюшной полости и измеряли ее длину в сантиметрах.
Для гистологического исследования проводили забор дистального, медиального и проксимального отделов ободочной кишки. Материал фиксировали в жидкости Буэна. Образцы тканей проводили по спиртовым растворам возрастающих концентраций, заливали в парафин, изготовляли гистологические препараты. Проводку материала осуществляли в аппарате Tissue-Tek VIP5Jr (Sakura, Japan). Обезвоженные образцы заливали в гистомикс на аппарате Tissue-Tek TEC (Sakura, Japan), изготовляли продольно ориентированные гистологические срезы толщиной 4-6 мкм на микротоме модели Microm HM340E (Thermo Scientific, USA), монтировали их на предметные стекла, проводили стандартную гистологическую обработку препаратов и окрашивали их гематоксилином и эозином. Анализ и съемку гистологических препаратов проводили на микроскопе AxioPlan 2 Imaging (Carl Zeiss, Germany)
с цифровой камерой AxioCam RHC (Carl Zeiss, Germany).
На окрашенных гематоксилином и эозином гистологических срезах в собственной пластинке слизистой оболочки проксимального, медиального и дистального отделов ободочной кишки при увеличении 100 проводили подсчет числа лимфоидных узелков на протяжении всех трех отделов. Методом точечного счета при увеличении 200 оценивали объемную плотность структурных компонентов слизистой оболочки – бокаловидных клеток, колоноцитов, просвета крипт, соединительной ткани, сосудов и клеточных элементов в собственной пластинке слизистой оболочки.
Статистическую обработку показателей проводили с учетом характера распределения непараметрическими методами (U-критерий Манна-Уитни) в программе Statistica 8.0. Вычисляли медиану и интерквартильный размах – 25%-75%. Различия считали достоверными при р≤0,05.
Результаты исследования. По сравнению с самцами у самок показатели массы тела (P<0.001; самки-21.0 (20.0, 22.0), самцы- 24.8 (22.8, 25.5)) и длины ободочной кишки (P<0.02; самки-5.0 (4.5, 5.3), самцы- 6.0 (5.3, 6.0) была меньше.
В эпителиальной выстилке ободочной кишки у мышей обоего пола выявлялись колоно-циты и бокаловидные клетки овальной формы. На поверхности эпителиального слоя и в узких просветах крипт определялась слизь. Базальная пластинка была тонкой, собственная пластинка слизистой оболочки образована рыхлой волокнистой соединительной тканью, содержащей небольшое количество диффузно рассеянных клеточных элементов: макрофагов, лимфоцитов, единичных плазмоцитов, а также фибробластов и фиброцитов. В базальном отделе собственной пластики слизистой оболочки выявлялись щелевидные лимфатические сосуды. Мышечная пластинка была образована 2-3 рядами продольно ориентированных гладкомышечных клеток. Подслизистая основа была представлена рыхлой волокнистой соединительной тканью с небольшим количеством диффузно рассеянных клеточных элементов – макрофагов, лимфоцитов, фибробластов, фиброцитов, единичных в поле зрения (увеличение 400) нейтрофилов. Кровеносные сосуды - артерии и вены, венулы и артериолы, капилляры неравномерно полнокровны. Мышечная оболочка образована внутренним циркулярным и наружным продольно ориентированным слоями. Лейомиоциты представлены темными и светлыми клетками. Серозная оболочка была образована тонким слоем рыхлой волокнистой соединительной ткани и уплощенным мезотелием (рис. 1)
Количество лимфоидных узелков в слизистой оболочке ободочной кишки у самок и самцов
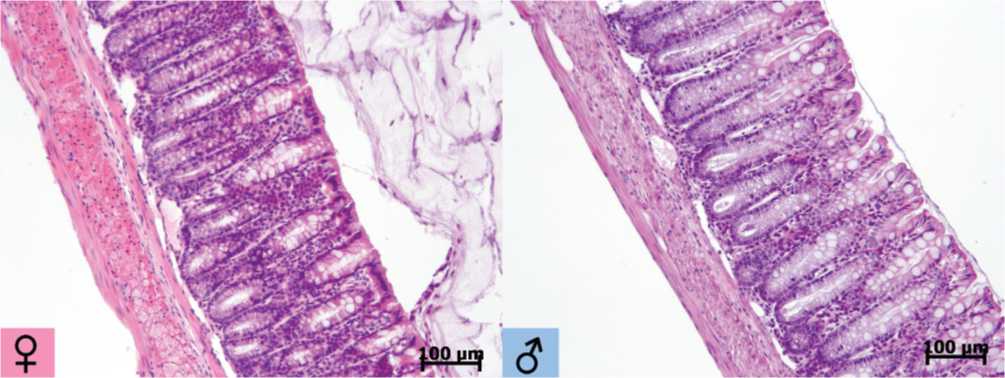
Рис. 1. Гистоструктура стенки ободочной кишки у половозрелых самок и самцов мышей C57BL/6. Крипты глубокие с узкими просветами. Эпителиальная выстилка сохранена на всем протяжении. Цитоплазма бокаловидных клеток заполнена секретом. Подслизистая основа представлена узким слоем соединительной ткани. В базальных отделах собственной пластинки слизистой оболочки лимфатические сосуды со щелевидными просветами. Мышечная оболочка представлена циркулярным и продольным слоями гладкой мускулатуры. Окраска гематоксилином и эозином. Ув. 160.
мышей C57BL/6 статистически значимо не различалось (табл. 1).
Морфометрическая оценка структурных компонентов стенки ободочной кишки позволила установить, что у самок по сравнению с самцами среди клеток эпителиальной выстилки ниже показатель объемной доли бокаловидных клеток и клеточных элементов в собственной пластинке слизистой оболочки, но выше колоноцитов, соединительной ткани и сосудов (табл. 2).
В проксимальном и дистальном отделах ободочной кишки у самок по сравнению с сам-
Таблица 1.
Количество лимфоидных узелков в гистологических срезах ободочной кишки у самок и самцов мышей C57BL/6
|
Параметры |
Проксимальный отдел |
Медиальный отдел |
Дистальный отдел |
Все отделы ободочной кишки |
|
Самки |
0.00 (0.00,1.00) |
0.00 (0.00,2.00) |
1.00 (1.00,3.00) |
3.00 (1.00,5.00) |
|
Самцы |
0.00 (0.00,0.00) |
0.00 (0.00,1.00) |
2.00 (0.00,4.00) |
2.50 (2.00,4.00) |
|
Статистическая значимость |
0.23 |
0.95 |
0.84 |
0.73 |
|
Статистическая значимость между отделами |
Проксимальный и медиальный |
Проксимальный и дистальный |
Медиальный и дистальный |
- |
|
Самки |
0.95 |
0.03 |
0.13 |
|
|
Самцы |
0.39 |
0.06 |
0.18 |
Таблица 2.
Морфометрическая характеристика структурных компонентов слизистой оболочки ободочной кишки у самок и самцов мышей C57BL/6
|
Параметры |
Показатели всех отделов ободочной кишки в % |
||
|
Самки |
Самцы |
Статистическая значимость |
|
|
Бокаловидные клетки |
42.04 (37.55,47.86) |
59.36 (54.57,65.33) |
<0.001 |
|
Колоноциты |
171.32 (158.15,177.08) |
154.72 (149.62,163.61) |
<0.001 |
|
Просветы крипт |
19.91 (16.76,24.49) |
29.69 (25.68,32.27) |
0.08 |
|
Соединительная ткань, сосуды |
36.30 (32.32,43.19) |
15.94 (17.33,24.59) |
<0.001 |
|
Клеточные элемент |
15.47 (10.49,19.46) |
25.86 (19.30,28.27) |
<0.001 |
цами среди клеток эпителиальной выстилки был ниже показатель объемной доли бокаловидных клеток и клеточных элементов. В медиальном отделе ободочной кишки половых различий этих показателей не выявлено (табл. 3). Показатели просвета крипт в проксимальном и дистальном отделах ободочной кишки у самок были выше, чем у самцов. Объемная доля соединительной ткани и сосудов в собственной пластинке слизистой оболочки у самок была выше, по сравнению с самцами только в дистальном отделе. Количество лимфоидных узелков в дистальном отделе ободочной кишки было выше, чем в дистальном у мышей обоего пола, но статистически значимые различия показателей выявлены только у самок.
Таким образом, половые гистофизиологиче-ские различия ободочной кишки у половозрелых мышей С57BL/6 (табл. 3) характеризируются тем, что у самцов по сравнению с самками: выше показатели длины ободочной кишки и объемной доли бокаловидных клеток в эпителиальной выстилке и клеток в собственной пластинке слизистой оболочки. Половые различия ободочной кишки наиболее выражены в проксимальном и дистальном отделах.
Обсуждение результатов исследования. Данные о половых гистофизиологических различиях толстой кишки у человека и экспериментальных животных в литературе представлены недостаточно. Половые различия характеризуются тем, что по сравнению с женщинами у мужчин больше длина толстой кишки, масса кала и содержание в нем желчных кислот [1].
По нашим данным длина ободочной кишки у половозрелых самцов мышей C57BL/6 была выше, чем у самок той же линии на 17%. Большая длина ободочной кишки у самцов определяется тем, что масса их тела больше, чем у самок, и, соответственно, у них более высокая потребность в питательных веществах [9], и количество потребляемой пищи выше. E. Pullianainen и P. Tunkkari [10] показали, что у самцов и самок птицы (Lagopus lagopus – белая куропатка) длина ободочной кишки изменяется в зависимости от сезона года. У половозрелых самцов и самок в июле она не отличается, а весной и осенью показатели её длины выше у самок, что связано с сезонным повышением уровня половых гормонов.
По сравнению с половозрелыми самцами у самок мышей C57BL/6 с нормальным эстральным циклом в эпителиальной выстилке ободочной кишки меньше показатели объёмной доли бокаловидных клеток и клеточных элементов в собственной пластинке слизистой оболочки. Большие показатели объёмной доли бокаловидных клеток в эпителиальном пласте ободочной кишки у самцов, по-видимому, обусловлены изменением под влиянием тестостерона экспрессии генов Notch и Math сигнальных путей, играющих ключевую роль в процессе дифференцировки кишечного эпителия. Высокая экспрессия Notch гена в эпителии кишки у мышей обусловливает уменьшение популяции секреторных клеток [11], напротив, ингибирование Notch пути приводит к увеличению численности популяций секреторных клеток в эпителиальном пласте [12]. Xi-De Wang et al. [13] на экспериментальных животных показали, что в раннем постнатальном периоде при низком уровне тестостерона повышается экспрессия гена Notch 1 в эпителии предстательной железы, а в о н о X и
о го о
0) Z о Е 5 о ы
X
о го
о
0) н го Q. го X к го ы о
0) 5 о
о
|
i СО о о О X И ” 5 2 i со О о: s аз 0) S н в о |
СО ^ о |
ф S о |
о о о |
го о |
о о |
О О о |
о о о |
|
|
S о Ф 5 |
•st СО о |
со о |
со О) о |
О) о о |
го го о |
|||
|
)Z Z § 5 о EZ |
о о о |
о о о |
(М о о |
о |
о о о |
|||
|
СО о со 5 СО со со о EZ |
)Z Ь о 1^ |
67 го со со О ГО о Р го о |
со ю (М <э г- со со со |
•st §^ ^го |
57 ГО 2 го со |
го ^z ю |
||
|
)Z § S ф |
о со ^ 2 ^ ю m |
6? от го 5 S О) ю |
г^ °° ю ^ го |
го со $2 5 LO го го |
со го ^ ^ Ю СО ю го |
|||
|
о Q. Z EZ |
со ГО со го СО см < СМ см см |
со со CO •st о го |
со ю < ю ^ го |
^5 •st 6 Ю 1~ ю ю |
57 •st го 'd-ГО 1~ ГО Р о |
|||
|
S СО о со 0) СО со со о EZ |
। Р о |
со ^ S СО СО о СО СО о ГО |
й 2 го СМ ^ СМ го ^.ю |
•st гоГ р го ^ р со |
со "^ го го со ^ ^ ГО ^ |
СО ю й со см ^ |
||
|
-0 ф 1 5 |
со ГО СО 5 О о со m |
^ 5 s СМ О) S ГО ГО to |
о о 5 06 со со" го го |
ч- см" р? 2 ^ со СМ о ^ |
го О) со го го |
|||
|
z EZ |
о ю о г^ ГО 1~ ГО o' ГО |
со ю ю о СО СО ю с5 |
67 о 5 ^ < О) •st СО |
го го S ^> со ю |
СП Р •St го го го |
|||
|
.0 1— 0) СО СО EZ |
ф с[ Z о ш |
н о о о |
н ^ 1— ф со о EZ |
СК S о S О О б о Н О |
ф о 2 5 ° |
|||
период половой зрелости при высоком уровне тестостерона экспрессия снижается. Эти данные косвенно свидетельствуют о регуляции Notch пути андрогенами. Данные о влиянии эстрадиола на экспрессию гена Notch и его влиянии на дифференцировку эпителия в литературе отсутствуют.
Таким образом, выявленное нами увеличение у самцов мышей С57BL/6 содержания в эпителиальном слое ободочной кишки бокаловидных клеток, по-видимому, отражает супрессию Notch пути дифференцировки эпителия тестостероном и, соответственно, повышение экспрессии генов Math, которые ответственны за дифференцировку эпителия в секреторные клетки.
В эпителиальной выстилке дистального и проксимального отдела ободочной кишки, в отличие от медиального, показатель объёмной доли бокаловидных клеток выше как у самок, так и у самцов. Количество лимфоидных узелок в дистальном отделе ободочной кишки у самок выше, чем в проксимальном.
По данным литературы, восходящий и нисходящий отделы толстой кишки имеют различные источники эмбрионального развития. Восходящая и поперечная ободочная кишка у человека формируются из туловищной кишки; а нисходящая и сигмовидная - из задней кишки [14, 15]. Показано, что восходящий и нисходящий отделы ободочной кишки у человека соответствуют медиальному и дистальному отделам кишки у мыши. На биопсийном материале у здоровых людей методом DNA microarray в эпителиальных клетках слизистой оболочки восходящей и нисходящей ободочной кишки выявлены различия по экспрессии 214 генов у взрослых лиц и 87 – у плодов [16]. При язвенном колите у человека поражается преимущественно нисходящий отдел ободочной кишки [17], а при раке толстой кишки чаще вовлекается восходящая ободочная кишка [16]. Опухоли, локализованные в этом отделе, имеют более злокачественное течение. Кроме того, различия клинического течения и локализации воспалительных и опухолевых процессов в толстой кишке, могут быть связаны с метаболизмом глюкозы и желчных кислот, а также градиентом концентрации желчных кислот [16].
Выявление нами половые гистофизиологи-ческие различия ободочной кишки и её отделов, очевидно, предопределяют особенности течения патологических процессов в зависимости от пола и отдела толстой кишки.
Выводы.
-
1) По сравнению с половозрелыми самками у самцов мышей C57BL/6 больше показатели массы тела и длины ободочной кишки.
-
2) По сравнению с самками у самцов в слизистой оболочке ободочной кишки и, особенно
в её дистальном отделе, выше объемная доля бокаловидных клеток и клеточных элементов, что отражает большую выраженность компартментов слизистого и иммунологического барьера.
Список литературы Половые морфологические различия слизистой оболочки ободочной кишки у половозрелых мышей C57Bl/6
- Lampe J.W., Fredstrom S.B., Slavin J.L., Potter J.D. Sex differences in colonic function: a randomized Trial// Gut. - 1993 - №34(4). - p. 531-536.
- Eliakim R., Abulafia O., Sherer D.M. Hyperemesis gravidarum: a current review// Am. J.Perinatol. -2000 - №17(4). - p.207-18.
- Heitkemper M.M., Shaver J.F., Mitchell E.S. Gastrointestinal symptoms and bowel patterns across the menstrual cycle in dymenorrheic and nondymenorrheic women// Nurs.Res. - 1988 -№37(2). - p.108-113.
- Kane S., Stone L.J., Ehrenpreis E. Thalidomide as "salvage" therapy for patients with delayed hypersensitivity response to infliximab: a case series// J. Clin. Gastroenterol. - 2002 - №47(3). -p. 149-150.
- Kamm M.A., Fartning M.J. G. and Lennard-Jones J.E. Bowel function and transit rate during the menstrual cycle// Gut. - 1989 - №30(5). - p. 605-608.
- Camilleri M., Atanasova E., Carlson P.J., Ahmad U., Kim H.J., Viramontes B.E., McKinzie S., Urrutia R. Serotonin-transporter polymorphism pharmacogenetics in diarrhea-predominant irritable bowel syndrome// Gastroenterology. - 2002 -№123(2). - p.425-432.
- Scherl E., Frissora C.L. Irritable bowel syndrome genophenomics: correlation of serotonin-transporter polymorphisms and alosetron response// Pharmacogenomics. J. - 2003 - №41. - p. 64-66.
- Кабак Я.М. Практикум по эндокринологии//М.: изд-во МГУ. -1968 -. 275 с.
- Moss R., Parkinson J.A. The digestion of heather (Calluna vulgaris) by red grouse (Lagopus lagopus scoticus)// Br J Nutr - 1972 - р.285-298.
- Pullianien E., Tunkkari P. Seasonal changes in the gut length of the willow grouse (Lagopus lagopus) in Finnish Lapland //Ann. Zool. Fennici. - 1983 - №20. - p.53-56.
- Zecchini V., Domaschenz R., Winton D., Jones P. Notch signaling regulates the differentiation of postmitotic intestinal epithelial cells//Genes. Dev. - 2005 - №12. - p. 1686-1691.
- Van Es J.H., Jay P., Gregorieff A., van Gijn M.E., Jonkheer S., Hatzis P., Thiele A., van den Born M., Begthel H., Brabletz T., Taketo M.M., Clevers H. Wnt signalling induces maturation of Paneth cells in intestinal crypts// Nat. Cell. Biol. - 2005 - №3. - p. 381-386.
- Wang Xi-De, Ching Ching Leow, Jiping Zha, Zhijun Tang. Notch signaling is required for normal prostatic epithelial cell proliferation and differentitiation// Developmental Biologi. - 2006 - №290. - p. 286-294.
- Bufill J.A. Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location// Ann. Intern. Med. - 1990 - №113(10). -p.779-788.
- Bonithon-Kopp C., Benchamiche A.M. Are there several colorectal cancers? Epidemiological data// Eur. J. Cancer. Prev. - 1999 - №8(1). - p.3-12.
- Glebov O.K., Rodriguez L.M., Nakahara K., Jenkins J., Cliatt J., Humbyrd C.J., DeNobile J., Soballe P., Simon R,. Wright G., Lynch P., Patterson S., Lynch H., Gallinger S., Buchbinder A., Gordon G., Hawk E., Kirsch I.R. Distinguishing right from left colon by the pattern of gene expression// Cancer. Epidemiol. Biomarkers. Prev. - 2003 - №12(8). -p.755-762.
- Белоусова Е.А. Иммунные механизмы при воспалительных заболеваниях кишечника и принци пы селективной иммунокорреции// Российский журнал гастроэнтерологии, гепатологии, коло-проктологии. - 1992 - № 7. - с. 2-10.


