Получение антисептических пленок методом электроформования
Автор: Карнилов М.С., Рыклин Д.Б., Ржеусский С.Э.
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Технология материалов и изделий текстильной и легкой промышленности
Статья в выпуске: 3 (53), 2025 года.
Бесплатный доступ
Одним из актуальных направлений создания новых видов материалов с уникальными свойствами для применения в различных сферах деятельности человека являются нанотехнологии. Статья посвящена разработке антисептических перевязочных материалов, содержащих новые антибактериальные компоненты, методом электроформования. Для достижения поставленной цели в рамках данной работы необходимо было решить следующие задачи осуществлен выбор волокнообразующих полимеров и функциональных добавок для получения нановолокнистых антисептических материалов, определены режимы электроформования при использовании антибактериальных добавок, выявлено влияние антибактериальных добавок на стабильность процесса электроформования и структуру получаемых материалов, оценена антибактериальную активность образцов при добавлении к ним антибактериальных добавок. Для обеспечения антисептического эффекта было предложено использовать антибактериальные добавки, такие как тетраметилендиэтилентетрамин и полигексаметиленгуанидин гидрохлорид. Процесс электроформования нановолокнистого слоя осуществлялся на установке Fluidnatek LE-50. В качестве волокнообразующего полимера был выбран поливиниловый спирт. В результате исследований установлено, что использование предложенных функциональных добавок позволяет придать антибактериальные свойства материалу. Установлено, что полученные образцы нановолокнистых материалов, обладают достаточной антибактериальной активностью, чтобы в условиях лаборатории уверенно подавлять рост патогенных микроорганизмов под собой.
Электроформование, поливиниловый спирт, тетраметилендиэтилентетрамин, полигексаметиленгуанидин, антибактериальный
Короткий адрес: https://sciup.org/142246493
IDR: 142246493 | УДК: 677.017.8:687.14 | DOI: 10.24412/2079-7958-2025-3-65-76
Текст научной статьи Получение антисептических пленок методом электроформования
DOI:
Применение нанотехнологий в настоящее время относится к наиболее перспективным направлениям в разработке новых материалов с уникальными свойствами, которые могут быть использованы в различных сферах человеческой деятельности. В числе областей применения данных материалов медицина занимает одно из ключевых мест.
Для исследовательских и терапевтических нужд современной медицины активно применяются разнообразные по форме и дисперсному составу металлические, полупроводниковые, полимерные, оксидные, углеродные наноструктурированные материалы, например, наноструктурированные материалы с содержанием частиц серебра, контрастные средства на основе суперпарамагнитных наночастиц оксида железа (Хубутия и др., 2012).
Одной из разновидностей наноструктурирован-ных материалов медицинского назначения являются нановолокнистые материалы, получаемые методом электроформования, сущность которого заключается в получении нановолокон за счет воздействия электрического поля на раствор или расплав полимера (Haider, Haider and Kang, 2018; Stace et. al., 2019; Mehnath et. al., 2020). Электроформование позволяет получать пленки и композиционные материалы, структура и состав которых обеспечивают достижение заданного уровня водо- и паропроницаемости, антибактериальных и антивирусных свойств. В связи с этим в мире наблюдается устойчивый интерес к применению нановолокнистых материалов в биоинженерии и медицине для создания изделий санитарно-гигиенического, косметологического и лечебного назначения, в том числе, для обеспечения доставки лекарств и заживление ран (Wang, 2009). Нановолокнистые материалы, как лечебное средство, применяются в качестве различных покрытий, в которых они выполняют как защитные, так и лечебные функции при повреждениях, например, внутренних органов (Chagas et. al., 2021; Su et. al., 2021; Hermenegildo et. al., 2022).
В ряде патентов исследователями разработан ряд раневых покрытий на основе тканых и нетканых материалов природного или синтетического происхождения, содержащие наночастицы серебра, хлоргексидина гид-рохлорид, антибиотики и т. д. (Миклис, и др., 2020; Liu, 2021]. Они показывают хорошую биосовместимость, фармакологическую активность, а по отношению к некоторым из них уже имеется положительный клинический опыт применения.
Однако почти ко всем антимикробным компонентам рано или поздно развивается устойчивость микроорганизмов (Шамина и др., 2020; Решедько и др., 2006). Бактериальные клетки изменяют течение своих биохимических реакций, вырабатывают инактивирующие антибиотики ферменты, утолщают клеточную стенку, совершенствуют системы активного транспорта и т. д. (Абдулкадырова, 2023). Все эти механизмы уменьшают или отменяют активность антимикробных препаратов, которые ранее были высокоэффективными. Антибиотики, широко используемые в 50–60-х годах XX века в современном здравоохранении не используются вовсе. Это заставляет искать новые вещества, обладающие антимикробной активностью, не смотря на широкий ассортимент противомикробных препаратов в аптеках.
Таким образом, актуальной является разработка антисептических перевязочных материалов, содержащих новые антибактериальные компоненты, методом электроформования.
Для достижения поставленной цели в рамках данной работы необходимо было решить следующие задачи:
-
1. Осуществить выбор волокнообразующих полимеров и функциональных добавок для получения наново-локнистых антисептических материалов.
-
2. Определить режимы электроформования при использовании антибактериальных добавок.
-
3. Определить влияние антибактериальных добавок на стабильность процесса электроформования и структуру получаемых материалов.
-
4. Оценить антибактериальную активность образцов при добавлении к ним антибактериальных добавок.
Методы и средства исследований
Процесс электроформования нановолокнистого слоя осуществлялся на установке Fluidnatek LE-50 (рисунок 1). Для получения разрабатываемого материала была использована подложка из пергаментной сили-конизированной бумаги. Данный вид подложки не затрудняет протекание процесса электроформования и, благодаря низкой адгезии, обеспечивает снятие пленки без повреждений.
Подложка фиксировалась на коллекторе – осадительном электроде, на который подавался отрицательный потенциал.
При выборе волокнообразующего полимера для получения нановолокнистых пленок принимались во внимание такие предъявляемые к нему требования, как биосовместимость, биодеградируемость, а также приемлемые механические свойства получаемых материалов: низкая жесткость, достаточная прочность, предотвращающая повреждение пленки при хирургических манипуляциях, а также при воздействии потока крови (Gao et. al., 2021; Pillai et.al., 2021). На основании анализа различных полимеров в качестве основного компонента пленки был выбран поливиниловый спирт (ПВС).
ПВС является биосовместимым полимером, не оказывает токсической нагрузки на организм пациента и не вызывает иммунного ответа, обладает специфическим характером и скоростью растворения, способен выводиться из организма пациента и не накапливается в тканях и органах. Благодаря нетоксичности ПВС применяется в медицине в качестве клеев, пластырей, стерильных салфеток, хирургических нитей, фармацевтических препаратов, для изготовления плазмозаменяющих растворов. ПВС является водорастворимым полимером, в связи с чем широко применяется в инновационной медицине для получения нановолокнистых материалов с высокой скоростью растворения. (Рыклин др., 2024).
ПВС гигроскопичен, растворяется в холодной воде крайне медленно, но при повышенных температурах (около 90 °С) достаточно быстро переходит в раствор. (Николаев, 1979).
Для достижения антисептического эффекта было предложено использовать антибактериальные добавки такие как тетраметилендиэтилентетрамин (ТМДЭТА) и полигексаметиленгуанидин гидрохлорид (ПГМГ).

Рисунок 1 – Установка Fluidnatek LE-50
Figure 1 – Electrospinning machine Fluidnatek LE-50
Растворы ТМДЭТА обладают противовирусным, антибактериальным, а также фунгицидным действием, воздействуя в том числе и на устойчивые к воздействию дезинфектантов микроорганизмы. Применение ТМДЭТА в помещениях с животными и людьми также является безопасным (Yu, Baek, Cho, 2019). На обработанной поверхности образует микропленку, тем самым обеспечивая защиту от повторной контаминации на срок не менее 11 месяцев.
ПГМГ гидрохлорид обладает высокой бактерицидной и фунгицидной активностью. Растворы препарата в 0,05%-ой концентрации вызывают гибель грамположи-тельных и грамотрицательных микроорганизмов в течение 5–25 мин. Продукт является абсолютно безопасным для здоровья людей и животных и экологически безвредным для окружающей среды (Лезова и др.,1996).
Как было определено ранее, рациональная концентрация ПВС в прядильном растворе составляет 14 % (Рыклин и др., 2020). Вместе с тем установлено, что при введении в прядильный раствор функциональных добавок для поддержания на оптимальном уровне вязкости, электропроводности и других характеристик прядильных растворов целесообразно снижать содержание в них волокнообразующего полимера на 1–2 %.
Для исследования были приготовлены следующие образцы растворов, составы которых приведены в таблице 1. Прядильные растворы были изготовлены следующим способом. В дистиллированную воду комнатной температуры (23–25 °С) были добавлены антисептические добавки в кристаллическом виде в заданном количестве. Затем в полученный раствор добавляли ПВС. Суспензия выдерживалась на водяной бане при температуре воды 70–75 °С в течение 30–40 минут до полного растворения ПВС.
Известно, что наличие функциональных добавок в растворах волокнообразующего полимера может оказывать как положительное, так и отрицательное влияние на процесс электроформования. Это влияние связано с тем, что даже небольшое количество функционального компонента может сильно повлиять на электропроводность прядильного раствора. Так, добавление в 14 % раствор поливинилового спирта частиц серебра в количестве 0,1 %, может увеличить производительность установки для электроформования в 3 раза, однако, более высокий расход прядильного раствора при тех же параметрах процесса электроформования может снизить качество готового материала (Черников, Ржеус- ский, Рыклин., 2023). В то же время использование такой гемостатической добавки как хлорид алюминия может снизить скорость электроформования (Демидова и др., 2021).
В связи с этим в рамках исследования была поставлена задача определения влияния введения в прядильный раствор каждой из добавок на рациональные режимы процесса электроформования, структуру и эффективность применения нановолокнистых пленок.
Исследование структуры полученных образцов материалов осуществлялось с использованием сканирующего электронного микроскопа LEO 1420 (Сarl Zeiss, Германия).
Оценка антибактериального действия полученных материалов осуществлялась методом измерения зоны задержки роста вокруг образцов на твердой питательной среде Мюллера Хинтона, а также оценкой наличия роста бактерий под ними. Для изучения антибактериальной активности использовали музейные штаммы и клинические изоляты Pseudomonas aeruginosa и Staphylococcus aureus.
Результаты исследований
В результате проведённых экспериментов были определены рациональные режимы электроформования, представленные в таблице 1. При указанных параметрах работы установки Fluidnatek LE-50 процесс электроформования протекал стабильно, не происходил срыв капли с конца иглы, амплитуда колебаний волокнообразующей струи находилась в пределах 4–5 см. Стоит отметить, что использование добавки ПГМГ повышало производительность установки, а использование добавки ТМДЭТА дало возможность уменьшить напряжённость электростатического поля.
При получении материалов из ПВС без функциональных добавок на конце иглы из капли прядильного раствора образовывалась одна струя, расщепление которой на более тонкие струи происходило на расстоянии нескольких миллиметров, в то время как при добавлении в раствор ПГМГ и ТМДЭТА приводило к формированию 4–5 волокнообразующих струй непосредственно из капли раствора, что привело к повышению производительность установки.
Изображения структуры нановолокнистых материалов, полученные методом сканирующей электронной микроскопии, представлены на рисунке 2.
Таблица 1 – Рациональные режимы процесса электроформования Table 1 – Rational modes of the electroforming process
|
Образец |
1 |
2 |
3 |
|
Состав прядильного раствора |
Дистиллированная вода – 86 %; ПВС –14 % |
Дистиллированная вода – 87,4 %; ПВС –12 %; ПГМГ– 0,6 % |
Дистиллированная вода – 87,3 %; ПВС – 12 %; ТМДЭТА – 0,7 % |
|
Состав нановолокнистых материалов без учета остаточной влаги |
ПВС – 100 % |
ПВС – 95,2 %; ПГМГ – 4,8 % |
ПВС – 94,5 %; ТМДЭТА – 5,5 % |
|
Расход, мл/ч |
5 |
6,5 |
5 |
|
Расстояние между эмиттером и коллектором, см |
4 |
4 |
4 |
|
Потенциал эмиттера, кВ |
20 |
20 |
17 |
|
Потенциал коллектора, кВ |
-6 |
-6 |
-5 |

a б (b)

в (с) г (d)
Рисунок 2 – СЭМ изображения нановолокнистых материалов: а, б – образец 1; в, г – образец 2
Figure 2 – SEM image of the nanofibrous webs:
а, b – Sample 1; c, d – Sample 2
Таблица 2 – Характеристики волокон полученных материалов
Table 2 – Characteristics of fibers of the obtained materials
|
Образец 1 |
Образец 2 |
Образец 3 |
|
|
Средний диаметр волокна, нм |
178 |
185 |
189 |
|
Коэффициент вариации по диаметру волокна, % |
45 |
54 |
37 |

д (e) е (f)
Окончание рисунка 2 – СЭМ изображения нановолокнистых материалов: д, е – образец 3; а, в, д – х10000; б, г, е – х1000
End of figure 2 – SEM image of the nanofibrous webs:
e, f – Sample 3; а, c, e – х10000; b, d, f – х1000
Анализ результатов
Анализируя изображения, полученные методом электронной микроскопии при увеличении в 10000 раз, можно отметить, что введение в состав прядильных растворов антисептических добавок не оказало существенного влияния на структуру получаемых нановолокон. Однако на изображениях, полученных при увеличении в 1000 раз, можно заметить некоторую неравномерность распределения добавок, а также наличие незначительного количества местных дефектов в виде застывших капель прядильного раствора, размеры которых не превышают 5 мкм.
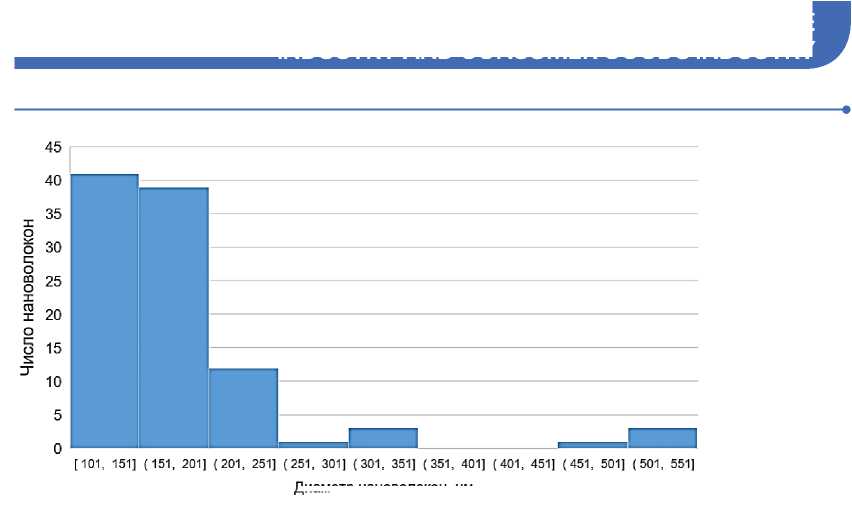
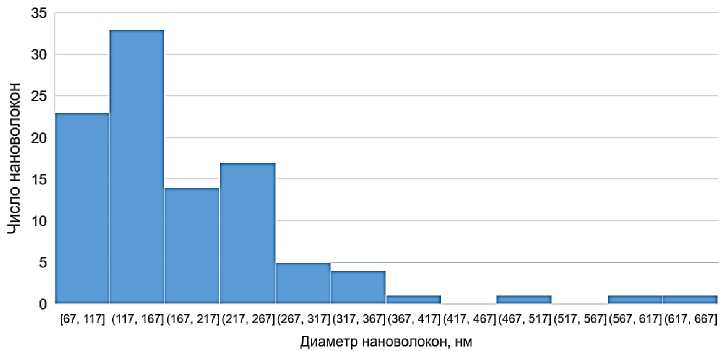
Определение среднего диаметра получаемых волокон и их неравномерности по толщине осуществлялось на основе измерений 100 волокон образца по изображениям, полученным при увеличении в 10000 раз. Гистограммы распределения волокон по диаметру представлены на рисунке 3. Результаты статистической обработки полученные при измерениях данных представлены в таблице 2. Можно отметить не-
значительное увеличение среднего диаметра волокон, полученных при добавлении в раствор антисептических добавок. При этом во всех полученных вариантах материалов около 80 % волокон имело диаметр менее 200 нм.
Отмеченное ранее повышение производительности установки, достигаемое при получении образца 2, содержащего добавку ПГМГ, сопровождалось некоторым увеличением неровномерности материала по диаметру волокна.
Оценка эффективности нановолокнистых материалов представлена на рисунке 4.
Белый фон в чашке Петри представляет собой сплошную зону роста бактерии. На этом фоне хорошо видна чистая зона вокруг образцов, что свидетельствует о высвобождении антибактериального компонента и его действии на микроорганизм (Шеряков, 2008). Установлено, что средняя величина зоны задержки роста вокруг нановолокнистого материала для образца № 2 составляет 1,6 мм ( n = 3). Для образца № 3 зона задерж-
a
Диаметр нановолокон, нм б (b)

в (с)
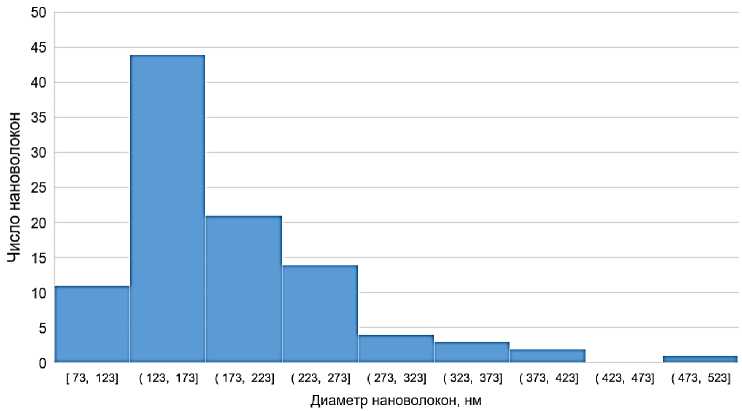
Рисунок 3 – Гистограммы распределения нановолокон по диаметру в полученных образцах нановолкнистых пленок: а – образец 1, б – образец 2; в – образец 3 Figure 3 – Histogram of nanofiber distribution by diameter in the samples of nanofibrous films: а – Sample 1; b – Sample 2; с – Sample 3

Рисунок 4 – Антибактериальная активность нановолокнистых материалов по отношению к Staphylococcus aureus. Справа образец 3, слева образец 2
Figure 4 – Antibacterial activity of nanofibrous materials against Staphylococcus aureus.
Sample 3 on the right, Sample 2 on the left
ки роста наблюдается не со всех сторон, поэтому зону задержки роста следует считать равной 0.
Аналогичные результаты были получены при исследовании образцов по отношению к грамотрицательному микроорганизму Pseudomonas aeruginosa. Зона задержки роста для образца № 2 составила 2,0 мм, а для образца № 3 - от 0 до 1 мм.
Была изучена антибактериальная активность по отношению к двум микроорганизмам под образцом нано-волокнистого материала. Во всех исследованиях ( n = 3 для каждого образца и каждого микроорганизма) было показано, что под образцом не наблюдается рост микроорганизма.
Образец № 1 не подавлял рост микроорганизмов ни вокруг себя, ни под собой, что свидетельствует об отсутствии антибактериальной активности.
Выводы
С целью разработки антисептических нановолокни-стых материалов методом электроформования в качестве антибактериальных добавок было предложено использовать тетраметилендиэтилентетрамин (ТМДЭТА) и полигексаметиленгуанидин гидрохлорид (ПГМГ).
Экспериментально установлено, что использование добавки ПГМГ способствовало повышению производительности установки для электроформования, а введение в состав прядильного раствора добавки ТМДЭТА дало возможность уменьшить напряжённость электростатического поля.
Анализ изображений, полученных методом электронной микроскопии, показал, что введение в состав прядильных растворов антисептических добавок не оказало существенного негативного влияния на структуру получаемых нановолокон.
В результате исследования можно сделать вывод о том, что использование таких функциональных добавок как ТМДЭТА и ПГМГ позволяет придать антибактериальные свойства материалу. Установлено, что образцы нановолокнистых материалов № 2 и № 3, содержащие предложенные компоненты, обладают достаточной антибактериальной активностью, чтобы в условиях лаборатории уверенно подавлять рост патогенных микроорганизмов под собой. При этом представляет интерес проведения дальнейших исследований, направленных на изучение влияния концентрации функциональных добавок на антибактериальную активность материала.


