Получение антитоксических сывороток и возможность их применения в диагностике холеры
Автор: Якушева Ольга Александровна, Алексеева Людмила Павловна, Писанов Руслан Вячеславович, Зюзина Вера Павловна, Яговкин Михаил Эдуардович, Дуванова Ольга Викторовна, Шипко Елена Сергеевна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Отработана рациональная схема получения кроличьих антитоксических сывороток. Получены четыре серии высокоактивных кроличьих сывороток к холерному токсину, выделенному из штамма Vibrio cholerae Сlassical 569В (Инаба) и очищенному современными методами. Сыворотки могут применяться как в иммуноферментном анализе для выявления холерного токсина, так и в методе культуры клеток. Подобраны оптимальные методы осаждения сывороточных антитоксических иммуноглобулинов и длительного хранения сывороток без использования лиофильного высушивания и глубокой заморозки. Чистый холерный токсин и антитоксические сыворотки к нему будут использованы в диагностике холеры.
Антитоксические сыворотки, иммунизация, иммуноферментный анализ, холерный токсин, культура клеток
Короткий адрес: https://sciup.org/147227108
IDR: 147227108 | УДК: 579.843.1:612.017.4:57.083.3 | DOI: 10.17072/1994-9952-2019-4-426-433
Текст научной статьи Получение антитоксических сывороток и возможность их применения в диагностике холеры
Маркером эпидемического потенциала холерного вибриона является его токсигенность. Для детекции холерного токсина (ХТ) отечественные и зарубежные ученые разработали целый ряд экспериментальных и коммерческих диагностикумов на основе поликлональных и моноклональных антител, которые часто используются как связывающие и детектирующие антитела в «сэндвич»-системах иммуноферментного анализа (ИФА). Моноклональные антитела, обладая моноспецифичностью по отношению к одному эпитопу, способны точно определить небольшие различия в антигене, чем обеспечивают повышение специфичности реакции и применяются как детектирующие антитела. Поликлональные антитела чаще всего используют для связывания антигена, так как они направлены к разным его эпитопам и способны связывать большее количество антигена [Crowther, 2009].
U. Tuteja et al. [2007] создали «сэндвич»-метод ИФА для одновременного определения холерных вибрионов и токсина, где в качестве связывающих антител применялись специфические гипериммунные сыворотки кролика, а в роли детектирующих выступал конъюгат моноклональных антител к холерному токсину с пероксидазой хрена. В результате была сконструирована диагностическая ИФА тест-система с чувствительностью 60 пг/мл.
В другой работе описана тест-система на основе поликлональных антител для детекции ХТ в культуральных жидкостях методом «сэндвич» дот-ИФА, с чувствительностью 1 нг/мл [Meza-Lucas et al. 2016]. E. Yamasaki et al. [2017] разработали иммунохроматографическую тест-полоску для определения ХТ с чувствительностью 10 нг/мл, где
источником выявляющих антител были антитоксические кроличьи сыворотки.
Кроме того, в зарубежной практике антитоксические поликлональные антитела широко используются как отдельные диагностические инструменты.
Отечественные ученные сконструировали анти-тельный коагглютинирующий диагностикум, способный обнаружить очищенный холерный энтеротоксин в растворах в количестве 1–10 нг/мл [Белая и др., 1984].
В.А. Федорова и др. [1996] предложили для выявления ХТ непрямой «сэндвич» вариант дот-ИФА, где использовали пару антител, поликлональную сыворотку кролика и моноклональные антитела, специфичные к пространственно удаленным эпитопам ХТ. С помощью вышеуказанной реакции удалось обнаружить ХТ как на поверхности бактериальных клеток, так и в культуральной среде.
Для обнаружения токсинпродуцирующих штаммов Vibrio cholerae был разработан непрямой метод GM1-ДОТ-ИФА, с чувствительностью 10 нг/мл, где в качестве выявляющих антител применяли специфическую поликлональную сыворотку кролика и антивидовой конъюгат [Маркина и др., 2011].
Т.Л. Захарова и др. [2008] разработали специфичную многокомпонентную тест-систему, представляющую собой модифицированный вариант дот-ИФА, состоящую из 6 очищенных протектив-ных антигенов (холерный токсин, B-субъединица, токсин-корегулируемые пили адгезии (ТКПА), антигены О1 сероварианта Инаба и Огава, О139 антиген) и 6 специфичных поликлональных антисывороток к ним.
И.С. Тюменцева и др. [2014] сконструировали набор реагентов тест-системы иммуноферментной магноиммуносорбентной («МИС-ИФА-Хол.токс-СтавНИПЧИ»), которая предназначена для селективного концентрирования холерогена из фильтратов исследуемых агаровых культур на МИС с последующей постановкой ИФА. Результаты экспериментов показали 100%-ную специфичность модифицированного метода ИФА при испытании не-токсигенных штаммов рода Vibrio . Показано также, что из 32 токсигенных штаммов лишь два с низкой способностью к продукции энтеротоксина не дали положительного результата.
Вышеописанные тест-системы для выявления ХТ на основе поликлональных антител не входят в перечень зарегистрированных и рекомендованных к использованию диагностических препаратов, поэтому остается актуальной проблема конструирования новых тест-систем, отвечающих в наибольшей степени требованиям высокой чувствительности и специфичности.
Производство коммерческих отечественных кроличьих поликлональных антитоксических сывороток в настоящее время приостановлено, однако эти сыворотки необходимы для создания медицинских диагностических препаратов, позволяющих выявлять ХТ как в реакциях ИФА, так и в тесте нейтрализации ХТ на культуре клеток. Получение антитоксических сывороток – это сложный многоэтапный процесс, зависящий от качества очистки ХТ, схемы иммунизации животных, дозы, способа и кратности введения токсина, временных интервалов, общей продолжительности иммунизации, применения адъювантов.
Цель работы – получение высокоспецифичных и чувствительных антитоксических сывороток и выделения из них фракций специфических иммуноглобулинов для обнаружения токсигенных штаммов V. cholerae O1 и О139 в различных серологических реакциях.
Материалы и методы исследования
С целью получения специфических сывороток использовали очищенный препарат холерного токсина из штамма V. cholerae О1 569В, полученный в результате 2-этапной очистки: ультрафильтрации и ионообменной хроматографии на приборе FPLC Pathfinder Duoflow (Bio-Rad).
Для иммунизации использовали кроликов породы «Советская шиншилла» массой 2.5–3.0 кг. Содержание и уход за животными, а также их эвтаназия проводились в соответствии с требованиями «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей».
Перед началом иммунизации животных помещали на двухнедельный карантин, затем отбирали кровь, получали нормальные сыворотки и проверяли в ИФА с Escherichia coli , Aeromonas hy-drophhila , Salmonella typhimurium , имеющими общие детерминанты с ХТ. Животных отбраковывали, если нормальные сыворотки (НКС) давали положительный результат в GM 1 ИФА [Sack et al.
1980] в разведении 1:100. Отрицательные НКС использовали как контроль.
Флаконы после забора крови инкубировали в термостате при 37°С в течение 30 мин. После ретракции сгустка клеточных элементов крови от него избавлялись путём центрифугирования при 3000 об/мин в течение 10 мин. Сыворотки делили на аликвоты и хранили при –20°С. Рабочий титр, чувствительность и специфичность полученных сывороток определяли в GM 1 ИФА с ХТ (5мкг/мл), супернатантами V. cholerae О1 ctx+, V. cholerae О1 ctx-и супернатантами гетерологичных микроорганизмов.
Параллельно отрабатывали метод длительного хранения сыворотки без использования глубокого замораживания и лиофилизации. Для сохранения нативной структуры сывороточных иммуноглобулинов к сывороткам добавляли сульфат аммония до конечной концентрации 1.6 М и выдерживали при 4°С, для проверки активности сывороточных антител в течение трех лет отбирали аликвоты. Ферментативную активность протеаз в сульфатных суспензиях оценивали с помощью бензоиларгинин-р-нитроанилида при длине волны 405 нм. Оценку микробного роста в сульфатной суспензии в процессе хранения осуществляли при помощи посева образцов на мясо-пептонный агар.
Определение специфичности иммуноглобулинов сыворотки крови кролика, иммунизированного холерным токсином, проводили методом иммуноблоттинга c использованием токсинсодержащих препаратов в полусухой буферной системе. Визуализацию реакции осуществляли с помощью анти-кроличьего пероксидазного конъюгата и 3.3-диаминобензидина-4-гидрохлорида.
Количественное определение белка проводили методом сравнения поглощения белков при 260 и 280 нм на приборе Bio-Rad SmartSpec Plus.
Преципитирующую активность полученных сывороток с ХТ определяли в реакции иммунодиффузии (РИД) в 1%-ном агаровом геле.
Нейтрализующую активность сыворотки ХТ определяли на модели монослойной клеточной линии CHO-K1 (клетки яичника китайского хомячка), полученной из Российской коллекции клеточных культур позвоночных института цитологии РАН (г. Санкт-Петербург). Вне периода постановки опытов коллекционная культура клеток хранилась в криоконсервированном состоянии в биохранилище с жидким азотом при –196°С. Все этапы работы с перевиваемой линией клеток были выполнены в соответствии с рекомендациями [Фрешни, 2018]. Для культивирования клеток использовали пластиковую посуду различного формата для работы с клеточными культурами (Costar) и питательную среду RPMI (Sigma) c 10% сыворотки (HyaClon). Для снятия монослоя клеток с поверхности пластика применяли растворы трипсина и версена (Sigma). Культивирование проводили в СО 2 -инкубаторе при 37°С, концентрации СО 2 5%, влажности не менее 70%. Клетки линии CHO-K1 высевали в лунки 96-луночного планшета в дозе 5 т. кл./лунку. ХТ в количестве 300 нг/мл или супернатанты токсигенных штаммов V. cholerae в разведении 1:10 инкубировали с антитоксической сывороткой в разведении 1:500, 1:1000 в течение 30 мин., после чего вносили в лунки планшетов с клетками в объеме 100 мкл и титровали. В качестве контроля использовали супернатанты, обработанные нормальной кроличьей сывороткой.
Методы осаждения белков использовали при нехроматографическом фракционировании сыво- роток крови с применением сульфата натрия [Yamasaki et al., 2013], сульфата аммония [Антитела… 1991], каприловой кислоты [Способ …, 1997], метанола [Скоупс, 1978].
Результаты и их обсуждение
Гипериммунизацию кроликов проводили с целью получения антитоксических сывороток крови к холерному токсину штамма V. cholerae О1 569В. В результате было отработано две схемы иммунизации с применением адъюванта и без него.
В ранее проведенных исследованиях было показано, что наиболее интенсивно индуцирует анти-телообразование в организме подопытных животных внутрикожный путь введения, так как в этой области лимфоток быстрый, а сосудистая абсорбция низкая. Кроме того, в коже много дендритных клеток Лангерганса, способствующих переносу ХТ к лимфатическим узлам [Hum, Chantler, 1980]. Поэтому для первой схемы иммунизации был выбран внутрикожный путь введения холерогена в количестве 200 мкг. Для снижения воспалительного ответа ХТ вводили двукратно с интервалом в один месяц в 20 точек на спине. После первого этапа иммунизации титр специфических антител к ХТ в GM 1 -ИФА был низким – 1:10000. Повторная иммунизация не дала желаемого результата – титр повысился до 1:20000. Поскольку поставленная цель – получение высокоактивных сывороток не была достигнута, использовали вторую схему для иммунизации [Сизова и др. 2016] – трехкратно с 2недельными интервалами между инъекциями ХТ. При этом 100 мкг холерогена вводили в вену уха и 200 мкг в смеси с полным адъювантом Фрейнда – в холку кролика. Осуществляли забор крови для предварительной оценки динамики титра специфических антител к ХТ после второго и третьего введения холерогена. Результаты определения активности сыворотки в GM 1 ИФА с хроматографически очищенным ХТ штамма V. cholerae 569В свидетельствовали о нарастании титра антитоксических антител. Через две недели после последней иммунизации был проведен забор крови и получена экспериментальная сыворотка с титром специфических антител к ХТ в GM 1 ИФА 1:80000.
Полученная сыворотка специфично реагировала в GM 1 ИФА с супернатантами токсигенных штаммов V. cholerae и не взаимодействовала с не-токсигенными штаммами и гетерологичными микроорганизмами, липополисахаридами (ЛПС) О1 и О139 штаммов. Оптическая плотность (ОП) лунок, сенсибилизированных ХТ, превышала в 5–6 раз показатели ОП лунок, содержащих нормальную сыворотку кролика (таблица).
Затем специфичность полученной сыворотки была изучена в иммуноблоттинге. Для этого супернатант токсигенного штамма V. cholerae О1
569В, был разделен в SDS-ПААГ и перенесен на нитроцеллюлозную мембрану, после чего она была обработана полученной антитоксической сывороткой в разведении 1:5000. Как показано на рис. 1, в бесклеточном супернатанте и в очищенном препа- рате ХТ сыворотка выявляет зону примерно 54–56 кД, которая соответствует молекулярной массе хо-лерогеноида и не выявляет дополнительных белков и ЛПС.
Активность и специфичность антитоксических сывороток в GM1-ИФА
|
Штаммы |
Кол-во штаммов |
Вторая схема иммунизации |
НКС |
|
Рабочее разведение сыворотки |
|||
|
1:40000 |
1:100 |
||
|
V. cholerae О1 Сlassical |
3 |
ОП≥1.523±0.016 |
ОП≤0.141±0.017 |
|
V. cholerae О1 El Tor ctx+ |
7 |
||
|
V. cholerae О139 |
5 |
||
|
V. cholerae О1 El Tor ctx- |
10 |
ОП≤0.112±0.010 |
|
|
ЛПС О1 1мкг/мл |
|||
|
ЛПС О139 1мкг/мл |
|||
|
E. coli |
2 |
||
|
A. hydrophila |
2 |
||
|
S. typhimurium |
2 |
||
|
Положительный контроль |
ОП≥1.620±0.013 |
||
|
Отрицательный контроль |
ОП≤0.096±0.004 |
||
Примечание. Отрицательный контроль – фосфатно-солевой буфер.
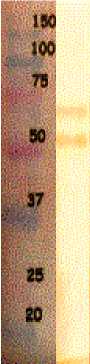
300 нг/мл инкубировали с антитоксической сывороткой в разведениях 1:500, 1:1000, после чего вносили в лунки планшетов с клетками. Мы установили, что сыворотка нейтрализует токсин в разведении 1:1000. Супернатанты токсигенных штаммов V. cholerae в разведении 1:10 инкубировали с антитоксической сывороткой в разведении 1:1000. Сыворотка нейтрализовала действие ХТ супернатантов, что выражалось в отсутствии удли- нения клеток CHO-K1 (рис. 2).
1 2 3
Рис. 1 . Иммуноблоттинг препаратов ХТ с сывороткой:
1 – маркеры молекулярных масс; 2 – препарат очищенного ХТ; 3 – супернатант токсигенного штамма V. cholerae О1 569В
В работах ряда зарубежных авторов показано, что некоторые супернатанты штаммов V. chole-rae О1 и V. cholerae nonO1/nonO139, не имеющие гена холерного токсина, продуцируют вещества, способные вызывать морфологические изменения клеток CHO-K1, характерные для ХТ. При этом продуцируемые биологически активные вещества иммунохимически отличаются от энтеротоксина [Wilia et al., 1999; Sathyamoorthy et al., 2000; Tu-teja et al., 2007].
Нейтрализующую активность сыворотки проверяли на препарате ХТ и супернатантах токси-генных штаммов V. cholerae . ХТ в количестве
б
Рис. 2. Нейтрализующая способность сыворотки:
а – действие холерного токсина на культуру клеток СНО-К1; б – нейтрализующее действие сыворотки; в – контрольный образец культуры клеток СНО-К1
Полученная антитоксическая сыворотка обладает высокой нейтрализующей активностью и является эффективным инструментом при тестировании супернатантов штаммов V. cholerae для дифференциации холерного токсина от других биологически ак- тивных веществ в культуре клеток.
На основании вышеприведенных данных можно заключить, что полученная по второй схеме иммунизации антитоксическая сыворотка в большей степени отвечает диагностическим требованиям по чувствительности и специфичности, в связи с чем четыре группы лабораторных животных иммунизировали по второй схеме. В результате было получено 4 экспериментальные серии антитоксических сывороток, которые были проверены на содержание преципитирующих антител. Наличие последних важно при создании диагностикумов. В реакции преципитации с препаратом ХТ 3- и 4-я антитоксические сыворотки образовывали преципитат до разведения 1:8 – 1:16, тогда как сыворотки 1- и 2-й серий преципитировали до разведения 1:16 – 1:32, что указывало на высокий пул специфических иммуноглобулинов в их составе.
В GM 1 ИФА при определении активности взаимодействия сывороток с холерогеном наиболее высокие показатели ОП наблюдались для 1- и 2-й серий. С помощью этих серий детекцию токсина в исследуемых образцах можно осуществлять до рабочего разведения сывороток 1:40000–1:80000, так как соответствующие им значения ОП в 5–6 раз превышают отрицательный контроль. Более низкие титры специфических антител отмечены у 3- и 4-й серий сывороток: токсин выявляется на уровне рабочих титров 1:10000–1:20000 (показатели ОП в 2–3 раза ниже).
Применение сывороток в GM 1 ИФА как диагностических реагентов обусловило необходимость установления минимальной дозы холерогена, которую можно обнаружить в различных токсинсо-держащих образцах. Исследования показали, что при рабочем разведении сывороток 1:20000– 1:40000 чувствительность метода составляет 10– 20 пг (предельное количество токсина, которое можно обнаружить в опытных пробах). Специфичность антитоксических сывороток была подтверждена их отрицательной реакцией в GM 1 ИФА с бесклеточными супернатантами нетоксигенных штаммов представителей V.cholerae О1 и О139 и препаратами ЛПС О1 и О139.
Для разработки иммуноферментных тест-систем необходимо получение специфической иммуноглобулиновой фракции. В настоящее время в литературе описано достаточное количество простых в исполнении и не требующих специального оборудования методов получения иммуноглобулинов. Наиболее часто используют методы высаливания антител насыщенными растворами сернокислого аммония и сернокислого натрия, так как эти методы дают наименьшую потерю антител [Бусыгин, 1975], а для уменьшения загрязнения иммуноглобулиновой фракции альбуминами используют каприловую кислоту [Способ …, 1997].
Для выбора наиболее оптимального метода, обеспечивающего достаточный выход и сохранность нативной структуры специфических белков, мы сравнили несколько методических приёмов выделения иммуноглобулинов: с помощью каприловой кислоты, сульфата натрия, метанольной воды и насыщенного сульфата аммония. При этом наибольший выход по белку отмечен при использовании метанольного метода. Однако в реакции GM 1 –ИФА самые высокие показатели ОП зарегистрированы при взаимодействии ХТ с фракцией иммуноглобулинов, осаждённых с помощью сернокислого натрия или 50%-ного насыщения сульфатом аммония, что свидетельствовало о содержании в них значительного пула специфических антител и сохранности структурной организации. Поэтому в дальнейшем иммуноглобулины из иммунных сывороток осаждали этими методами.
Для любого иммунохимического метода важным является хранение иммунореагентов. Поэтому мы провели исследования для оценки возможности длительного хранения сывороточных антител без использования энергоемких технологий – лиофилизации и глубокой заморозки. Известно, что осаждение сульфатом аммония приводит к стабилизации белков. Суспензия белкового осадка в 2–4М растворе сульфата аммония стабильна в течение многих лет [Скоупс, 1978].
Результаты наших исследований показали, что сульфат аммония в концентрации 1.6 М способен длительное время обеспечивать сохранение исходного титра сыворотки в течение всего срока хранения и препятствовать росту посторонней микрофлоры.
При заборе крови происходит гемолиз эритроцитов и других клеточных компонентов, что способствует контаминации сывороток различными клеточными протеазами и ведет в конечном итоге к нарушению нативной структуры антител и их дальнейшей фрагментации. В предложенном варианте хранения создаются условия, препятствующие взаимодействию протеаз, образуемых при гемолизе эритроцитов и других клеточных компонентов крови, с иммуноглобулинами.
Заключение
В результате исследований было отработано две схемы иммунизации кроликов препаратом ХТ с применением адъюванта Фрейнда и без него. Специфичность полученных кроличьих поликлональных сывороток к очищенному холерному токсину штамма V. cholerae О1 569В была установлена в иммуноботтинге и GM1ИФА. Сыворотки обладали способностью нейтрализовать действие ХТ на культуру клеток CHO-K1. Совокупность полученных результатов позволила сделать вывод, что наиболее оптимальной является вторая схема им- мунизации. По этой схеме были получены четыре серии специфических антитоксических сывороток, способных обнаружить токсин в дозе 10–20 пг. Сравнение методических приёмов выделения иммуноглобулинов показало, что наиболее оптимальными методами являются осаждение с помощью сернокислого натрия или 50%-ного насыщения сульфатом аммония. Показано, что сывороточные антитела можно длительно сохранять в присутствии в 1.6 М сульфата аммония без снижения их чувствительности и специфичности.
Список литературы Получение антитоксических сывороток и возможность их применения в диагностике холеры
- Антитела. Методы / под ред. Д. Кэтти. М.: Мир, 1991. Т. 1. 384 с.
- Белая А.Ю. и др. Определение холерного энтеротоксина с помощью реакции коагглютинации // Вестник Академии медицинских наук СССР. 1984. № 10. С. 9-73.
- Бусыгин К.Ф. Люминесцентная диагностика инфекционных болезней животных. М.: Колос, 1975. 160 с.
- Захарова Т.Л. и др. Создание многокомпонентной диагностической иммуноферментной тест-системы для оценки экспрессии основных генов вирулентности и иммуногенности у холерных вибрионов // Биотехнология. 2008. № 2. С. 88-96.
- Маркина О.В. и др. GM1-ДОТ-ИФА для выявления токсинопродуцирующих штаммов Vibrio cholerae // Клиническая лабораторная диагностика. 2011. № 5. С. 49-52.
- Сизова Ю.В. и др. Влияние температуры на токсинопродукцию холерных вибрионов в речной воде // Здоровье населения и среда обитания. 2016. № 6. С. 54-56.
- Скоупс Р. Методы очистки белков. М: Мир, 1978. 74 с.
- Способ получения иммуноглобулинового препарата: пат. Рос. Федерация. № RU 2 111 001 C1; заявл. 20. 07.1997.
- Тюменцева И.С. и др. Разработка тест-систем магноиммуносорбентных для выявления холерного вибриона в объектах окружающей среды // Здоровье населения и среда обитания. 2014. № 4. С. 17-19.
- Федорова В.А. и др. Сравнительное изучение особенностей синтеза и специфичности энтеротоксина Vibrio cholerae O139 серовара с помощью моноклональных антител // Молекулярная генетика, микробиология и вирусология. 1996. № 3. С. 3-6.
- Фрешни Р.Я. Культура животных клеток: практическое руководство. М.: Лаборатория знаний, 2018. 791 с.
- Bhattacharyya S. et al. Role of the W07-toxin on Vibrio cholera-induced diarrhea // Biochim. Biophys. Acta. 2004. Vol. 1670, № 1. P. 69-80.
- Crowther J.R. Molecular biology methods. IFA Guide. Humana Press part Springer Science Business Media, 2009.
- Hum B.A.L., Chantler S.M. Production of reagent antibodies // Methods Enzymol. 1980. Vol. 70. P. 104-142.
- McCardell B.A. et al. Identification of a CHO-elongating factor produced by Vibrio cholera O1 // Microbial Pathoenesis. 2000. Vol. 29, № 1. P. 1-8.
- Meza-Lucas A. et al. Comparison of DOT-ELISA and Standard-ELISA for Detection of the Vibrio cholerae Toxin in Culture Supernatants of Bacteria Isolated from Human and Environmental Samples // Indian J Microbiol. 2016. Vol. 56, № 3. P. 379-382.
- Sack D.A. et al. Microtiter ganglioside enzyme-linked immunosorbent assay for Vibrio and Escherichia coli heat labile enterotoxins and antitoxins // J. Clin. Microbiol. 1980. Vol. 11, № 1. P. 25-45.
- Sathyamoorthy V. et al. Purification and characterization of a cytotonic protein expressed In vitro by the live cholera vaccine candidate CVD 103-HgR // Infect. Immun. 2000. Vol. 68, № 10. P. 6062-6065.
- Tuteja U. et al. Simultaneous direct detection of toxigenic and non-toxigenic Vibrio cholerae from rectal swabs and environmental samples by sandwich ELISA //J. Med. Microbiol. 2007. Vol. 56, № 10. P. 1340-1345.
- Wilia K. et al. Purification and characterization of novel toxin producend by Vibrio cholera O1 // Infect. Immun. 1999. Vol. 67, № 10. P. 5215-5222.
- Yamasaki E. et al. Detection of Cholera Toxin by an Immunochromatographic Test Strip // Methods Mol. Biol. 2017. Vol. 1600. P. 1-7.
- DOI: 10.1007/978-1-4939-6958-6_1
- Yamasaki E. et al. Development of an immunochromatographic test strip for detection of cholera toxin // Biomed Res Int. 2013. Epub 2013 Nov 7.
- DOI: 10.1155/2013/679038


