Получение чистой культуры сапротрофных бактерий
Автор: Тарасова И.А., Ковальская М.В.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Биотехнология
Статья в выпуске: 2, 2008 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718977
IDR: 14718977
Текст статьи Получение чистой культуры сапротрофных бактерий
Природные экосистемы, не подвергшиеся вмешательству человека, способны к самоочищению. Таким образом природа сама справляется с переработкой более не нужного ей органического материала. В утилизации органики участвует почва, содержащая естественную биоту (микроорганизмы, эдафон). Разнообразие почвенных микроорганизмов составляет микрофлору почвы, которая участвует в переработке мертвой органики в плодородный гумус.
Антропогенное воздействие на окружающую среду приводит к загрязнению почвы отходами производств и жизнедеятельности, где значительное место отведено органическим загрязнителям. Из-за этого изменяется соотношение между отдельными группами микроорганизмов, происходит подавление естественной биоты, в целом нарушаются естественные процессы самоочищения, почвообразования, накапливаются неразлагаемые отходы. Скопления трудноразлагаемых отходов приводят к экологическому дисбалансу и ухудшению санитарных условий жизни людей [2].
Данную экологическую проблему позволяет решить использование биопрепарата со специально подобранными микроорганизмами, ранее выделенными из почвы. Подобранные виды микроорганизмов-сапротрофов способны использовать различные виды мертвой органики в качестве основного источника энергии жизнедеятельности и редуцировать их на безвредные для окружающей среды продукты микробного метаболизма [8). Данный метод позволит восстановить и ускорить процесс естественного самоочищения почвы.
Цель работы — получение чистой культуры сапротрофных бактерий из отобранных проб компостной ямы.
Для выполнения данной цели были сформулированы следующие задачи:
-
— получить отдельные колонии с помощью метода Коха;
-
— провести идентификацию полученных колоний, отобрать колонии с различными ви- j дами микроорганизмов.
Стерилизацию чашек Петри, пробирок и колб производили сухим жаром при температуре 180 °C 60 мин; питательные среды — насыщенным паром под давлением 1 атм при 121 °C в течение 20—30 мин [5].
Перед каждым посевом лабораторное помещение проветривали, проводили влажную уборку, обеззараживали воздух в помещении при помощи ультрафиолетового бактерицидного облучателя. Рабочее место (лабораторный стол, ламинарный бокс) и все рабочие поверхности протирали спиртом [3; 4].
Для получения накопительной культуры сапротрофных бактерий былй отобраны несколько проб из компостной ямы. Полученную суспензию инокулировали в полусинте-тическую питательную среду (табл. 1). Как правило, для получения накопительных культур используют элективные среды, но в нашем случае это не представляется возможным, поскольку сапротрофный образ питания могут вести разнообразные физиологические группы микроорганизмов (сахаролитические, молочнокислые, использующие целлюлозу и др.). Поэтому для культивирования всего разнообразия микроорганизмов был использован мясо-пептонный бульон, подходящий почти для всех хемоорганотрофных бактерий {1$.
Для получения чистой культуры из отдельной колонии использовали принцип Коха, согласно которому каждая колония является потомством одной клетки. При выделении чистой культуры аэробных микроорганизмов накопительную культуру высевали на поверхность плотной среды. Методом последовательных разведений были приготовлены препараты с различной концентрацией исходной суспензии. Всего было сделано 15 разведений с коэффициентом разведения 10. Затем расплавленную на кипящей водяной бане стерильную питательную среду, содержащую агар, разливали в стерильные чашки Петри. После того как среда застывала, на ее поверхность наносили 0,1 мл накопительной культуры из каждого разведения и равномерно растирали стерильным шпателем Дригальского. После посева чашки выдерживали в термостате в течение двух дней при температуре 28 °C.
По истечении двух дней произвели подсчет колоний микроорганизмов на чашках Петри. В чашках с 1-го по 4-е разведения наблюдалось «газонное» зарастание. Подсчет колониеобразующих единиц вели для 5-го (652 КОЕ), 6-го (131 КОЕ) и 7-го разведения (44 КОЕ).
Для того чтобы получить изолированные колонии, вновь делали разведения и производили посев: исходная суспензия последовательно разводилась в несколько раз с целью снизить концентрацию клеток в жидкости до
20—40 клеток в 0,1 мл; затем полученные растворы высевались на плотную питательную среду (МПА) и каждая клетка давала отдельную колонию. Таким образом, были получены колонии разнообразных видов микроорганизмов, которые отличались по морфологическим признакам и формами клеток бактерий. Затем каждую выделенную колонию микроско-пировали светлопольным микроскопом.
Для микроскопирования готовились следующие препараты:
-
1) «раздавленная капля» (нативный);
-
2) фиксированный в агаре;
-
3) фиксированный над пламенем горелки / окрашенный (метод окрашивания по Граму) [6, 71
В ходе выполнения выделения чистой культуры необходимо было решить две методические трудности: во-первых, получить отдельные колонии; во-вторых, провести идентификацию полученных колоний, т. е. отобрать колонии с различными видами микроорганизмов (не повторяющиеся).
Отбор производили на основании морфологических признаков колонии: изрезанность края, форма поверхности, прозрачность, цвет и т. д. (Таблицы 2, 3, 4, 5, 6, 7, 8).В процессе микроскопирования Определяли форму клеток (кокки, палочки), наличие спор и дрожжей, подвижность и т. д.
Результаты микроскопирования: штамм № 1 представлен укороченными палочками (Рис. 1), штаммы № 2 и № 3 — палочки и спороносные палочки, штаммы № 4, № 5 и № 6 — кокки, штамм №7 — длинные палочки (рис. 2). Таким образом, нами выделено 7 чистых культур сапротрофных микроорганизмов. Каждая из них является исключительной по морфологии и форме клеток, из которых она состоит.
В будущем планируется провести дополнительные исследования по определению систематической принадлежности каждого штамма, а также изучение их свойств в целях создания коллекции штаммов, способных утилизировать органику различного состава, и применения их для биологической утилизации и переработки отходов.
Таблица /Состав питательной среды
|
Компоненты |
Количество, г / л |
|
Азофоска |
1,29 |
|
Агар |
9—12 |
|
Мясо-пептонный бульон |
9 |
Таблица 2
Описание колонии штамма № 1
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая, образует кратер в центре |
|
Размер, мм |
3 |
|
Цвет |
Белый |
|
Изрезанность края |
Волнистый |
|
Поверхность |
Матовая |
Таблица 3
Описание колонии штамма № 2
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая |
|
Размер, мм |
3 |
|
Цвет |
Бежевый |
|
Изрезанность края |
Волнистый |
|
Поверхность |
Глянцевая |
Таблица 4
Описание колонии штамма № 3
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая |
|
Размер, мм |
5 |
|
Цвет |
Белый |
|
Изрезанность края |
Волнистый |
|
Поверхность |
Матовая |
Таблица 5
Описание колонии штамма № 4
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая с фестончатым краем |
|
Размер, мм |
2 |
|
Цвет |
Белый |
|
Изрезанность края |
Волнистый |
|
Поверхность |
Матовая |
Таблица 6
Описание колонии штамма № 5
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая |
|
Размер, мм |
0,9 |
|
Цвет |
Белый |
|
Изрезанность края |
Гладкий |
|
Поверхность |
Матовая |
Таблица 7
Описание колонии штамма № 6
|
Признаки |
Результаты |
|
Форма поверхности |
Круглая с фестончатым краем |
|
Размер, мм |
3 |
|
Цвет |
Бежевый |
|
Изрезанность края |
Волнистый |
|
Поверхность |
Матовая |
Таблица 8
Описание колонии штамма -Л? 7
|
Признаки |
Результаты |
|
Форма |
Круглая |
|
Размер, мм |
1 |
|
Цвет |
Белый |
|
Изрезанность края |
Гладкий |
|
Поверхность |
Матовая |
Таблица 9
Морфология клеток и цитология штамма № 1
|
Признаки |
Результаты |
|
Форма и расположение клеток |
Укороченные палочки, одиночные, сцепленные по несколько |
|
Подвижность |
Малоподвижные с вращательным движением вокруг центра |
|
Наличие эндоспор |
Есть, много |
|
Окраска по Граму |
Г рамотрицательные |
Таблица 10
Морфология клеток и цитология штамма № 7
|
Признаки |
Результаты |
|
Форма и расположение клеток |
Длинные палочки, одиночные, сцепленные по несколько |
|
Подвижность |
Нет |
|
Наличие эндоспор |
Нет |
|
Окраска по Граму |
Г рамотрицательные |
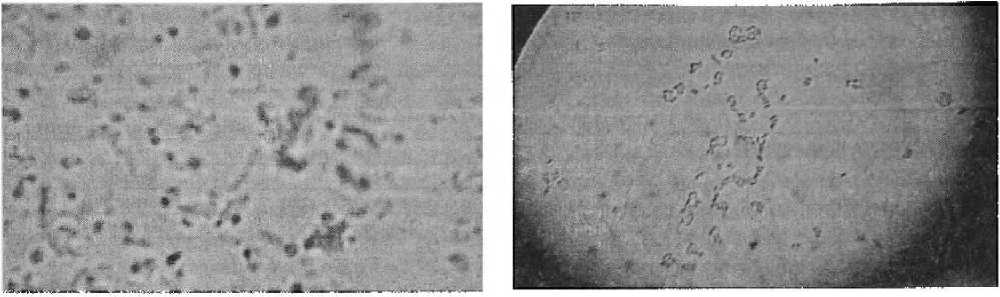
Рисунок / Рисунок 2Микроскопирование препарата Микроскопирование препараташтамма № / штамма № 7
Список литературы Получение чистой культуры сапротрофных бактерий
- Асонов Н. Р. Микробиология; 3-е изд., перераб. и доп./Н. Р. Леонов. М.: Колос, 1997. 352 с.
- Мудрецова-Висс К. А. Микробиология: санитария и гигиена учеб. для вузов/К. А. Мудрецо-ва-Висс, А. А. Кудряшова, В. П. Дедюгина//Владивосток: ДВГАЭУ, 1997. 312 с. ч
- Общая микробиология; пер. с нем. М.: Мир, 1987. 567 с.
- Определитель бактерий Берджи/под ред. Д. Хоулта, Н. Крига, П. Снита, Дж. Стейли и С. Уильямса. М.: Мир, 1997. Т. 1. 430 с.
- Практикум по микробиологии/Е. 3. Теппер, В. К. Шильникова, Г. И. Переверзева; изд. 2-е, перераб. и доп. М.: Колос, 1979. 216 с.
- Чеботарев Л. Н. Техническая микробиология: учеб. пособие/Л. Н. Чеботарев, Л. В. Богданов, Н. И. Лузина. Кемерово: КузПИ, 1986.
- Чеботарев Л. Н. Микробиология в иллюстрациях и схемах: учеб. пособие/Л. Н. Чеботарев, Л. В. Богданов, Н. И. Лузина//Кемерово: КузПИ, 1986. 96 с.
- Шлегель Г. Общая микробиология/Г. Шлегель. М.: Мир, 1987. 500 с.


