Получение DH-растений огурца (Cucumis sativus L.) в культуре неопыленных семяпочек in vitro
Автор: Домблидес Елена Алексеевна, Шмыкова Наталья Анатольевна, Белов Сергей Николаевич, Коротцева Ирина Борисовна, Солдатенко Алексей Васильевич
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. Приоритетным направлением в селекции огурца (Cucumis sativus L.) является создание гибридов Fr, которые отличаются от сортов высокой урожайностью, выравненностью растений по срокам созревания, размерам и качеству продуктивных органов. Целью данного исследования являлась оптимизация условий индукции гиногенеза в культуре неопыленных семяпочек in vitro для расширения спектра формообразования и ускоренного создания гомозиготных линий. Материалы и методы. В исследование были включены восемь перспективных коллекционных образцов огурца лаборатории селекции и семеноводства тыквенных культур ФГБНУ ФНЦО. В ходе экспериментов использовали протокол получения удвоенных гаплоидов для культур семейства Cucurbitaceae в культуре неопыленных семяпочек in vitro, разработанный в лаборатории биотехнологии ФГБНУ ФНЦО. Для индукции гиногенеза использовали питательную среду IMC с 30 г/л сахарозы, 7 г/л агара, 200 мг/л ампициллина и 0,2 мг/л тидиазурона (ТДЗ). Результаты. Оптимальным для введения в культуру является полураскрывшийся бутон или цветок в утренние часы...
Огурец (cucumis sativus l.), dh-растения, культура неопыленных семяпочек in vitro, гиногенез, гаплоиды огурца, гомозиготные линии
Короткий адрес: https://sciup.org/140245811
IDR: 140245811 | УДК: 635.53:573.6 | DOI: 10.18619/2072-9146-2019-6-3-9
Текст научной статьи Получение DH-растений огурца (Cucumis sativus L.) в культуре неопыленных семяпочек in vitro
Огурец (Cucumis sativus L.), принадлежащий к семейству тыквенных (Cucurbitaceae), является одним из наибо- лее широко культивируемых и экономически важных овощей. Использование теплиц в производстве овощей сделало огурец одной из основных овощных культур и способствовало замещению сортов гибридами, как за рубежом, так и в России. В современной селекции овощных культур сформи- ровалось и получило приоритетное направление создание гибридов F1, которые отличаются от сортов высокой урожайностью, выравненностью растений по срокам созревания, размером и качеством продуктивных органов. Основой селекционного процесса при создании гибридов является выведение родительских линий, в результате скрещивания которых получают гибридные семена. Для ускорения селекционного процесса и создания полностью гомозиготных родительских линий в течение одного года необходимо использование био- технологических методов получения удвоенных гаплоидов (DH-растений). Экспериментально получить удвоенные гаплоиды огурца можно тремя способами:
-
1. при использовании индуцированного партеногенеза in situ (опыление неполноценной (облученная или обработанная химическими веществами) пыльцой);
-
2. андрогенеза (культуры пыльников/микроспор in vitro ); 3. гиногенеза (культура неопыленных семяпочек in vitro ).
Основные достижения по получению удвоенных гаплоидов у огурца за последние 30 лет были освещены в ряде обзоров, где разбираются основные преимущества и ограничения каждого из методов (Przyborowski, 1996; Ga l^ zka, Niemirowicz-Szczytt, 2013; Dong et al., 2016; Домблидес и др., 2019).
Эффективность этих методов невысокая, при этом всегда надо учитывать, что генотип донорного растения для всех трех технологий будет играть определяющую роль. В природе гаплоиды самопроизвольно образуются у огурца с очень низкой частотой: на тысячу семян обычно образуется менее одного гаплоидного зародыша (Aalders, 1958), при этом известно, что в одной завязи содержится от 300 до 650 семяпочек. C помощью партеногенеза максимально можно получить до 4,8 гаплоидных эмбриоидов/завязь (Çagalar, Abak, 1999b). А для большинства генотипов при опылении завязей /-облученной пыльцой выход составляет от 0,19 до 1,2 эмбриоида на плод (Przyborowski, Niemirowicz-Szczytt, 1994; Galazka et al., 2015). Наилучший достигнутый результат для культуры пыльников составил до 3 эмбриоидов на 1 культивируемый пыльник и 0,93 DH-растения/пыльник (Song et al., 2007). При использовании гиногенеза in vitro результаты несколько ниже, в опубликованном патенте US Patent 5492827 эффективность разработанной технологии составляет 240 эмбриоидов из 300 завязей огурца (то есть 0,8 эмбриоидов на 1 завязь) (Dirks, 1996). Однако этот достаточно низкий выход не мешает в зарубежных селекционных компаниях получать удвоенные гаплоиды огурца по этой технологии в промышленных масштабах. Большинство же исследований, связанных с использованием культуры неопыленных семяпочек in vitro, носят только экспериментальный характер, и полученный результат возможно повторить лишь на определенных генотипах огурца. Diao et al., 2009 сообщили, что смогли добиться на огурце наибольшего процента индукции гиногенеза в семяпочках (89,4%) и максимального процента регенерации (9,0%). При этом им удалось получить из 366 культивируемых завязей 33 растения, что составляет 0,09 растений на 1 завязь. Li et al., (2013) сообщили об образовании эмбриоидов с частотой 12,4% (0,12 эмбриоидов на 1 культивируемую завязь. Другие исследователи смогли получить до 9 эмбриоидов и одно растение огурца из 18 культивируемых завязей, что составит 0,5 эмбриоидов и 0,05 растений на 1 культивируемую завязь (Ozsan et al., 2017). Наилучший результат был получен в лаборатории биотехнологии ФГБНУ ФНЦО (ВНИИССОК), где удалось достичь индукции гиногенеза у одного из образцов до 62,9% (Шмыкова, Супрунова, 2009) и получить до 20 растений из одной завязи (Шмыкова и др., 2015; Домблидес и др., 2019; Domblides et al., 2019). Однако применительно к другим генотипам выход удвоенных гаплоидов оставался значительно ниже, и разработанная технология нуждалась в дальнейшей модификации.
Целью данного исследования является оптимизация условий индукции гиногенеза в культуре неопыленных семяпочек in vitro у генотипов огурца из коллекции лаборатории селекции и семеноводства тыквенных культур ФГБНУ ФНЦО для создания гомозиготных линий и расширения спектра формообразования.
Материалы и методы исследования
Растительный материал и условия выращивания донорных растений. В работе использовали селекционные образцы огурца из коллекции лаборатории тыквенных культур ФГБНУ ФНЦО. Донорные растения выращивали в 2018-2019 годах в условиях вегетационной камеры при 23°С и фотопериоде 16 ч день/8 ч ночь, освещенности 9 тыс. люкс.
Женские бутоны, находящиеся на стадии 1 сутки до распускания цветка, с вечера изолировали с использованием колпачка из пергаментной бумаги и на следующий день рано утром срывали в фазе полураскрывшегося цветка. Сбор бутонов и закладку опытов производили с середины февраля по середину сентября, с растений, возраст которых не превышал 10 недель.
Cтерилизация эксплантов. С женских бутонов удаляли околоцветник и промывали под струей водопроводной воды с коммерческим моющим средством «АОС» в течение 5 минут. Поверхностную стерилизацию проводили 30 с в 96% этаноле, затем в течение 15 мин в 50% водном растворе коммерческого препарата «Белизна» с добавлением Твина-20 (1 капля на 100 мл), с последующим трехкратным промыванием в течение 10 мин в стерильной дистиллированной воде. Завязи помещали на стерильную влажную фильтровальную бумагу и сохраняли в стерильных условиях в стеклянных чашках Петри диаметром 11 см.
Культура неопыленных семяпочек. После стерилизации завязи разрезали скальпелем и выделяли семяпочки с помощью препаровальных игл под стереомикроскопом Carl Zeiss при x10 увеличении в стерильном ламинарном боксе.
Для индукции гиногенеза использовали питательную среду IМС (Induction Medium for Cucurbitaceae – разработана в лаборатории биотехнологии ФГБНУ ФНЦО (ВНИИС-СОК)) с минеральной основой МСм (Masuda et al., 1981) с добавлением аминокислот (100 мг/л пролина, 100 мг/л серина, 800 мг/л глутамина) и витаминов прописи среды NLN (Lichter, 1982) 30 г/л сахарозы, 7 г/л агара, 200 мг/л ампициллина и 0,2 мг/л тидиазурона (ТДЗ). Культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 16 ч день/8 ч ночь, освещенности 3,5 тыс. люкс.
Получение растений-регенерантов. Нормально развитые образовавшиеся эмбриоиды переносили на безгор-мональную среду MС (Murashige and Skoog, 1962) с 2% сахарозой и 3 г/л фитогеля. Эмбриоподобные структуры зеленого цвета, образовавшиеся из семяпочек, переносили на регенерационную среду СВМ (Gemes-Juhasz et al., 2002), дополненную источником железа (FeSO 4 x7H 2 O – 27,8 мг/л и Na 2 ЭДТАx2 H 2 O – 37,3 мг/л), с 2% сахарозой, 3 г/л фитогеля, 0,05 мг/л НУК и 0,2 мг/л БАП, а через 5-6 недель, после формирования точек роста и нормально развитых побегов, для укоренения помещали на безгормональную среду MС с 2% сахарозой и 3 г/л фитогеля. Культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 16 ч день/8 ч ночь, освещенности 3,5 тыс. люкс.
Выращивание растений-регенерантов. Растения с нормально развитыми листьями и корневой системой переносили в вегетационные сосуды, заполненные смесью торфа и перлита (7:3), накрывали перфорированными пластиковыми стаканчиками для адаптации растений к условиям in vivo. Выращивали растения-регенеранты в климатической камере при режиме 25°С круглосуточно, 16 ч день/8 ч ночь, освещение 9000 люкс.
Статистический анализ. Обработку экспериментальных данных проводили с использованием общепринятых математико-статистических методов с использованием пакета прикладных программ Microsoft Exel и Statistika 6.0
Результаты
Подбор оптимального режима поверхностной стерилизации эксплантов. Для исследования использовались образцы огурца, выращенные в вегетационной камере. На первом этапе работы необходимо было добиться получения хорошо растущей стерильной культуры. В связи с этим большое значение при отработке методики получения удвоенных гаплоидов имел этап стерилизации. Традиционно в нашей лаборатории мы используем 96% этанол и раствор гипохлорита натрия для стерилизации растительных эксплантов, подбирая для каждой культуры время воздействия и концентрацию. В последнее время для этих же целей мы стали использовать и противомикробные препараты, а именно β -лактамные антибиотики. Антибиотики достаточно часто используют для стерилизации растительных эксплантов (Okkel, Pederson, 1988; Simmonds, Grainger, 1993; Lin et al., 1995; Grewal et al., 2006; Yu, Wei, 2008). Однако спектр действия используемых в культуре in vitro антибиотиков чрезвычайно широк и ограничивается не только их стерилизующей функцией. В литературе имеются сведения как о положительном влиянии антибиотиков на рост культивируемых тканей и морфогенез (Данилова, Долгих, 2004; Meng et al., 2014; Grzebelus, Skop, 2014), так и об их фитотоксическом действии (Pollock et al., 1983). Исследования в нашей лаборатории показали, что введение антибиотиков в состав питательной среды способствует не только угнетению роста инфекции, но и большему образованию эмбриоидов в культуре микроспор in vitro . При этом для капусты белокочанной использование в среде ампициллина увеличивало выход эмбриоидов в некоторых генотипах (Минейкина, 2018), а для моркови столовой наилучшие результаты были получены при использовании цефотаксима (Вюртц и др., 2017). В предварительных исследованиях нами было определено влияние добавления в состав питательной среды ампициллина по сравнению с цефотаксимом для индукции гиногенеза у культур семейства Cucurbitaceae в культуре неопыленных семяпочек in vitro (неопубликованные данные).
В результате серии опытов был подобран эффективный режим ступенчатой поверхностной стерилизации c использованием 96% этанола и 50% водного раствора коммерческого препарата «Белизна», который оказался эффективным и в сочетании с добавлением в питательную среду ампициллина в концентрации 200 мг/л обеспечил 100% выход неинфицированных жизнеспособных эксплантов.
Также было отмечено, что для получения стерильной культуры, для образцов, выросших в вегетационной камере, достаточно стерилизации в водном растворе коммерческого препарата «Белизна» в течение 5-7 мин, однако более длительное нахождение в стерилизующем растворе (до 15 мин) способствует размягчению стенок завязи, в результате чего семяпочки удается извлекать более легко и без травмирования. Увеличение времени нахождения завязей в
Таблица 1. Индукция гиногенеза при различном режиме стерилизации бутонов огурца *
Tables 1. Gynogenesis induction in different modes of ovary sterilization*
|
Сортообразец |
Доля индуцированных семяпочек, % |
|
|
время стерилизации 7 минут |
время стерилизации 15 минут |
|
|
"1697/10" |
35,5±1,5 |
33,7±1,6 |
|
"1763" |
34,3±1,8 |
37,8±2,9 |
|
"1811" |
27,2±6,2 |
32,1±7,7 |
*опыт проведен в трехкратной повторности
*experiment carried out in the triple replication стерилизующем растворе с гипохлоритом натрия, при последующем троекратном промывании в большом объёме стерильной дистиллированной воды, не оказывало токсического воздействия на индукцию гиногенеза (табл.1).

А

Б
Рис. 1. Размер завязи бутонов огурца из разных узлов индивидуального растения
Fig. 1. Cucumber ovary sizes from different nodes of individual plant
Примечание: А. группа бутонов женских цветков с завязями маленького размера; Б. группа полураспустившихся женских цветков с завязями большого размера
Note: А. Female ovaries of small size; Б. Half-open female flowers with large ovaries
Оптимальная стадия развития женского гаметофита для индукции гиногенеза. Одним из критических факторов, влияющих на индукцию гиногенеза, является правильная идентификация оптимальной стадии развития женского гаметофита для введения в культуру in vitro . У культур семейства Cucurbitaceae зародышевый мешок образуется по Polygonium -типу. Мегаспорогенез или первые этапы мегагаметогенеза начинаются за 3-4 дня до распускания цветка. Зародышевый мешок полностью созревает и готов к оплодотворению через несколько часов после раскрытия цветка. По литературным данным, оптимальной стадией для введения в культуру in vitro является почти зрелый, либо полностью зрелый зародышевый мешок. Gémes Juhász et al. (2002), проводившие цитологическое изучение развития зародышевого мешка огурца, считают, что оптимальным является время за 6 часов до распускания цветка, в это время зародышевый мешок обычно восьмиядерный, хотя иногда встречаются и четырехядерные мешки. Li et al. (2013) изучали влияние стадии развития завязи огурца при введении в культуру in vitro . Было установлено, что лучшее время для введения экспланта в культуру - за одни сутки до распускания цветка, в случае если сбор был проведен раньше на 12 часов, то происходит снижение количества отозвавшихся семяпочек почти в девять раз. Ориентироваться на фазу развития, используя такой показатель, как время распускания цветка, очень сложно, так как у огурца цветки обычно распускаются до 11 часов дня и, следовательно, период за шесть часов до распускания цветка это 5 часов утра. Несколько сместить время распускания можно, используя для выращивания донорных растений климатическую камеру с регулируемым фотопериодом. По данным лаборатории биотехнологии ФГБНУ ФНЦО, для большинства тыквенных культур оптимальным является полураск-рывшийся бутон или цветок в утренние часы (Шмыкова, Супрунова, 2009; Шмыкова и др., 2015; Domblides et al., 2019). В связи с этим бутоны необходимо изолировать с вечера, а рано утром срывать.
Размер завязи полураскрывшегося бутона в пределах одного генотипа и даже растения может варьировать. Этот показатель будет отличаться у бутонов, расположенных в разных узлах на растении (рис. 1), и зависеть от количества женских бутонов, образовавшихся в одном узле. Проведенные нами исследования показали, что из бутонов большего размера, количество образовавшихся эмбриопо- добных структур будет выше (табл. 2). Возможно, это связано с тем, что в более крупных бутонах семяпочки тоже будут большего размера, следовательно, их несколько проще извлекать без травмирования. По нашим наблюдениям, даже незначительное травмирование семяпочки ингибирует гиногенез.
Следует отметить, что при оптимальном размере бутона общий выход эмбриоподобных структур у большинства генотипов составил в среднем около 30% от общего числа семяпочек. При меньших размерах завязи этот показатель у трех из четырех изученных генотипов был ниже почти в два раза, исключение составил образец «1808», у которого и при размерах завязи 1,6-2,0 см он составлял 30,4%.
Способ введения в культуру in vitro . При создании технологии получения удвоенных гаплоидов огурца обычно используется два разных способа введения в культуру in vitro . В первом случае молодая завязь огурца после поверхностной стерилизации разрезается продольно (Gémes Juhász et al., 2002; Li et al., 2013; Tantasawat et al., 2015; Sorntip et al., 2017; Ozsan et al., 2017) или поперечно (Diao et al., 2008; Moqbeli et al., 2013; Ozsan et al., 2017) на фрагменты, которые сразу же помещают на индукционную питательную среду, и только после трех-четырех недель культивирования развившиеся семяпочки (либо образовавшийся из них каллус и эмбриоиды) извлекают и пересаживают на свежую питательную среду для последующей регенерации из них растений. Во втором случае, семяпочки сразу выделяют из молодой завязи огурца и помещают на индукционную питательную среду (Шмыкова, Супрунова, 2009; Plapung et al., 2014 a,b; Tantasawat et al., 2015; Шмыкова и др., 2015; Domblides et al., 2019).
Проведенные нами исследования показали, что при введении в культуру in vitro фрагментов завязи большая часть семяпочек травмируется и не способна в дальнейшем формировать эмбриоподобные структуры. Кроме того, происходит быстрое разрастание соматических тканей, которые сдавливают развивающиеся семяпочки (рис. 2). Получить эмбриоиды при введении в культуру фрагментов завязей нам не удалось.
Выделение семяпочек из завязи сразу после этапа стерилизации представляет собой достаточно трудоемкий процесс, требующий определенных навыков. Подготовленный специалист выделяет в среднем 50 семяпочек за 40-60 мин. При этом особенно важно правильно
Таблица 2. Индукция гиногенеза в культуре неопыленных семяпочек in vitro, выделенных из завязей разного размера Table 2. Gynogenesis induction in culture of unpollinated ovules in vitro extracted from ovaries of different sizes
|
Генотип |
Размер завязи, см |
Выделенных семяпочек*, шт |
Количество индуцированных семяпочек всего, шт |
Среднее количество образовавшихся эмбриоподобных структур/на одну чашку Петри, шт |
|
«1808» |
1,6-2,0 |
250 |
76 |
15,2 |
|
2,1-2,6 |
250 |
98 |
19,6 |
|
|
НСР 05 |
6,01 |
|||
|
«1809» |
1,7-2,0 |
250 |
32 |
6,4 |
|
2,1-2,6 |
250 |
78 |
15,6 |
|
|
НСР 05 |
4,32 |
|||
|
«1810» |
1,6-2,0 |
250 |
24 |
4,8 |
|
2,1-2,6 |
250 |
56 |
11,2 |
|
|
НСР 05 |
2,98 |
|||
|
«1811» |
1,7-2,0 |
250 |
44 |
8,8 |
|
2,1-2,5 |
250 |
82 |
16,4 |
|
|
НСР 05 |
6,68 |
|||
*5 чашек Петри по 50 семяпочек в каждой для каждого варианта
*5 petri dish contain 50 each ovules for the each variant
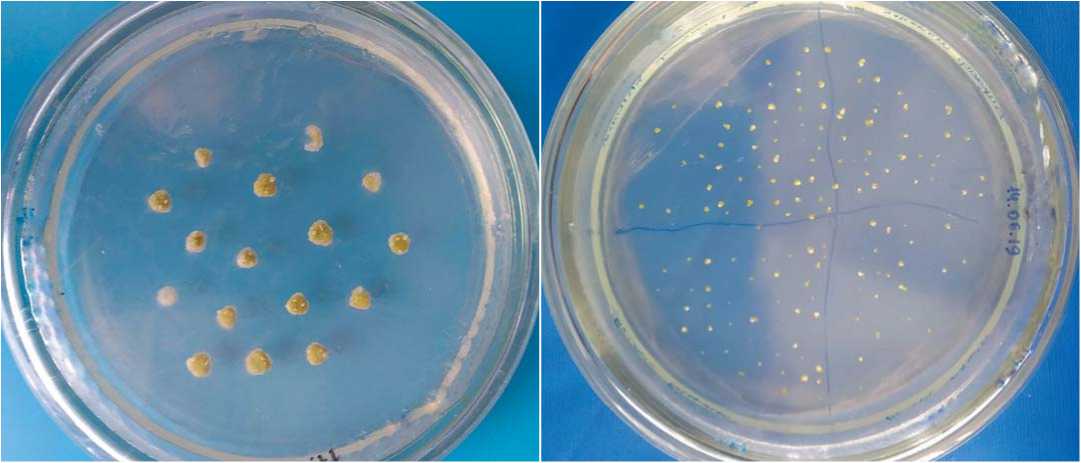
А
Б
Рис.2. Культивирование фрагментов завязи огурца и выделенных семяпочек на питательной среде в чашке Петри диаметром 10 см (14 суток культивирования).
Fig.2. Growth of cucumber ovary parts and extracted ovules on the nutrition medium in petri dish (10 cm.) after 14 days of cultivation
разрезать завязь, так, чтобы при последующем выделении не травмировать семяпочки. Несмотря на сложности, только этот способ введения в культуру мы считаем эффективным.
Эффективность получения удвоенных гаплоидов. Генотип является одним из важнейших факторов, определяющих выход удвоенных гаплоидов по разработанной методике. Нам удалось оптимизировать основные этапы технологии и получить растения-регенеранты R0 в культуре неопыленных семяпочек in vitro (рис.3). Отзывчивость образцов огурца, включенных в исследование в 2018-2019 году, значительно отличалась при использовании разработанной нами технологии (табл.3). Индуцировать образование эмбриоидов и эмбриогенного каллуса удалось у всех восьми включенных в исследование образцов огурца, а получить полноценные растения только из шести образцов. Максимальная индукция гиногенеза наблюдалась у образца "1810" и составляла 63,1%, однако регенерировать полноценные растения у этого образца не удалось. Максимальное количество растений – 12 штук было получено у образца "1763", а у образца "1809" наблюдался наибольший выход растений в пересчете на 10 культивируемых завязей – 20 шт.
Заключение
При использовании индукционной питательной среды IМС, разработанной специально для культур семейства Cucurbitaceae в лаборатории биотехнологии ФГБНУ ФНЦО, нам удалось достичь индукции гиногенеза у всех включен-
Таблица 3. Отзывчивость различных сортообразцов огурца Table 3. Response of different cucumber accessions
|
Сортообразец |
Количество завязей, шт |
Выделенных семяпочек, шт |
Количество индуцированных семяпочек, шт |
Доля индуцированных семяпочек, % |
Количество полученных растений, шт |
Выход растений от числа индуцированных семяпочек, % |
Выход растений/ на 10 завязей, шт |
|
"1697/10" |
5 |
386 |
131 |
33,6 ± 4,2c |
3 |
2,3 |
7 |
|
"1763" |
10 |
1212 |
468 |
37,0 ± 5,1c |
12 |
2,6 |
12 |
|
"1806" |
3 |
163 |
20 |
16,7 ± 10,4ab |
0 |
0,0 |
0 |
|
"1807" |
3 |
280 |
26 |
9,5 ± 1,2a |
2 |
7,7 |
7 |
|
"1808" |
4 |
349 |
236 |
60,4 ± 15,4d |
3 |
1,3 |
8 |
|
"1809" |
2 |
100 |
53 |
55,4 ± 19,6cd |
4 |
7,5 |
20 |
|
"1810" |
4 |
214 |
131 |
63,1 ± 18,9cd |
0 |
0,0 |
0 |
|
"1811" |
5 |
362 |
147 |
42,2 ± 12,1cd |
2 |
1,4 |
4 |
|
НСР 0,5 |
14,2 |
Примечание: значения с одинаковыми буквами существенно не отличались при P≤0,05 Note: the means with same letters have no significant difference at P≤0,05

А

Б
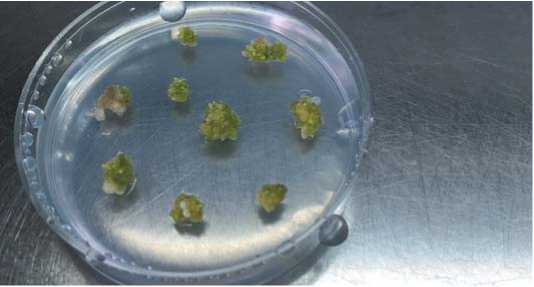
В

Г

Д

Е

Ж
Рис. 3. Получение растений-регенерантов R0 в культуре неопыленных семяпочек in vitro.
-
А. индукция гиногенеза через 4 недели культивирования на индукционной среде IМС с 3% сахарозой, 3 г/л фитогеля, 200 мг/л ампициллина и ТДЗ 0,2 мг/л.;
Б. образование побега из индуцированной семяпочки;
-
В. индуцированные семяпочки на регенерационной среде СВМ с 2% сахарозой, 3 г/л фитогеля, 0,05 мг/л НУК и 0,2 мг/л БАП;
Г. вторичный эмбриогенез из индуцированных семяпочек на регенерационной среде;
Д. укоренение образовавшихся побегов на безгормоналной среде MС с 2% сахарозой;
-
Е. адаптация растений-регенерантов к условиям in vivo;
Ж. растения-регенеранты R0
Fig.3. Production of plants (R0) through culture of unpollinated ovules in vitro.
-
A. Gynogenic induction after 4 weeks of cultivation on the IMC medium with 3% sucrose, 3 g/L phytogel, 200 mg/L, ampicillin and 0.2 mg/L thidiazuron (TDZ);
Б. Shoot formation from induced ovule;
-
B. Ovules with induced gynogenesis on regeneration medium CBM with 2% sucrose, 3 g/L phytogel, 0.05 mg/L NAA and 0.2 mg/L BAP;
Г. Secondary embryogenesis from ovules with gynogenic development on the regeneration medium;
Д. Root formation on the MS medium with 2% sucrose and without growth regulators;
-
E. Adaptation of regenerated plants to in vivo condition;
Ж. Regenerated plants (R0)
ных в исследование образцов. Основная проблема, с которой мы столкнулись, - это низкая регенерационная способность. При регенерации достаточно часто наблюдалось образование витрифицированных побегов и формирование растений с сильно укороченными междоузлиями. Использование безгормональной регенерационной среды не решало данную проблему. В нашем исследовании из 1212 индуцированных семяпочек, развились до полноценного растения, только 26, таким образом выход растений от числа индуцированных семяпочек у изученных образцов составил 2,1 %. Из двух сортообразцов получить растений нам так и не уда-
Об авторах:
Elena A. Domblides – Cand. Sci. (Agriculture),
Head of Laboratory of Reproductive Biotechnology in Crop Breeding,
Natalya A. Shmykova – Dr. Sci. (Agriculture),
Director of OFR Department, Professor in Biotechnology
Sergey N. Belov – Junior Researcher of Laboratory of Reproductive Biotechnology in Crop Breeding,
Irina B. Korottseva – Cand. Sci. (Agriculture), Head of Laboratory Cucurbits Crop Breeding and Seed Production,
Alexey V. Soldatenko – Dr. Sci. (Agriculture),
2015;14(3):81-92.
Список литературы Получение DH-растений огурца (Cucumis sativus L.) в культуре неопыленных семяпочек in vitro
- Вюртц ТС, Домблидес ЕА, Шмыкова НА, Федорова МИ, Кан ЛЮ, Домблидес АС. Получение DH-растений в культуре микроспор моркови. Овощи России. 2017;(5):25-30. DOI: 10.18619/2072-9146-2017-5-25-30
- Домблидес ЕА., Белов СН., Солдатенко АВ., Пивоваров В.Ф. Получение удвоенных гаплоидов огурца (Cucumis sativus L.). Овощи России. 2019;(5):3-14 DOI: 10.18619/2072-9146-2019-5-3-14
- Минейкина АИ. Создание исходного материала капусты белокачанной с использованием современных методов селекции: автореферат диссертации кандидата сельскохозяйственных наук. 2018;118.
- Супрунова НА, Шмыкова ТП. Индукция гиногенеза в культуре in vitro неопыленных семяпочек Cucumis sativus L. Гавриш. 2009;4:40-44
- Шмыкова Н.А., Химич Г.А., Коротцева И.Б., Домблидес Е.А. Перспективы получения удвоенных гаплоидов растений семейства Cucurbitaceae. Овощи России. 2015;(3-4):28-31. DOI: 10.18619/2072-9146-2015-3-4-28-31
- Данилова С.А., Долгих Ю.И. Стимуляция регенерации растений в культуре тканей кукурузы под действием антибиотика цефотаксима. Физиология растений. 2004;51(4):621-625.
- Aalders LE. Monoploidy in Cucumbers. J. Heredity. 1958;49(1):41-44.
- Caglar G, Abak K. Obtention of in vitro haploid plants from in situ induced haploid embryos in cucumber (Cucumis sativus L.). Turk J Agric For. 1999b;23(3):283-290.
- Diao WP, Jia YY, Song H, Zhang XQ, Lou QF, Chen JF. Efficient embryo induction in cucumber ovary culture and homozygous identification of the regenerants using SSR markers. SciHortic. 2008; 119(3):246-251.
- Dirks R. Method for the production of double-haploid cucumbers. United States Patent. 1996. No. 5, 492,827.
- Domblides EA, Shmykova NA, Khimich GA, Korotseva IB, Kan LY, Ermolaev AS, Belov SN, Korotseva KS, Domblides AS, Pivovarov VF, Soldatenko AV. Production of doubled haploid plants of Cucurbitaceae family crops through unpollinated ovule culture in vitro. VI International Symposium on Cucurbits. 2019; June 30/July 4, p.51.
- Dong YQ, Zhao WX, Li XH, Liu XC, Gao NN, Huang JH, Wang WY, Xu XL, Tang ZH. Androgenesis, gynogenesis, and parthenogenesis haploids in cucurbit species. Plant Cell Rep. 2016;35:1991-2019.
- Gałązka J, Niemirowicz-Szczytt K. Review of research on haploid production in cucumber and other cucurbits. FoliaHort. 2013;25(1):67-78.
- GałązkaJ, Stomnicka R, Gуral-Radziszewska K, Niemirowicz-Szczytt K. Follination to DH-lines - verification and optimisation of protocol for production of double haploids in cucumber. Acta Sci. Pol. Hortorum Cultus. 2015;14(3):81-92.
- Gemes-Juhasz A, Balogh P, Ferenczy A, Kristof Z. Effect of optimal stage of female gametophyte and heat treatment on in vitro gynogenesis induction in cucumber (Cucumissativus L.). PlantCellRep. 2002;21(2):105-111.
- Grewal D, Gill R, Gosal sS. Influence of antibiotic cefotaxime on somatic embryogenesis and plant regeneration in indica rice. Biotechnology Journal. 2006;1:1158-1162.
- Grzebelus, E, Skop L. Effect of ß-lactam antibiotics on plant regeneration in carrot protoplast cultures. In vitro Cell. Dev. Biol. - Plant. 2014;50:568-575.
- Li JW, Si SW, Cheng JY, Li JX, Liu JQ. Thidiazuron and silver nitrate enhanced gynogenesis of unfertilized ovule cultures of Cucumis sativus. BiolPlant. 2013;57(1):164-168.
- Lichter R. Induction of haploid plants from isolated pollen of Brassica napus. Z Pflanzenphysiol. 1982;105:427-434.
- Lin JJ, Assad-Garcis N, Kuo J. Plant hormone effect of antibiotics on the transformation efficiency of plant tissue by Agrobacterium tumefaciens Cell. Plant Sci. 1995;109:171-177.
- Matsuda K, Kikuta Y, Okazawa YA. Revision of the Medium for Somatic Embryogenesis in Carrot Suspension Culture. J. Fac. Agr. Hokkaido Univ. 1981;60:183-193.
- Meng Q, Liu Z, Zhang Y, Liu C, Ren F, Feng H. Effects of antibiotics on in vitro-cultured cotyledons. In Vitro Cell. Dev. Biol. Plant. 2014;50:436-441.
- Moqbeli E, Peyvast G, Hamidoghli Y, Olfati JA. In vitro cucumber haploid line generation in several new cultivars. Aspac J molbiolbiotechnol. 2013;21(1):18-25.
- Murashige T, Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 1962;15:473-497.
- Okkels FT, Pedersen MG. The toxicity to plant tissue and to Agrobacterium tumefaciens of some antibiotics. Acta Hort. 1988;225:199-207.
- Ozsan T, Gozen V, Onus A. Cucumber Gynogenesis: Effects of 8 Different Media on Embryo and Plant Formation. International J. of Agriculture Innovations and Research. 2017;6(2): 419-422.
- Plapung P, Khamsukdee S, Potapohn N, Smitamana P. Screening for cucumber mosaic resistant lines from the ovule culture derived double haploid cucumbers. Am J Agric Biol Sci. 2014a; 9(3):261-269.
- Plapung P, Khumsukdee S, Smitamana P. Development of cucumber lines resistant to Cucumber mosaic virus by ovule culture. Int J Agric Technol. 2014b;10(3):733-741
- Pollock K, Barfield DG, Shields R. The toxicity of antibiotics to plant cell cultures. Plant Cell Rep. 1983;2:36-39.
- Przyborowski JA, Niemirowicz-Szczytt K. Main factors affecting cucumber (Cucumissativus L.) haploid embryo development and haploid plant characteristics. PlantBreeding. 1994;112:70-75.
- Przyborowski JA. Haploidy in cucumber (Cucumis sativus L.). In vitro haploid production in higher plants. Kluwer Academic Publishers.1996.
- Simmonds JA, Grainger JL. The toxicity of antibiotics to protoplast cultures of Triticum aestivum L. Plant Science. 1993;89(2):209-214.
- Song H, Lou QF, Luo XD, Wolukau Jn, Diao WP, Qian CT, Chen JF. Regeneration of doubled haploid plants by androgenesis of cucumber (Cucumis sativus L.). Plant Cell Tiss Org Cult. 2007; 90(3):245-254.
- Sorntip A, Poolsawat O, Kativat C, Tantasawat PA. Gynogenesis and doubled haploid production from unpollinated ovary culture of cucumber (Cucumis sativus L.). Canadian Journal of Plant Science. 2017;98(2):353-361.
- Tantasawat PA, Sorntip A, Poolsawat O, Chaowiset W, Pornbungkerd P. Evaluation of factors affecting embryo-like structure and callus formation in unpollinated ovary culture of cucumber (Cucumis sativus). Int J AgricBiol. 2015;17(3):613-618.
- Yu Y, Wei ZM. Influences of cefotaxime and carbenicillin on plant regeneration from wheat mature embryos. Biologia Plantarum. 2008;52:553-556.


