Получение гидролизатов соевого белка с высокой антиоксидантной активностью
Автор: Григорян А.Э., Фоменко И.А., Детинкин И.А., Кусова И.У., Мешенцева Н.Г.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевые системы
Статья в выпуске: 4 (106) т.87, 2025 года.
Бесплатный доступ
На сегодняшний день наблюдается рост интереса к натуральным антиоксидантам, среди которых особое внимание уделяется гидролизатам белков с повышенной антиоксидантной активностью. В настоящем исследовании изучен ферментативный протеолиз изолята соевого белка с целью получения гидролизатов с высокой антиоксидантной активностью. Для протеолиза использовали протеолитические ферментные препараты (ФП) микробного (Alcalase, Neutrase, Flavourzyme, Протозим) и растительного (папаин, бромелаин) происхождения. В полученных гидролизатах была определена общая антиоксидантная емкость (ОАЕ), которая оценивалась тремя методами: FRAP, DPPH и ORAC (результаты выражались в мкмоль-экв. кверцетина/л). Гидролиз проводили при гидромодуле 1:15, дозировках ферментов 0,5–2,0 % от массы субстрата, с поддержанием pH и температуры в течение 4 часов. Установлено, что микробные протеазы обеспечивали более высокую степень гидролиза (СГ) по сравнению с растительными: максимальная СГ достигала 14,95 % для Alcalase, 13,89 % для Flavourzyme, 11,00 для Neutrase и 9,23 для Протозима при дозировке 2 %, в то время как для папаина и бромелаина – 5,06 % и 5,30 % соответственно. Анализ SDS-PAGE подтвердил более глубокое расщепление белка под действием микробных ферментов. По данным анализа ORAC, наивысшую антиоксидантную емкость продемонстрировал гидролизат, полученный с применением ФП Alcalase – 9487,27 мкмоль-экв. кверцетина/л, а по методу FRAP – гидролизаты Alcalase, Neutrase и Протозима (свыше 110 мкмоль-экв./л). Наибольшая ОАЕ по методу DPPH отмечена у гидролизата Neutrase (37,49 мкмоль-экв./л). Показано, что процесс гидролиза значительно повышает антиоксидантные свойства по сравнению с нативным изолятом. Установлено, что ферменты Alcalase, Neutrase, Flavourzyme и отечественный препарат Протозим перспективны для получения гидролизатов соевого белка с выраженной антиоксидантной активностью. Полученные данные могут быть использованы при разработке функциональных ингредиентов для пищевой промышленности.
Ферментативный гидролиз, протеазы, антиоксиданты, гидролизаты растительных белков
Короткий адрес: https://sciup.org/140313615
IDR: 140313615 | УДК: 664.38: 577.151.45 | DOI: 10.20914/2310-1202-2025-4-181-192
Текст научной статьи Получение гидролизатов соевого белка с высокой антиоксидантной активностью
Белки являются одними из основных компонентов различных продуктов питания: мяса, рыбы, молока, яиц, растений. Эти вещества вносят большой вклад в их питательную ценность, а также в функциональные и биологические свойства [1]. Многие свойства белков обусловлены наличием в их цепи различных биоактивных пептидов [2]. Эти специфические белковые фрагменты присутствуют в неактивной форме в исходном белке и могут высвобождаться в процессах его расщепления при получении белковых гидролизатов. Белковые гидролизаты – это сложные смеси пептидов и свободных аминокислот, которые образуются при гидролизе белка – расщеплении пептидных связей под действием ферментативных или химических процессов [3, 4].
Выделяют два основных способа гидролиза белков – химический (кислотный/щелочной гидролиз) и биологические методы (обработка протеолитическими ферментами и ферментация микроорганизмами) [1, 3–5]. Процессы химического гидролиза сложно контролировать, они сопряжены с образованием нежелательных продуктов и менее экологичны. Поэтому наиболее перспективными являются биологические методы, в особенности обработка протеазами [3–6]. Протеазы (протеолитические ферменты) – это обширная группа ферментов, которые воздействуют на пептидные связи, соединяющие аминокислотные остатки в молекуле белка, и расщепляют их, что приводит к образованию более коротких пептидов и аминокислот [7, 8]. Эти ферменты широко распространены в природе и встречаются у всех живых организмов [4, 7, 8]. Протеазы обладают высокой каталитической активностью и субстратной специфичностью, а разнообразие их структур и функций вызывает интерес исследователей с точки зрения поисков новых способов применения [4, 6, 8]. Кроме того, рынок промышленных протеолитических ферментных препаратов ежегодно растет в связи с широким спектром областей их применения: фармацевтическая, текстильная, пищевая промышленности, производство моющих средств, переработка сельскохозяйственных отходов и т. д. [7, 8]. Получение гидролизатов пищевых белков – одно из самых перспективных направлений изучения способов применения протеолитических ферментов.
На сегодняшний день активно изучается получение гидролизатов из мясных продуктов, молочных продуктов, рыбы, микроводорослей и растительных белков [4, 6, 9–12]. Кроме пищевой промышленности белковые гидролизаты могут найти свое применение в косметологии и в качестве биостимуляторов в растениеводстве [13, 14].
В рамках изучения способов получения и свойств белковых гидролизатов отдельного внимания заслуживает соевый белок [2, 3, 6].
Соя является одной из наиболее значимых масличных культур в мире, а соевый белок – самым популярным растительным белком с наиболее высоким уровнем промышленного производства за счет своего высокого содержания в соевых бобах и сбалансированного аминокислотного состава [15–17]. На сегодняшний день активно ведется изучение и развивается применение гидролизатов белка сои в производстве продуктов питания – они являются наиболее распространенным типом гидролизатов в различных категориях пищевых продуктов [6]. Гидролизаты белка сои обладают хорошими функционально-техническими свойствами и проявляют биологическую активность [2, 3]. Одним из самых важный свойств гидролизатов белков является их антиоксидантная активность.
Избыточное накопление активных форм кислорода (АФК), свободных радикалов и про-оксидантных металлов в организме может приводить к повреждению клеток, перекисному окислению и денатурации белков или нуклеиновых кислот [18]. В связи с этим высокое внимание привлекают различные соединения с антиоксидантной активностью, т. е. способностью предотвращать процессы окисления, связанные с АФК [19]. Натуральные антиоксиданты предпочтительнее с точки зрения безопасности, чем синтетические [5, 18]. В связи с этим наблюдается рост интереса к изучению антиоксидантных свойств гидролизатов белков. Известны пептиды с антиоксидантной активностью, обнаруженные в гидролизатах белка конопли [20], рапса [21], нута [22] и т. д. Известен ряд исследований, в которых были подтверждены антиоксидантные свойства различных ферментативных гидролизатов и соевого белка [23–25]. Эта тема привлекает внимание исследователей из России, однако в отечественной научной литературе не так много работ, посвященных ферментативной биоконверсии соевого белка [26–28]. В связи с этим целью настоящего исследования является изучение протеолиза изолята соевого белка ферментными препаратами протеолитического действия микробного и растительного происхождения для получения белковых гидролизатов с высокой антиоксидантной активностью.
Материалы и методы
В работе использовался изолят соевого белка, произведенный Linyl Shansong Biological Products Co., Ltd (Китай). Также в ходе экспериментов применялись ферментные препараты (ФП) Alcalase ® 2.4 LFG, Neutrase ® 0,8 L и Flavourzyme ® 1000L, произведенные «Novozymes» (Дания); папаин и бромелаин производства “Sigma-Aldrich” (США); «Протозим» производства Биопрепарат (Россия).
Содержание абсолютно сухого вещества (АСВ) в белковом изоляте определяли по ГОСТ 31640–2012, сырой протеин (N • 5,71) по ГОСТ 30648.2–99.
Для проведения ферментативного гидролиза навеску изолята соевого белка, взятую по АСВ, суспендировали в дистиллированной воде в соответствии с гидромодулем 1:15. Далее в суспензию вносили ФП с дозировкой 0,5; 1,0; 1,5 и 2,0% от массы субстрата. Гидролиз вели при постоянном перемешивании при выбранных для каждого фермента рН и температуре, которые представлены в таблице 1.
Таблица 1.
Условия ферментативного гидролиза
Table 1.
Conditions of enzymatic hydrolysis
|
Ферментный препарат Enzyme preparation |
Алкалаза 2.4 LFG Alcalase ® 2.4 LFG |
Нейтраза 0.8L Neutrase ® 0,8 L |
Флавозим 1000L Flavourzyme ® 1000L |
Папаин Papain |
Бромелаин Bromelain |
Протозим Protozyme |
|
рН |
8,0 |
7,0 |
7,0 |
7,0 |
7,0 |
8,0 |
|
Температура, °C Temperature, °C |
50 |
50 |
50 |
50 |
55 |
60 |
Параметры температуры и рН, при которых вели гидролиз, выбирали исходя из данных научной литературы о применении исследуемых ФП. Условия гидролиза с применением ФП Alcalase и Flavourzyme были взяты из работы Dent T. и соавт. [29]; для Neutrase из исследования da Silva Crozatti T. и соавт. [30]; для бромелаина из работы Gao Y. и соавт. [31]; для папаина из данных Nath A. и соавт. [32]. Условия гидролиза для ферментного препарата «Протозим» были подобраны в соответствии с рекомендациями производителя.
Степень гидролиза (СГ) определяли как отношение концентрации выделившегося аминного азота в реакционной смеси, измеренной по методу Серенсена (ОФС.1.2.3.0022.15) к концентрации общего азота в реакционной смеси, измеренной по методу Кьельдаля.
Для оценки пептидного профиля гидролизатов был проведен SDS-PAGE по методу Лэммли [33]. Концентрация разрешающего геля – 10%, концентрирующего – 5%. Для проведения SDS-PAGE использовали камеру для вертикального электрофореза Bio-Rad Mini-PROTEAN ® Tetra (США). Также использовали маркер молекулярной массы белков 10-200 кДа производства Servicebio (Китай).
Для оценки общей антиоксидантной емкости (ОАЕ) использовали методы FPAP, DPPH и ORAC. Для приготовления реактива FRAP смешивали 0,3 М ацетатный буфер (рН 3,6), 10 мМ раствор фотометрического реагента – TPTZ (2, 4, 6-Tris(2-pyridyl)-s-triazine) (Acros Organics, Китай), растворяя его в 40 мМ соляной кислоте, и 20 мМ водный раствор хлорида железа (III) (PanReac AppliChem, Испания) в соотношениях 10:1:1, соответственно. Для измерения ОАЕ образцов в пробирку вносили 1,45 мл свежеприготовленного реактива FRAP и 50 мкл образца или дистиллированной воды для измерения контрольной пробы. Реакционную смесь инкубировали в течение 30 мин при 37 ºС в темноте. После инкубации пробы центрифугировали при
3600 об/мин в течение 4 мин для осаждения образовавшегося осадка. Затем регистрировали оптическую плотность при длине волны 594 нм. ОАЕ образцов считали по градуировочному графику для построения которого использовали кверцетин (Sigma-Aldrich, Индия) в диапазоне концентраций 140–300 мкМ, и выражали в мкмоль-экв. кверцетина/л образца.
Для определения ОАЕ методом DPPH к 1,45 мл 100 мкМ этанольному раствору DPPH (ChemCruz, Santa Cruz Biotechnology, США) добавляли 50 мкл образца или этанола в качестве контрольной пробы. Реакционную смесь инкубировали в темноте в течение 30 мин при температуре 22 °C. После инкубации пробы центрифугировали при 3600 об/мин в течение 4 мин для осаждения образовавшегося осадка. Затем регистрировали оптическую плотность при длине волны 517 нм, используя в качестве контрольной пробы 96% этанол. ОАЕ образцов считали по градуировочному графику, для построения которого использовали кверцетин (Sigma-Aldrich, Индия) в диапазоне концентраций 100–250 мкМ, и выражали в мкмоль-экв. кверцетина/л образца.
Для метода ORAC использовали флуориметр-люминометр Fluoroskan Ascent FL (Termo Labsystems, Финляндия) и 96-луночные планшеты (Greiner bio-one, Германия). В каждую лунку планшета вносили 30 мкл образца, разведенного фосфатным буфером в зависимости от активности, в качестве контрольной пробы использовали 75 мМ фосфатный буфер (рН 7,4). Затем в каждую лунку добавляли 200 мкл 0,5 мкМ свежеприготовленного флуоресцеина натрия (Sigma-aldrich, США). Планшет закрывали защитной пленкой (SSIbiо, США) инкубировали в течение 30 мин при 37 °С. После инкубации к реакционной смеси добавляли 30 мкл 153 мкМ AAPH (Aldrich Chemistry, США). Измерения интенсивности флуоресценции проводили при 37 °С в течение 60 мин с интервалом считывания 5 мин, с использованием длин волн возбуждения и эмиссии 485 нм и 535 нм, соответственно.
Для построения градуировочного графика использовали раствор кверцетина (Sigma-aldrich, Индия) в диапазоне концентраций 1-14 мкМ. ОАЕ образцов считали по градуировочному графику, который строили для каждого планшета, и выражали в мкмоль-экв. кверцетина/л образца.
Результаты и обсуждение
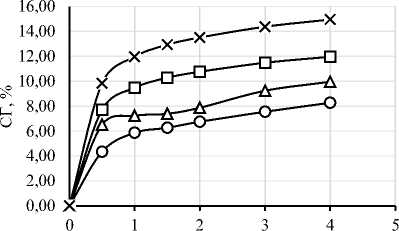
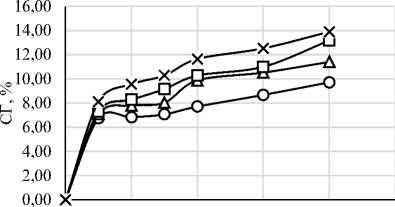
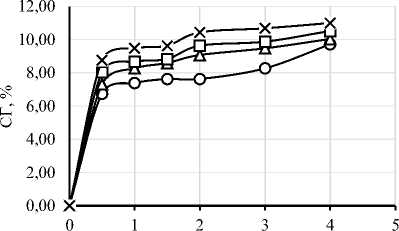
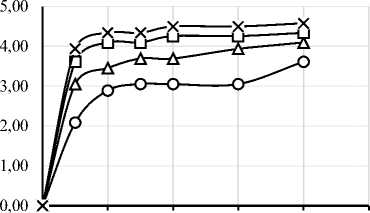
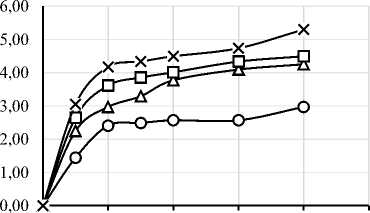
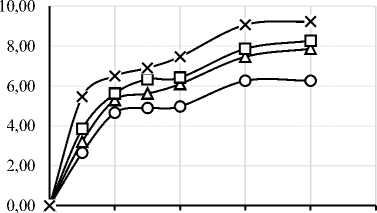
В ходе работы был проведен протеолиз исследуемого изолята белка шестью различными ферментными препаратами. На рисунке 1 представлены графики зависимости степени гидролиза (СГ) от времени ферментативной реакции. Выбор ФП и условия проведения гидролиза существенно влияют на пептидный профиль, функциональные свойства и биологическую активность гидролизатов [4, 6]. Степень гидролиза и характеристики гидролизатов существенно зависят от температуры, времени, рН, концентрации субстрата и активности ФП [34]. Важно отметить, что протеазы могут обладать специфичностью относительно последовательности аминокислот, что делает важным исследования действия конкретных ФП на исследуемый субстрат [35]. Понимание взаимодействия между различными типами ферментов и их субстратами необходимо для оптимизации процессов гидролиза с учётом конкретных областей применения в промышленности [6].
Время гидролиза, ч | Hydrolysis time, h
0,5% 1,0% 1,5% —X— 2,0%
Время гидролиза, ч | Hydrolysis time, h
0,5% 1,0% 1,5% —X— 2,0
(a)
Время гидролиза, ч | Hydrolysis time, h 0,5% 1,0% 1,5% —X— 2,0%
(b)
Время гидролиза, ч | Hydrolysis time, h 0,5% 1,0% 1,5% —X— 2,0%
(c)
Время гидролиза, ч | Hydrolysis time, h
0,5% 1,0% 1,5% —X— 2,0%
(d)
Время гидролиза, ч | Hydrolysis time, h 0,5% 1,0% 1,5% —X— 2,0%
(e)
(f)
Рисунок 1. Графики зависимости степени гидролиза от времени ферментативной реакции с использованием протеолитических ферментных препаратов ((a) – Alcalase 2.4L FG, (b) – Flavourzyme 1000L, (c) – Neutrase 0,8 L, (d) – Папаин, (e) – Бромелаин, (f) – Протозим)
Figure 1. Graphs of the dependence of the degree of hydrolysis on the time of the enzymatic reaction using proteolytic enzyme preparations ((a) – Alcalase 2.4L FG, (b) – Flavourzyme 1000L, (c) – Neutral 0.8L, (d) – Papain, (e) – Bromelain, (f) – Protozyme)
Микробные протеазы в исследуемых дозировках продемонстрировали более высокую степень гидролиза, чем растительные. Максимальная СГ для микробных ФП составила: 14,95% для Alcalase, 13,89% для Flavourzyme, 11,00% для Neutrase, 9,23% для ФП «Протозим». У растительных протеаз максимальная СГ составила 5,30% для бромелаина и 5,06% для папаина. Для всех 6 ФП скорость ферментативной реакции была максимальной в первые 30 минут протеолиза.
Tsou M.J. И соавт. сообщили, что при гидролизе изолята соевого белка ФП Neutrase в течение 4 часов при дозировке фермента 1% была получена СГ ~15%, что немногим выше, чем в настоящем исследовании (10,03% при той же концентрации фермента в течение 4 часов) [36]. В другом исследовании гидролиз изолята соевого белка ФП Neutrase (дозировка 1% по массе субстрата, 4 часа) была получена СГ 1,29% [30]. Полученные отличия, вероятно, связаны с разными применяемыми изолятами белка. Gao Y. и соавт. продемонстрировали СГ бромелаином ~14% для изолята соевого белка (дозировка – 2% от массы субстрата, 4 часа) [31]. Эти данные расходятся с настоящим экспериментом (СГ – 5,30% при той же дозировке ФП и времени), что опять же, вероятно, связано с особенностями объекта исследования. Это подтверждает важность изучения действия ФП на конкретный субстрат.
Сообщается, что при помощи гидролиза изолята белка сои с применением ФП Flavourzyme дозировкой 1% по массе субстрата в течение 4 часов была получена СГ ~12%, что хорошо согласуется с нашим исследованием (СГ – 11,40% при той же дозировке ФП и времени) [37]. Dent T. и соавт. получили СГ изолята белка сои ~10% после 3 часов гидролиза ФП Flavourzyme дозировкой 1% по массе субстрата и СГ ~8% после 3 часов гидролиза ФП Alcalase с той же дозировкой. Эти данные хорошо согласуются с нашими (СГ – 10,51% для Flavourzyme и 9,23% для Alcalase при тех же дозировках ФП и времени) [29]. Интересно отметить, что при дозировке фермента 1% более высокая СГ наблюдалась у ФП Flavourzyme, тогда как при дозировке 2%, лучшая деструкция белков была у ФП Alcalase. Известна работа, в которой подбирались оптимальные рН, температура и дозировка фермента при гидролизе изолята белка сои для ФП Alcalase. При дозировке 1,5% в течение часа была получена СГ 15,56%, тогда как в нашей работе было достигнуто 9,47% в тех же условиях [38]. В другом исследовании, в котором изучалось действие ФП Alcalase на изолят соевого белка при дозировке 2,5% были получены значения СГ ~12–17,79% при времени протеолиза 1–4,5 часа. И, хотя в нашей работе подобная дозировка данного ФП не изучалось, можно сделать предположение о том, что эти данные хорошо согласуются с нашим исследованием – СГ составила 11,96–14,95% при времени гидролиза 1–4 ч с дозировкой ФП 2% [23].
Yin C. и соавт. сообщали о СГ ~2% при гидролизе папаином при дозировке ФП 0,5% в течение получаса, что хорошо соответствует данным, полученным в настоящем исследовании в аналогичных условиях – 2,09% [39]. Насколько нам известно, ранее не сообщалось о кинетике протеолиза изолята соевого белка ФП «Протозим». По полученным данным можно сделать вывод, что данный ФП протеолитического действия довольно эффективен для получения гидролизатов соевого белка с СГ 5–10%.
После сравнения полученных нами данных с информацией из научной литературы можно обратить внимание, что существует существенные различия в результатах исследований между различными авторскими коллективами. Кроме уже упомянутой субстратной специфичности протеолитических ферментов, вклад в эту разницу может внести и особенность методологии вычисления СГ. На сегодняшний день не существует стандартного метода определения этого показателя гидролиза, и различные методы, которые обычно используются, могут давать разные результаты. Кроме того, некоторые анализы могут быть более подходящими для определённых субстратов или типов протеаз [35]. Данные, полученные в настоящем исследовании, отражают кинетику гидролиза изолята белка сои исследуемыми ФП при различных дозировках. Эта информация может быть полезна для выбора рациональных параметров времени и количества ферментного препарата для получения гидролизатов белка сои с конкретной СГ.
На рисунке 2 представлен SDS-PAGE полученных гидролизатов. Анализ проводили для гидролизатов, полученных после 4-x часов гидролиза с дозировкой фермента 2% от массы субстрата.
-200 кДа
-140 кДа
-110 кДа
-75кДа
-55кДа
-42 кДа
-ЗОкДа
-200 кДа
-140 кДа
-110 кДа
-75 кДа
-55кДа
-42 кДа

-ЗОкДа
-23кДа
-18кДа
-18кДа
~10кДа I ~10кДя
12 3 4 5 6 7
Рисунок 2. SDS-PAGE нативного изолята белка сои и его гидролизатов. 1 – Изолят белка сои, 2 – Alcalase, 3 – Flavourzyme, 4 – Neutrase, 5 – Папаин, 6 – Бромелаин, 7 – Протозим
Figure 2. SDS-PAGE of native soy protein isolate and its hydrolysates. 1 – Soy Protein Isolate, 2 – Alcalase, 3 – Flavourzyme, 4 – Neutralase, 5 – Papain, 6 – Bromelain, 7 – Protozyme
Как видно из рисунка 2, в полученных гидролизатах не осталось полипептидов массой более 30 кДа. Для нативного соевого белка полосы в диапазоне молекулярной массы от 80 до 45 кДа представляют собой субъединицы β-конглицинина, а полосы в диапазоне от 45 до 20 кДа представляют собой различные кислотные и основные субъединицы глицинина [29]. В гидролизате, полученном под действием ФП Alcalase практически отсутствуют полосы, что говорит о высокой степени деструкции белка. О подобном сообщали Fathi P. и соавт., также наблюдавшие отсутствие белковых полос в гидролизате белка из рисовых отрубей, полученных под действием ФП Alcalase [40]. Для ФП Flavourzyme также не было выявлено четких полос, за исключением полосы ~20 кДа, что также свидетельствует о высокой степени гидролиза белка. Для ФП Neutrase видны полосы 30, 23 и 20 кДа, что говорит о наличии большого количества полипептидов данной молекулярной массы и не такой высокой СГ, как у Alcalase и Flavourzyme. Для ФП растительного происхождения видны жирные полосы в диапазоне 18–23 кДа. Насыщенность полос в этом диапазоне масс для выбранных ФП свидетельствует об относительно низкой СГ по сравнению с другими исследуемыми протеазами. Для ФП «Протозим» видна полоса около 15 кДа и практически отсутствуют полосы с молекулярной массой выше 20 кДа. В целом результаты анализа SDS-PAGE демонстрируют, что микробные ферменты в исследуемых условиях позволили достичь более глубокого расщепления белка, чем растительные.
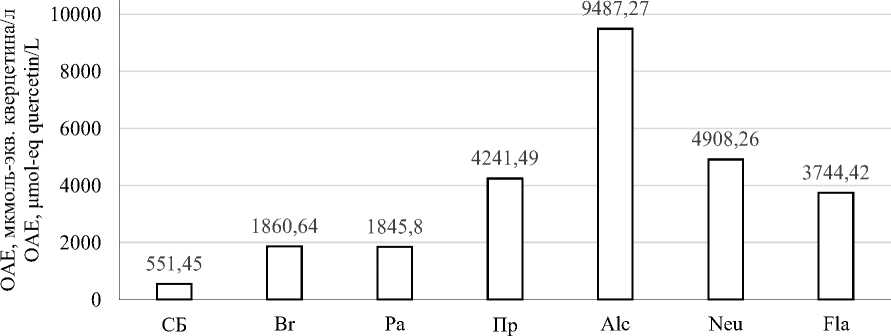
В ходе работы в образцах гидролизатов была определена общая антиоксидантная емкость (OAE) методами FRAP, DPPH и ORAC.
Для анализа были взяты образцы фугатов гидролизатов соевого белка, полученные под действием ФП Alcalase (Alc), Neutrase (Neu), Flavouzyme (Fl), Протозим (Пр), папаин (Pa) и бромелаин (Br), а также фугат суспензии нативного соевого изолята. Для всех изучаемых ферментных препаратов была выбрана дозировка 2%, а гидролиз проводили в течение 4 часов.
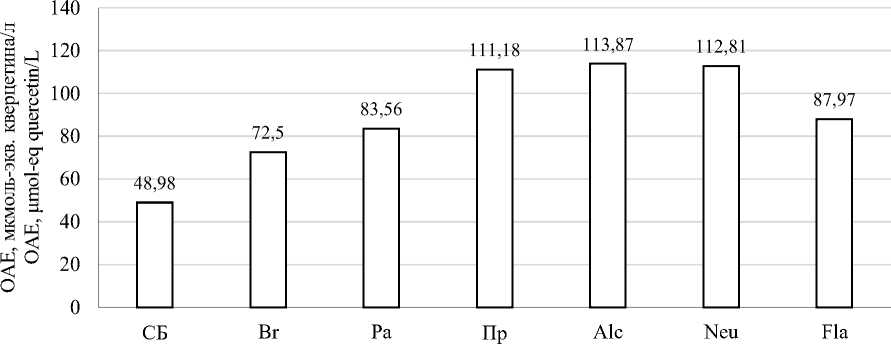
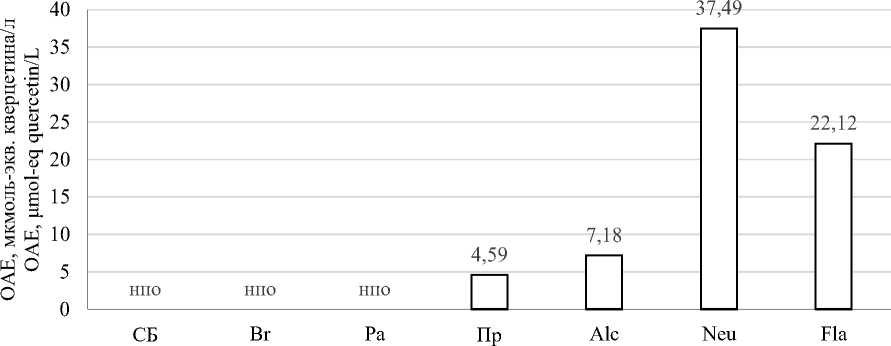
На рисунке 3 представлены результаты определения антиоксидантного потенциала полученных гидролизатов.
В результате анализа FRAP было обнаружено, что все гидролизаты обладали большей антиоксидантной активностью, чем суспензия нативного изолята соевого белка. При этом для образцов, полученных под действием растительных протеаз наблюдались меньшие значения OAE, чем для образцов, полученных под действием микробных ферментов. Максимальные результаты наблюдались у гидролизатов, полученных под действием ФП Alcalase, Neutrase и Протозим – 113,87, 112,81 и 111,18 мкмоль-экв. кверцетина/л соответственно. Для анализа ORAC были обнаружены схожие результаты: увеличение OAE гидролизатов относительно нативного изолята, низкие значения OAE для гидролизатов растительных протеаз и наиболее высокие результаты у образцов, полученных под действием ФП Alcalase, Neutrase и Протозим. При этом OAE у гидролизата Alcalase была существенно выше, чем у других образцов – 9487,27 мкмоль-экв. кверцетина/л.
Анализ DPPH показал, что гидролизаты, полученные под действием ФП Neutrase и Flavourzyme, обладают самой высокой OAE – 37,49 и 22,12 мкмоль-экв. кверцетина/л соответственно. Гидролизаты растительных протеаз и суспензия нативного изолята соевого белка не проявили свойств по поглощению радикалов DPPH.
(a)
(b)
(c)
Рисунок 3. Общая антикосидантная емкость, измеренная методами: (a) – FRAP; (b) – DPPH; (c) – ORAC
Figure 3. Total antioxidant capacity measured by the following methods: (a) – FRAP; (b) – DPPH; (c) – ORAC
В целом результаты анализов по определению ОАЕ демонстрируют, что более высокая СГ микробных протеаз соответствует лучшим антиоксидантным свойствам, хотя и заметна ограниченная корреляция между СГ и OAE. Используемые методы анализа оценивают разные механизмы антиоксидантного эффекта: FRAP – восстановительную способность, DPPH – способность поглощать свободные радикалы, ORAC – способность ингибировать окисление, вызванное пероксильными радикалами [41]. Таким образом, полученные гидролизаты изолята соевого белка могут эффективно поглощать гидроксильные радикалы, при этом обладают умеренной восстановительной способностью и малоэффективны в отношении поглощения свободных радикалов DPPH. Высокая OAE, измеренная методом ORAC у гидролизата Alcalase может свидетельствовать о наличии большого количества пептидов, богатых гидрофобными аминокислотами [42]. Наличие активности FRAP свидетельствует о наличии пептидов и свободных аминокислот, способных отдавать электроны свободным радикалам и прерывать цепную реакцию окисления [43]. Известно исследование, в котором были изучены антиоксидантные свойства гидролизатов изолята белка нута, в котором гидролизаты, полученные под действием папаина и бромелаина продемонстрировали большую антиоксидантную емкость (методы FRAP и ORAC), чем гидролизаты, полученные при протеолизе ФП Alcalase [22]. В настоящем исследовании наблюдалась противоположная тенденция, что еще раз свидетельствует о важности изучения действия различных протеолитических ФП на конкретный субстрат.
Важной задачей дальнейших исследований может стать идентификация пептидов, вносящих наибольший вклад в антиоксидантную активность исследуемых гидролизатов с целью объяснения механизмов их антиоксидантных свойства. Также сообщалось, что фракционирование гидролизатов растительных белков может способствовать выделению фракций с лучшими антиоксидантными свойствами [44].
Заключение
В ходе работы был изучен протеолиз изо-лята соевого белка 6-ю различными протеолитическими ферментными препаратами микробного и растительного происхождения – Alcalase, Neutrase, Flavourzyme, папаин, бромелаин и Протозим. При дозировке ФП 2% от массы субстрата в течение 4-x часов гидролиза СГ для микробных ФП составила: 14,95% (Alcalase), 13,89% (Flavourzyme), 11,00% (Neutrase), 9,23% (Протозим); для растительных ФП – 5,30% (бромелаин) и 5,06% (папаин). Полученные суспензии гидролизатов были подвергнуты центрифугированию и в фугатах была определена общая антиоксидантная емкость методами FRAP, DPPH и ORAC. Было обнаружено, что процесс гидролиза привел к повышению антиоксидантных свойств в сравнении с суспензией нативного изолята белка. Наилучшими антиоксидантными свойствами, измеренными методами FRAP и ORAC обладал гидролизат полученный под действием ФП Alcalase – 113,87 и 9487,27 мкмоль-экв. кверцетина/л соответственно. Для метода DPPH было обнаружено, что самая высокая OAE была у гидролизата, полученного под действием ФП Neutrase – 37,49 мкмоль-экв. кверцетина/л. Было установлено, что гидролизаты изолята соевого белка, полученные под действием ФП Alcalase обладают высокой способностью поглощать пероксильные радикалы и умеренной восстановительной способностью. Гидролизаты, полученные под действием ФП Neutrase, Flavourzyme и Протозим также обладают высокой OAE, измеренной методом ORAC (около 4000–5000 мкмоль-экв. кверцетина/л) и сравнимой с гидролизатами Alcalase OAE, измеренной методом FRAP. Таким образом ФП Alcalase, Flavourzyme, Neutrase и Протозим перспективны для получения гидролизатов изолята соевого белка с высокой антиоксидантной активностью, однако требуются дальнейшие исследования механизма антиоксидантной активности и определение аминокислотных последовательностей биологически активных пептидов. Важно отметить, что о действии отечественного ФП Протозим на изолят соевого белка ранее не сообщалось. В ходе настоящей работы было установлено, что его применение позволяет эффективно получать гидролизаты соевого белка со степенью гидролиза около 10% с высокой антиоксидантной емкостью.


