Получение глюкозо-фруктозного сиропа из якона
Автор: Романюк Т.И., Чусова А.Е., Тарарыков М.П., Матвиенко Н.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (88), 2021 года.
Бесплатный доступ
Использование инулинсодержащего сырья для получения глюкозо-фруктозного сиропа позволяет значительно уменьшить в нем количество глюкозы, а долю фруктозы увеличить до 97%. В связи с этим целью исследований явилось изучение процесса получения глюкозо-фруктозных сиропов биоконверсией инулинсодержащего сырья якона. Деполимеризацию фруктанов осуществляют ферментом инулиназой, гидролизующей полимер до фруктозы и сахарозы. Объектом исследования служили корнеплоды якона с содержанием инулина 17,3%, ферментный препарат инулиназа из A. awamori 2250. Рациональным режимом гидротермообработки клубней якона является: температура 85 ?, продолжительность 30 мин, гидромодуль 1:0,5. Рациональные режимы осахаривания якона ферментным препаратом инулоаваморин П10х: рН 5,5; дозировка ферментного препарата 14 единиц на 1 инулина якона, температура 50 ? для якона, продолжительность гидролиз 3,5-4 часа. Таким образом, нами подобраны рациональные режимы осахаривания якона ферментным препаратом инулоаваморин П10х: рН 5,5; дозировка ферментного препарата 14 единиц на 1 инулина якона, температура 50 ? для якона, продолжительность гидролиз 3,5-4 часа. Получен фруктозо-глюкозный сироп, представляющий собой вязкую жидкость без осадка и посторонних включений. Цвет от желтого до светло-коричневого различной интенсивности, вкус сладкий без горечи. Запах, как правило, отсутствует, при этом допускается легкий фруктовый или карамельный аромат. По физико-химическим свойствам фруктозо-глюкозный сироп имеет следующие показатели: сухие вещества 70-80%; редуцирующие вещества 88-90% в пересчете на абсолютно сухое вещество; фруктоза 87 89% в пересчете на абс. сухое вещество; глюкоза 1% в пересчете на абс. сухое вещество; остаточное содержание инулина 1-2% в пересчете на абс. сухое вещество; белковые вещества 6-6,5% в пересчете на абс. сухое вещество; содержание золы 4% в пересчете на абс. сухие вещества. Энергетическая ценность фруктозо глюкозного сиропа составляет 315 ккал/100 г.
Якон, глюко-фруктозный сироп, инулин, инулиназа, биоконверсия
Короткий адрес: https://sciup.org/140261171
IDR: 140261171 | УДК: 664.165 | DOI: 10.20914/2310-1202-2021-2-87-92
Текст научной статьи Получение глюкозо-фруктозного сиропа из якона
В настоящее время происходит интенсивный рост производства заменителей сахара, особенно углеводной группы, в частности, глюкозно-фрук-тозных сиропов (ГФС). По своему составу и биологической ценности они превосходят сахарозу, обладают хорошей влагоудерживающей способностью, высокой гигроскопичностью. Высокие бактерицидные свойства сиропов характеризуются постоянным химическим составом, Для цитирования
низкой вязкостью. ГФС являются перспективными заменителями сахара при выработке хлебобулочных, кондитерских и молочных продуктов, безалкогольных напитков и консервов т. д. [1–2].
Обычно глюкозо-фруктозные сиропы получают кислотным или ферментативным гидролизом крахмала зерновых культур или сахарозы с последующей изомеризацией глюкозы во фруктозу. При кислотном гидролизе образуются побочные продукты (фурфурол,
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License оксиметилфурфурол, гидроксиметилфурфурол), имеющие токсические свойства. Кроме того, сам процесс протекает в довольно жестких условиях и требует нейтрализации кислоты, которая придает сиропам солоноватый привкус. Для улучшения качества ГФС и повышения их биологической ценности, кислотный гидролиз заменяют ферментативным [3, 4].
Перспективным является производство ГФС гидролизом полифруктана инулина, содержащегося в нетрадиционном сельскохозяйственном сырье – яконе [5].
Якон ( Polimnia sonchifolia ) с древних времен разводят в Перу и других латиноамериканских странах, он является дальним родственником подсолнечника и топинамбура, выращивается для получения съедобных корневых клубней. Якон используют для получения сахара, инулина и спирта, а также как кормовое растение. В настоящее время интродуцирован в США, Новой Зеландии, Японии, Западной Европе, России и Молдове. Корневые клубни якона значительно различаются по форме, размеру и сладости. Масса их составляет 100–500 г. Свежие корнеплоды якона содержат 69–83% воды, 0,4–2,2% белка и 20% сахаров, состоящих в основном из инулина. Отмечают высокое содержание в корневых клубнях калия. Якон используют для получения сахара, инулина и спирта, а также как кормовое растение [6–8].
Использование инулинсодержащего сырья для получения глюкозо-фруктозного сиропа позволяет значительно уменьшить в нем количество глюкозы, а долю фруктозы увеличить до 97% [2].
Деполимеризацию фруктанов осуществляют ферментом инулиназой (КФ 3.2.1.7; 2,1-β-D-фруктан-фруктаногидролаза), гидролизующей полимер до фруктозы и сахарозы. Продуцентами, имеющими промышленное значение, являются грибы рода Aspergillus и дрожжи Kluyveromyces. Представляют интерес также бактериальные инулиназы, обладающие высокой термостабильности [9, 10–20].
Цель работы – изучение процесса получения глюкозо-фруктозных сиропов биоконверсией инулинсодержащего сырья – якона.
Материалы и методы
Объектом исследования служили корнеплоды якона с содержанием инулина 17,3%, ферментный препарат инулиназа из A. awamori 2250.
Инулиназную активность определяли, используя в качестве субстрата 2% раствор инулина. Гидролиз проводили при температуре 50 ℃, рН 4,7 в течение 20 минут. Об активности фермента судили по накоплению редуцирующих веществ, которые определяли по Бертрану
Содержание инулина в растительном сырье определяли полумикрометодом Бертрана, определение фруктозы проводили методом Кольтгофа.
Клубни якона предварительно подвергали сортировке и мойке. В связи с действием полифенолоксидазы, находящейся в клубнях, измельченные корнеплоды темнеют, что неблагоприятно сказывается на окраске полученного сиропа. Поэтому для инактивации тирозиназы клубни подвергали бланшировке – обваривали в воде с температурой 85 ℃ в течение 3 минут, обработанные клубни измельчали до размера частиц 1–3 мм.
Результаты и обсуждение
Существует много способов предварительной подготовки якона к гидролизу с целью наиболее полного выделения инулина. Наиболее приемлемой для промышленных масштабов является гидротермообработка измельченных клубней.
Основными факторами, влияющими на процесс перехода инулина из клубней в раствор, являются: температура, гидромодуль (соотношение измельченных клубней и воды), а также продолжительность обработки.
Исследование влияния температуры на процесс перехода инулина из клубней в раствор проводили в интервале температур 85–100 ℃. Измельченные корнеплоды помещали в колбы, содержимое заливали дистиллированной водой в количестве 1:1, проводили тепловую обработку в течение 20 минут, затем исследовали количество инулина, оставшееся в мезге и перешедшее в жидкую фазу.
Экспериментальные данные (рисунок 1) показали, что оптимальной температурой выхода инулина из клубня якона является 85–87 ℃. Дальнейшее повышение температуры уменьшает выход полисахарида, а количество сахаров возрастает, по-видимому, это связано с термическим разложением инулина.
Изучение влияния количества воды на переход инулина из клубней якона проводили при температуре 85о С в течение 30 минут.
Экспериментальные данные (рисунок 2) показали, что с увеличением количества добавляемой воды к массе измельченных корнеплодов, увеличивается масса инулина, перешедшего в жидкую фазу. Наибольший выход инулина наблюдался при соотношении измельченных корнеплодов и воды 1:0,5.
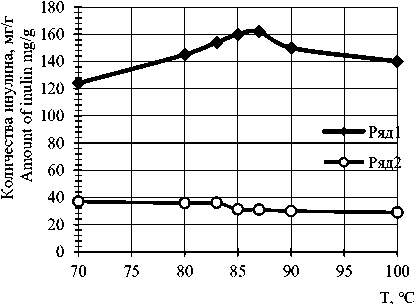
Рисунок 1. Изменение количества инулина в процессе разваривания якона 1 – перешедшее в фильтрат; 2 – остающееся в мезге
Figure 1. Change in the amount of inulin in the process of boiling yacon 1-transferred to the filtrate; 2-remaining in the pulp
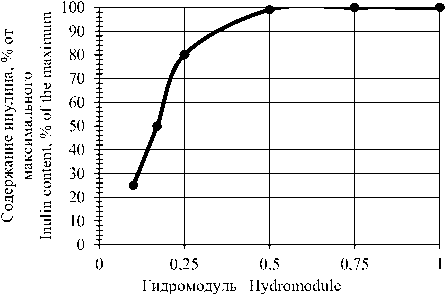
Рисунок 2. Влияние гидромодуля на переход инулина в жидкую фазу при разваривании якона, % от максимального
Figure 2. Effect of the hydromodule on the transition of inulin to the liquid phase during the boiling of the yacon, % of the maximum
Далее было изучено влияние продолжительности гидротермообработки на процесс извлечения инулина из тканей корнеплодов якона. Процесс разваривания осуществляли в интервале времени 15–60 мин при ранее подобранной температуре. На рисунке 3 показано влияние продолжительности разваривания инулинсодержащего сырья на переход инулина в раствор. Как видно из рисунка, минимальное количество инулина, остающееся в мезге якона достигается при продолжительности разваривания 30 мин. При этом практически все сахара переходят в раствор. Таким образом, оптимальной для перехода сахаров в жидкую фазу является продолжительность процесса гидротермообработки 30 мин.
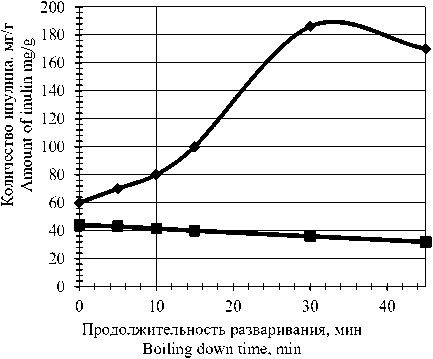
Рисунок 3. Влияние продолжительности разваривания якона на переход инулина в жидкую фазу: 1 – перешедшее в фильтрат, мг; 2 – остающееся в мезге, мг
Figure 3. The effect of the duration of yacon boiling on the transition of inulin to the liquid phase: 1-transferred to the filtrate, mg; 2-remaining in the pulp, mg
Таким образом, рациональным режимом гидротермообработки клубней якона является: температура – 85 ℃, продолжительность – 30 мин, гидромодуль – 1:0,5.
Гидролиз инулина – важная технологическая операция при получении фруктозных сиропов и фруктозы из инулина. Исследован процесс ферментативного гидролиза инулина, содержащегося в яконе препаратом инулоаваморин П10х с инулиназной активностью 600 ед./г. Проведенные во Всероссийском научно-исследовательском ветеринарном институте патологии, фармакологии и терапии (НИВИПФиТ) токсикологические испытания показали отсутствие общей токсикологичности у препарата инулоа-ваморин П10х, что позволит применять его в пищевой промышленности.
Основными факторами, влияющими на процесс осахаривания инулинсодержащего сырья, являются: рН реакционной среды, дозировка ферментного препарата, температура и продолжительность процесса. Оптимальными условиями действия инулоаваморина П10х являются рН среды 5,5, температура 50 ℃.
Изучение влияния температуры на процесс ферментативного гидролиза инулинсодержащего сырья проводили при дозировке инулоавамо-рина 14 единиц на 1 г инулина в интервале температур 40–60 ℃.
Динамика гидролиза якона при различных температурах представлена на рисунке 4. Максимальное расщепление инулина (100%) наблюдается через 3,5 ч ферментации якона при температуре 50 ℃. Повышение температуры до 60 ℃ способствует уменьшению активности фермента, а, следовательно, и степени осахаривания инулинсодержащего сырья, что, вероятно, связано с термической инактивацией фермента.
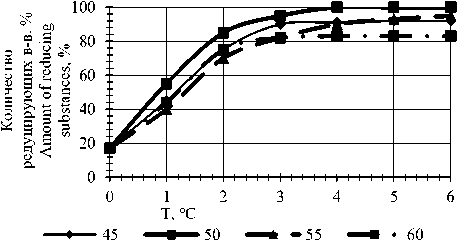
Рисунок 4. Влияние температуры на осахаривание якона при дозировке ферментного препарата 14 ед./г инулина
Figure 4. The effect of temperature on the saccharification of yacon at the dosage of the enzyme preparation 14 u/g inulin
При изучении влияния дозировки инуло-аваморина П10х на степень осахаривания инулинсодержащего сырья гидролиз полисахарида осуществляли в мезге при оптимальных условиях действия используемого ферментного препарата, который вносили в количестве 10 – 18 единиц на 1 г инулина.
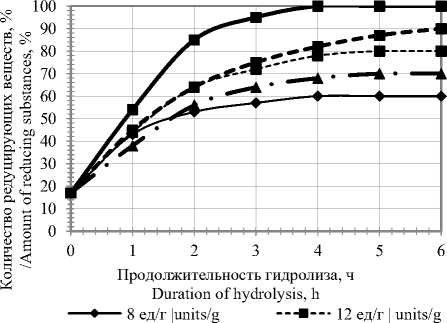
^^* • 10 ед/г | units/g ■ 14 ед/г | units/g
—-■—- 16 ед/г | units/g
Рисунок 5. Динамика осахаривания якона при различной дозировке ферментного препарата
Figure 5. Dynamics of saccharification of yacon at different dosages of the enzyme preparation
Анализ экспериментальных данных (рисунок 5) показал, что оптимальной дозировкой инулоаваморина при гидролизе инулина, содержащегося в яконе является 14 единиц (максимальное количество редуцирующих веществ 95–100%).
При этом продолжительность гидролиза инулина составляет 3,5 – 4 ч. Внесение ферментного препарата в меньших количествах не зависимо от используемого сырья позволяет получить гидролизаты с содержанием редуцирующих веществ не более 70 – 90%. Увеличение дозировки инулоаваморина способствует некоторому снижению скорости реакции при приближении к полному гидролизу инулина. Это вполне логичные результаты, согласующиеся с традиционной обратно пропорциональной зависимостью концентрации фермента и продолжительности процесса.
Таким образом, нами подобраны рациональные режимы осахаривания якона ферментным препаратом инулоаваморин П10х: рН 5,5; дозировка ферментного препарата 14 единиц на 1 инулина якона, температура 50 ℃ для якона, продолжительность гидролиз 3,5–4 часа.
От полученных гидролизатов прессованием мезгу отделяли, полученный фильтрат осветляли путем пропускания его через адсорбент. В качестве адсорбента служил активированный уголь. Осветленный гидролизат упаривали под вакуумом при температуре 60–70 ℃ до получения сиропа, содержащего не менее 70% сухих веществ.
Заключение
Полученный фруктозо-глюкозный сироп представляет собой вязкую жидкость без осадка и посторонних включений. Цвет – от желтого до светло-коричневого различной интенсивности, вкус – сладкий без горечи. Запах, как правило, отсутствует, при этом допускается легкий фруктовый или карамельный аромат.
По физико-химическим свойствам фруктозоглюкозный сироп имеет следующие показатели: сухие вещества 70–80%; редуцирующие вещества 88–90% в пересчете на абсолютно сухое вещество; фруктоза 87–89% в пересчете на абс. сухое вещество; глюкоза 1% в пересчете на абс. сухое вещество; остаточное содержание инулина 1–2% в пересчете на абс. сухое вещество; белковые вещества 6–6,5% в пересчете на абс. сухое вещество; содержание золы 4% в пересчете на абс. сухие вещества. Энергетическая ценность фруктозо глюкозного сиропа составляет 315 ккал/100 г.
Получен фруктозо-глюкозный сироп, который может использоваться в различных отраслях пищевой промышленности.
Список литературы Получение глюкозо-фруктозного сиропа из якона
- Маргиева З.З. Использование сиропа якона при производстве кисломолочных напитков // Научные труды студентов Горского государственного аграрного университета «Студенческая наука-агропромышленному комплексу». 2019. С. 308-310.
- Булавинова О.В. Нетрадиционные растения – заменители сахара при диабете // В сборнике: Образование, наука, производство – 2017. 2017. С. 229–231.
- Кореяман Я.И., Рудниченко Е.С., Мельникова Е.И., Нифталиев С.И. и др. Экстрагирование физиологически ценных компонентов натурального подсластителя якона // Химическая технология. 2008. Т. 9. № 12. С. 626–627.
- Adriano L.S., Dionísio A.P., Pinto de Abreu F.A., Ferreira Carioca A.A. et al. Acute postprandial effect of yacon syrup ingestion on appetite: A double blind randomized crossover clinical trial // Food Research International. 2020. V. 137. P. 109648. doi: 10.1016/j.foodres.2020.109648
- Холявка М.Г., Ковалева Т.А. Разработка гетерогенного биокатализатора реакции гидролиза инулина для получения фруктозных сиропов // В сборнике: Актуальные вопросы медицинской науки. сборник научных работ студентов и молодых ученых Всероссийской научно-практической конференции с международным участием, посвященной 1000-летию г. Ярославля. ГОУ ВПО "Ярославская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию", 2010. С. 30–31.
- Терещенко Ю.В. Трактовка основных показателей вариабельности ритма сердца // Новые медицинские технологии на службе первичного звена здравоохранения: материалы межрегиональной конференции. 2010. С. 3–11.
- Османьян Р.Г. характеристика корнеплодов якона и продуктов его переработки [использование пюре из якона (polymnia sonchifolia, compositae) при производстве функциональных хлебобулочных изделий] // Пищевая и перерабатывающая промышленность. Реферативный журнал. 2009. № 1. С. 42.
- Кононков П.Ф. Интродукция якона в России. Москва, 2011.
- Цугкиева В.Б., Гулуева Д.Т., Содержание питательных веществ в биомассе якона // Известия Горского государственного аграрного университета. 2011. Т. 48. № 1. С. 117–118.
- Шереметова С.Г., Голованева А.М. перспективы использования экстрактов и сиропов стевии и якона в кисломолочных продуктах // Инновационные технологии в пищевой промышленности: наука, образование и производство: материалы IV Международной заочной научно-технической конференции. Воронежский государственный университет инженерных технологий, 2017. С. 102–104.
- Шереметова С.Г., Байдичева О.В., Хрипушин В.В., Рудаков О.Б. и др. Контроль цветности и концентрации сиропов стевии, топинамбура, цикория и якона с применением цифровой фотографии // Современные проблемы технологии производства, хранения, переработки и экспертизы качества сельскохозяйственной продукции: материалы Международной научно-практической конференции. 2007. С. 356–360.
- Голованева О.М., Шереметова С.Г. Перспективы использования экстрактов и сиропов стевии и якона в кисломолочных продуктах // Инновационные технологии в пищевой промышленности: наука, образование и производство. 2018. С. 307-310.
- Дзантиева Л. Б., Цугкиева В. Б., Гулуева Д. Т. Использование якона, интродуцированного в Рсо-Алания, для приготовления мармелада // Инновационные технологии производства и переработки сельскохозяйственной продукции. 2019. С. 420-422.
- Ермоленкова Г.В. Якон-надежда 21 века // Наше сельское хозяйство. 2019. №. 9. С. 78-81.
- Flores A.C., Morlett J.A., Rodríguez R. Inulin potential for enzymatic obtaining of prebiotic oligosaccharides // Critical reviews in food science and nutrition. 2016. V. 56. №. 11. P. 1893-1902. doi: 10.1080/10408398.2013.807220
- Ahmed W., Rashid S. Functional and therapeutic potential of inulin: A comprehensive review // Critical reviews in food science and nutrition. 2019. V. 59. №. 1. P. 1-13. doi: 10.1080/10408398.2017.1355775
- Vogt L., Meyer D., Pullens G., Faas M. et al. Immunological properties of inulin-type fructans // Critical reviews in food science and nutrition. 2015. V. 55. №. 3. P. 414-436. doi: 10.1080/10408398.2012.656772
- Xu W., Ni D., Zhang W., Guang C. et al. Recent advances in Levansucrase and Inulosucrase: evolution, characteristics, and application // Critical reviews in food science and nutrition. 2019. V. 59. №. 22. P. 3630-3647. doi: 10.1080/10408398.2018.1506421
- Rawat H.K., Soni H., Treichel H., Kango N. Biotechnological potential of microbial inulinases: recent perspective // Critical reviews in food science and nutrition. 2017. V. 57. №. 18. P. 3818-3829. doi: 10.1080/10408398.2016.1147419
- Ho Do M., Seo Y.S., Park H.Y. Polysaccharides: bowel health and gut microbiota // Critical reviews in food science and nutrition. 2020. P. 1-13. doi: 10.1080/10408398.2020.1755949


