Получение химерного белка-элиситора MF2/MF3 и оценка его защитной активности против вируса табачной мозаики
Автор: Ерохин Д.В., Синельников И.Г., Шашков И.А., Денисенко Ю.А., Поплетаева С.Б., Щербакова Л.А., Джавахия В.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: ДНК-технологии
Статья в выпуске: 3 т.59, 2024 года.
Бесплатный доступ
Использование препаратов на основе безопасных для окружающей среды белковых элиситоров устойчивости растений к болезням может стать приемлемой альтернативой синтетическим пестицидам-ксенобиотикам, поскольку в естественных условиях такие элиситоры разлагаются до безвредных природных аминокислот. Этот подход также существенно снизит риск возникновения резистентности патогенов к средствам защиты растений. Ранее нами были выделены и исследованы бактериальные белки-элиситоры MF2 и MF3, способные индуцировать защитные реакции у широкого круга растений к вирусным и грибным патогенам. Белок MF2 размером 7,2 кДа выделен из Bacillus thuringiensis . Его первичная структура оказалась в высокой степени гомологичной аминокислотной последовательности бактериальных белков холодового шока CspD. Другой белок, MF3 (16,9 кДа) - пептидил-пролил цис/транс-изомераза FKBP типа, выделен из Pseudomonas fluo-rescens . В настоящей работе впервые был получен состоящий из двух элиситоров химерный белок MF2/MF3 и показана его защитная активность в патосистеме табак ( Nicotiana tabacum L.)-вирус табачной мозаики (ВТМ, семейство Virgaviridae , род Tobamovirus , вид Tobacco mosaic virus ). Также впервые установлено, что защитная активность MF2/MF3 не уступает активности смеси индивидуальных белков, взятых в эквивалентных концентрациях. Нашей целью было получение химерного белка MF2/MF3 методом гетерологичной экспрессии в Escherichia coli , оценка его способности индуцировать устойчивость к вирусу табачной мозаики, а также сравнение защитной активности полученного рекомбинантного элиситора с активностью индивидуальных элиситорных белков MF2 и MF3 и их смеси. Белок MF2/MF3, представлявший собой структуру из двух доменов, в которой элиситор MF2 был присоединен к N-концевому участку MF3 через полиаланиновый линкер (AAALIAA), получили на основе конструкции, созданной с использованием классической и Overlap-ПЦР. Рекомбинантный MF2/MF3 экспрессировался трансформированными клетками Escherichia coli Rosetta в виде растворимого белка массой около 25 кДа и был очищен до гомогенного состояния методом металл-аффинной хроматографии. Для оценки антивирусной активности химерного белка MF2/MF3 и сравнения его защитного эффекта с эффектом индивидуальных белков и их смеси использовали биотест с прединокуляционной обработкой отделенных от растения листьев табака некрозообразующего сорта Xanthi NN, которые затем заражали ВТМ. Растения выращивали в климатической камере (PGV 36, «Conviron», Канада) до стадии 3-5 настоящих листьев, в опытах использовали листья 3-го или 4-го яруса. Перед инокуляцией изолированные листьев обрабатывали препаратами химерного MF2/MF3 белка, индивидуальных белков (либо MF2, либо MF3) или их смеси. При этом на одну половинку листа наносили указанные препараты (5 капель по 10 мкл, 10 листьев на каждый вариант обработки), на другую половинку - соответствующий контроль. На следующий день листья инокулировали ВТМ. В первой серии экспериментов проверяли, сохранили ли препараты, полученные с помощью гетерологичной экспрессии свою целевую активность. Поэтому на половинки листьев наносили белки MF2/MF3, MF2, или MF3, а контрольные половинки листьев обрабатывали дистиллированной водой. Во второй серии опытов, целью которых было сравнение защитной активности химерного элиситора с каждым из индивидуальных элиситорных белков, на одну половинку листа наносили MF2/MF3, на вторую - MF2 или MF3. Наконец, в третьей серии экспериментов сравнивали защитный эффект химерного элиситора MF2/MF3 с эффектом смеси MF2 и MF3 после обработки половинок листьев MF2/MF3 и нанесения на их контрольные половинки смеси элиситорных белков. Кроме того, в каждую серию экспериментов включали вариант, в котором на обе половинки 5 листьев наносили капли дистиллированной воды, после чего листья заражали ВТМ (необработанный контроль). Было показано, что полученный химерный элиситор а также рекомбинантные MF2 и MF3 обладает высокой защитной активностью против ВТМ. При этом противовирусная активность элиситора MF2/MF3 приблизительно в 1,5 раза превышала активность каждого из белков. Сравнение уровней защитного эффекта смеси индивидуальных элиситоров и белка MF2/MF3 не выявило между ними статистически значимых различий. Таким образом, химерный MF2/MF3 обладал такой же целевой активностью, как и смесь MF2 и MF3. Эти результаты свидетельствуют о возможности использования вместо смеси элиситоров MF2 и MF3 рекомбинантного элиситора MF2/MF3, получение которого более технологично, чем приготовление смеси, требующее выращивания штаммов-продуцентов каждого из индивидуальных белков и их раздельного выделения.
Защита растений, болезни растений, устойчивость растений, элиситорные белки, химерные белки, вирус табачной мозаики
Короткий адрес: https://sciup.org/142242467
IDR: 142242467 | УДК: 632.938.2:577.112.4:577.112.6 | DOI: 10.15389/agrobiology.2024.3.446rus
Текст научной статьи Получение химерного белка-элиситора MF2/MF3 и оценка его защитной активности против вируса табачной мозаики
Один из основных подходов, используемых для защиты урожаев от болезней в промышленном производстве продуктов растениеводства, — применение синтетических пестицидов (как правило, ксенобиотиков), обладающих высокой эффективностью против различных фитопатогенных грибов и бактерий. При этом пока почти нет пестицидов, способных обеспечить столь же эффективный контроль фитовирусов, поражающих сельскохозяйственные культуры. Кроме того, применение пестицидов-ксенобиотиков сопряжено с риском возникновения форм патогенов, резистентных к таким защитным средствам (1, 2).
В связи с этим возникает необходимость увеличения доз пестицидов и числа обработок, что, в свою очередь, повышает риск загрязнения окружающей среды (3, 4). Использование небиоцидных средств защиты от возбудителей болезней растений, включая фитопатогенные вирусы, на основе биогенных молекул, может стать одной из природосберегающих альтернатив применению синтетических пестицидов (5-7). Поиск биогенных молекул, способных индуцировать естественные механизмы устойчивости растений, представляет собой актуальное направление, вызывающее интерес многих исследователей.
Число публикаций, связанных с идентификацией элиситоров различной природы и изучением их способности защищать сельскохозяйственные культуры, постоянно растет. Хотя большая часть подобных исследований посвящена препаратам на основе хитозана (8) или аналогам и производным таких сигнальных молекул растений, как жасмонат, салицилат, β-аминомасляная кислота (BABA) (9-12), к настоящему времени накоплен обширный экспериментальный материал и о белках — индукторах неспецифической устойчивости растений к различным патогенам, названных MAMP-элиситорами (microbe-associated molecular patterns) (10-12). Эти белки распознаются системой врожденного иммунитета растений (13-15), взаимодействуя с их рецепторами (16-17), и активируют природные защитные ответы (12). Препараты на основе белковых элиситоров экологически безопасны, поскольку их компоненты представляют собой природные аминокислоты. Как правило, такие элиситоры не обладают биоцидным действием (прямой токсичностью) по отношению к фитопатогенам, и это существенное отличие от синтетических пестицидов открывает возможность защищать растения с помощью индуцирующих их устойчивость белков, не создавая условий для накопления резистентных форм в популяциях патогена (2). Кроме того, элиситоры белковой или пептидной природы представляются технологически привлекательными, поскольку возможна разработка сравнительно дешевых технологий их получения на основе микробного синтеза (14) и защиты посредством включения белковых препаратов в микрокапсулы природных биополимеров (18).
Первым белковым индуктором устойчивости растений к болезням, нашедшим практическое применение, был термостабильный бактериальный белок харпин (19), на основе которого разработан и зарегистрирован коммерческий препарат Messenger® («Eden Bioscience Corporation», США). Этот препарат был разрешен для применения на разнообразных сельскохозяйственных культурах в США, Мексике, Испании, Китае и других странах (20). Позже был идентифицирован и изучен ряд новых белковых элиситоров бактериального и грибного происхождения (7, 13, 21, 22), в том числе белок PeaT1, выделенный из гриба Alternaria tenuissima (23-25). Препарат ATaiLing («Zhongbao Chemicals Co., Ltd.», Китай), разработанный на основе PeaT1, был коммерциализирован в Китае в качестве первого иммунопротеинового средства защиты растений с противовирусным действием (26).
Среди идентифицированных и исследованных нами микробных белков, способных индуцировать устойчивость сельскохозяйственных растений, наиболее перспективными с практической точки зрения представляются белки MF2 (7,2 кДа) и MF3 (16,9 кДа) соответственно из Bacillus thu-ringiensis и Pseudomonas fluorescens (27-29). Были определены их полные аминокислотные последовательности и структура кодирующих генов (29, 30), а также получены рекомбинантные штаммы Escherichia coli , которые продуцируют препаративные количества этих белков, достаточные для проведения лабораторных и полевых испытаний (27, 29).
MF2 (cold shock protein D, номер в GenBank AY272058) относится к семейству белков холодового шока (cold shock proteins, CSP) (31-33). Его первичная структура, по наши данным, в высокой степени гомологична наиболее консервативным аминокислотным последовательностям белка CspD из B. anthracis , B. cereus и B. subtilis. Белок MF3 представляет собой пептидил-пролил цис/транс-изомеразу (ППИ-азу) типа FKBP (FK506 binding protein) (34-36). Идентификация его активного центра, ответственного за индукцию защитных реакций растений, позволила выявить консервативный мотив, состоящий из 29 аминокислот (29). Вегетационные и полевые испытания показали, что оба белка индуцируют системную устойчивость (СУ) у ряда однодольных и двудольных растений к разнообразным фитопатогенам, включая вирусы картофеля, томата и табачной мозаики, а также фитопатогенные грибы и оомицеты (37). Белки MF2 и MF3 способны сохранять активность, индуцирующую защитные реакции растений, в течение 15 мин после кипячения. У обработанных ими растений высокая индуцированная устойчивость сохранялась как минимум в течение месяца.
MF2 и MF3 принадлежат к разным классам белков и, помимо общей способности индуцировать СУ, обладают другими функциями. Так, все исследованные CspD, к которым относится MF2, имеют высокое сродство к ДНК и РНК и могут связываться с любыми нуклеотидными последовательностями, хотя демонстрируют определенное предпочтение некоторых специфических мотивов, особенно в составе одноцепочечных участков нуклеиновых кислот (31-33). Пептидил-пролил цис/транс изомеразы (в том числе MF3) представляют собой группу шаперонов, принадлежащих к семейству циклофилинов, которые встречаются во всех организмах, образуют одно из крупнейших семейств белков и участвуют в нескольких биохимических процессах, включая передачу сигналов и фолдинг/рефолдинг белков. Они также известны как FK506-связывающие белки (FKBP) из-за их способности связывать иммунодепрессанты, такие как FK506, циклоспорин и рапа-мицин (34-36).
Не исключено, что описанные функциональные различия MF2 и MF3 могут вносить вклад в особенности действия этих белков, приводя к активации несовпадающих друг с другом защитных ответов. Исследуя механизмы их действия, мы показали, что пептид csp15 (активный центр белка MF2), добавленный в культуру клеток табака, индуцирует такие неспецифические защитные реакции растений, как изменение обмена ионов K+/H+ на плазмалемме, обратимое защелачивание среды суспензионной культуры растительных клеток и окислительный взрыв (13). Кроме того, обработка клубней картофеля раствором csp15 приводила к накоплению салициловой кислоты в обработанных растениях и выделению этилена (13).
MF3 проявляет другой тип защитной активности, то есть он не вызывает ни один из перечисленных выше типов защитных реакций, харак-448
терных для MF2, при добавлении в культуру клеток табака либо при обработке клубней картофеля. Согласно нашим данным, MF3 сохраняет свою ППИ-азную активность после выделения, и мы предполагаем, что он может быть использован растением-хозяином для борьбы с патогенами, как это происходит в случае собственных растительных ППИ-аз у других организмов (36). Еще одним возможным механизмом его защитного действия может быть прайминг генов, связанных с развитием защитных реакций, которые активируются в обработанных растениях только в ответ на контакт с патогеном.
Можно предположить, что одновременная обработка растений обоими белками активирует большее разнообразие ответов, приводящих к развитию устойчивости, чем в случае индивидуального применения элиситоров, что, в свою очередь, позволит усилить защитный эффект. Для индуцирования устойчивости посредством совместного применения MF2 и MF3 возможны два подхода — использование рекомбинантного химерного белка, содержащего оба элиситора, или применение эквимолярной смеси индивидуальных белков.
В настоящей работе впервые получен химерный белок MF2/MF3 и показана его защитная активность в патосистеме табак—ВТМ. Также впервые установлено, что защитная активность MF2/MF3 не уступает активности смеси индивидуальных белков, взятых в эквивалентных концентрациях.
Нашей целью было получение химерного белка MF2/MF3 методом гетерологичной экспрессии в Escherichia coli , оценка его способности индуцировать устойчивость к вирусу табачной мозаики, а также сравнение защитной активности полученного рекомбинантного элиситора с активностью индивидуальных элиситорных белков MF2 и MF3 и их смеси.
Методика. Защитную активность исследуемых препаратов оценивали, используя патосистему Nicotiana tabacum L.— вирус табачной мозаики (ВТМ; семейство Virgaviridae , род Tobamovirus , вид Tobacco mosaic virus ).
Штамм ВТМ LS-1 был выделен из растений табака (с. Эшери, г. Сухуми, ГрузССР, в настоящее время Республика Абхазия) и депонирован в Государственной коллекции фитопатогенных микроорганизмов Всероссийского НИИ фитопатологии (ВНИИФ). Штамм поддерживали на растениях табака сорта Samsun, которые выращивали в климатической камере (PGV 36, «Conviron», Канада) при 16-часовом фотопериоде и температуре 24 °С/20 °С (день/ночь). Для поддержания пула вирусной инфекции здоровые растения инокулировали, натирая их разведенным в дистиллированной воде соком листьев зараженных растений, смешанным с карборундом (38).
Генетическую последовательность, содержащую рамку считывания из слитых последовательностей, кодирующих MF2 и MF3, получали в два этапа методом классической и Overlap-ПЦР. Для амплификации генов mf2 и mf3 были разработаны следующие олигонуклеотиды (области сайтов рестрикции выделены заглавными буквами):
Название Последовательность pET28_Mf2_NdeI_F 5´-gctaaCATatgcaaacaggtaaagttaaa-3´ pET28_MF2_link 5´-agagctgcggcgttttttgtaacgttagcagcttg-3´ pET28_MF3R_NotI 5´-aatctcGCGGCCGCtcagtggtgatggccaccttc-3´ pET28_MF3_Link 5´-aaaaaacgccgcagctctgatcgccgccaataaggctgtc-3´
На 5´-конец последовательности pET28_Mf2_NdeI_F был добавлен сайт рестрикции NdeI. На 5´-конец обратного праймера добавили последовательность линкера, имеющую область гомологии длиной 18 нуклеотидов с 5´-концом олигонуклеотидной последовательности pET28_MF3_link, которая использовалась в качестве прямого праймера для амплификации гена, кодирующего белок MF3. Обратный праймер pET28_MF3R_NotI на 5´-конце содержал сайт рестрикции NotI.
На первом этапе получали два ПЦР-продукта, содержащих кодирующие последовательности генов mf2 и mf3 . ПЦР смесь содержала 25 мкл 2½ ПЦР буфера, 1 мкл dNTP, 2 мкл 10 мкМ смеси олигонуклеотидов (pET28_MF2_NdeI_F и pET28_MF2_link для mf2 и pET28_MF3R_NotI и pET28_MF3_Link для mf3 ) и 1 мкл полимеразы Phanta Max («Vazyme», Китай) (общий объем 50 мкл). Температурный профиль ПЦР был следующим: 30 с при 95 °С и 15 с при 60 °С и 60 с при 70 °С (32 цикла).
Продукты амплификации экстрагировали из агарозного геля при помощи набора Cleanup Mini («Евроген», Россия) и осуществляли второй раунд ПЦР для сшивки двух генов: 300 нг продукта амплификации mf3 и 150 нг продукта амплификации mf2 в эквимолярном соотношении смешивали в реакционной смеси, содержащей 25 мкл 2½ ПЦР буфера, 1 мкл dNTP и 1 мкл полимеразы Phanta Max («Vazyme», Китай) (общий объем 50 мкл). Температурный профиль Overlap-ПЦР был следующим: 30 с при 94 °С и 60 с при 60 °С (15 циклов).
Полученный ПЦР-продукт и коммерческий вектор pET28b («Nov-agen», США) обрабатывали рестриктазами NotI и NdeI («Thermo Fisher Sci-entific», США) и лигировали, используя метод рестриктазно-лигазного клонирования с Т4-ДНК лигазой («Thermo Fisher Scientific», США) в соответствии с инструкцией производителя. Полученной лигазной смесью трансформировали химически компетентные клетки E. coli NEB Turbo («NEB», США) и осуществляли селекцию трансформантов на среде LB («Condalab», Испания) с канамицином (50 мкг/мл). Из резистентных колоний была выделена плазмида pET28-MF3/MF2, использованная для трансформации экс-прессионного штамма E. coli Rosetta.
Клетки штамма Е. coli Shuffle, использованного нами ранее для продукции MF2 и MF3, и штамма Rosetta, трансформированные плазмидными векторами pET-MF2, pET28-MF3, pET28-MF2/MF3, помещали в стандартную среду TB (Terrific Broth, «AppliChem GmbH», Германия), содержащую канамицин в концентрации 50 мкг/мл, и культивировали при 37 °С и 260 об/мин на качалке (Certomat H, «Sartorius AG», Германия) до OD 550 = 22,5. Затем в суспензию добавляли изопропил-β-D-1-тиогалактопиранозид (IPTG) до конечной концентрации 0,05 мМ и продолжали культивирование в течении 16 ч. Полученные бактериальные культуры центрифугировали 30 мин при 4000 g (Jouan BR4i, «JOUAN», Франция). Осажденные клетки (1,52,0 г сырой биомассы) суспендировали в 50 мл буфера: 50 мМ Трис-НСl (pH 8,0), содержавшего 0,15 М NaCl, 2 мМ EDTA и 2 мкг/мл лизоцима, инкубировали 30 мин во льду и обрабатывали ультразвуком (5 импульсов по 40 с) на ультразвуковом гомогенизаторе QS4-system («NanoLab», США). Клеточную суспензию быстро охлаждали во льду до 0 °С, центрифугировали 30 мин при 4000 g для отделения лизата, который использовали для дальнейшей очистки. В случае MF3 перед очисткой дополнительно прогревали клеточный лизат при 100 °С для денатурации сторонних белков, что позволяло получить более чистый препарат целевого белка. Перед очисткой полученные лизаты анализировали на наличие целевых белков с использованием стандартной процедуры SDS-PAAG электрофореза.
Для процедуры очистки рекомбинантных белков использовали хроматографическую систему ӒKTA pure™ («GE Healthcare», США). Выделение MF3 и MF2 основывалось на использовании аффинной хроматографии на Ni-NTA сефарозе. Поскольку MF3 имеет 3 остатка гистидина на С-конце-450
вом участке, очистку этого белка проводили без введения гистидиновой метки. Для очистки MF2 на C-концевой участок белка на этапе клонирования в экспрессионный вектор добавили 4 остатка гистидина. Осветленный клеточный лизат, полученный, как описано выше, наносили со скоростью 1,5 мл/мин на хроматографическую колонку HisTrap excel 5½1 ml, 7½25 mm с Ni NTA-сефарозой Exel в качестве носителя («Cytiva», США). Колонку промывали 5 объемами буфера для промывки (50 мМ Трис-НС1, pH 7,5, 1 М NaCl и 20 мМ имидазола) и элюировали связавшиеся белки в линейном градиенте (буфер А: 50 мМ Трис-НС1, pH 7,5 с 0,25 М NaCl; буфер Б: 50 мМ Трис-НС1, pH 7,5 с 0,25 М NaCl и 0,25 М имидазола). Скорость потока — 3 мл/мин, объем градиента — 30 мл. Белки MF3 и MF2 были элюированы при концентрации буфера Б соответственно примерно 35 и 20 %.
Для оценки антивирусной активности химерного белка MF2/MF3 и сравнения его защитного эффекта с эффектом индивидуальных белков и их смеси использовали разработанный ранее биотест (38) с прединокуляцион-ной обработкой отделенных от растения листьев табака некрозообразующего сорта Xanthi NN. Растения выращивали в климатической камере при указанных выше условиях до стадии 3-5 настоящих листьев и использовали листья 3-го или 4-го яруса. Разведение сока зараженных ВТМ растений сорта Samsun в этих опытах подбирали таким образом, чтобы при инокуляции контрольных (не обработанных белками) изолированных листьев Xanthi NN на каждой половинке листа развивалось примерно 100200 некрозов.
Поскольку в предварительных экспериментах было установлено, что удельная защитная активность полученного препарата MF2 примерно вдвое превышала активность препарата MF3, индивидуальные белки использовали в концентрациях соответственно 0,5 и 1,0 мкг/мл. Суммарная конечная концентрация двух белков в смеси составляла 0,75 мкг/мл (0,25 мкг/мл MF2 + 0,5 мкг/мл MF3). То есть содержание каждого элиситора в смеси было вдвое ниже, чем в препаратах индивидуальных белков.
Для прединокуляционной обработки изолированных листьев использовали препараты химерного MF2/MF3, индивидуальных белков (MF2 или MF3) или их смеси. При этом на одну половинку листа наносили указанные препараты (5 капель по 10 мкл, 10 листьев на каждый вариант обработки), на другую его половинку — соответствующий контроль. На следующий день листья инокулировали ВТМ.
В первой серии экспериментов проверяли, сохранилась ли целевая активность препаратов химерного белка MF2/MF3 и индивидуальных белков MF2 и MF3, полученных с помощью гетерологичной экспрессии. При этом контрольные половинки листьев обрабатывали дистиллированной водой. Во второй серии опытов, целью которых было сравнение защитной активности химерного элиситора с каждым из индивидуальных элиситор-ных белков, на одну половинку листа наносили MF2/MF3, на вторую — MF2 или MF3. Наконец, в третьей серии экспериментов сравнивали защитный эффект химерного элиситора MF2/MF3 с эффектом смеси MF2 и MF3 после обработки половинок листьев MF2/MF3 и нанесения на их контрольные половинки смеси элиситорных белков. Кроме того, в каждой серии экспериментов был вариант, в котором на обе половинки 5 листьев наносили капли дистиллированной воды, после чего листья заражали ВТМ (необработанный контроль).
Через 4-5 сут после заражения подсчитывали число некрозов на каждой из половинок листьев, сравнивали число некрозов на обработанных и контрольных половинках и рассчитывали процент подавления некрозооб-разования относительно необработанного контроля. Эксперименты каждой серии повторяли трижды. Каждый из экспериментов включал 10 повторностей для каждого варианта обработки.
Средние значения ( M ), стандартные отклонения (±SD) и стандартные ошибки средних (±SEM), а также значимость различий при p ≤ 0,05 ( t -критерий Стьюдента для независимых выборок) определяли с использованием программного обеспечения STATISTICA v. 6.1 («StatSoft, Inc.», США).
Результаты. Использовав метод гетерологичной экспрессии, мы получили химерный белок MF2/MF3, представляющий собой структуру из двух доменов, в которой белок MF2 присоединен к N-концевому участку MF3 через полиаланиновый линкер (AAALIAA). Такая конструкция обеспечивала максимальную подвижность доменов относительно друг друга (рис. 1).
|aaaaaacgccgcagctctgatcgccgccaataaggctgtc| atcgttgaaggtaaccgtggaccacaagctgetaacgttacaaaaaacgccgcagctctgategccgccaataaggctgtctccatcgactataccctgaccaagcacget +^4^W++++4™++++^W++^H^H™H-+-^-H-^^ tagcaacttecattggcaeetggtgttcgacgattgcaatgttttttgcggcgtcgagactagcggcggttattccgacagaggtagctgatatgggactggttcgtgcga
I______55______._______I________iI______5Q______,_______,_______,_______,______65_____________,_______,_______,_______5_______,_______,_______x_______x______10______x_______.________x_______I______15______X_______I_______
IVEGNRGPQAANVTKNAAALIAANKAVS1DYTLTKHA ^^^^^^^^^иаамммшав»’ - - - - --
IVEGN RGPQAAN VTKNAAAL I A A N К A V S I DYTLTKHA
~1 1 55 1 1 ' T go 1 1 1 1 65 ’ 1 1 1 70 1 1 1 ' 75 1 1 1 1 80 1 1 ' 1 85 1
|g ttcgacgattgcaatgttttttgcggcgtcgaga| \\ pET28_MF2Jink
Рис. 1. Нуклеотидная и соответствующая ей аминокислотная последовательность участка линкера сконструированного химерного белка MF2/MF3.
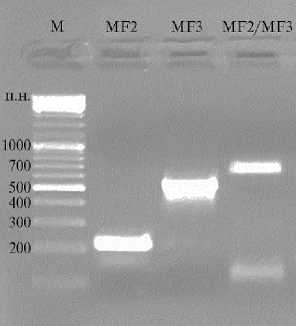
Рис. 2. Результаты гель-электрофо-реза ПЦР-продуктов, кодирующих последовательности белков MF2, MF3 и химерного белка MF2/MF3 (1 % агарозный гель, TAE буфер, краситель — бромистый этидий; M — маркер молекулярных масс O’GeneRuler™ Ready-to-use 100 bp Plus DNA Ladder, «Thermo Fisher Scientific», США).
На первом этапе сборки экспрессионной конструкции были ампли-фицированы два фрагмента размером 209 и 513 п.н., кодирующих полную аминокислотную последовательность белков MF2 и MF3, после чего с помощью Overlap-ПЦР получили химерную последовательность для MF2/MF3 размером 712 п.н. Соответствие длин полученных ПЦР-фрагментов расчетным было верифицировано результатами гель-электрофореза (рис. 2).
Правильность сборки конструкции pET28-MF2/MF3, полученной на основе рекомбинантного гена, интегрированного в вектор pET28b рестриктазно-лигазным методом, была подтверждена стандартными процедурами (построение карты рестрикции и секвенирование по Сэнгеру).
Эту конструкцию использовали для трансформации клеток E. coli Rosetta. После процедуры индукции и разрушения клеток химерный полипептид MF2/MF3 обнаружили в растворимой фракции клеточного лизата E. coli. В нерастворимой фракции MF2/MF3 находился в следовых количествах. Молекулярная масса полипептида составила 25 кДа, что соответствовало теоретически рассчитанной (рис. 3). Рекомбинантный гибридный белок показал высокую стабильность в растворе и был очищен до гомогенного состояния при помощи металл-аффинной хроматографии.
Известно, что у листьев табака реак ция на ВТМ может варьироваться: даже при использовании стандартизиро- ванного вирусного инокулята число некрозов на разных листьях одного и того же яруса иногда различается во много раз. Это существенно затрудняет сравнение защитной активности тестируемых образцов белковых элиситоров. В то же время при раздельной инокуляции половинок одного и того же листа число некрозов, образующихся на них в ответ на инфицирование ВТМ, оказывается примерно одинаковым (38). Поэтому при оценке защитной активности белка MF2/MF3 с активностью MF2, MF3 или их смеси во второй и третьей серии опытов сравниваемые препараты наносили на раз- ные половинки одного и того
п,н
MF2/MF3
*------ 25
HP Р
Рис. 3. SDS-PAAG-электрофореграм-ма белков растворимой (Р) и нерастворимой (НР) фракции Escherichia coli Rosetta pET28-MF2/MF3. M — маркер молекулярных масс (BenchMark™ Unstained Protein Ladder, «Thermo Fisher Scientific», США).
же листа.
Результаты первой серии экспериментов свидетельствовали о том, что полученный с помощью гетерологичной экспрессии химерный белок MF2/MF3, а также рекомбинантные MF2 и MF3 обладали защитной активностью против ВТМ, как и белки MF2 и MF3, выделенные нами ранее из Bacillus thuringiensis и Pseudomonas fluorescens (27-29), которые были способны подавлять вызванное ВТМ некрозообразование. Так, в опытах по тестированию MF2 (рис. 4, А) и MF3 (см. рис. 4, Б) среднее число некрозов на обработанных половинках составляло соответственно 64,2 и 112,1 шт., что было в 1,7 и 1,6 раза ниже (р = 0,03 и 0,02), чем в вариантах с необработанным контролем (108,1 для MF2 и 180,0 для MF3). Обработка химерным белком MF2/MF3 (см. рис. 4, А, Б)
вдвое или почти втрое уменьшала число некрозов по сравнению с необработанным контролем (р = 0,003).
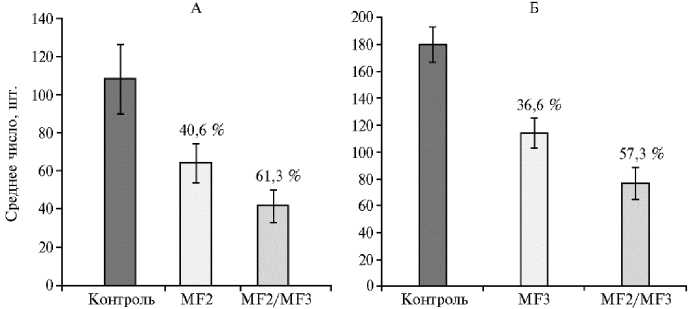
Рис. 4. Некрозообразование на листьях табака ( Nicotiana tabacum L.) сорта Xanthi NN, зараженных вирусом табачной мозаики, после прединокуляционной обработки водой (контроль) , элиситорами MF2, MF3 и химерным белком MF2/MF3. Цифры над столбиками — степень подавления некрозообразования в процентах относительно числа некрозов на половинках не обработанного препаратами контроля ( n = 10 в каждом варианте каждого из трех опытов, M ±SEM). В каждом из опытов различия с контролем и между обработками статистически значимы при р ≤ 0,05.
Полученные нами ранее данные об усилении защитного эффекта смеси MF2 и MF3, содержащей белки в меньшей концентрации, чем в препаратах каждого из этих белков (38), можно рассматривать как предварительное доказательство разных механизмов их действия, вероятно, вследствие активации большего разнообразия защитных ответов растений. Кроме того, эти результаты позволяют предположить, что на основе смеси белковых элиситоров может быть создан препарат, эффективно препятствующий развитию ВТМ, который поражает также томаты и другие пасленовые, имеющие сельскохозяйственное значение. Однако в таком случае технология производства препарата будет включать отдельную процедуру получения каждого из белков, очистку и приготовление смеси. Это неудобство можно преодолеть благодаря разработке препарата на основе рекомбинантного элиситора, включающего оба белка, который обладает целевой активностью, сопоставимой с активностью смеси MF2 и MF3.
Результаты второй серии опытов, включавшей сравнение активности полученных препаратов MF2, MF3 и рекомбинантного MF2/MF3, показали, что среднее число некрозов на половинках листьев, обработанных химерным белком, было в среднем в 1,5 ниже, чем на половинках тех же листьев, обработанных MF2 или MF3. Таким образом, защитная активность полученного химерного белка MF2/MF3 статистически значимо (p ≤ 0,05) превосходила активность белков MF2 и MF3 в отдельности (см. рис. 4).
В третьей серии экспериментов было установлено, что среднее число некрозов в образцах, обработанных смесью индивидуальных белков и химерным белком, составило соответственно 45,9 и 47,4 % от необработан- ного препаратами контроля. То есть химерный белок обладал такой же це- левой активностью, как и смесь белковых элиситоров (рис. 5).
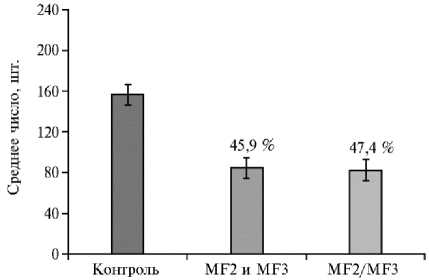
Рис. 5. Некрозообразование на листьях табака ( Nicotiana tabacum L.) сорта Xanthi NN, зараженных вирусом табачной мозаики, после прединокуляционной обработки водой (контроль) , смесью элиситорных белков MF2 и MF3 и химерным элиситором MF2/MF3. Цифры над столбиками — степень подавления некрозообразо-вания в процентах относительно числа некрозов на половинках не обработанного препаратами контроля ( n = 10 в каждом варианте каждого из трех опытов, M ±SEM). Различия с контролем статистически значимы при р ≤ 0,05, различие при обработках смесью и химерным белком статистически незначимо.
Несмотря на то, что в обзорах последних лет (39, 40), посвященных мерам повышения эффективности препаратов с использованием элиситоров СУ у растений, изучение совместного защитного действия различных элиситоров признается перспективным направлением исследований, число работ по этой тематике невелико по сравнению с объемом публикаций об элиситорах в целом. Диапазон исследований, в которых сравнивалось действие смеси элиситоров с индивидуальными препаратами в основном ограничен комбинациями синтетических элиситоров друг с другом (41-43) или с элиситорами на основе бактериальных штаммов (44, 45).
Харпин — единствен- ный представитель белковых элиситоров, для которого изучалось защитное действие в составе смесей с другими элиситорами, хотя и небелковой при- роды. Так, совместное применение коммерческого препарата на основе харпина (препарат Messenger®, «Eden Bioscience Corporation», США) в комбинации с другими коммерческими препаратами на основе синтетических элиситоров — фосфитом калия (препарат Phoenix®, «Orion Future Technology, Ltd.», Великобритания) и производным салицилловой кислоты
(препарат Rigel-G®, «Orion Future Technology, Ltd.», Великобритания) показало усиление защитного эффекта (46). Есть также сообщения об экспериментах, в которых харпин сочетали с препаратами на основе ростостимулирующих бактерий рода Bacillus (47). Насколько нам известно, изучение защитной активности смеси MF2 и MF3, ранее проведенное нашей группой (38), было первым исследованием совместного защитного действия исключительно белковых элиситоров.
В настоящей работе был впервые получен химерный белковый элиситор для индукции СУ у растений. Использование химерного белка MF2/MF3 привело к достоверному усилению защитного эффекта по сравнению с эффектами индивидуальных белков. Подобное действие характерно для смесей элиситоров с разными механизмами индукции СУ у растений (48), что дополнительно подтверждает косвенные данные (38) о неодинаковых механизмах действия MF2 и MF3. Также полученные результаты продемонстрировали сравнимую эффективность защитного действия MF2/MF3 и смеси индивидуальных элиситоров, что позволяет обсуждать возможность применения этого химерного элиситора в качестве альтернативы смеси.
Итак, конструкция, полученная нами с использованием классической и Overlap-ПЦР, кодирует белковый элиситор MF2/MF3, представляющий собой химерную структуру, в которой белок MF2 присоединен к N-концевому участку MF3 через полиаланиновый линкер (AAALIAA). Рекомбинантный MF2/MF3 экспрессировался трансформированными клетками Escherichia coli Rosetta. Данные по подавлению некрозообразования на растениях табака сорта Xanthi NN показали, что защитная активность полученного химерного белка MF2/MF3 более чем на 20 % превышает защитную активность индивидуальных белковых элиситоров и сравнима с защитной активностью их смеси. То есть для защиты растений вместо смеси индивидуальных элиситоров, экспрессируемых разными продуцентами, возможно применение гибридного белка MF2/MF3. В принципе, как смесь белков MF2 и MF3, так и химерный MF2/MF3 могут использоваться для создания новых экологически безопасных средств борьбы с болезнями сельскохозяйственных культур. Но впервые полученные в этой работе результаты могут стать основой для разработки более удобной биотехнологии создания таких средств, а именно для получения противофитовирусного препарата, содержащего оба элиситорных белка. Это позволит существенно сократить время и расходы на ферментацию, выделение, очистку и защиту от неблагоприятных воздействий окружающей среды (с помощью инкапсулирования в частицы биоразлагаемых полимеров) каждого из целевых белков при приготовлении их смесей. Наши данные косвенно свидетельствуют о различиях в механизмах защитного действия белков MF2 и MF3. Для изучения молекулярных основ индуцированной этими белками устойчивости к вирусным патогенам мы планируем секвенировать транскриптом растений, обработанных MF2, MF3 по отдельности, смесью MF2 и MF3 а также химерным белком MF2/MF3, с последующим анализом экспрессии генов, связанных с различными защитными ответами растений.
Список литературы Получение химерного белка-элиситора MF2/MF3 и оценка его защитной активности против вируса табачной мозаики
- Mikaberidze A., Paveley N., Bonhoeffer S., van den Bosch F. Emergence of resistance to fungi-cides: the role of fungicide dose. Phytopathology, 2017, 107(5): 545-560 (doi: 10.1094/PHYTO-08-16-0297-R).
- Thind T.S. New insights into fungicide resistance: a growing challenge in crop protection. Indian Phytopathology, 2022, 75: 927-939 (doi: 10.1007/s42360-022-00550-4).
- Alengebawy A., Abdelkhalek S.T., Qureshi S.R., Wang M.-Q. Heavy metals and pesticides toxicity in agricultural soil and plants: ecological risks and human health implications. Toxics, 2021, 9(3): 42 (doi: 10.3390/toxics9030042).
- Wee S.Z., Aris A.Z. Ecological risk estimation of organophosphorus pesticides in riverine ecosys-tems. Chemosphere, 2017, 188: 575-581 (doi: 10.1016/j.chemosphere.2017.09.035).
- Mishra A.K., Sharma K., Misra R.S. Elicitor recognition, signal transduction and induced resistance in plants. Journal of Plant Interactions, 2012, 7(2): 95-120 (doi: 10.1080/17429145.2011.597517).
- Peng D.-H., Qiu D.-W., Ruan L.-F., Zhou C.-F., Sun M. Protein elicitor PemG1 from Mag-naporthe grisea induces systemic acquired resistance (SAR) in plants. Molecular Plant-Microbe Interactions, 2011, 24(10): 1239-1246 (doi: 10.1094/MPMI-01-11-0003).
- Shcherbakova L., Odintsova T., Stakheev A., Fravel D., Zavriev S. Identification of a novel small cysteine-rich protein in the fraction from the biocontrol Fusarium oxysporum strain CS-20 that mitigates Fusarium wilt symptoms and triggers defense responses in tomato. Front. Plant Sci., 2016, 6: 1207 (doi: 10.3389/fpls.2015.01207).
- Shagdarova B.T., Ilyina A.V., Lopatin S.A., Kartashov M.I., Arslanova L.R., Dzhavakhiya V.G., Varlamov V.P. Study of the protective activity of chitosan hydrolyzate against septoria leaf blotch of wheat and brown spot of tobacco. Applied Biochemistry and Microbiology, 2018, 54: 71-75 (doi: 10.1134/S0003683818010118).
- Wiesel L., Newton A.C., Elliott I., Booty D., Gilroy E.M., Birch P.R.J., Hein I. Molecular effects of resistance elicitors from biological origin and their potential for crop protection. Front. Plant Sci., 2014, 21(5): 655 (doi: 10.3389/fpls.2014.00655).
- Albert M. Peptides as triggers of plant defence. Journal of Experimental Botany, 2013, 64(17): 5269-5279 (doi: 10.1093/jxb/ert275).
- Erbs G., Newman M.-A. The role of lipopolysaccharide and peptidoglycan, two glycosylated bacterial microbe-associated molecular patterns (MAMPs), in plant innate immunity. Molecular Plant Pathology, 2012, 13(1): 95-104 (doi: 10.1111/j.1364-3703.2011.00730.x).
- Newman M.-A., Sundelin T., Nielsen J.T., Erbs G. MAMP (microbe-associated molecular pat-tern) triggered immunity in plants. Front. Plant Sci., 2013, 4: 139 (doi: 10.3389/fpls.2013.00139).
- Щербакова Л. А., Джавахия В.Г., Duan Y., Zhang J. Микробные белки — элиситоры устойчивости растений к фитопатогенам и их потенциал для экологически ориентированной защиты сельскохозяйственных культур. Сельскохозяйственная биология, 2023, 58(5): 789-820 (doi: 10.15389/agrobiology.2023.5.789rus).
- Qui D., Dong Y., Zhang Y., Li S., Shi F. Plant immunity inducer development and application. Molecular Plant-Microbe Interactions, 2017, 30(5): 355-360 (doi: 10.1094/MPMI-11-16-0231-CR).
- Mejia-Teniente L., Torres-Pacheco I., González-Chavira M.M., Ocampo-Velazquez R.V., Her-rera-Ruiz G., Chapa-Oliver A.M., Guevara-González R.G. Use of elicitors as an approach for sustainable agriculture. African Journal of Biotechnology, 2010, 9(54): 9155-9162.
- Gómez-Gómez L., Boller T. FLS2: an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis. Molecular Cell, 2000, 5(6): 1003-1011 (doi: 10.1016/s1097-2765(00)80265-8).
- Boller T., Felix G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors. Annual Review of Plant Biology, 2009, 60: 379-406 (doi: 10.1146/annurev.arplant.57.032905.105346).
- Popletaeva S.B., Statsyuk N.V., Voinova T.M., Arslanova L.R., Zernov A.L., Bonartsev A.P., Bonartseva G.A., Dzhavakhiya V.G. Evaluation of eliciting activity of peptidyl prolyl cys/trans isomerase from Pseudonomas fluorescens encapsulated in sodium alginate regarding plant resistance to viral and fungal pathogens. AIMS Microbiology, 2018, 4(1): 192-208 (doi: 10.3934/micro-biol.2018.1.192).
- Wei Z.-M., Laby R.J., Zumoff C.H., Bauer D.W., He S.Y., Collmer A., Beer S.V. Harpin, elicitor of the hypersensitive response produced by the plant pathogen Erwinia amylovora. Science, 1992, 257(5066): 85-88 (doi: 10.1126/science.1621099).
- Fontanilla J.M., Montes M., De Prado R. Induction of resistance to the pathogenic agent Botrytis cinerea in the cultivation of the tomato by means of the application of the protein “Harpin” (Messenger). Communications in Agricultural and Applied Biological Sciences, 2005 70(3): 35-40.
- Wang H., Yang X., Guo L., Zeng H., Qiu D. PeBL1, a novel protein elicitor from Brevibacillus laterosporus strain A60, activates defense responses and systemic resistance in Nicotiana bentham-iana. Applied and Environmental Microbiology, 2015, 81(8): 2706-2716 (doi: 10.1128/AEM.03586-14).
- Zhang Y., Zhang Y., Qiu D., Zeng H., Guo L., Yang X. BcGs1, a glycoprotein from Botrytis cinerea, elicits defence response and improves disease resistance in host plants. Biochemical and Biophysical Research Communications, 2015, 457(4): 627-634 (doi: 10.1016/j.bbrc.2015.01.038).
- Kulye M., Liu H., Zhang Y., Zeng H., Yang X., Qiu D. Hrip1, a novel protein elicitor from necrotrophic fungus, Alternaria tenuissima, elicits cell death, expression of defence-related genes and systemic acquired resistance in tobacco. Plant Cell Environ., 2012, 35(12): 2104-2120 (doi: 10.1111/j.1365-3040.2012.02539.x).
- Zhang W., Yang X., Qiu D., Zeng H., Guo L., Mao J. Activator protein PeaT1 induced systemic resistance to Tobacco mosaic virus in tobacco. Acta Phytopathologica Sin., 2010, 40: 290-299.
- Zhang W., Yang X., Qiu D., Guo L., Zeng H., Mao J., Gao Q. Pea T1-induced systemic acquired resistance in tobacco follows salicylic acid-dependent pathway. Molecular Biology Reports, 2011, 38: 2549-2556 (doi: 10.1007/s11033-010-0393-7).
- Mao J., Liu Q., Yang X., Long C., Zhao M., Zeng H., Liu H., Yuan J., Qiu D. Purification and expression of a protein elicitor from Alternaria tenuissima and elicitor-mediated defence responses in tobacco. Annals of Applied Biology, 2010, 156(3): 411-420 (doi: 10.1111/j.1744-7348.2010.00398.x).
- Кромина К.А., Джавахия В.Г. Экспрессия бактериального гена CspD в растениях табака приводит к повышению устойчивости к грибным и вирусным фитопатогенам. Молeкуляр-ная генетика, микробиология и вирусология, 2006, 1: 31-34.
- Shumilina D., Krämer R., Klocke E., Dzhavakhiya V. MF3 (peptidyl prolyl cis-trans isomerase of FKBP type from Pseudomonas fluorescens) — an elicitor of non-specific plant resistance against pathogens. Phytopathol. Polonica, 2006, 41: 39-49.
- Джавахия В.Г., Воинова Т.М., Шумилина Д.В. Поиск активного центра пептидил-пролил-цис/транс-изомеразы из Pseudonomas fluorescens, ответственного за индукцию устойчивости к вирусу табачной мозаики у растений табака (Nicotiana tabacum L.). Сельскохозяйственная биология, 2016, 51(3): 392-400 (doi: 10.15389/agrobiology.2016.3.392rus).
- Djavakhia V.G., Nikolaev O.N., Voinova T.M., Battchikova N.V., Korpela T., Khomutov R.M. DNA sequence of gene and amino acid sequence of protein from Bacillus thuringiensis, which induces non-specific resistance of plants to viral and fungal diseases. Journal of Russian Phyto-pathological Society, 2000, 1: 75-81.
- Horn G., Hofweber R., Kremer W., Kalbitzer H.R. Structure and function of bacterial cold shock proteins. Cell. Mol. Life Sci., 2007, 64: 1457-1470 (doi: 10.1007/s00018-007-6388-4).
- Скабкин М.А., Скабкина О.В., Овчинников Л.П. Мультифункциональные белки с доме-ном холодового шока в регуляции экспрессии генов. Успехи биологической химии, 2004, 44: 3-52.
- Овчинников Л.П., Скабкин М.А., Рузанов П.В., Евдокимова В.М. Мажорные белки мРНП в структурной организации и функционировании мРНК в клетках эукариот. Молекулярная биология, 2001, 35(4): 548-558.
- Subin C.S., Pradeep M.A., Vijayan K.K. FKBP-type peptidyl-prolyl cis-trans isomerase from thermophilic microalga, Scenedesmus sp.: molecular characterisation and demonstration of ac-quired salinity and thermotolerance in E. coli by recombinant expression. Journal of Applied Phy-cology, 2016, 28: 3307-3315 (doi: 10.1007/s10811-016-0854-z).
- Chang H.-H., Lee C.-J., Chang C.-J., Jan F.-J. FKBP-type peptidyl-prolyl cis-trans isomerase interacts with the movement protein of tomato leaf curl New Delhi virus and impacts viral repli-cation in Nicotiana benthamiana. Molecular Plant Pathology, 2022, 23(4): 561-575 (doi: 10.1111/mpp.13181).
- Кромина К.А., Игнатов А.Н., Абдеева И.А. Участие пептидил-пролил-цис/транс-изомераз в патологическом процессе. Биологические мембраны, 2008, 25(4): 243-251.
- Dzhavakhiya V.G., Filippov A.V., Skryabin K.G., Voinova T.M., Kouznetsova M.A., Shulga O.A., Shumilina D.V., Kromina K.A., Pridannikov M.V., Battchikova N.V., Korpela T. Proteins inducing multiple resistance of plants to phytopathogens and pests. Intern. Pat. Classifica-tion: C07K 14/21. Intern. applic. number: PCT/FI2004/000766. Intern. Filing date: 17 December 2004 (17.12.2004). Priority data: 20031880 22 December 2003. Intern. Public. number: WO 2005/061533 A1.
- Popletaeva S., Erokhin D., Dzhavakhiya V. Comparison of the protective activity of elicitor pro-teins MF2 and MF3 applied individually or in combination against tobacco mosaic virus on tobacco leaves. In: Agriculture digitalization and organic production. ADOP 2023. Smart innovation, systems and technologies. V. 362 /A. Ronzhin, A. Kostyaev (eds.). Springer, Singapore, 2023: 225-234 (doi: 10.1007/978-981-99-4165-0_21).
- Urban L., Lauri F., Ben Hdech D., Aarrouf J. Prospects for increasing the efficacy of plant resistance inducers stimulating salicylic acid. Agronomy, 2022, 12(12): 3151 (doi: 10.3390/agron-omy12123151).
- Reglinski T., Havis N., Rees H.J., de Jong H. The practical role of induced resistance for crop protection. Phytopathology, 2023, 113(4): 719-731 (doi: 10.1094/PHYTO-10-22-0400-IA).
- Walters D.R., Havis N.D., Paterson L., Taylor J., Walsh D.J., Sablou C. Control of foliar path-ogens of spring barley using a combination of resistance elicitors. Frontiers in Plant Science, 2014, 5: 241 (doi: 10.3389/fpls.2014.00241).
- Oxley S.J., Walters D.R. Control of light leaf spot (Pyrenopeziza brassicae) on winter oilseed rape (Brassica napus) with resistance elicitors. Crop Protection, 2012, 40: 59-62 (doi: 10.1016/j.cro-pro.2012.04.028).
- Aćimović S.G., Meredith C.L., Santander R.D., Khodadadi F. Proof of concept for shoot blight and fire blight canker management with postinfection spray applications of prohexadione-calcium and acibenzolar-S-methyl in apple. Plant Disease, 2021, 105(12): 4095-4105 (doi: 10.1094/PDIS-08-20-1744-RE).
- Anith K.N., Momol M.T., Kloepper J.W., Marois J.J., Olson S.M., Jones J.B. Efficacy of plant growth-promoting Rhizobacteria, acibenzolar-S-methyl, and soil amendment for integrated management of bacterial wilt on tomato. Plant Disease, 2004, 88(6): 669-673 (doi: 10.1094/PDIS.2004.88.6.669).
- Bahadou S.A., Ouijja A., Boukhari M.A., Tahiri A. Development of field strategies for fire blight control integrating biocontrol agents and plant defense activators in Morocco. Journal of Plant Pathology, 2017, 99: 51-58.
- Percival G.C., Noviss K., Haynes I. Field evaluation of systemic inducing resistance chemicals at different growth stages for the control of apple (Venturia inaequalis) and pear (Venturia pirina) scab. Crop Protection, 2009, 28(8): 629-633 (doi: 10.1016/j.cropro.2009.03.010).
- Esquivel-Cervantes L.F., Tlapal-Bolaños B., Tovar-Pedraza J.M., Pérez-Hernández O., Leyva-Mir S.G., Camacho-Tapia M. Efficacy of biorational products for managing diseases of tomato in greenhouse production. Plants, 2022, 11(13): 1638 (doi: 10.3390/plants11131638).
- Park K., Park J.-W., Lee S.-W., Balaraju K. Disease suppression and growth promotion in cucumbers induced by integrating PGPR agent Bacillus subtilis strain B4 and chemical elicitor ASM. Crop Protection, 2013, 54: 199-205 (doi: 10.1016/j.cropro.2013.08.017).


