Получение и характеристика биокатализаторов на основе иммобилизованных гликозидаз
Автор: Мещерякова О.Л., Новикова Ю.С., Анохина Е.П., Корнеева О.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 4 (62), 2014 года.
Бесплатный доступ
Ферменты подкласса гликозидаз, расщепляющие поли- и олигосахариды до простых сахаров, имеют большое прикладное значение для различных областей промышленности. К таким ферментам относятся α-L-фукозидаза и β-фруктофуранозидаза. α-L-Фукозидаза расщепляет фукоидан бурых водорослей до фукозы и фукоолигосахаридов. Фукоза обладает пребиотическим, иммунотропным действием, а также широким спектром биологических активностей в организме позвоночных, фукоолигосахариды - антиоксидантными и пребиотическими свойствами. В связи с этим фукоза и ее полимеры могут быть востребованы в пищевой, кормовой и фармацевтической промышленности. β-Фруктофуранозидазa гидролизует сахарозу с образованием инвертного сиропа повышенного качества и биологической ценности, что представляет интерес для сахарной промышленности. С целью интенсификации процессов гидролиза фукоидана и сахарозы за счет более высокой стабильности и возможности многократного использования ферментных препаратов проведена иммобилизация α-L-фукозидазы на хитозане и β-фруктофуранозидазы на ионообменнике марки ФИБАН А-6 адсорбционным методом. Активности иммобилизованных α-L-фукозидазы и β-фруктофуранозидазы составили 80 и 70 % от активности свободных ферментов соответственно. Установлено, что иммобилизованная β-фруктофуранозидаза проявляет максимальную активность при рН 4,0-4,1, иммобилизованная α-L-фукозидаза - при рН 7,0. Оптимальные значения рН иммобилизованных ферментов совпадают с таковыми для свободных ферментов. Оптимальная температура гидролиза субстратов иммобилизованными α-L-фукозидазой и β-фруктофуранозидазой составила 50 и 70 °С соответственно, что на 10 °С и 20 °С выше по сравнению со свободными ферментами. Исследования показали достаточную стабильность иммобилизованных гликозидаз, так при 4-кратном их использовании ферментативная активность снижалась в 1,5 раза; при хранении полученных биокатализаторов в холодильной камере в течение 4-6 месяцев сохранялось 80 % каталитической активности ферментов.
Гликозидазы, α-l-фукозидаза, β-фруктофуранозидаза, фукоидан, фукоза, фукоолигосахариды, сахароза, инвертный сироп, адсорбция, иммобилизация, хитозан, волокнистый ионообменник, гидролиз, субстрат
Короткий адрес: https://sciup.org/14040319
IDR: 14040319 | УДК: 577.15
Текст научной статьи Получение и характеристика биокатализаторов на основе иммобилизованных гликозидаз
Гликозидазы - ферменты, широко распространенные в природе и играющие большую роль в обмене веществ живой клетки, преобразуя олиго- и полисахариды в более простые сахара, доступные клетке для дальнейшего катаболизма с целью получения необходимых структурных элементов и химической энергии [1]. Особенно велико прикладное значение этих ферментов для биотехнологии и пищевой промышленности с целью получения функциональных продуктов.
Так, в последнее время возрос интерес к разработке биотехнологий пищевых продуктов диабетического и профилактического назначения. Актуальным в настоящее время является производство «минорного» сахара - фукозы, обладающего пребиотическим, иммунотроп-ным действием [2, 3] и биологической активностью в организме позвоночных [4, 5], а также фукоолигосахаридов, проявляющих антиоксидантную и пребиотическую активность [3, 6].
Одним из перспективных способов получения фукозы и фукоолигосахаридов является гидролиз фукоиданов бурых водорослей a-L-фукозидазой. a-L-Фукозидаза расщепляет гликозидные связи в фукоиданах - матричных полисахаридах бурых водорослей с образованием фукозы и фукоолигосахаридов, которые представляют интерес для пищевой, кормовой и фармацевтической промышленности.
Достаточно устойчивый и стабильно возрастающий спрос имеет производство инвертного сиропа (сахара), представляющего собой смесь глюкозы и фруктозы в различном соотношении и являющегося крупнотоннажным продуктом пищевой промышленности. Этот продукт в 1,2-1,5 раза слаще сахарозы и отличается более мягким вкусом, меньшей вязкостью и большим содержанием сахаристых веществ по сравнению с сахарными сиропами [7]. Замена кислотного способа инверсии сахарозы при производстве инвертного сахара на ферментативную с использованием специфического фермента в-фруктофуранозидазы позволяет существенно повысить качество инвертного сахара и его биологическую ценность.
Иммобилизация ферментов a-L-фукозидазы и в-фруктофуранозидазы позволит интенсифицировать процессы гидролиза фукоиданов и сахарозы за счет более высокой стабильности и возможности многократного использования ферментных препаратов, что существенно снизит стоимость конечных продуктов. А получение гетерогенных биокатализаторов на основе указанных иммобилизо- ванных гликозидаз, способных работать в непрерывном режиме, является перспективным подходом к промышленному усовершенствованию этих процессов.
Целью данного исследования являлось получение высокостабильных биокатализаторов на основе иммобилизованных a-L-фукозидазы и в-фруктофуранозидазы для увеличения кратности их использования в реакционных циклах.
Объектами исследования служили a-L-фукозидаза Aspergillus awamori и в-фруктофуранозидаза Kluyveromyces marxianus Y-303 с каталитическими активностями 2310 ед/г и 2700 ед/мг соответственно.
В качестве носителя для иммобилизации a-L-фукозидазы использовали хитозан со степенью деацетилировани >85 % и молекулярной массой >300 kDa; в-фруктофуранозидазы - волокнистый ионообменник марки ФИБАН А-6, подготовку которого осуществляли путем кондиционирования и перевода его в нужную ионообменную форму [8].
Активность a-L-фукозидазы определяли по количеству свободной фукозы по методу Дише [9], определение активности в-фруктофуранозидазы осуществляли методом Бертрана [10] и методом Сомоджи-Нельсона [11]. За единицу активности a-L-фукозидазы и в-фруктофуранозидазы принимали такое количество фермента, которое образует 1 мкмоль фукозы или редуцирующих веществ соответственно за 1 мин в стандартных условиях.
Иммобилизацию a-L-фукозидазы и в-фруктофуранозидазы проводили адсорбционным способом. Для иммобилизации a-L-фукозидазы сорбент помещали в водный раствор фермента различных концентраций (0,1-2,0 мг/см3). Иммобилизацию в-фрукто-фуранозидазы осуществляли по разработанной нами ранее методике [12]. Эффективность иммобилизации контролировали по содержанию остаточного белка в ферментном растворе.
Содержание белка определяли модифицированным методом Лоури [11], используя калибровочный график, построенный по бычьему сывороточному альбумину («Sigma», США).
Для определения оптимального рН действия свободных и иммобилизованных ферментов осуществляли гидролиз субстратов в интервале рН 3,0-8,0. Влияние температуры на каталитическую активность свободных и иммобилизованных ферментов исследовали в интервале температур 20-80 °С.
Стабильность полученных биокатализаторов на основе иммобилизованных ферментов исследовали в течение 6 мес.
В качестве носителя для иммобилизации α-L-фукозидазы использовали хитозан. Хитозан отличается от других носителей высокой сорбционной емкостью и способностью образовывать прочные комплексы с белковыми молекулами. Основной моделью взаимодействия хитозана с белковыми молекулами выступает сорбционная модель физико-химического взаимодействия субстратов. При этом исключается химическое взаимодействие с образованием прочных ковалентных связей. [13]. Кроме того, хитозан сохраняет свойства поверхности в растворенном состоянии, что делает его пригодным для проведения иммобилизации адсорбционным способом в водных растворах фермента.
На рисунке 1 показана кривая сорбции фермента на хитозане в зависимости от кон-цент рата.
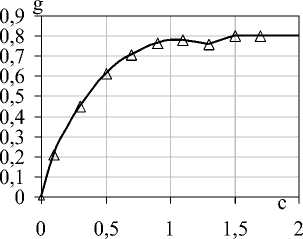
Рисунок 1. Кривая сорбции α-L-фукозидазы на хитозане в зависимости от концентрации раствора ферментного препарата: g – масса белка, связавшегося с носителем, мг/г; c – концентрация водного раствора фермента, мг/см3
Исследование зависимости сорбции от концентрации раствора фермента показало, что максимальная степень сорбции α-L-фукозидазы наблюдалась в интервале концентраций 0,1-1,8 мг/см3. При увеличении концентрации фермента оптическая плотность растворов при сорбции не отличалась от свободного фермента, что говорит о том, что иммобилизация фермента идет в интервале низких концентраций. Было установлено, что для иммобилизации α-L-фукозидазы достаточно 1,2 г хитозана, который содержал в среднем 0,8 мг фермента. Выход иммобилизованного фермента находился в диапазоне 65-68 %.
График имеет вид плавно восходящей кривой с горизонтальным участком после насыщения, на которой наблюдается небольшой перегиб. Этот эффект, по-видимому, является результатом полислойной адсорбции и следствием особенностей и равновесного характера процессов сорбции и десорбции. Он обусловлен актив- 208
ностью поверхности твердой фазы, определяемой величиной ее поверхностного потенциала или взаимодействием функциональных групп в процессе эллюирования фермента. Вблизи точек перегиба кривая имеет практически горизонтальный участок, что свидетельствует о постоянной концентрации фермента.
При создании гетерогенного ферментного препарата на основе иммобилизованной α-L-фукозидазы необходимо изучить физикохимические свойства полученного комплекса фермент-носитель. В связи с этим были исследованы зависимости каталитической активности свободной и иммобилизованной α-L-фукозидазы от рН и температуры. На рисунке 2 показана зависимость свободной и иммобилизованной α-L-фукозидазы от величины рН.
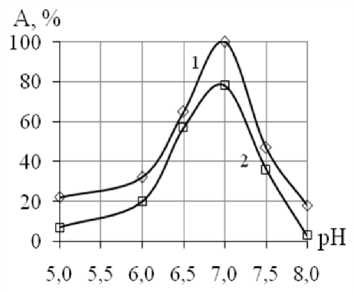
Рисунок 2. Зависимость активности (% от максимальной) от рН при температуре 40 оС: 1-свободной, 2- иммобилизованной α-L-фукозидазы.
Как видно на рисунке 2, иммобилизованная α-L-фукозидаза так же, как и свободная, проявляла максимальную активность при рН 7,0. Таким образом, иммобилизация не влияла на оптимальные значения рН действия фермента.
Исследования влияния температуры на активность свободной и иммобилизованной α-L-фукозидазы показали, что оптимальная температура гидролиза субстрата смещается в сторону более высоких значений с максимальной активностью при 50 оС (рисунок 3), что на 10 оС выше, чем для свободного фермента. Влияние температуры на активность ферментов объясняется тем, что она, с одной стороны, воздействует на белковую часть фермента, приводя его к денатурации и снижению каталитической функции, а с другой стороны – интенсифицирует скорость реакции образования фермент-субстратного комплекса и все последующие этапы преобразования субстрата. В результате связывания молекул фермента с носителем возрастает их термостабильность. Это положение подтверждено в ряде работ [14, 15, 16].
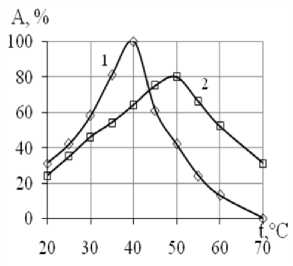
Рисунок 3. Влияние температуры на активность α-L-фукозидазы (% от максимальной) при рН 7,0: 1 – свободный фермент, 2 – иммобилизованный
Проводились исследования процесса иммобилизации β-фруктофуранозидазы и влияния его на физико-химические свойства фермента.
Для иммобилизации β-фруктофурано-зидазы в качестве носителя использовали волокнистый ионообменник ФИБАН А-6. Этот носитель имеет следующие характеристики: 1) высокая скорость ионообменных и сорбционных процессов; 2) устойчивость к действию агрессивных сред и температуры; 3) хорошая смачиваемость водой; 4) возможность применения в виде тонких фильтрующих слоев и многократных циклов кислотно-щелочной обработки и высушивания-увлажнения; 5) обладает большой обменной емкостью и высокими механическими свойствами. Все вышеперечисленное позволяет рекомендовать использовать данное волокно в качестве носителя для иммобилизации ферментов.
Кривая сорбции β-фруктофуранозидазы на волокнистом носителе показана на рисунке 4. Кривая сорбции β-фруктофуранозидазы, как и в случае с α-L-фукозидазой имеет перегиб, что свидетельствует о сложности протекания процесса. Очевидно, что помимо взаимодействия сорбент-сорбат, результатом которого является формирование мономолекулярного слоя белка, дальнейшее нарастание количества сорбированного фермента происходит в ходе взаимодействия
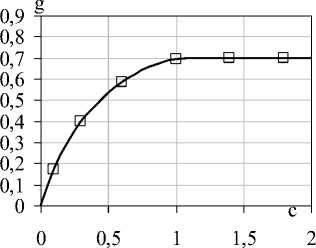
Рисунок 4. Кривая сорбции β-фруктофуранозидазы на ФИБАН А-6 в зависимости от концентрации раствора ферментного препарата: g – масса белка, связавшегося с носителем, мг/г; c – концентрация водного раствора фермента, мг/см3
Было установлено, что для иммобилизации β-фруктофуранозидазы достаточно 1,0 г ФИБАН А-6, который содержал в среднем 0,7 мг фермента. Выход иммобилизованного фермента находился в диапазоне 68-71 %.
Емкость используемых для иммобилизации волокнистых носителей превышает емкость гранульных в среднем в 3 раза. Только при низких концентрациях β-фруктофуранозидазы (до 1,0 мг/см3) количество сорбированного фермента сопоставимо с этой же величиной. Это связано, вероятно, с более легкой доступностью молекул фермента к сорбционным центрам носителя благодаря наличию транспортных пор. Процесс включения молекул фермента в поры носителя можно рассматривать как “улавливание” биомолекул. Ферменты, внедренные таким способом в матрицу носителя, защищены от действия микробов и макромолекулярных веществ, продуцируемых микробами. Биокатализаторы в таком виде также более удобны для использования, что в ряде случаев делает их применение более предпочтительным, чем биокатализаторов в другой форме.
Было изучено влияние рН реакционной смеси на активность препаратов свободной и иммобилизованной β-фруктофуранозидазы.
Как видно на рисунке 5, иммобилизованная β-фруктофуранозидаза проявляла максимальную активность при рН 4,0-4,1.
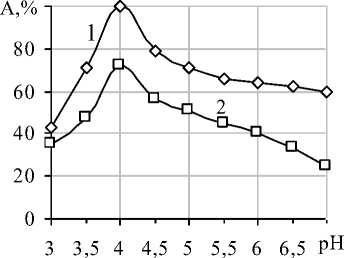
Рисунок 5. Зависимость активности (% от максимальной) от рН при температуре 40 оС: 1-свободной, 2- иммобилизованной β-фруктофуранозидазы
Небольшой сдвиг рН (на 0,1 единиц) может быть обусловлен различием между локальными значениями рН микроокружения активного центра и рН, измеряемым в объеме раствора. На локальное значение рН микроокружения оказывают влияние следующие факторы: заряд матрицы носителя, изменение заряда субстрата при превращении его в продукты, диффузия субстрата и продукта, изменение суммарного заряда белка при иммобилизации [18].
В ходе работы была проведена серия экспериментов по определению влияния температуры на активность свободной и иммобилизованной β-фруктофуранозидазы.
Для иммобилизованной β-фруктофуранозидазы оптимальная температура гидролиза сахарозы составила 70 оС (рисунок 4). Данный показатель на 20 оС выше, чем для свободного фермента[17].
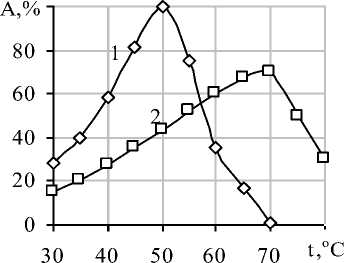
Рисунок 4. Влияние температуры на активность β-фруктофуранозидазы (% от максимальной) при рН 4,0: 1 – свободный фермент, 2 – иммобилизованный
Можно предположить, что повышение оптимальных температур действия иммобилизованных ферментных препаратов обусловлено тем, что при присоединении к носителю происходит повышение жесткости третичной структуры, ответственной за каталитическое превращение субстрата. Чем больше образовано связей между носителем и ферментом, тем стабильность белковой молекулы выше по отношению к температуре [18].
Опыты по определению активности свободных и иммобилизованных ферментов показали, что в процессе иммобилизации происходит снижение каталитических активностей α-L-фукозидазы и β-фруктофуранозидазы на 20 % и 30 % соответственно. Причиной снижения активности ферментов при иммобилизации могут быть диффузионные затруднения, препятствующие доступу субстрата к активному центру фермента, а также возможное ограничение конформационной подвижности белка вследствие его многоточечного связывания с поверхностью носителя.
Изучалось влияние условий хранения и кратность использования полученных биокатализаторов. Было установлено, что при многократном использовании (4-5 раз) иммобилизованных гликозидаз снижение ферментативной активности было незначительно (рисунок 6).
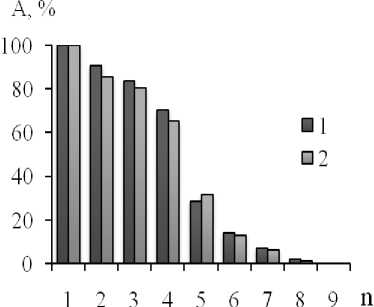
Рисунок 6. Кратность использования иммобилизованной β-фруктофуранозидазы (1) и α-L-фукозидазы (2) в реакции гидролиза субстрата: А – активность иммобилизованного фермента (% от максимальной); n – количество реакционных циклов
Остаточную активность измеряли периодически сначала 2-4 раза в неделю, затем каждые 1-2 мес. При условиях хранения полученных биокатализаторов в холодильной камере наблюдалось незначительное снижение каталитической активности иммобилизованных ферментов по истечении 4-6 месяцев (до 70 % активности), что свидетельствует об эффективности предложенных способов иммобилизации.
В результате было установлено, что данные способы иммобилизации являются простыми и эффективными для получения гетерогенных биокатализаторов на основе иммобилизованных гликозидаз. В таких биокатализаторах отсутствуют токсические сшивающие реагенты, которые могут оказывать дезактивирующее действие на ферментативную активность, поэтому ферменты сохраняли высокую активность. Адсорбция ферментов на поверхности носителей прочная, так как поры носителей имеют подходящий размер, а поверхностное покрытие - соответствующую микроструктуру и химическую природу, вследствие чего полученные биокатализаторы проявляли достаточно высокую термостабильность.
Кроме того, исследования влияния иммобилизации на кратность использования ферментов показали перспективность использования полученных биокатализаторов в непрерывном режиме в нескольких реакционных циклах гидролиза субстрата.
Таким образом, были получены гетерогенные биокатализаторы β-фруктофуранозидазы и α-L-фукозидазы, отличающиеся высокой активностью, термостабильностью и кратностью использования в реакциях гидролиза субстратов.
Работа выполнена в рамках НИОКР по программе У.М.Н.И.К. (ГК №11720р/17208 от 05.04.2013).
Вестник ВГУИТ, №4, 2014


