Получение и исследование биосовместимости трехмерного биоактивного каркаса с заданными свойствами на основе децеллюляризованной гетерологичной костной ткани
Автор: Пономарева Юлия Вячеславовна, Милякова Марина Николаевна, Сарбаева Наталья Николаевна, Атрашкова Александра Евгеньевна, Супильников Алексей Александрович, Ваньков Владимир Александрович
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 3 (45), 2020 года.
Бесплатный доступ
Разработка новых имплантируемых материалов для регенерации кости остается актуальной проблемой, которая в настоящее время рассматривается с позиций тканевой инженерии. Такие продукты должны представлять собой биоактивный трехмерный матрикс, содержащий либо клетки, либо биологически активные белки в виде факторов роста, сигнальных молекул, либо необходимые гены и/или их продукты. В работе представлен фрагмент результатов исследований по технологии создания, путям достижения значимых качественных и количественных параметров свойств такого матрикса и оценена биосовместимость in vivo с использованием оригинальной модели критического дефекта костной ткани.
Децеллюляризация, костный матрикс, остеорегенерация, биосовместимость
Короткий адрес: https://sciup.org/143172361
IDR: 143172361 | УДК: 616
Текст научной статьи Получение и исследование биосовместимости трехмерного биоактивного каркаса с заданными свойствами на основе децеллюляризованной гетерологичной костной ткани
To cite: Ponomareva Yu.V., Milyakova M.N., Sarbaeva N.N., Atrashkova A.E., Supilnikov A.A., Vankov V.A. Production and biocompatibility evaluation of a three-dimensional bioactive matrix with specified properties based on decellularized heterologous bone tissue // Bulletin of Medical University Reaviz. - 2020. - № 3. - P. 5-14.
Кость на протяжении всей жизни сохраняет способность к ремоделированию и регенерации. Однако существует множество клинических состояний, когда регенеративный процесс нарушен или невозможен в полном объеме, особенно при ее критических дефектах [1]. Применительно к стоматологической практике, частично или полностью беззубые челюсти с течением времени подвергаются атрофии от умеренной до тяжелой, что значительно затрудняет, а порой делает невозможным процесс протезной реабилитации [2]. В настоящее время проблема дефицита костной ткани решается за счет остеопластики. В России сформировался рынок костных материалов, лидирующие позиции на котором принадлежат таким компаниям, как Geistlich Pharma AG, ААР Biomate rials GMBH, Tecnoss S.R.L. Приоритет при выборе костных материалов зарубежного производства специалистами может быть объяснен их предсказуемым поведением в ране и воз можностью получения стабильных клинических результатов. Российские производители (АО «ОЭЗ «ВладМиВа», ООО «Ко-нектбиофарм», ООО «БиоНова», ООО «Лиоселл», ООО «НПК «Полистом»), следуя трендам времени, продолжают завоевывать рынок костных материалов, но их суммарная доля остается невысокой.
Тем не менее, разработка новых материалов для регенерации кости остается актуальной проблемой, которая в свете последних тенденций стала рассматриваться с позиций тканевой инженерии. То есть, костный имплантат - это не только материал, обладающий в основном остеокондук-тивными и, возможно, остеоиндуктивными свойствами, а биоактивный трехмерный матрикс, содержащий либо клетки, либо биологически активные белки в виде факторов роста, сигнальных молекул, либо необходимые гены и/или их продукты [3, 4]. Закономерно, что на пути создания продукта тканевой инженерии для восстановления критических дефектов кости, является получение биоактивного трехмерного матрикса, при достижении определенных свойств которого возможен переход к следующим этапам.
Цель исследования: оценить биосовместимость децеллюляризованного костного матрикса in vivo, полученного по разработанному протоколу.
Материалы и методы
У свиней породы Ландрас обоего пола и весом более 100 кг сразу после забоя выделяли проксимальные и дистальные эпифизы бедренной и плечевой костей, а также позвонки грудного и поясничного отделов. Далее во влажной среде фосфатно-солевого раствора производили распил анатомических объектов в форме костных блоков, представленных исключительно пластинчатой костной тканью трабекулярного строения размерами 0,5х0,5х0,5 см; 0,5х0,5х1,0 см и 1,0х1,0х1,0 см. Распиленное сырье в зависимости от размера сортировали по партиям и сразу же погружали в 6 % раствор перекиси водорода, подогретый до 37 °C, и обрабатывали с использованием шейкера (GFL 3017) в режиме 135 оборотов в минуту. По истечении 3 часов костные блоки промывали фосфатносолевым раствором. Затем этап обработки повторяли. Общее количество повторов составило от 6 до 8 и зависело, как от исходного состояния сырья, а именно от его пористости, так и от сохранения необходимой увлажненности в процессе предшествующего распила. Затем партии блоков помещали в воронку Бюхнера, через которую подавали непрерывный поток подогретой до 37 °C 6 % раствора перекиси водорода с моментальной аспирацией вакуумным отсосом (ОХПУ-4-01), при давлении 40-70 кПа. Циклы проточного промывания и аспирации повторяли не менее 5-6 раз. Затем каждую партию 6-8 раз при помощи шейкера в режиме 135 оборотов в минуту промывали подогретой до 37 °C дистилли рованной водой. Данный этап позволял провести отмывку компонентов, содержащихся в межтрабекулярных пространствах свиных костей. С целью удаления фрагментов клеток и их белков с поверхностей трабекул выполняли децеллюляризацию. Для этого использовали подогретый до 37 °C трехкомпонентный гипертонический раствор, включающий буфер Серенсена, трис и натрия хлорид. Обработку децеллюляри-зующей смесью осуществляли при помощи шейкера в режиме 125 оборотов в минуту. Как только рабочий раствор мутнел, производили его смену. Децеллюляризацию на шейкере завершали при условии, что рабочий раствор оставался прозрачным. Затем, образцы децеллюляризованного костного матрикса переносили в воронку Бюхнера, через которую подавали непрерывный поток подогретого до 37 °C трехкомпонентного гипертонического раствора, а затем дистиллированной воды для снижения концентрации содержащихся ионов солей на поверхности трабекул. Все растворы, проходящие через образцы, аспирировали вакуумным отсосом при давлении 40-60 кПа.
С целью контроля качества децеллю-ляризации каждый костный блок просматривали в проходящем свете, а затем определяли его цвет, используя шкалу Vita. Блоки, имеющие какие-либо включения или цвет, отличный от В1 или С1 исключали из дальнейшей обработки.
Образцы децеллюляризованных костных блоков, прошедших контроль качества, подвергали дальнейшей децеллюляризации в сочетании с делипидизацией. Для этого применяли теплый (37 °C) 2 % раствор дезоксихолата натрия (AppliChem, Германия), приготовленный с использованием трисфосфатного буфера и панкреатической липазы (Sigma-Aldrich, Германия). При этом, активность последней в готовом растворе составляла не менее 100 ед/мл. Этап осуществляли при помощи шейкера в режиме 125 оборотов в минуту. Через каждые 3 часа процесс обработки на шейкере останавливали, делали проточное промы- вание идентичным раствором (по завершению дистиллированной водой) с аспирацией жидкостей через воронку Бюхнера.
Деминерализацию блоков осуществляли при помощи 0,5 М раствора соляной кислоты, периодически его меняя.
Финальную отмывку осуществляли дистиллированной водой, а затем фосфатносолевым раствором при помощи шейкера.
Для определения содержания нейтральных липидов в децеллюляризован-ном костном матриксе использовали унифицированный метод определения триглицеридов по глицерину после предварительной подготовки образцов протеиназой К (Sigma-Aldrich) при 60 °C. Результат признавали удовлетворительным только при полном отсутствии триглицеридов в образцах. Если получали значение отличное от нуля, то все образцы партии подвергали повторной обработке раствором дезоксихолата натрия с добавлением липазы, но с более низкой концентрацией действующих компонентов.
Для оценки белков в составе матрикса в камере VE-20 (Helicon) проводили электрофорез в полиакриламидном геле по системе Лэммли. Полученные гели окрашивали кумасси G-250. В качестве стандартов молекулярной массы использовали Thermo ScientificTM RageRulerTM Brad Range Unstained Protein Ladders.
Стерилизацию децеллюляризованных костных матриксов осуществляли согласно разработанному протоколу раствором надуксусной кислоты с последующей отмывкой и упаковкой в герметично закрывающиеся пластиковые емкости с добавлением разбавленного стерильного буфера Серенсена. В качестве вторичной упаковки служили фольгированные запаивающиеся пакеты. Хранение образцов осуществляли при комнатной температуре.
Оценка биосовместимости образцов децеллюляризованного костного матрикса in vivo проведена на основании результатов тестов in vitro, подтвердивших отсутствие острой токсичности.
Биосовместимость изучена на лабораторных крысах (п = 18) обоего пола с массой тела 280 ± 50 грамм. При организации эксперимента были соблюдены все требования, предъявляемые к планированию и проведению исследований с участием биологических систем.
Животных содержали в условиях вивария при свободном доступе к пище и воде. Для анестезии и аналгезии крыс использовали комбинированный препарат золетил (3 мкг/кг) в сочетании с рометаром (2 мкг/кг), вводимые парентерально. Эвтаназию осуществляли теми же ветеринарными препаратами, но в летальной дозировке.
Для оценки тканевой реакции на имплантацию децеллюляризованных костных матриксов использовали экспериментальную модель, заключающуюся в выполнении операции экзартикуляции на уровне 04 позвонка хвостового отдела. Для этого в положении крысы на животе сдвигали кожу хвоста к его корню и накладывали циркулярную давящую повязку. На уровне хвостовых С4-С5 позвонков производили рассечение кожи справа и слева с формированием двух полулунных лоскутов. Поэтапно лигировали и перевязывали дорсальную и боковые вены, группу мелких вен, расположенных ниже тела 04 позвонка, а также брюшную артерию. Острым путем между С4-С5 позвонками пересекали связки и межпозвоночный диск, после чего ослабляли давящую повязку для контроля гемостаза. Далее производили дебридмент хряща на дистальной поверхности 04, а затем в краниальном направлении стоматологическим бором формировали канал диаметром 4 мм и глубиной 6 мм (рис. 1, а). В канал (объем 75,4 мм3) имплантировали образец предварительно смоделированного и несколько большего по размерам де-целлюляризованного костного матрикса (п = 12). У контрольных животных (п = 6) выполняли ложную операцию, при которой костный канал ничем не заполняли. На кожу культи накладывали отдельные узловые швы (рис. 1, б). На поверхность раны наносили асептическое покрытие (террамицин спрей 2,5 %).
В послеоперационном периоде ежедневно осматривали крыс, фиксировали основные физиологические показатели, состояние кожи хвоста и наложенных швов, наличие патологического отделяемого из раны. Швы снимали на 5-6 сутки. Срок наблюдения за экспериментальными животными составил 28, 45 и 90 суток, соответственно.
По наступлению контрольных сроков у животных после эвтаназии производили отсечение фрагментов культей хвостов в пределах С4-позвонков. Фиксацию полученного биоматериала осуществляли в 10 % нейтральном растворе формалина, после чего промывали, декальцинировали, обезвоживали, заливали в парафин, изготавливали серийные срезы толщиной 4 мкм и окрашивали гематоксилином-эозином, пикросириусом красным, пикрофуксином по Ван Гизон. Морфологическую оценку клеточно-тканевой реакции на имплантированные образцы проводили при помощи световой микроскопии (Olympus 55i, Япония).
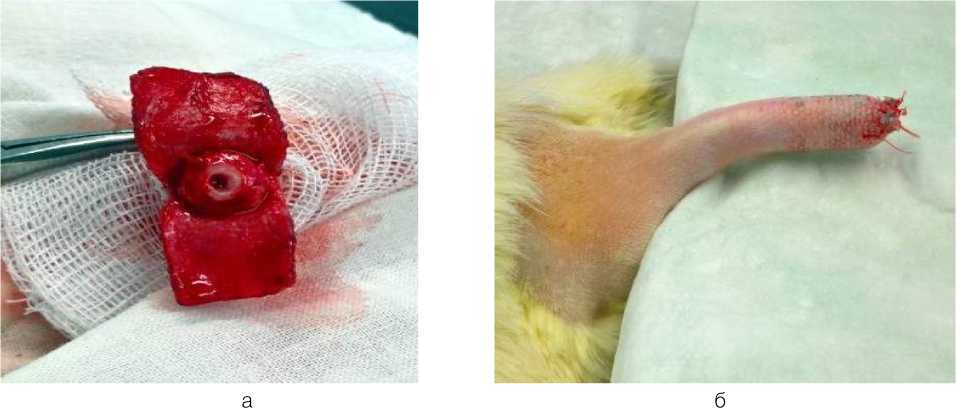
Рис. 1. Модель внутрикостной имплантации крысе при исследовании биосовместимости децеллюляри-зованного костного матрикса: а - сформированный внутрикостный канал в 04-позвонке хвостового отдела крысы; б - ушитая культя хвоста крысы, после экзартикуляции на уровне 04-позвонка
Полученные результаты и их обсуждение
Продукты на основе аллогеной и ксеногенной костной ткани хорошо известны своими остеокондуктивными, а некоторые -остеоиндуктивными свойствами. Но каждый из них, в зависимости от технологии (условий отбора, скрининга сырья, его обработки, консервации, стерилизации), используемой производителем, проявляет большую вариабельность своих свойств [5]. Это продемонстрировано на примере сравнительного анализа нескольких, казалось бы, идентичных по заявленным свойствам готовых продуктов, отличающихся друг от друга не только остеоиндуктивными свойствами, но и манипуляционными. Итогом таких отличий становятся разные клинические результаты [6].
Остеоиндуктивный потенциал децеллю-ляризованных костных матриксов может быть повышен путем введения соответствующих факторов роста. Последние обеспечивают хемотаксис, пролиферацию и дифференцировку клеточного микроокружения [7]. Введение соответствующих факторов требует тщательной подготовки поверхно сти децеллюляризованного костного матрикса при полном сохранении молекулярной структуры коллагена в его составе.
Разрабатывая протокол получения де-целлюляризованного костного матрикса, в качестве основных задач, были поставлены: во-первых, «избыточность»технологии, которая, независимо от исходного объема сырья, позволяла получать готовый продукт (рис. 2, а). При этом, в качестве контрольного показателя было принято полное отсутствие нейтральных липидов на поверхности децеллюляризованной гетерологичной кости. Известно, что липиды на поверхности любых материалов способны образовывать гидрофобную пленку, делая недоступными химически активные группы молекул коллагена, что после имплантации затрудняет процессы естественной адсорбции белков, выступающих в роли факторов миграции и адгезии для клеток. Кроме того, липиды под действием ряда химических и физических факторов легко подвергаются окислению с образованием высокотоксичных продуктов на поверхности продукта, предназначенного для имплантации.
Второй задачей при разработке протокола и получении матрикса было сохранение молекулярной структуры коллагена при максимально полном удалении клеточных белков. Электрофоретическое разделение белков матрикса показало, что основным его компонентом являлся коллаген (белковые фракции с молекулярной массой около и более 150 кДа). Других полос на электрофореграммах, свидетельствующих о наличии иных белков в составе образцов, не было выявлено.
За счет сохранения молекулярной структуры коллагена, упругие свойства которого известны, готовые образцы можно было легко сжать, после чего они расправлялись, восстанавливая исходную форму (рис. 2, б). Кроме того, они легко моделировались любым режущим инструментом.
Следующим критическим моментом в технологии получения децеллюляризован-ных костных матриксов является процесс консервации и стерилизации, поскольку они в значительной степени могут влиять на молекулярную структуру нативного коллагена.
Нативный коллаген легко формирует водородные связи за счет карбоксилсодержащих аминокислот и ионные связи. За счет их формирования возможно прослеживать неизмененную структуру фиксированных коллагенсодержащих тканей при использовании гистологических красителей. Изменение структуры коллагена может происходить при обработке нативных тканей кислотами, спиртами, эфирами, физическими факторами. Так, потеря молекул воды из тройной спирали коллагена при лиофилизации приводит не только к структурным, но и конформационным изменениям этого белка [8]. Поэтому был выбран влажный способ консервации матрикса, что облегчало его манипуляционные свойства, так как отсутствовала необходимость выполнения регидратации перед имплантацией. На следующих этапах создания ткане-инженерной конструкции это позволит проводить длительное культивирование такого матрикса совместно с клетками или выполнить его молекулярную модификацию (рис. 2, в).
Имплантация образцов децеллюляри-зованного костного матрикса не вызвала каких-либо осложнений в послеоперационном периоде у крыс вплоть до завершения всего эксперимента.
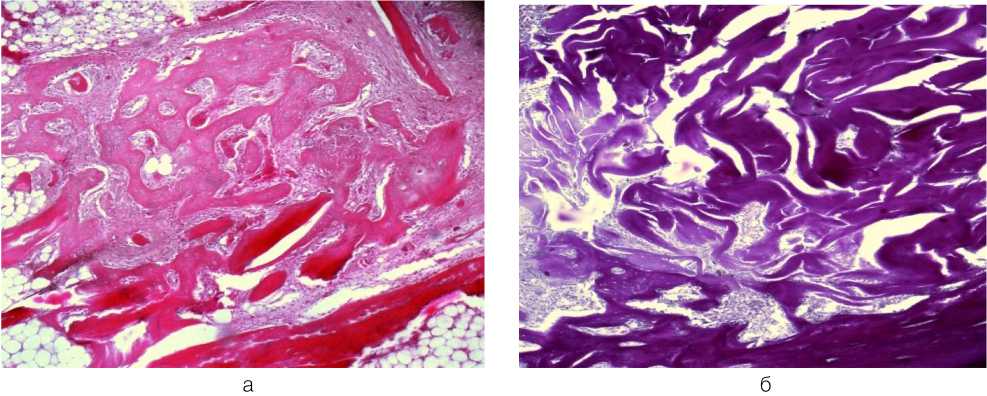
При исследовании макрообъекта на 28 сутки, представленного С4-позвонком крысы, не было отмечено значимого снижения объема имплантированной гетерологичной децеллюляризованной костной ткани у наружного края ранее сформированного костного канала. При гистологическом исследовании отмечено, что имплантированный материал равномерно выполнял весь объем костного канала и легко идентифицировался по эозинофильно окрашенным трабекулам гетерологичной костной ткани, включающих лакуны. Межтрабекулярные пространства имплантата содержали единичные клетки фибробластического и лимфоцитарного ряда, а также очаги грануля- ционной ткани, в просвете сосудов которой содержались эритроциты. В области дна и боковых стенок дефекта признаки регенерации костной ткани, которая на этом сроке была представлена новообразованными трабекулами с широкими лакунами, содер жащими остеоциты с гиперхромными ядрами (рис. 3, а). На периферии новообразованных трабекул присутствовали единичные остеобласты. В кортикальной пластине небольшие очаги лакунарной резорбции.

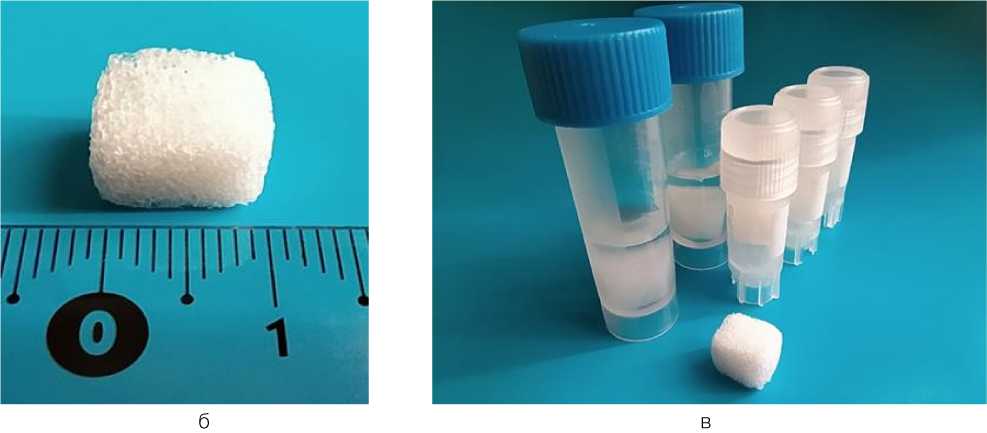
Рис. 2. Децеллюляризованный костный матрикс: а - после этапа децеллюляризации и делипидизации; б - образец объемом 1 см3; в - стерильные образцы в упаковке
На макропрепаратах ложноопериро-ванных животных к 28 суткам сохранялся видимый дефект костной ткани. На микропрепаратах преимущественно дно полости было заполнено незрелой костной тканью в виде трабекул, на периферии которых присутствовали группы из единичных остеобла- стов. В области боковых стенок - очаги грануляционной ткани. В кортикальной пластинке - признаки лакунарной резорбции.
К 45-м суткам на макропрепарате С4-позвонка имплантированный материал был расположен на уровне наружного края костного канала. На свободной поверхно- сти децеллюляризованного костного матрикса хорошо прослеживались мелкие, заполненные кровью сосуды. Гистологическое исследование показало, что имплантированные образцы сохраняли трабекулярное строение гетерологичной костной ткани и идентично нативной костной ткани позвонка крысы воспринимали красители. Межтрабекулярные пространства имплантата были неравномерно заполнены грануляционной тканью, включающей в основном клетки фибробластического ряда, а также единичные лимфоциты. Основные изменения заключались в сокращении объема канала, в среднем, на половину от его первоначального диаметра за счет продолжающегося центростремительного роста новообразованной костной ткани, в том числе по поверхности трабекул матрикса (рис. 3, б). В кортикальной пластине сохранялись очаги лакунарной резорбции.
На 45-е сутки в контрольных макропрепаратах по-прежнему сохранялся видимый дефект костной ткани. При гистологическом исследовании дефект со стороны дна не более, чем на одну треть был заполнен незрелой костной тканью. Центральная часть канала содержала грануляционную ткань с примесью единичных лимфоцитов. В кортикальной пластине процессы выраженной лакунарной резорбции.
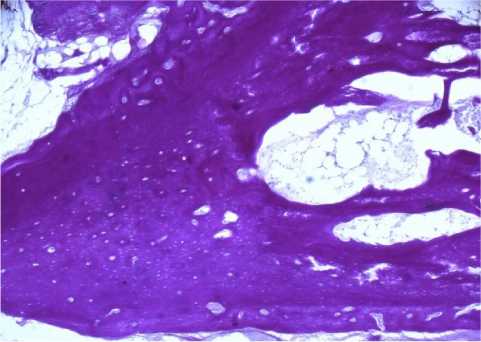
К 90-м стукам наружный край имплантированного децеллюляризованного матрикса находился на одном уровне относительно свободного края смоделированного дефекта. Трабекулярная структура имплантированного матрикса хорошо прослеживалась только в верхней трети костного канала. Большая часть дефекта была представлена зрелой пластинчатой костной тканью (рис. 3, в). Кортикальная пластинка на этом сроке значительно утолщена.
На макропрепаратах группы ложно-оперированных животных к 90-м суткам сохранялись видимые экспериментальные дефекты в позвонках. На микропрепаратах полость менее, чем на половину была заполнена пластинчатой костной тканью с единичными сформированными остеонами. Большая часть объема дефекта включала фиброзную ткань с очагами отека, дезорганизации коллагеновых волокон, элементами грануляционной ткани и единичными клетками воспаления. Кортикальная пластинка включала очаги лакунарной резорбции.
Костные дефекты, сформированные в теле С4-позвонка крыс общим объемом более 0,5 см3, являются критическими, поэтому процессы репаративной регенерации в отсутствии остеопластического материала протекают по типу субституции. Эти данные подтвердились для группы ложно-оперированных животных. К концу эксперимента у этих крыс полость содержала и костную ткань и фиброзную с признаками ремоделирования последней.
Децеллюляризованный костный матрикс при имплантации в сформированную полость не препятствовал миграции клеток вглубь материала. В присутствии матрикса протекали процессы репаративной регенерации, определяемые по центростремительному росту костной ткани, замещающей грануляционную, однако полностью не завершившиеся к трем месяцам с момента его имплантации. Большое число новообразованных сосудов в структуре матрикса позволяло судить об его ангиогенном потенциале, однако это требует проведения дополнительных исследований. Характерно, что ни на одном из сроков не были обнаружены остеокластоподобные клетки, выявляемые на поверхности большинства ксеногенных материалов [9], что свидетельствовало о его биосовместимости, неспособности индуцировать воспалительную реакцию гранулематозного типа, при возможном течении регенеративных процессов непосредственно на поверхности матрикса.
в
Рис. 3. Морфологические изменения в смоделированном канале при имплантации деминерализованного костного матрикса: а - новообразованные трабекулы костной ткани вокруг трабекул матрикса в дне канала через 28 суток. Окраска гематоксилином и эозином. х60; б - локус формирования пластинчатой костной ткани (появление гаверсовых каналов в трабекулах) на уровне средней трети канала и сохранение трабекулярной структуры матрикса в средней и верхней третях канала через 45 суток. Окраска пикрофуксином по Ван Гизон. х60; в - трабекулярные структуры, представленные пластинчатой костной тканью, заполняющие канал через 90 суток. Окраска пикрофуксином по Ван Гизон. хбО
Список литературы Получение и исследование биосовместимости трехмерного биоактивного каркаса с заданными свойствами на основе децеллюляризованной гетерологичной костной ткани
- Dimitriou R., Jones E., Mc Gonagle D., Giannoudis P.V. Bone regeneration: current concepts and future directions // BMC Med. - 2011. - Vol. 966.
- Reich K.M., Huber C.D., Lippnig W.R., Ulm C., Watzek G., Tangl S. Atrophy of the residual alveolar ridge following tooth loss in an historical population // Oral Dis. - 2011. - Vol. 17 (1). - P. 33-44.
- Chen Y. Orthopaedic application of gene therapy // J Orthop Sei. - 2001. - Vol. 6. - P. 199-207.
- Calori G.M., Donati D., Di Bella C., Tagliabue L. Bone morphogenetic proteins and tissue engineering: future directions // Injury. - 2009. - P. 40 (Suppl 3). - P. S67-76.
- Winkler T., Sass F.A., Duda G.N., Schmidt-Bleek K. A review of biomaterials in bone defect healing, remaining shortcomings and future opportunities for bone tissue engineering: The unsolved challenge // Bone Joint Res. - 2018. - Vol. 7(3). - P. 232-243.
- Kumar P., Vinitha B., Fathima G. Bone grafts in dentistry // J Pharm Bioallied Sei. - 2013. - Vol. 5 (Suppl. 1). - P. S125-S127.
- Sharma P., Kumar P., Sharma R., Bhatt V.D., Dhot P.S. Tissue Engineering; Current Status & Futuristic Scope // J Med Life. - 2019. - Vol. 12 (3). - P. 225-229.
- Rodriguez-Ares M.T., Löpez-Valladares M.J., Tourino R., Vieites B., Gude F., Silva M.T., Couceiro J. Effects of lyophilization on human amniotic membrane // Acta Ophthalmol. - 2009 - Vol. 87(4). - P. 396-403.
- Bonarcev A.P., Muraev A.A., Deev R.V., Volkov A.V. Material-associirovannaya kostnaya rezorbciya // STM. -2018. - T. 10, №4. - S. 26-33.


