Получение и применение антиплацентарной крови при акушерско-гинекологических заболеваниях коров
Автор: Юсупов С.Р., Валиуллина Д.Ф., Дарменова А.Г.
Статья в выпуске: 2 т.230, 2017 года.
Бесплатный доступ
В статье описываются метод получения антиплацентарной крови (АПК), результаты лечения и профилактики акушерско-гинекологических заболеваний коров с применением антиплацентарной крови.
Корова, антиплацентарная кровь (апк), карункулы, крипты, плацента
Короткий адрес: https://sciup.org/14288939
IDR: 14288939 | УДК: 619:591.11:618:636.2
Текст научной статьи Получение и применение антиплацентарной крови при акушерско-гинекологических заболеваниях коров
На сегодняшний день основным фактором понижения воспроизводительной функции маточного поголовья служат акушерско-гинекологические заболевания, что приводит к массовому распространению бесплодия у коров. В настоящее время наиболее перспективным путем повышения продуктивности животноводства является внедрение современных технологий, позволяющих с высокой эффективностью применить новые методы лечения и профилактики при акушерско-гинекологических заболеваниях коров, сохраняя и повышая качество и безопасность продукции.
В ветеринарной практики используется множество различных методов лечения гинекологических заболеваний у коров, но они не всегда являются эффективными, даже при оптимальных условиях содержания. Применение новых эффективных методов лечения и профилактики акушерско-гинекологических заболеваний является одним из основных критериев увеличения поголовья скота и повышения его продуктивности [5, 6].
Препараты из тканей плаценты в последние годы чаще применяют для профилактики и лечения послеродовой патологии. В некоторых литературных источниках встречаются примеры влияния препаратов из плаценты на скорость инволюции матки, так как в плаценте содержится множество биологически активных веществ, в том числе эстрадиол и его производные – эстрон и эстриол, которые ускоряют пролиферативные процессы в эндометрии и повышают тонус мускулатуры матки коровы [2, 3].
Актуальным направлением в лечении и профилактике акушерско-гинекологических заболеваний у коров является применение антиплацентарной крови (С.Р. Юсупов, Ф.А. Сунагатуллин «Методы получения антипла-центарной крови, ее применение для профилактики и лечения, послеродовых акушерско-гинекологических заболеваний у коров». Патент на изобретение № 2537026. «31» октября
2014 г.).
Лечебно-профилактические свойства антиплацентарной крови, полученной после двукратного подкожного введения лошадям плацентолизата коров, основаны на содержании в ней биологических активных веществ, в том числе гипериммунной сыворотки (специфических антител), которые направленно воздействуют на ускорение выведения лохий и инволюции матки у новотельных коров.
Материалы и методы исследования. Исследования проводились на кафедре акушерства и патологии мелких животных имени А.П.Студенцова ФГБОУ ВО Казанская Государственная академия ветеринарной медицины, в ООО «Колос» Тетюшского района Республики Татарстан и ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности».
Методика получения антиплацентарной крови (АПК) заключалась в том, что лошади двукратно с интервалом 14 дней подкожно вводили плацентолизат в дозе по 20 мл, содержащий части котиледонов и карункулов матки коров, а через 14 дней после повторного введения брали кровь из яремной вены.
На первом этапе исследований для получения плацентолизата, содержащего части котиледонов и карункулов, использовали матку с содержимым после забоя 3-х здоровых коров с 3, 4 и 5 месячной беременностью.
Матки коров отделяли от жировой ткани и вскрывали (рис. 1).
Для получения карункулов и котиледонов было проведено полное вскрытие матки и удаление плода с околоплодной жидкостью.
Получение материала из матки коровы в 3 месяца беременности: плод (3 мес.) – его длина составляла 15 см, массой 145 г, полости тела плода закрыты, все органы сформированы и имели четкие очертания, живот незначительно увеличен. Получены кусочки карунку-лов и котиледонов общей массой 120 г.
Получение материала из матки коровы в 4 месяца беременности: плод (4 мес.) – его длина составляла 24 см, массой 170 г. Полос- ти тела плода закрыты, волосяной покров отсутствует. Кусочки карункулов и котилединов общей массой 350 г.
Получение материала из матки коровы в 5 месяца беременности: плод (5 мес.) – его длина составляла 39 см, массой 320 г. Полос- ти тела плода закрыты. Кусочки карункулов и котилединов общей массой 850 г.
Карункулы матки коров имели выпуклые полукруглые формы, а каждый котиледон содержал главную ветвь, состоящую из пупочных кровеносных сосудов (рис.1 б, в, г).
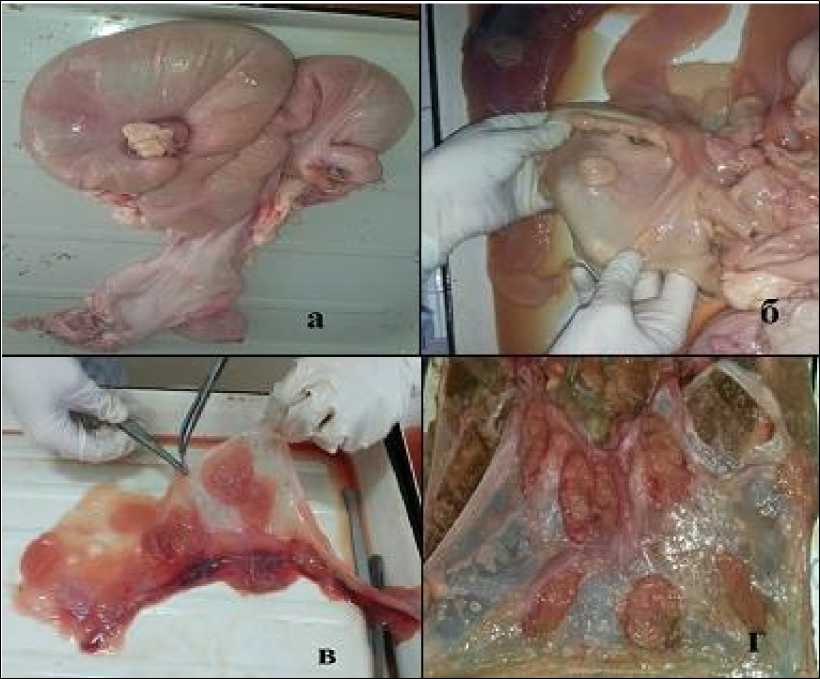
Рисунок 1 - Подготовка материала для получения плацентолизата а – отделение от жировой ткани и вскрытие матки; б – карункулы в матке коров (беременность 3 месяца); в – котиледоны в хорионе (беременность 4 месяца); г – котиледоны в хорионе (беременность 5 месяцев).
Для получения плацентолизата брали 50 г кусочков карункулов и котиледонов и тщательно растирали в чашке пестиком, растворяя их в 20 мл теплого (+200С) физиологического раствора натрия хлорида. Затем фильтровали в течение 1 часа.
Полученный путем фильтрации плацен-толизат вводили лошадям опытной группы (N=3) подкожно в области шеи двукратно с интервалом 14 дней в дозе по 20 мл и сравнивали с состоянием животных контрольной группы (N=3), которым подкожно в области шеи двукратно с интервалом 14 дней вводили физиологический раствор в дозе по 20 мл.
До и после введения плацентолизата и физиологического раствора у опытной и контрольной групп животных брали кровь для гематологического исследования. После второго введения плацентолизата у лошади с хо- рошими показателями иммунологического ответа (с высокими показателями антител класса IgM, IgA, IgG) из яремной вены брали антиплацентарную кровь, которую консервировали раствором натрия цитрата. Для этого в стерильную посуду наливали 10%-ный раствор натрия цитрата из расчета 10 мл на 100 мл крови. Перед введением антиплацентар-ную кровь подогревали в водяной бане.
При лечении коров (N=5) с послеродовыми акушерско-гинекологическими заболеваниями АПК вводили подкожно в области шеи в дозе 10 мл, двукратно с интервалом 6 дней.
С профилактической целью послеродовых заболеваний новотельным коровам (N=5), вводили подкожно однократно в дозе 10 мл.
Результаты исследования. За состоянием животных опытной и контрольной групп вели постоянное наблюдение. У этих групп, физиологические показатели животных (общее состояние, аппетит, пульс, дыхание, температура тела) не отличались и были в пределах нормы.
Результаты гематологического исследования крови лошадей опытной и контрольной групп до и после введения плацентолизата и физиологического раствора отражены в таблице 1.
Таблица 1- Гематологические показатели крови лошадей в опытной и контрольной группах
|
Показатели |
Границы нормы |
Опытная группа (введение плацентолизата) |
Контрольная группа (введение физраствора) |
|||||
|
До введения |
После 1-го введения |
После 2-го введения |
До введения |
После 1-го введения |
После 2-го введения |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
Лейкоциты |
6,0 12,0 |
9,7±1,21 |
10,4±0,36 |
9,9±0,55 |
9,13±0,46 |
9,37±0,11 |
6,50±0,42 |
|
|
Лимфоциты |
3,0-8,6 |
4,27±0,70 |
2,93±0,47 |
2,33±0,29* |
4,30±0,04 |
3,50±0,14 |
1,47±0,11 |
|
|
Моноциты |
0,2-1,3 |
0,13±0,04 |
0,17±0,04* |
0,17±0,04 |
0,17±0,08 |
0,13±0,04 |
0,13±0,04 |
|
|
Гранулоциты |
1,0-4,3 |
5,33±0,63 |
7,07±0,36 |
7,40±0,80 |
4,70±0,07 |
5,57±0,11* |
4,93±0,60 |
|
|
Эритроциты |
6,0 12,0 |
6,93±0,35* |
7,90±0,72 |
7,68±0,67 |
9,70±0,42 |
8,99±0,05 |
9,65±0,06 |
|
|
Гемоглобина |
100180 |
136,0±8,60 |
146,0±13,8 |
142,7±10,35 |
173,3±1,08 * |
170,3±2,16 |
178,3±2,16 |
|
|
Тромбоциты |
100600 |
151,0±37,5 3 |
272,7±36,58 |
234,3±31,81 |
122±2,12 |
122,7±2,48* |
197,0±5,66 |
|
|
Лейкоформула |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
Лимфоциты |
25-60 |
43,8±3,29 |
28,6±3,24 |
23,5±0,37 |
46,33±0,82 |
39,37±1,31* |
22,50±0,37 |
|
|
Моноциты |
4-11 |
1,20±0,57* |
1,60±0,25 |
1,50±0,25 |
1,40±0,07 |
1,27±0,04 |
1,43±0,18 |
|
|
Гранулоциты |
16-36 |
55,0±3,03 |
69,83±3,36* |
74,6±4,01 |
50,3±0,83 |
58,43±0,68 |
76,13±0,74 |
|
Примечание: * – Р < 0,05.
Из данных таблицы видно, что у лошадей опытной группы после первого введения плацентолиза наблюдалось увеличение лейкоцитов на 7,2% (с 9,7±1,21 до 10,4±0,36), а после повторного введения – на 2,6% (с 9,7±1,21 до 9,9±0,55). В контрольной группе животных после первого введения физиологического раствора количество показателя лейкоцитов увеличилось на 2,6% (с 9,13±0,46 до 9,37±0,11), а после повторного введения снизилось на –28,8% (с 9,13±0,46 до 6,50±0,42). Лейкоциты вырабатывают антитела – белковые частицы, поражающие любые чужеродные микроорганизмы, попавшие в кровь организма лошадей. Количество моноцитов у животных опытной группы после первого введения плацентолизата увеличилось на 30,7% (с 0,13±0,04 до 0,17±0,04), а после повторного введения оставалось без изменений. У животных контрольной группы уровень моноцитов снизился на 23,5% (с 0,17±0,08 до 0,13±0,04), а после повторного введения не изменился. У животных опытной группы после первого введения плацентоли-зата количество гранулоцитов увеличилось на 33,4% (с 5,33±0,63 до 7,07±0,36), а после повторного введения – на 39,6% (с 5,33±0,63 до
7,40±0,80). В контрольной группе количество гранулоцитов после первого введения физиологического раствора повысилось на 18,5% (с 4,70±0,07 до 5,57±0,11), а после повторного введения – на 4,9% (с 4,70±0,07 – до 4,93±0,60).
Среднее содержание гемоглобина, эритроцитов и тромбоцитов в период опытов оставалось в пределах физиологической нормы. Однако после повторного введения пла-центолизата в опытной группе животных отмечалось увеличение в лейкоцитарной формуле показателя гранулоцитов на 35,6% (с 55,00±3,03 до 74,57±4,01), моноцитов – на 25% (с 1,20±0,57 до 1,50±0,25). Это свидетельствует о специфическом взаимодействии антител с антигенами в организме у опытных животных (повышение гранулоцитов сопровождалось увеличением количества лейкоцитов).
При изучении терапевтической эффективности было установлено, что использование подкожного введения антиплацентарной крови в дозе 10 мл двукратно с интервалом 6 дней при комплексном лечении коров с послеродовыми эндометритами сроки выздоровления в опытной группе (N=5) сокраща- лись на 1-2 дня, чем при лечении коров в контрольной группе (N=5) без применения АПК.
При однократном подкожном введении АПК новотельным коровам в опытной группе (N=5) в дозе 10 мл у животных наблюдалось 100%-ное отделение последа в течение 4-5 часов, а в контрольной группе коров (N=5), где АПК не вводились, самостоятельное отделение последа наблюдалось только у 80% животных. Проявления послеродовых заболеваний (эндометриты, субинволюция матки) у коров опытной и контрольной групп не отмечались.
Заключение. Применение антиплацен-тарной крови при лечении коров с послеродовыми эндометритами позволило сократить сроки лечения и снизить экономические затраты. Использование АПК сразу после выведения плода привело отделению последа у всех опытных коров.
Результаты исследования свидетельст- вуют об эффективности применения АПК при лечении и профилактике акушерско-гинекологических заболеваний у коров.
Резюме
В статье описываются метод получения антиплацентарной крови (АПК), результаты лечения и профилактики акушерско-гинекологических заболеваний коров с применением антиплацентарной крови.
Список литературы Получение и применение антиплацентарной крови при акушерско-гинекологических заболеваниях коров
- Титова, В. Воздействие на инволюцию матки у коров квантовым методом/В. Титова, Ф. Насибов, Е. Байтлесов, В. Катюков, Г.Власова/Молочное и мясное скотоводство. -2006. -№1, C.24-25.
- Шипилов, В. С. Физиологические основы профилактики бесплодия коров. М., 1977, -288 с.
- Gibert, R.O., Ship ST, Guard CL, Erb HN, Frajblat M: Prevalence of endometritis and its effects on reproductive performance of dairy cows. Therigenology 2005, № 64: 1879-1888 p.
- Cunningham, J., 2002. Physiology of reproductive system. In: textbook of veterinary physiology, 3rd ed., Webster B saunder Co., Philadelphia, pp: 402-403.


