Получение исходного материала растений винограда методом in vitro
Автор: Сегет О.Л.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 11, 2025 года.
Бесплатный доступ
Цель исследований – выявить оптимальные параметры получения оздоровленного посадочного материала винограда категории «Исходные» в культуре in vitro для разработки улучшенной технологии создания базисных маточников. Экспериментальное исследование было осуществлено на базе селекционнобиотехнологической лаборатории ФГБНУ СКФНЦСВВ (г. Краснодар). Годы проведения исследований – 2021–2024 гг. В качестве объектов для изучения были взяты следующие подвои винограда: Берландиери × Рипариа Кобер 5ББ, Берландиери × Рипариа SО4, Берландиери × Рупестрис Рюгжери 140, Рипариа × Рупестрис 10114; питательные среды, содержащие минеральные соли по прописи Мурасиге и Скуга (МС), в концентрациях 1/2 МС, 1/3 МС, и 1/4 МС. Были использованы общепринятые методы исследований в практике клонального микроразмножения растений: стерилизация исходного материала, введение в культуру in vitro, собственно клональное микроразмножение, укоренение in vitro с последующей адаптацией к условиям in vivo. На этапе микроразмножения виноградного подвоя Берландиери × Рипариа Кобер 5ББ для этапа укоренения или этапа, предшествующего укоренению, подходит среда 1/2 МС с добавлением 6БАП (0,5 мг/л) и ИУК (0,5 мг/л). Побеги на данной среде формировались самые длинные, средняя длина побегов составляла 4,37 см, количество листьев – 3,25 шт., площадь листовой поверхности – 3,88 см2. Среду с пониженным содержанием макросолей часто используют для укоренения растений, в нашем случае на среде также хорошо формировались корни. В среднем количество корней составило – 4,15 шт., длиной – 8,57 см. В остальных вариантах развивались медленно растущие побеги с укороченными междоузлиями. Питательная среда 1/2 МС + ИУК 0,5 мг/л + 0,5 мг/л 6БАП может быть использована на этапе размножения подвоев Кобер 5 ББ, SО4, Рюгжери 140, 10114 способом черенкования, а также на этапах элонгации и укоренения.
Виноград, подвой винограда, 6-БАП, ИУК, оздоровление винограда, растения категории «Исходные»
Короткий адрес: https://sciup.org/140313037
IDR: 140313037 | УДК: 634.8.034 | DOI: 10.36718/1819-4036-2025-11-3-14
Текст научной статьи Получение исходного материала растений винограда методом in vitro
Введение. Виноград – одна из значимых сельскохозяйственных культур Российской Федерации, продуктивность и срок жизни, которой зависит от качественного посадочного материала.
В России свыше 130 тыс. га занято виноградниками, более 30 % основных площадей виноградных насаждений расположены в Краснодарском крае.
В рамках подпрограммы «Развитие виноградарства, включая питомниководство» на 2017– 2030 гг. запланировано ежегодное расширение площадей на 5 тыс. га, занятых многолетними виноградными насаждениями. Для успешной реализации целей программы годовая потребность Российской Федерации в посадочном материале винограда оценивается в объеме более 100 млн штук [1].
В последние годы отечественное производство саженцев обеспечивало в среднем половину от необходимого объема. Нехватка компенсировалась закупками посадочного материала за рубежом, в частности из Италии, Сербии, Австрии и Франции.
Завозимый посадочный материал слабо адаптирован к жестким агроэкологическим условиям умеренно континентального климата в южных регионах России, нередко инфицирован, что сказывается на снижении продуктивности и уменьшении срока эксплуатации насаждений.
На виноградниках, заложенных инфицированными, слабоадаптированными саженцами, уменьшается продолжительность жизни насаждений в 1,5–2,0 раза – до 15–20 лет вместо 40 лет в Европе, снижается продуктивность на 20–30 %, увеличиваются капитальные вложения на перезакладку виноградников.
В России в настоящее время посадочный материал производится низших категорий качества, без инструментального контроля фито-санитарного состояния саженцев.
Согласно Федеральному закону № 454 «О семеноводстве» от 30.12.2021, к посадочному материалу винограда высших категорий качества относятся «Исходный» и «Базисный». В настоящее время недостаточно сформировано научнометодическое и технологическое обеспечение процесса получения посадочного материала этих категорий. Это обуславливает актуальность и значимость для отрасли виноградарства и виноделия предлагаемого исследования по выявлению оптимальных параметров получения оздоровленного посадочного материала винограда категории «Исходные» в культуре in vitro для разработки улучшенной технологии создания базисных маточников [2].
Начальным шагом в создании безвирусного посадочного материала служит проверка исходных растений на наличие вирусов. Для этой цели используются два метода диагностики, один из которых должен быть особенно чувствительным, как, например, иммуноферментный анализ (ИФА) или полимеразная цепная реакция (ПЦР). Это позволяет более точно выявлять вирусные инфекции, даже в тех случаях, когда растения внешне выглядят здоровыми. Несмотря на высокую точность этих методов, существует вероятность наличия скрытых инфекций, когда вирусы могут находиться в растениях в неактивной форме или в низкой концентрации, что затрудняет их обнаружение. В подобных ситуациях требуется комплексное оздоровление растений [3].
В питомниках для оздоровления растений обычно применяются различные виды терапии: хемотерапия и термотерапия в сочетании с биотехнологическими методами.
Биотехнологические методы, основанные на использовании апикальных меристем, представляют собой важный инструмент в клеточной и молекулярной биологии, особенно в контексте выращивания безвирусных растений. Апикальная меристема - это ткань, расположенная в «конусе нарастания» (обеспечивает рост стебля в длину) и в зоне деления корня (обеспечивает рост корня в длину). Апикальная меристема способствует удлинению растения как вверх, так и вниз. Основная идея применения апикальных меристем заключается в том, что в этих тканях, как правило, отсутствуют вирусные частицы и другие патогены. Это связано с тем, что меристемные клетки активно делятся, а проводящие системы (флоэма и ксилема), через которые вирусы и другие патогены могут распространяться, в этой области еще не развиты. Однако существует возможность медленного проникновения вирусов через плазмодесмы - маленькие каналы, соединяющие соседние клетки и позволяющие обмениваться веществами и сигналами. Для получения здоровых новых растений исследователи часто используют метод микроклонального размножения, который включает изоляцию апикальных меристем, их рост в искусственных условиях на питательных средах и в конечном итоге акклиматизацию полученных растений. Этот подход позволяет не только получить чистый от вирусов посадочный материал, но и сохранить генетическую идентичность исходного растения [4].
Инактивация вирусных частиц в растениях является важной проблемой, особенно в сельском хозяйстве. Существуют различные методы, которые помогают справиться с вирусными инфекциями, и каждый из них имеет свои плюсы и минусы.
Гидротермальная обработка заключается в погружении пораженных частей растения в горячую воду при определенной температуре и времени. Этот метод эффективен для некоторых вирусов, но требует точного контроля температуры, чтобы избежать повреждения тканей растения.
Суховоздушный метод - растения помещают в камеру с контролируемой температурой, где происходит нагревание воздуха. Этот метод может быть более удобен, но требует более длительного времени обработки [5].
Применение химических веществ . Для инактивации вирусов могут использоваться различные химические реагенты, такие как детергенты, спирты или другие дезинфицирующие средства. Эти методы могут быть эффективными в зависимости от типа вируса, но необходимо учитывать их возможное негативное влияние на растения [6].
Молекулярные технологии , например использование РНК-интерференции или генетическая модификация, применяются для создания устойчивых к вирусам сортов [7].
Существуют различные гипотезы, объясняющие механизм освобождения растений от вирусов в процессе термообработки.
Денатурация вирусных белков - высокие температуры могут вызывать денатурацию белков вируса, что приводит к их инактивации. Вирусы состоят из белков и нуклеиновых кислот, и изменения в структуре белков могут сделать вирусы неспособными к заражению.
При термообработке может происходить разрушение клеточных структур, которые служат «помощниками» для вируса при его размножении. Например, некоторые белки, которые взаимодействуют с вирусами, могут быть денатурированы или разрушены.
Нагревание может активировать физиологические механизмы защиты растения, такие как синтез инфекционных белков, которые могут затруднить репликацию вируса. Это может повышать устойчивость растения к вирусным инфекциям [8].
Термообработка может помочь снизить количество вирусов, присутствующих в растениях, что делает дальнейшую инфекцию менее вероятной. Снижение вирусной нагрузки может помочь растению справиться с оставшимися вирусами с помощью своих защитных механизмов.
Элиминация инфицированных тканей – неконтролируемый рост некоторых растений может привести к образованию волокнистых или мертвых тканей, где вирусы могут размножаться. Термообработка может способствовать укреплению и восстановлению здоровых тканей, что поможет предотвратить дальнейшее заражение [9].
Несмотря на существование различных теорий, ни одна из них не дает исчерпывающего объяснения всем эмпирическим данным, полученным в ходе термотерапии растений.
В настоящее время одним из наиболее перспективным способов оздоровления растений считается выделение апикальных меристем с последующей регенерацией растений и их клональным микроразмножением в стерильных условиях. Метод базируется на получении генетически идентичных исходному образцу растений бесполым путем в условиях in vitro . В основе этого метода лежит уникальная способность растительной клетки проявлять тотипотентность, то есть способность давать начало целому растению под влиянием экзогенных воздействий.
Однако внедрение данного метода в промышленных масштабах связано с определенными сложностями. В процессе микроклональ-ного размножения растений in vitro следует учитывать множество факторов, таких как тип эксплантов, генетическая предрасположенность и специфические требования к питательным средам. Разные экспланты, такие как побеги, листья, корни или меристемы, могут иметь уникальные потребности в гормонах, углеводах и других питательных веществах, что делает необходимость разработки специализированных питательных сред. К примеру, некоторые экспланты имеют потребность в повышенном уровне ауксинов для стимуляции корнеобразо-вания, в то время как другие лучше развиваются на средах с высоким содержанием цитокининов для индукции побегообразования [10].
Кроме того, генотипические различия между сортами могут значительно влиять на результаты регенерации; растения одного вида, но с разными генотипами, могут реагировать совер- шенно иначе на одно и то же вещество или концентрацию питательных веществ. Поэтому исследование оптимальных питательных сред для конкретного вида или сорта – это необходимый шаг для эффективного микроклонального размножения растений [11].
Также на первом этапе клонального микроразмножения растений возникают сложности – высокий уровень контаминации эксплантов и продуцирование некоторыми растениями избыточного количества фенольных соединений, которые снижают результативность инициации.
Поэтому важно правильно выбрать период отбора эксплантов для введения в культуру, так как имеет значение и возраст, и физиологическое состояние материнского растения, в том числе прохождение фаз органо- и морфогенеза конкретной культуры. Для одних культур считается оптимальным вычленение апикальных меристем из пророщенных в лабораторных условиях почек – март, апрель, для других период активного роста – май, июнь [12].
Для успешной регенерации в культуре in vitro важное значение имеет размер экспланта. Так, для целей микроразмножения растений можно использовать экспланты большего размера – 0,5–2,0 мм, для целей оздоровления растений от вирусных и фитоплазменных заболеваний необходимо вычленять верхушки размером не более 0,1–0,2 мм.
Следующий шаг – это выбор стерилизующего вещества, его концентрация и продолжительность обработки. В качестве средств для поверхностной обработки эксплантов используют соединения из различных групп. Для обработки эксплантов плодовых культур и земляники часто используют хлорсодержащие вещества, такие как гипохлорит натрия и кальция, хлорамин. Очень часто для дезинфекции эксплантов использовали ртутьсодержащие вещества: сулему, йодид ртути, мертиолят. В настоящий момент их использование запрещено.
Иногда для уничтожения поверхностной грибной микрофлоры используют фунгициды «Бенлат», «Превикур», «Беномил», «Ридомил-Каптан». При контаминации эксплантов внутренней инфекцией, применяют различные антибиотики (цефотаксим, карбенициллин, стрептомицин). Скрытые инфекции способны проявляться не моментально, а спустя некоторое время после начала культивирования; при этом они могут быть визуально незаметны, но нега- тивно воздействовать на рост и развитие эксплантатов.
В связи с этим разработка индивидуальной методики стерилизации, включающей подбор препаратов, их концентраций и времени обработки с целью достижения максимальной стерильности культуры при минимальном угнетении эксплантов, остается актуальной.
Успех микроклонального размножения в значительной степени зависит от грамотного подбора компонентов питательной среды. Ключевым фактором является сбалансированное соотношение и концентрация регуляторов роста (биологически активных веществ), входящих в состав среды.
Анализ научных работ в области клонального микроразмножения растений показал, что чаще всего используют модифицированные среды Mурасиге и Скуга (MS), Driver and Kuniyu-ki (DKW), WPM, Шенка и Хильдебрандта (SH), с различными вариациями гормональных веществ, витаминов, макроэлементов, сахарозы. Оптимизация состава среды под конкретный генотип растения имеет особую важность, так как даже в составе одного вида у растений может наблюдаться различная реакция [13].
На этапе укоренения растений-регенерантов in vitro также первостепенное значение имеет состав питательной среды, тип и концентрация стимулятора корнеобразования. Необходимо отметить, что большинство исследователей использовали для укоренения растений-регенерантов различные варианты питательной среды Мурасиге и Скуга (или разбавленную в 2–3 раза MS), с содержанием сахарозы 15 мг/л и исключением мезоинозита.
Ученые из Греции успешно повышали уко-реняемость подвоя GF-677 с помощью замены Fe-EDTA на Fe-EDDHA.
В качестве индукторов ризогенеза чаще всего используют ауксины: β-индолилмасляную кислоту (β-ИМК), β-индолилуксусную кислоту (β-ИУК), φ-нафтилуксусную кислоту (φ-НУК) в концентрациях от 0,1 до 3,0 мг/л.
В различных протоколах размножения in vitro, разработанных ранее для Vitis spp., требования к составу питательных сред сильно варьировались. Однако одними из самых распространенных и широко используемых являются среда MS (Murashige и Skoog, 1962) и среда 1/2 MS, которые оказывали эквивалентное воздействие на пролиферацию побегов V. rotundifolia при культи- вировании in vitro. Похожими свойствами обладала среда WPM, которая использовалась для культивирования древесных растений [14].
Mhatre et al. (2000) сообщили о совершенно другом протоколе, в котором на различных стадиях размножения V. vinifera in vitro требовались как NN, так и MS в модифицированной форме.
В своем следующем исследовании Mhatre et al. (2000) сообщили, что для размножения побегами V. vinifera оптимальным цитокинином был признан BAP (6-бензиламинопурин). Даже среди двух сортов одного и того же мускатного винограда концентрация BAP в 1,13 мг/л была наилучшей для сорта Карлос, в то время как для сорта Фрай требовалась 4-кратная концентрация BAP (4,5 мг/л) [15].
Одним из самых распространенных гормонов, широко использующихся в методах выращивания, – это салициловая кислота (СК). Она может снижать чувствительность растений к стрессам окружающей среды, регулируя рост и развитие растений, фотосинтез, цветение, дыхание и поглощение ионов, антиоксидантную защитную систему.
Регуляторы роста растений обычно играют важную роль в определении того, как растения должны реагировать на различные стрессы, тем самым улучшая физиологическую адаптацию к неблагоприятным условиям [16].
Регуляторы роста регулируют механизмы физиологического ответа на стресс различными способами, регулируя биохимические, физиологические и молекулярные процессы, тем самым помогая в активации адаптивных механизмов, положительно регулируя уровни транскрипции в клетках и способствуя надлежащему количеству белков, смягчающих стресс, элементов транскрипции и генов, ответственных за первичный метаболизм.
Для роста растений важны ауксины, поскольку они влияют на различные физиологические процессы, такие как удлинение клеток, фототропизм, гравиотропизм, гидротропизм, поддержание апикального доминирования и контроль роста корней. Ауксины могут влиять на различные аспекты роста и развития клеток, взаимодействуя с другими растительными гормонами. Кроме того, использование ауксина может увеличить размер ягод, урожайность и запас углерода, замедлить накопление сахара, более синхронизированное созревание и задержать созревание плодов и ягод, что может быть полезно для продления времени сбора урожая и переработки фруктов на желаемой стадии [17].
Кроме того, на данном этапе важно подобрать интенсивность освещения и качественный состав светового потока, так как от этого зависят процессы формирования надземной части растений и корнеобразования.
Опасения, касающиеся изменений фенотипа или генотипа растений при соблюдении параметров основных методов микроклонального размножения, обычно не находят подтверждения. В то же время некоторые исследователи отмечают положительные эффекты. Например, виноградные растения, полученные in vitro , демонстрируют повышенную устойчивость к морозам, в том числе весенним, обладают мощной корневой системой и большей силой роста. Трехлетние кусты в виноградниках Дижона дали обильный урожай высокого качества. Такие преимущества безвирусного материала винограда, полученного культурой меристем, отмечаются в работах T. Sakurai, K. Takei, A. Harado, A. Deloire, M. Charpentier, M. Barlass et al., которые рекомендуют этот метод для промышленного питомниководства, особенно для создания маточных насаждений.
Микроклональное размножение представляет собой эффективный метод воспроизводства растений, особенно для сортов и подвоев, которые уже хорошо адаптированы к конкретным климатическим условиям. Важно отметить, что для полноценного развития микроклональ-ного размножения в России необходимо проводить исследования, направленные на создание и оптимизацию питательных сред, учитывающих генетические и физиологические особенности местных сортов [18].
Оптимизация питательных сред может включать в себя такие аспекты, как состав макро- и микроэлементов – разные растения могут требовать различного соотношения питательных веществ для оптимального роста и развития в условиях in vitro ; использование стимуляторов роста – подбор и тестирование гормонов, таких как ауксины и цитокинины, могут значительно повысить эффективность укоренения и прорастания; pH и осмотическое давление – оптимизация pH среды и осмотических условий также может влиять на усвоение питательных веществ растениями.
Таким образом, оптимизация питательной среды с учетом генотипических особенностей размножаемых сортообразцов является актуальной и требует дальнейших научных исследований в области биотехнологии растений.
Цель исследований – выявить оптимальные параметры получения оздоровленного посадочного материала винограда категории «Исходные» в культуре in vitro для разработки улучшенной технологии создания базисных маточников.
Задача: оптимизация минерального, гормонального состава питательных сред и их концентраций для оптимизации автотрофного питания пробирочных растений винограда в разрезе сортовой специфики.
Объекты и методы. В качестве объектов для изучения были взяты следующие подвои винограда: Берландиери × Рипариа Кобер 5ББ, Берландиери × Рипариа SО4, Берландиери × Рупестрис Рюгжери 140, Рипариа × Рупестрис 101-14; питательные среды, содержащие минеральные соли по прописи Мурасиге и Скуга (МС), в концентрациях 1/2 МС, 1/3 МС и 1/4 МС.
Опыт микроклонального размножения проводился по общепринятым методикам в лабораторных условиях ФГБНУ СКФНЦСВВ.
Для обеззараживания применяли следующие растворы: 70 %-й этиловый спирт, 3 %-й раствор перекиси водорода и 50 %-й хлорсодержащий раствор (время обработки меристем 5 мин и далее трехкратная промывка меристем дистиллированной водой). Размер меристем сортообразцов винограда для культивирования в условиях in vitro – 0,2 мм.
Введенные меристемы разместили в культуральную комнату, где поддерживались следующие условия: освещенность в диапазоне 2000– 3000 люкс, температура от 25 до 28 °C и влажность воздуха в пределах 70–75 %. На вариант опыта высаживали по 30 шт. меристем.
Статистическую обработку для морфометрических параметров развития проводили методом доверительных интервалов, при помощи «пакета анализа» программы MS Excel с доверительной вероятностью 95 % (α = 0,05).
Процесс получения исходных растений винограда с помощью метода in vitro состоит из следующих этапов (рис. 1–4).

Рис. 1. Выбор растения донора, отбор и стерилизация эксплантов, получение хорошо растущей культуры
Selection of a donor plant, selection and sterilization of explants, obtaining a well-growing culture


Рис. 2. Микроразмножение растений, получение максимального количества клонов Micropropagation of plants, obtaining the maximum number of clones

Рис. 3. Укоренение растений и адаптация к нестерильным условиям Rooting of plants and adaptation to non-sterile conditions

Рис. 4. Пикировка в кассеты, доращивание в условиях теплицы Picking into cassettes and growing in a greenhouse
Результаты и их обсуждение. Погружение эксплантов винограда в хлорсодержащий раствор (концентрация активного вещества 50 %,)
показало наиболее эффективный результат по обеззараживанию растительного материала (рис. 5).
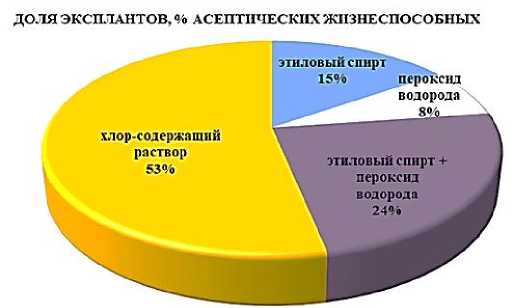
Рис. 5. Эффективность дезинфицирующих растворов для обработки эксплантов винограда (среднее по сортам)
Efficiency of disinfectant solutions for processing grape explants (average by varieties)
Доля асептически чистых и способных к дальнейшему росту эксплантов достигла 53 %. Применение этилового спирта и перекиси водорода показало меньшую выживаемость эксплантов винограда из-за недостаточной стерилизующей их способности.
Проведена оценка оптимального состава питательной среды на этапе введения в культуру in vitro эксплантов винограда сортов Кобер 5 ББ, SО4, Рюгжери 140, 101-14. Среды отличались содержанием макросолей: 1/2, 1/3, 1/4 состава по прописи Мурасиге-Скуга (табл. 1).
Таблица 1
Влияние состава питательных сред на морфогенетическую активность первичных апикальных меристем
The influence of the composition of nutrient media on the morphogenetic activity of primary apical meristems
|
Сорт |
Приживаемость меристем, % |
||
|
1/2 МС |
1/3 МС |
1/4 МС |
|
|
Берландиери × Рипариа Кобер 5ББ |
52,5 |
35,8 |
11,7 |
|
Берландиери × Рипариа SО4 |
68,4 |
26,5 |
5,1 |
|
Берландиери × Рупестрис Рюгжери 140 |
51,8 |
32,5 |
15,7 |
|
Рипариа × Рупестрис 101-14 |
67,0 |
31,8 |
1,2 |
|
НСР 0,05 |
3,2 |
1,9 |
2,9 |
Установлено, что лучше всего регенерация эксплантов проходит на среде, содержащей половинный состав солей по прописи Мурасиге– Скуга. Приживаемость на данной среде составляет от 51,8 до 68,4 %. На среде 1/3 МС приживаемость эксплантов составляла 26,5–35,8 %, что выше в сравнении со средой 1/2 МС в среднем по сортам на 28,3 %.
По результатам исследований видно, что с уменьшением концентрации солей в среде снижается уровень регенерации эксплантов. Так, приживаемость эксплантов на среде 1/4 МС сос- тавляла от 1,2 % у подвоя 101-14, 5,1 % у подвоя SО4, 11,7 % у подвоев Кобер 5 ББ, 15,7 % у Рюгжери 140.
На этапе микроразмножения виноградного подвоя Берландиери × Рипариа Кобер 5ББ проводилась оценка оптимального гормонального состава среды 1/2 МС. Из трех испытанных концентраций гормонов 6-БАП (0,5; 1,0; 1,5 мг/л), на фоне ауксина ИУК в концентрации 0,5 мг/л, лучшие показатели были на среде, содержащей 0,5 мг/л 6-БАП и 0,5 мг/л ИУК (табл. 2).
Таблица 2
Влияние гормонального состава среды на рост и развитие микропобегов подвоя Кобер 5ББ The influence of the hormonal composition of the environment on the growth and development of microshoots of the Kober 5BB rootstock
|
Концентрация гормона 6-БАП, мг/л |
Средняя длина стебля, см |
S листа, см2 |
Среднее число листьев, шт. |
Средняя длина корней, см |
Среднее число корней, шт. |
|
0,5 |
4,37 |
3,88 |
3,25 |
8,57 |
4,15 |
|
1,0 |
3,87 |
3,13 |
2,15 |
7,37 |
3,65 |
|
1,5 |
3,8 |
2,79 |
2,45 |
7,75 |
3,15 |
|
НСР 0,05 |
0,3 |
0,5 |
0,5 |
0,6 |
0,7 |
В данном варианте микропобеги раньше и активней начали свое развитие. Учет проводился через 25 дней после посадки. Побегообразование отсутствовало во всех вариантах опыта. Однако было отмечено, что в варианте на среде ½ МС + ИУК 0,5 мг/л + 6-БАП 0,5 мг/л сформировались самые длинные побеги. Средняя длина побегов составляла 4,37 см, количество листьев – 3,25 шт., площадь листовой поверхности – 3,88 см2. Среду с пониженным содержанием макросолей часто используют для укоренения растений, в нашем случае на среде также хорошо формировались корни. В среднем количество корней составило 4,15 шт., длиной – 8,57 см.
В остальных вариантах развивались медленно растущие побеги укороченными междоузлиями.
Таким образом, можно сделать вывод, что данный состав среды в большей степени подходит для этапа укоренения или этапа, предшествующего укоренению.
На этапе укоренения провели оценку влияния среды с добавлением ауксина и цитокинина (1/2 МС + ИУК 0,5 мг/л + 0,5 мг/л 6-БАП) на морфогенез микропобегов опытных подвоев винограда. Микропобеги подвоев высадили на питательную среду и спустя 45 сут провели оценку исследуемых показателей. Результаты представлены в таблице 3.
Таблица 3
|
Показатель |
Сортообразец |
НСР 0,05 |
|||
|
Кобер 5ББ |
SO4 |
Рюгжери 140 |
101-14 |
||
|
Длина побега, см |
7,32 |
4,34 |
5,16 |
5,34 |
1,56 |
|
Количество междоузлий, шт. |
6,18 |
4,26 |
4,88 |
5,05 |
1,24 |
|
Количество листьев, шт. |
5,8 |
3,8 |
3,4 |
3,1 |
1,53 |
|
Количество корней, шт. |
4,7 |
3,62 |
1,56 |
3,04 |
1,59 |
|
Длина корней, см |
10,7 |
3,8 |
3,4 |
3,1 |
2,65 |
Основные показатели роста микропобегов подвоев винограда (45 сут)
Main growth indicators of micro shoots of grape rootstocks (45 days)
По данным таблицы 3 видно, что наиболее длинные побеги формируются у подвоя Кобер 5 ББ – 7,32 см, у подвоев Рюгжери 140 и 101-14 – средняя длина побега составляла 5,16 и 5,34 см, у подвоя SO4 – 4,34 см. По количеству междоузлий лидирует Кобер 5ББ – 6,18 шт., у остальных подвоев количество междоузлий составляет 4,26–5,05 шт. на побег. Соответственно по количеству листьев сохраняется такая же тенденция: Кобер 5 ББ – 5,8 шт., у остальных подвоев – 3,1–3,8 шт.
Количество образующихся на среде корней в среднем составляет 4,7 шт. у Кобер 5 ББ, 3,62 и
3,04 шт. у подвоев SO4 и 101-14, наименьшее количество корней формировалось у подвоя Рюгжери 140 – 1,56 шт. Наиболее длинные корни формировались у подвоя Кобер 5ББ – 10,7 см, у остальных подвоев средняя длина варьировала в пределах 3,1–3,8 см.
Резюмируя, можно сделать вывод, что питательная среда 1/2 МС + ИУК 0,5 мг/л + 0,5 мг/л 6-БАП может быть использована на этапе размножения подвоев Кобер 5 ББ, SО4, Рюгжери 140, 101-14 способом черенкования, а также на этапах элонгации и укоренения (Рис.).

Рис. 6. Развитие микрорастений подвоя винограда Берландиери × Рипариа Кобер 5ББ на питательной среде 1/2 МС + ИУК 0,5 мг/л + 0,5 мг/л 6-БАП Development of micro plants of grape rootstock Berlandieri × Riparia Kober 5BB on a nutrient medium 1/2 MS + IAA 0.5 mg/l + 0.5 mg/l 6-BAP
Заключение. Выявлено, что на этапе микроразмножения виноградного подвоя Берландие-ри × Рипариа Кобер 5ББ для этапа укоренения или этапа, предшествующего укоренению, в большей степени подходит среда 1/2 МС с добавлением 6-БАП (0,5 мг/л) и ИУК (0,5 мг/л). Побеги на данной среде формировались самые длинные, средняя длина побегов составляла 4,37 см, количество листьев – 3,25 шт., площадь листовой поверхности – 3,88 см2. Среду с пониженным содержанием макросолей часто используют для укоренения растений, в нашем случае на среде также хорошо формировались корни. В среднем количество корней составило
4,15 шт., длиной – 8,57 см. В остальных вариантах развивались медленно растущие побеги с укороченными междоузлиями.
Установлено, что питательная среда 1/2 МС + ИУК 0,5 мг/л + 0,5 мг/л 6-БАП для Кобер 5 ББ, SО4, Рюгжери 140, 101-14 при размножении способом черенкования может быть использована на этапе размножения подвоев, а также на этапах элонгации и укоренения. Лучшие показатели были у подвоя Кобер 5 ББ: побеги длиной 7,32 см, количество междоузлий и листьев – 6,18 и 5,8 шт. соответственно, среднее количество корней – 4,7 шт., средняя длина корней – 10,7 см.


