Получение межвидовых биопленок дрожжей вида Saccharomyces cerevisiae и бактерий вида Streptococcus thermophilus методом ко-флокуляции
Автор: Редкозубов С.В., Чурюмов А.А., Ивашова В.И., Лагунова В.К., Ерёменко П.С., Егошина Е.А.
Журнал: Медицина и биотехнологии @medbiosci
Рубрика: Биотехнология
Статья в выпуске: 4 т.1, 2025 года.
Бесплатный доступ
Введение. Кариес – одно из самых распространенных стоматологических заболеваний. Основной причиной данной патологии является нарушение видового состава микробиоты ротовой полости. Главным возбудителем кариеса является бактерия Streptococcus mutans, начинающая доминировать в составе пелликулы зубов среди представителей своего рода с выделением молочной кислоты, разрушающей целостность эмали. Прикрепление патогенных микроорганизмов к зубному налету происходит, как и у представителей нормофлоры, за счет белков – лектинов. Это создает перспективу для внедрения в микробиомный состав ротовой полости непатогенных, не продуцирующих кислоту микроорганизмов путем искусственного их включения в состав пелликулярной микрофлоры. Цель исследования – создать метод включения в микробиом ротовой полости микроорганизмов, не продуцирующих кислоту, основанный на ко-флокуляции дрожжей и стрептококков. Материалы и методы. В качестве микроорганизмов, не продуцирующих кислоту, были выбраны дрожжи Saccharomyces cerevisiae I-224 и Saccharomyces boulardii. Как продуцент внеклеточного экзополисахаридного матрикса общей биопленки использовали Streptococcus thermophilus var. lactis. Биомассу дрожжей наращивали на стерильном виноградном сусле, биомассу стрептококков – на жидкой среде YPD при 26 °С в течение пяти суток. После раздельного культивирования молочного стрептококка и винных дрожжей производили декальцификацию культур методом центрифугирования при 4 000 об/мин и обработкой осадка 0,3 моль/л раствором оксалата калия. Осажденную биомассу микробов соединяли и подвергали флокулированию добавлением 1,0 % раствора хлорида кальция. Эффективность формирования ко-флокулятов устанавливали микроскопически при увеличении × 900 после окраски препарата метиленовым синим. Результаты исследования. Дрожжи Saccharomyces cerevisiae I-224 активно интегрировались в общий полисахаридный матрикс, о чем свидетельствовало просветление пространства вокруг ко-флокулята и отсутствие свободных клеток стрептококков и дрожжей. Слабо флокулирующие пробиотические дрожжи Saccharomyces boulardii почти не образовывали единых с бактериями флокулятов. Обсуждение и заключение. Разработан оригинальный метод, позволяющий создавать межвидовые конгломераты бактерий и дрожжей, объединенных общим экзополисахаридным матриксом. Метод открывает перспективу создания орального пробиотика, снижающего кислотную нагрузку на эмаль зубов, поскольку позволяет частично заменить кислотопродуцирующие бактерии на возбудителей спиртового брожения.
Межвидовые биоплёнки, Saccharomyces cerevisiae, Streptococcus thermophilus, лектины, экзополисахарид
Короткий адрес: https://sciup.org/147252585
IDR: 147252585 | УДК: 60:602.3:582.282.23 | DOI: 10.15507/3034-6231.001.202504.376-382
Текст научной статьи Получение межвидовых биопленок дрожжей вида Saccharomyces cerevisiae и бактерий вида Streptococcus thermophilus методом ко-флокуляции
EDN:
В естественных условиях обитания микроорганизмы чаще встречаются в виде биопленок, чем в виде отдельных клеток. Биопленки могут покрывать абиотические поверхности, органы и ткани живых организмов. К факторам, позволяющим микроорганизмам образовывать биопленки, относятся в том числе и белки - лектины, входящие в состав клеточной стенки бактерий и грибов. В зависимости от вида микроорганизма лектиновый фактор межклеточного взаимодействия может иметь различные условия реактивности, в том числе требовать присутствия катионов кальция и/или остатков маннозы для эффективного межклеточного слипания [1]. Из литературных данных известны три группы генов лек-тиновой флокуляции: маннозо-зависимые Flo1 и NewFlo, а также нечувствительный к маннозе (MI) [2].
Известный механизм флокуляции саха-ромицетных дрожжей представляет собой белково-углеводную модель. Флокулирующие дрожжевые клетки обладают одновременно углеводными α-маннановыми остатками на поверхности клеточной стенки, и белковыми зимолектинами (лектины дрожжей) – рецепторами α-маннановых остатков, также входящих в состав наружного манно-протеинового слоя клеточной стенки грибков. В литературе высказано предположение, что взаимодействие зимолектинов с маннановыми компонентами приводит к флокуляции в присутствии ионов кальция, необходимых для правильной конформации зимолектинов [5].
Условно-патогенные стрептококки ротовой полости способствуют развитию кариеса, а также являются возбудителями молочнокислого брожения. Видовой состав в условиях нормобиоты чаще представлен Streptococcus salivarius (подвидом которого является лактококк S. thermophilus), S. mitis, S. oralis [3]. S. mutans и S. sanguis обнаруживаются в большом количестве в ротовой полости в случае повреждения эмали зубов. Представители вида S. salivarius известны способностью синтезировать внеклеточные полисахариды, в том числе маннаны, при утилизации моно- и дисахаридов. Отметим, что внеклеточный экзополисахарид стрептококка, не ассоциированный с клеточной стенкой в виде капсулы, на 1/4 состоит из остатков маннозы, что позволяет ему участвовать в формировании межвидовой биопленки путем взаимодействия с зимолектинами в присутствии катионов кальция. Экзопо-лисахариды способствуют прикреплению к зубной эмали других представителей микробиоты полости рта (явление ко-аггре-гации) и благоприятствуют увеличению стабильности общего полимерного матрикса биопленки [4].
Таким образом, возникает возможность включения возбудителей спиртового брожения в состав биопленки ротовой полости вместе с непатогенными представителями оральной микробиоты, продуцирующими экзо-полисахаридный матрикс, при их совместной флокуляции, что будет способствовать снижению кислотной нагрузки на зубную эмаль. Цель исследования – разработать метод ко-флокуляции дрожжей вида Saccharomy-ces cerevisiae и бактерий рода Streptococcus thermophilus var. lactis в общем экзополиса-харидном матриксе.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения эксперимента был взят штамм осадочных винных дрожжей из Коллекции микроорганизмов виноделия лаборатории микробиологии Всероссийского национального научно-исследовательского института виноградарства и виноделия «Магарач» Национального исследовательского центра «Курчатовский институт» вида Saccharomyces cerevisiae , каталожный номер I-224, образующий осадок в виде крупных флокул. Негативным контролем служили нефлокулирующие пробиотические дрожжи Saccharomyces boulardii из препарата «Энтеростим Форте» (Индия). В качестве продуцента экзополисахаридного матрикса применяли бактериальный штамм S. thermophilus , выделенный из коммерческой молочной закваски Danisco CHOOZIT TA 45 (Франция). Для наращивания биомассы дрожжи культивировали при температуре 26 °С в течение пяти суток на стерильном виноградном сусле столовых сортов (массовая концентрация сахаров - 180,0 г/л, pH - 3,5); бактерии культивировали при температуре 26 °С в течение пяти суток на среде YPD (г/л: глюкоза – 20,0, пептон – 20,0, дрожжевой экстракт – 10,0; рН – 6,0–7,0).
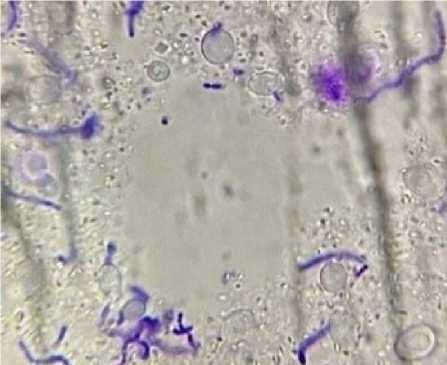
Р и с. 1. Межвидовои ко-флокулят Saccharomyces cerevisiae I-224 и Streptococcus thermophilus
F i g. 1. Interspecies co-flocculate of Saccharomyces cerevisiae I-224 and Streptococcus thermophilus
Источник: здесь и далее рисунки получены авторами в программе MicroCamera
Source: herein and hereafter, the figures were obtained by the authors using the MicroCamera software
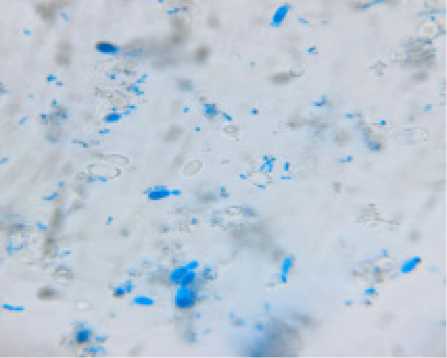
Р и с. 2. Отсутствие ко-флокуляции между Saccharomyces boulardii и Streptococcus thermophilus
F i g. 2. Absence of the co-flocculation between Saccharomyces boulardii and Streptococcus thermophilus
Ко-флокулят получали следующим способом: в стадию логарифмического роста биомассу микроорганизмов осаждали центрифугированием (4000 об/мин) в течение 2 мин, надосадочную жидкость сливали. Для разделения дрожжевых моновидовых флокул на отдельные клетки, активации клеточной стенки и экзополисахаридного матрикса перед дальнейшей межвидовой ко-флокуляцией полученные осадки монокультур ресуспензировали в стерильном растворе 0,3 моль/л оксалата калия. Встряхивание в пробирке производили до полного разрушения хлопьев, определяемого визуально. Ресуспензировали в стерильном растворе 0,9 % хлорида натрия. Полученный ресуспензат повторно центрифугировали, надосадочную жидкость удаляли. Осадок еще раз ресуспензировали в растворе 0,9 % хлорида натрия. По 1 мл полученной декальцифицированной взвеси дрожжей и бактерий помещали в общую пробирку, куда добавляли 2,0 мл 1,0 % стерильного раствора хлорида кальция. Полученную смесь активно встряхивали и оставляли на 30 мин для ко-флокуляции. Результаты учитывали микроскопически при увеличении × 900 с иммерсией после окраски 0,001 % раствором метиленового синего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На рисунке 1 видно, что окрашенные цепочки стрептококков и клетки дрожжей включены в общий полисахаридный матрикс биопленки. Жизнеспособные дрожжи и матрикс не окрашиваются метиленовым синим. Матрикс становится видимым благодаря тому, что он обильно инкрустирован многочисленными кристаллами оксалата кальция. Предполагается, что дрожжи удерживаются в матриксе за счет высокой флокулирующей активности поверхностных лектинов S. сerevisiae I-224 с экзополисахари-дом S. thermophilus . Пространство, свободное от кристаллов оксалата кальция (в центре рисунка), не содержит стрептококков и дрожжевых клеток, что свидетельствует о прочности связывания всех компонентов биопленки.
Дрожжи с меньшей флокулирующей активностью, Saccharomyces boulardii, значительно хуже включаются в состав ко-флокулята (рис. 2). На изображении видно, что дрожжевые клетки взаимодействуют между собой, при этом практически не присоединяются к межвидовому ко-флокуляту со стрептококками.
Полученные результаты открывают возможность создания орального пробиотика на основе ко-флокуляции лактококка и дрожжей, а также введения в микробиом ротовой полости клеток других микробионтов, клеточная стенка которых обладает достаточным сродством к лектиновой кальций-зависимой флокуляции. Поскольку основным фактором образования зубного налета является осаждение гликопротеинов слюны, которые формируют защитную пелликулу, возникает базис для соединения полисахаридного матрикса искусственно полученного ко-флокулята с уже имеющейся биопленкой на эмали зуба [5].
ОБСУЖДЕНИЕ И ЗАКЛЮЧЕНИЕ
Зимолектины наружного манно-протеинового слоя клеточной стенки дрожжей способны прочно связывать клетки грибков друг с другом через остатки маннозы в присутствии катионов кальция. Аналогичный эффект наблюдается при связывании дрожжей с внеклеточным экзополисахаридным маннозосодержащим матриксом, продуцируемым молочным стрептококком. Метод декальцификации клеточной стенки дрожжей и экзополи-сахарида стрептококков анионами оксалата с последующей ко-флокуляцией в присутствии катионов кальция позволяет создать прочный межвидовой конгломерат дрожжей и по-лисахарид-продуцирующих стрептококков, имитирующий биопленку. Разработанный метод предполагается применить для изготовления препарата комплексного орального пробиотика, позволяющего вытеснить возбудителей кариеса из биопленки зубного налета и снизить кислотную нагрузку на эмаль зубов путем частичной замены возбудителей молочнокислого брожения на возбудителей спиртового брожения.


