Получение межвидовых гибридов перца (Capsicum L.) S-плазмотипа с использованием эмбриокультуры in vitrо
Автор: Супрунова Т.П., Пышная О.Н., Шмыкова Н.А., Джос Е.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: ДНК-технологии в генетике и селекции
Статья в выпуске: 3 т.44, 2009 года.
Бесплатный доступ
Проводили межвидовые реципрокные скрещивания между четырьмя дикими видами перца (Capsicum L.). С использованием культуры зародышей in vitrо получили стерильные межвидовые гибриды C. frutescens × C. chinense. Выполнили цитологический анализ нарушений в развитии гамет у всех пяти растений гибридов F1 по стадиям развития микроспор и пыльцы. Для молекулярного анализа использовали полимеразную цепную реакцию (ПЦР) и праймеры, позволяющие амплифицировать SCAR-маркеры (sequence-characterized amplified region) цитоплазматической мужской стерильности (ЦМС). Эти маркеры были идентифицированы у образца C. frutescens, использованного в качестве материнского компонента при скрещивании с C. chinense, а также у всех пяти растений стерильных гибридов F1.
Перец, межвидовая гибридизация, культура зародышей in vitrо, цитоплазматическая мужская стерильность (цмс), scar-маркеры
Короткий адрес: https://sciup.org/142133251
IDR: 142133251 | УДК: 633.842:575.22:581.143.6
Текст научной статьи Получение межвидовых гибридов перца (Capsicum L.) S-плазмотипа с использованием эмбриокультуры in vitrо
Отдаленная гибридизация относится к основным селекционным методам передачи хозяйственно ценных признаков от дикорастущих видов к культурным сортам и разновидностям, что позволяет расширить спектр генетической изменчивости культурных растений. Одно из последствий отдаленной гибридизации — получение форм с цитоплазматической мужской стерильностью (ЦМС). Для ЦМС-индуцирующей цитоплазмы характерна экспрессия специфических митохондриальных генов, нарушающая формирование жизнеспособной пыльцы. Эта экспрессия может подавляться либо компенсироваться одним или несколькими ядерными генами, известными как гены-восстановители фертильности. ЦМС служит прекрасной моделью для изучения ядерного и цитоплазматического взаимодействия (1, 2). Митохондриальные гены, определяющие ЦМС и обнаруженные у большого числа видов растений, демонстрируют значительное разнообразие кодируемых белков и специфических фенотипических эффектов (3).
В связи с ростом популярности перца Capsicum annuum внимание исследователей привлекают другие (как культурные, так и дикорастущие) виды этого рода, обладающие селекционно важными свойствами — устойчивостью к патогенам и вредителям, высоким содержанием биологически активных веществ, ЦМС и т.д. Первые сообщения о межвидовых скрещиваниях между представителями рода Capsicum появились еще в середине XX столетия (4-6). В последние десятилетия проводился детальный цитологический анализ межвидовых гибридов перца и изучалось развитие мужских гамет (7-9), однако механизм ядерно-цитоплазматических взаимодействий, приводящих к стерильности, остается неизвестным (1).
У C. annuum L. ЦМС впервые обнаружена у линии PI 164835 из Индии (10). Несмотря на широкое использование ЦМС-форм перца для получения F1 гибридов, детальное изучение и молекулярный анализ генов ЦМС у этой культуры проводится только последние 10 лет. С помощью анализа полиморфизма длин рестрикционных фрагментов (RFLP — restriction fragment length polymorphism) митохондриальной ДНК фертильной и стерильной линий перца были выявлены структурные различия во фланкирующих областях митохондриальных генов coxII (mitochondrial cytochrome c oxidase subunit II) и atp6 (ATP-synthase complex), определяющих ЦМС (11). Позже D. Kim с соавт. (12) на основании полученных сиквен-сов генов coxII и atp6 стерильных и фертильных линий перца предложи- ли SCAR-маркеры (sequence-characterized amplified region, локус-специ-фические маркеры, полученные на основе амплификации предварительно секвенированного региона ДНК), позволяющие различать стерильные и фертильные (соответственно S- и N-цитоплазма) образцы.
Целью нашего исследования было получение межвидовых гибридов перца, обладающих цитоплазматической мужской стерильностью (ЦМС), цитологический анализ микроспорогенеза, а также оценка потомства на наличие генов ЦМС с помощью SCAR-маркеров.
Методика. Реципрокные скрещивания осуществляли между растениями перца четырех видов — C. annuum (сорт Огненный вулкан), C. fru-tescens (сорт Созвездие), C. chinense (сорт Огненная дева), C. baccatum (сорт Маленький принц). Фенологические наблюдения, изучение морфологических признаков и показателей репродуктивности растений проводили в соответствии с описанием Международного генетического института растительных ресурсов (IPGRI) (13).
Для получения растений гибридов F1 через эмбриокультуру семена из зрелых плодов стерилизовали коммерческим раствором «Белизна» в течение 20 мин, после чего промывали стерильной дистиллированной водой. Выделенные из семян недоразвитые зародыши помещали на модифицированную среду Мурасиге и Скуга (14) с 6-бензиламинопурином (6-БАП) (0,2 мг/л) и тидиазуроном (0,2 мг/л). Для формирования корневой системы побеги межвидовых гибридов переносили на безгормональную среду того же состава. Культивирование зародышей и растений-регенерантов in vitro проводили при 14-часовом фотопериоде и температуре 22-23 ° С. Полученные сеянцы высаживали в вегетационные сосуды с почвосмесью (торф c перлитом, 3:1) и выращивали в климатической камере при 16-часовом фотопериоде, освещенности 15 тыс. лк и температуре 22-24 ° С. Наблюдения за растениями выполняли в течение 18 мес. В конце 1-го года вегетации часть растений была перенесена в теплицу («Richel», Франция) с малообъемной технологией.
Для цитологического анализа бутоны фиксировали смесью 96 % этилового спирта и ледяной уксусной кислоты (3:1) в течение 24 ч, затем промывали 70 % этанолом. Поперечные срезы пыльников окрашивали 2 % раствором ацетокармина. Препараты просматривали под микроскопом Mikroskop Nf («Carl Zeiss», Германия) при увеличениях х 200 и х 400.
Растения родительских линий C. frutescens и C. chinense , а также пять растений F1, полученных от их скрещивания, протестировали на наличие ЦМС-специфических SCAR-маркеров. Тотальную ДНК выделяли из молодых листьев, как описано (15), с незначительными модификациями: растительные пробы растирали непосредственно в экстракционном буфере, после чего пробирки инкубировали в термостате 20 мин при температуре 65 ° С. Амплификацию ДНК в полимеразной цепной реакции (ПЦР) проводили в реакционной смеси объемом 25 мкл, содержащей 1 х Taq-буфер (50 % глицерол, 20 мM Трис-HCl — pH 8,0, 100 мM KCl, 0,1 мM EDTA, 1 мM DTT, 0,5 % Твин 20) из соответствующего набора, 1,5 мМ MgCl2, 0,2 мМ каждого dNTP, 0,5 мкМ каждого праймера, 0,2 ед. Taq-полимеразы («Promega», США) и 50-100 нг ДНК. Использовали термоциклер MyCycler («Bio-Rad», США) в следующем режиме: предварительная денатурация — 4 мин при 94 ° С; денатурация — 40 с при 94 ° С; отжиг праймеров — 40 с при 52 или 56 ° С (соответственно для atp6 и coxII) ; синтез ДНК — 40 с при 72 ° С, 30 циклов; заключительная элонгация — 10 мин при 72 ° С. Контролем служила ПЦР-смесь, не содержащая ДНК. Продукты амплификации разделяли электрофорезом в 1,5 % агарозном геле с 0,5 х ТВЕ-буфером (0,89 М Трис-НС1, 0,89 М борная кислота, 20 мМ EDTA, рН 7,5), окрашивали бромистым этидием; результаты фотодокументировали с помощью гель-документирующей системы CN-1500 Darkroom («Vilber Lourmat», Франция). Для амплификации
SCAR-маркеров использовали следующие две пары праймеров (12), синтезированные в ЗАО «Синтол» (Россия):
atp6 SCAR:
5 ′ -AGTCCACTTGAACAATTTGAAATAATC-3 ′ (F) 5 ′ -GTTCCGTACTTTACTTACGAGC-3 ′ (R)
coxII SCAR:
5 ′ -GTCGGGAGAACTACCTAACTA-3 ′ (F) 5 ′ -GGCTACCTAGTGATTTACAAGCA-3 ′ (R).
Статистическую обработку данных проводили биометрическим методом с использованием программы Excel.
Результаты. Во всех 12 комбинациях реципрокных скрещиваний растений перца ( C. annuum , C. frutescens, C. chinense, C. baccatum ) гибридизация была успешной. Число опыленных цветков варьировало от 50 до 132 шт. на растение, число завязавшихся в результате опыления плодов — от 9 до 89 шт. на растение. В F1 доля завязавшихся плодов в зависимости от комбинации скрещивания составляла от 11,5 % (C. chinense х C. annuum ) до 90,0 % ( C. frutescens х C. chinense ), осемененность на один плод — от 7 до 78 шт. (табл. 1).
-
1. Репродуктивные показатели у гибридов перца ( Capsicum l. ) в F1 в зависимости от комбинаций в реципрокных скрещиваниях растений
Комбинация
Число, шт.
Доля завязавшихся плодов, %
Среднее число семян в плоде, шт.
опыленных цветков
завязавшихся плодов
C. chinense х C. baccatum
132
89
67,4
30
C. baccatum х C. chinense
100
37
37,0
26
C. chinense х C. annuum
130
15
11,5
44
C. annuum х C. chinense
100
38
38,0
74
C. baccatum х C. annuum
100
41
41,0
30
C. annuum х C. baccatum
100
71
71,0
78
C. frutescens х C. baccatum
90
22
24,4
40
C. baccatum х C. frutescens
50
20
40,0
32
C. frutescens х C. chinense
50
45
90,0
30
C. chinense х C. frutescens
38
9
23,4
7
C. frutescens х C. annuum
90
43
47,8
46
C. annuum х C. frutescens
62
24
38,7
68
-
2. Морфологические и биометрические ( M ± m ) характеристики родительских форм перца ( Capsicum L. ) и пяти гибридных растений F1, полученных от них с использованием метода эмбриокультуры in vitrо
Вид, растение
Длина, см
Лист, см
Окраска плода
Описание цветка
междоузлия
черешка
длина
ширина
Р о д и т е л ь с к и е
ф о р м ы
C. frutescens
3,3±0,3
2,4±0,4
5,3±0,5
2,9±0,3
Фиолетовая, красная
Фиолетовый, тычиночные нити, тычинки и пестик фиолетовые, чашечка без опушения
C. chinense
9,0±0,3
1,9±0,1 7,4±0,4
Р а с т е н и я F1
4,1±0,2 Темно-зеленая, темно-красная
( C. frutescens х C . chinense )
Белый, мелкий, с лонгости-лией, тычиночные нити белые, тычинки фиолетовые, пестик белый, чашечка опушенная
¹ 1
2,0±0,6
1,5±0,3
5,6±0,5
2,1±0,2
Желтая
Белый, тычиночные нити белые, тычинки фиолетовые, пестик белый
¹ 2
2,1±0,6
1,8±0,2
6,7±0,5
2,2±0,1
Красная
Белый с фиолетовой окантовкой, тычинки, тычиночные нити и пестик фиолетовые
¹ 3
6,3±1,5
3,4±0,4
8,6±0,7
3,3±0,3
Красная
Белый, тычинки, тычиночные нити и пестик фиолетовые
¹ 4
5,9±1,2
3,4±0,3
8,6±0,9
3,1±0,3
Красная
Белый, тычиночные нити светло-фиолетовые, тычинки фиолетовые, пестик белый
¹ 5
3,3±0,6
1,7±0,2
5,6±0,7
2,1±0,1
Желтая
Фиолетовый, тычинки, тычиночные нити и пестик фиолетовые
-
3. Характеристика развития микроспор, пыльцы и состояния тапетума в пыльниках родительских форм перца Capsicum frutescens и C. chinense , а также пяти гибридных растений F1, полученных от них с использованием метода эмбриокультуры in vitrо
Длина бутона, мм
Стадия развития микроспор и пыльцы
Состояние тапетума
1,1-1,4
C. f r u t e s c e n s Распад тетрад
Клетки интенсивно окрашены
1,5-1,8
Молодые микроспоры
Клетки двухъядерные
1,9-2,2
Ранняя вакуолизированная стадия, ядро в центре
Сохранились единичные клетки
2,3-2,6
микроспоры
Поздняя вакуолизированная стадия, ядро
Клеточная структура утрачена
2,7-3,0
прижато к стенке, оболочки утолщены Пыльца
Отсутствует
3,1-3,9
Пыльца
Отсутствует
Более 4,0
Пыльца
Отсутствует
1,1-1,4
C. c h i n e n s e Микроспороциты
Клетки интенсивно окрашены
1,5-1,8
Тетрады
Клетки интенсивно окрашены
1,9-2,2
Молодые микроспоры
Стенки клеток частично лизиро-
2,3-2,6
Поздняя вакуолизированная стадия, ядро прижа-
ваны
Тапетум без клеточной структуры, со-
2,7-3,0
то к стенке, оболочки утолщены Пыльца
хранились лишь небольшие участки Отсутствует
3,1-3,9
Пыльца
Отсутствует
Более 4,0
Пыльца
Отсутствует
1,1-1,4
Р а с т е н и е ¹ 1
Микроспороциты
Клетки интенсивно окрашены
1,5-1,8
Тетрады, монады
Клетки интенсивно окрашены
1,9-2,2
Тетрады, монады
Частичная реорганизация тапетума
2,3-2,6
Тонкостенные микроспоры, остатки монад
Реорганизация части тапетума, дру-
2,7-3,0
Тонкостенные микроспоры
гая часть подвергается разрушению Реорганизованный тапетум
3,1-3,9
Тонкостенные микроспоры
Реорганизованный тапетум
Более 4,0
Тонкостенные микроспоры
Реорганизованный тапетум
1,1-1,4
Р а с т е н и е ¹ 2
Монады
Клетки интенсивно окрашены
Продолжение таблицы 3
1,5-1,8
1,9-2,2
2,3-2,6
2,7-3,0
3,1-3,9
Более 4,0
Монады Клетки интенсивно окрашены
Остатки монад Реорганизация тапетума
Остатки монад Реорганизованный тапетум
Остатки монад Реорганизованный тапетум
Остатки монад Реорганизованный тапетум
Остатки монад Реорганизованный тапетум
Р а с т е н и е ¹ 3
1,1-1,4
1,5-1,8
1,9-2,2
2,3-2,6
2,7-3,0
3,1-3,9
Более 4,0
Микроспороциты Клетки интенсивно окрашены
Микроспороциты Клетки интенсивно окрашены
Тетрады, монады Сохраняется клеточная структура
Тетрады, монады Частичное разрушение клеток
Большинство микроспор тонкостенные Частичное разрушение клеток
Стерильная пыльца Остатки отдельных участков
Стерильная пыльца Остатки отдельных участков
Р а с т е н и е ¹ 4
1,1-1,4
1,5-1,8
1,9-2,2
2,3-2,6
2,7-3,0
3,1-3,9
Микроспороциты Клетки интенсивно окрашены
Микроспороциты Клетки интенсивно окрашены
Тетрады Клетки интенсивно окрашены
Тетрады Разрушение тапетума
Большинство микроспор тонкостенные Сохранены лишь отдельные клетки
Стерильная пыльца, единичные пыльцевые зерна Отсутствует окрашены
Более 4,0
Стерильная пыльца, единичные пыльцевые зерна Отсутствует окрашены
Р а с т е н и е ¹ 5
1,1-1,4
1,5-1,8
1,9-2,2
2,3-2,6
2,7-3,0
3,1-3,9
Более 4,0
Микроспороциты Реорганизация клеточных структур
Микроспороциты Реорганизованный тапетум
Разрушенные клетки Реорганизованный тапетум
Разрушенные клетки Реорганизованный тапетум
Разрушенные клетки Реорганизованный тапетум
Разрушенные клетки Реорганизованный тапетум
Разрушенные клетки Реорганизованный тапетум
Только одна из 12 комбинаций реципрокных скрещиваний — C. fru-tescens x C. chinense дала стерильное потомство, поэтому растения указан- ных родительских линий и гибридов F1 изучили по морфологическим признакам, а также провели цитологический и молекулярный анализ. Оказалось, что семена гибридов F1 (при значительной доле внешне нормально развитых — 55,3 %) не прорастают в естественных условиях, поскольку содержат недоразвитый эндосперм и глобулярный зародыш, поэтому для получения растений из таких семян применили метод эмбриокультуры in vitrо. Известно, что при работе с эмбриокультурой важно установить оптимальные сроки изоляции зародышей от материнского растения и подобрать состав питательных сред, обеспечивающих получение жизнеспособных семян. В этой связи мы изучили стадии развития зародышей у родителей — C. fru-tescens и C. chinense (учитывали стадии глобулярного, сердечковидного, торпедовидного и сформированного зародыша) и показали, что у растений обоих видов они развиваются одинаково: на 25-е сут — имеют сердцевидную форму, на 30-е сут — торпедовидную. Было определено, что оптимальными для введения в культуру in vitro являются торпедовидные и сформированные зародыши, и подобран оптимальный состав питательных сред для их культивирования (см. раздел «Методика»), на которых происходило не только формирование полноценного зародыша, но и клональное микроразмножение. Доля развивающихся зародышей составила 22,7 %.
гибридные растения
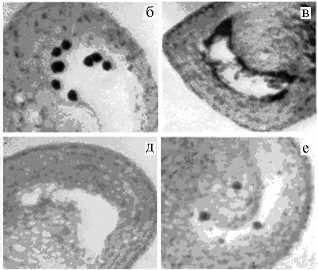
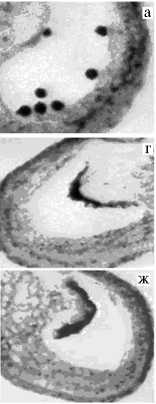
Рис.1. Анатомическая структура мужского гаметофита родительских форм перца ( Capsicum L.) и пяти гибридных растений F 1 , полученных от них с использованием метода эмбриокультуры: а и б — соответственно C. frutescens и C. chinense ; в-ж — соответcтвенно
ацетокармином; увеличение х 200.
¹¹ 1, 2, 3, 4 и 5. Окрашивание
Всего в результате использования эмбриокультуры удалось получить пять растений F1, Три из них (¹¹ 1, 2 и 5, выращивались в климатической камере) по основным морфологическим признакам занимали в основном промежуточное положение между родительскими формами со сдвигом в сторону материнского компонента (табл. 2). Растения ¹ 3 и ¹ 4 (были перенесены из климатической камеры в условия теплицы с малообъемной гидропоникой) по всем морфологическим по- казателям оказались сходными между собой и отличались от остальных растений (хотя по некоторым признакам приближались к отцовской линии) (см. табл. 2).
Цитологический анализ микроспорогенеза подтвердил фертильность пыльцы у обоих родителей. У родительских форм при развитии микроспор и пыльцы в пыльниках наблюдался лизис клеток тапетума (рис. 1, a, б; табл. 3), у межвидовых гибридов в пыльниках происходила реорганизация тапетума, он утрачивал ядра и клеточное строение, образуя ценоцитную структуру, которая окрашивалась ацетокармином в темный цвет (см. рис. 1, в, г, ж; рис. 2 в, г) и не изменялась, пока сохранялся пыльник. Тапетум этого типа плотно охватывал в одних случаях спорогенную ткань, в других — тетрады и монады, препятствуя их развитию (см. рис. 1, ж; см. рис. 2, a, в, г). Образование пыльцевых гнезд в пыльниках стерильных растений замедлялось (см. рис. 1, в, г, д, ж). Описанные отклонения у стерильных растений проявлялись в разной степени (см. табл. 3).
Рис. 2. Нарушение развития мужского гаметофита у стерильных растений перца ( Capsicum L.) в F 1 : a — монады; б — масса дегенерирующих микроспор; в — фрагмент реорганизованного тапетума; г — фрагмент пыльцевого гнезда. Окрашивание ацетокармином, увеличение ½400.
мирование пыльцевого гнезда
Наиболее выраженные изменения происходили у растения ¹ 5: изменения в тапетуме отмечали в период, предшествующий мейозу, тетрады и микроспоры в пыльниках не формировались. У растений ¹¹ 1, 2 и 3 микроспорогенез нарушался на стадии мейоза, что подтверждалось наличием монад в пыльниках. Реорганизация тапетума наступала позднее, чем у растения ¹ 5, причем изменения могли охватывать лишь отдельные участки ткани. Поэтому у растений ¹ 1 и ¹ 3, кроме монад, встречаются и тетрады, при распаде которых образовывались тонкостенные микроспоры (см. рис. 1, д, е; см. рис. 2, б). Однако пыльцевые зерна у них обнаружены не были. Только у растения ¹ 4 отклонения в развитии пыльника оказались незначительными: происходило фор-и даже единичных пыльцевых зерен, кото рые окрашиваются ацетокармином (см. рис.1, е), а тапетум перед раскрытием бутона отсутствовал, как и у родительских форм. Однако у этого растения не происходило раскрытие пыльников и рассеивание пыльцы. Следует отметить, что в целом степень стерильности растений ¹ 3 и ¹ 4, вегетирующих в условиях малообъемной теплицы, была ниже, чем у растений ¹¹ 1, 2 и 5, развивающихся в климатической камере. Этот факт можно объяснить влиянием условий окружающей среды (температура, освещенность и др.) на уровень экспрессии генов, обусловливающих ЦМС (8, 10).
Для определения плазмотипов образцов (двух родительских форм и пяти полученных от них стерильных растений F1) мы использовали SCAR-маркеры. Известно (12), что в результате ПЦР со SCAR-праймерами для atp6 и coxII фрагменты размером соответственно 607 и 708 п.н. амплифи-цируются только у генотипов с S-цитоплазмой. В наших опытах эти SCAR-маркеры не амплифицировались у отцовской линии C. chinense , но амплифицировались у материнской линии C . frutescens и в образцах ДНК пяти полученных гибридных растений (F1). Следовательно, митохондриальный геном линии C . frutescens содержит гены, специфичные для S-плазмотипа. Поскольку этот геном наследуется по материнской линии, растения F1 также обладали стерильной S-цитоплазмой.
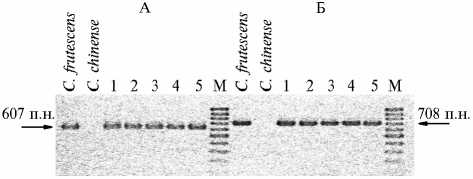
Рис 3. Электрофореграмма продуктов ПЦР-амплификации SCAR-маркеров цитоплазматической мужской стерильностиу у двух родительских форм перца (Capsicum frutescens и C. chinense) и полученных от них с использованием метода эмбриокультуры in vitrо растений F1: А и Б — применение праймеров, специфичных соответственно для митохондриальных генов atp6 и coxII; 1-5 — гибридные растения F1; М — маркер молекулярных масс (1 kb DNA ladder, «Gibco BRL», США).
Таким образом, из всех 12 комбинаций скрещиваний между четырьмя видами перца (Capsicum L.) только в варианте C. frutescens х C. chinense отобрано потомство, обладающее цитоплазматической мужской стерильностью. Гибридные растения F1 от этой комбинации были получены через эмбриокультуру. По большинству морфологических показателей растения были схожи и занимали в основном промежуточное положение относительно родительских форм при наличии, тем не менее, различий по ряду признаков. Как оказалось, у всех пяти растений F1 нарушен микроспорогенез, однако стадии развития микроспор и пыльцы, на которых на- блюдались эти нарушения, у разных растений неодинаковы. Митохондриальный геном линии C. frutescens и пяти гибридных растений F1, полученных от скрещивания с C. chinense, содержит гены, специфичные для S-плазмотипа. При использовании C. frutescens в качестве материнского компонента в скрещивании с C. annuum мы выделили фертильные гибриды, хотя анализ их ДНК также выявил наличие SCAR-маркеров, сцепленных с митохондриальными генами ЦМС (данные не представлены). Вероятно, у использованного образца C. chinense (сорт Огненная дева) имеются ядерные гены, взаимодействие которых с митохондриальным геномом обусловливает цитоплазматическую мужскую стерильность.
Л И Т Е Р А Т У Р А
-
1. C h a s e C.D. Cytoplasmic male sterility: a window to the world of plant mitochondrial– nuclear interactions. Trends Gen., 2007, 23(2): 81-90.
-
2. И в а н о в М.К., Д ы м ш и ц Г.М. Цитоплазматическая мужская стерильность и восстановление фертильности пыльцы у высших растений. Генетика, 2007, 43(4): 451-468.
-
3. L i n k e B., B o r n e r T. Mitochondrial effects on flower and pollen development. Mitochondrion, 2005, 5: 389-402.
-
4. H i r o s e T., N i s h i S., T a k a s h i m a S. Studies on the interspecies crossing in cultivated Capsicum L. Crossability. Sci. Rep. Kyoto Prefect Univ. Agric., 1960, 12: 40-60.
-
5. E s h b a u g h L.H. Genetic and biochemical systematic studies of chili peppers ( Capsicum - Solanaceae ). Bull. Torrey. Bot. Club., N.Y., 1975, 102: 396-403.
-
6. P i l l a i E.R.S., G e o r g e M.K., M e r c y S.T. Studies on interspecific hybrids of five species of Capsicum with special reference to its qualitative characters. Agric. Res. J. Kerala, 1977, 15: 1-5.
-
7. K u m a r O.A., P a n d a R.C., R a o K.G.R. Cytogenetic studies of the F1 hybrids of Capsicum annuum with C. chinense and C. baccatum . Theor. Appl. Genet., 1987, 74(2): 242-246.
-
8. S h i f r i s s C. Male sterility in pepper ( Capsicum annuum L.). Euphytica, 1997, 93: 83-88.
-
9. L u o X.-D., D a i L.-F., W a n g S.-B. e.a. Male gamete development and early tapetal degeneration in cytoplasmic male-sterile pepper investigated by meiotic, anatomical and ultrastructural analyses. Plant Breed., 2006, 125: 395-399.
-
10. P e t e r s o n P.A. Cytoplasmically inherited male sterility in Capsicum . Am. Nat., 1958, 92: 111-119.
-
11. K i m D.H., K a n g J.G., Kim B.-D. Identification of coxII and atp6 regions as associated to CMS in Capsicum annuum L. by using RFLP and long and accurate PCR. J. Kor. Soc. Hort. Sci., 2001, 42: 121-127.
-
12. K i m D.H., K i m B.-D. Development of SCAR markers for early identification of cytoplasmic male sterility genotype in chili pepper ( Capsicum annuum L.). Mol. Cell, 2005, 20(3): 416-422.
-
13. C a r v a l h o S.I.C., B i a n c h e t t i L.B., H e n z G.P. Germplasm collection of Capsicum ssp. maintained by Embrapa HORTALICAS (CNPH). Capsicum and Eggplant Newsletter, 2003, 22: 17-20.
-
14. M a t s u d a K., K i k u t a Y., O k a z a w a Y.A. Revision of the medium for somatic embryogenesis in carrot suspension culture. J. Fac. Agr., 1981, 60: 183-193.
-
15. E d w a r d s S.K., J o h n s t o n e C., T h o m p s o n C. A simple and rapid method for the preparation of plant genomic DNA for PCR analyses. Nuc. Acids Res., 1991, 19(6): 1349.
ГНУ Всероссийский НИИ селекции и семеноводства овощных культур Россельхозакадемии,


