Получение порошка оксида цинка из глубоких эвтектических растворителей
Автор: Сажнев Михаил Павлович, Харин Олег Игоревич, Макаров Николай Александрович
Журнал: Вестник Бурятского государственного университета. Химия. Физика @vestnik-bsu-chemistry-physics
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
Порошок оксида цинка ZnO был осажден из систем хлорид - мочевина водой и натриевой щёлочью. Полученный материал обжигали при температурах 500-700 ℃ и исследовали методами РФА, БЭТ, РФЛа, СЭМ, ЭДС. Также для изучения структуры глубокого эвтектического растворителя применяли ИК-спектроскопию. По данным РФА расчитали параметры решётки для всех образцов. Оксид цинка кристаллизуется в гексагональной структуре вюрцита P63mc с параметрами решётки а = 3,24992 Å и с = 5,20658 Å. Для получения оксида цинка на основе проведённых анализов определены оптимальный состав исходного ГЭР и температура синтеза прекурсора.
Оксид цинка, глубокие эвтектические растворители, синтез, термообработка, структура
Короткий адрес: https://sciup.org/148331442
IDR: 148331442 | УДК: 543 | DOI: 10.18101/2306-2363-2025-1-36-48
Текст научной статьи Получение порошка оксида цинка из глубоких эвтектических растворителей
Оксид цинка — полупроводниковое соединение типа AIIBVI, которое характеризуется широкой запрещенной зоной 3,3 эВ, сравнительно высокой энергией связи экситона 60 мэВ при комнатной температуре [1–4] и естественной электропроводностью n-типа [5]. Утверждается [6], что вакансии О2 (VO) являются донорами, могут быть ответственны за проводимость n-типа и междоузлия Zn (Zni) являются слабыми быстродиффундирующими донорами, поэтому они не стабильны. Вакансии цинка являются глубокими акцепторами с низкими энергиями образования химических связей в условиях, приводящих к росту проводимости n-типа. Кроме того, система склонна к самокомпенсации — при введении акцеп- торов автоматически увеличивается концентрация компенсирующих доноров. Глубокая валентная зона ZnO, обусловленная сильной связью Zn-O, также затрудняет генерацию свободных дырок. Оксид цинка представляет собой сложный полупроводник, который кристаллизуется в гексагональной структуре вюр-цита (P63mc) [7]. Близкая к тетраэдрической координации, она приводит к возникновению полярной симметрии в ZnO, что является причиной его сильной анизотропии, в том числе в процессе роста кристаллов [8]. Все эти свойства обусловливают применение оксида цинка в качестве материала для варисторной керамики [9], прозрачных проводящих оксидов (TCO) [10], биосенсоров, в том числе за счёт своей биосовместимости [11] и терморегулирующих покрытий ТРП [12,13], а также сорбентов для поглощения SO2 и H2S [14]. Из-за описанных выше особенностей структуры и свойств оксида цинка для его применения необходим чёткий контроль состава и морфологии кристаллов. В статье приводятся результаты исследования порошков оксида цинка, полученных путем осаждения из глубоких эвтектических растворителей (ГЭР) — систем, образованных из эвтектической смеси кислот Льюиса или Бренстеда, и оснований, которые могут содержать множество анионов и/или катионов [15].
Экспериментальная часть
В качестве исходной эвтектической системы для синтеза была выбрана смесь: хлорид цинка — мочевина (мольное соотношение 3 к 10). Осаждение из ГЭР проводили двумя способами: водой и натриевой щёлочью. Состав исходных смесей для получения ГЭР и чистота компонентов представлены в таблице 1.
Таблица 1
Составы смесей для получения ГЭР
|
Компонент 1 |
ZnCl2 (чистота — «Ч») |
|
Компонент 2 |
(NH2)2CO (чистота — «ЧДА») |
Смесь исходных порошков помещалась в водяную баню, где плавилась при температуре 80 ℃, после плавления и обесцвечивания перемешивалась магнитной мешалкой в течение 120 минут. После этого смесь осаждали охлаждённой до 5 ℃ водой объёмом 2,125 л. Полученную систему фильтровали и промывали дистиллированной водой.
Альтернативным было осаждение щёлочью. Твердый гранулированный NaOH добавляли в систему в мольном соотношении 2:1 к хлориду цинка и затем выдерживали 30 минут. Полученную систему фильтровали и промывали водой до достижения нейтральной среды (pH = 7).
После фильтрования порошки сушили при температуре 70 ℃ и далее синтезировали в печи на воздухе при температурах 500–700 ℃, со скоростью нагрева 2 ℃/мин и выдержкой 2 часа. Наименования образцов, полученных в ходе экспериментов, представлены в таблице 2.
Наименования образцов
Таблица 2
|
Температура синтеза, ℃ |
Способ осаждения |
|
|
Вода |
NaOH |
|
|
500 |
Zn-Cl-500 |
Na-Zn-Cl-500 |
|
600 |
Zn-Cl-600 |
Na-Zn-Cl-600 |
|
700 |
Zn-Cl-700 |
Na-Zn-Cl-700 |
Пос ле термообра бот ки для анализа порошков использовали ме тоды ре нтгенофазового а на л и за ( Р ФА), сканирующей электронной микроскоп и и (С ЭМ) , Брунауэра-Эммета-Те лле ра (Б ЭТ) и энергодисперсионной рентгеновской спек т ро скоп и и ( ЭДС) для контроля фазового и химического состава , а та кже оценк и м орф о лог и и к ри с т аллов . Дл я и з уче ни я ст руктуры ГЭР применялась ИК-с п ек троск опия ме т одом Н П ВО .
О бс уждени е р ез у л ь т ато в
Для п од тве р ж дени я фазового состава прекурсоров и прокаленных пор ошков прове дён ре нтге но фа зовый анализ. Результаты представлены на рис у нк а х 1 и 2. В с лу ча е прим е н е ния д и ст и ллированной воды в качестве осадителя в составе преку рсора наблюд а е т ся н а ли чи е ф аз симонколлеита и хлорида аммония, кото ры е об р а зу ю тся в ход е гидролиза ГЭР водой. Синтез при температурах 5 00–700 ℃ п озволяе т п олу ч ит ь е ди н ст ве нн у ю ф а зу — оксид цинка ZnO.
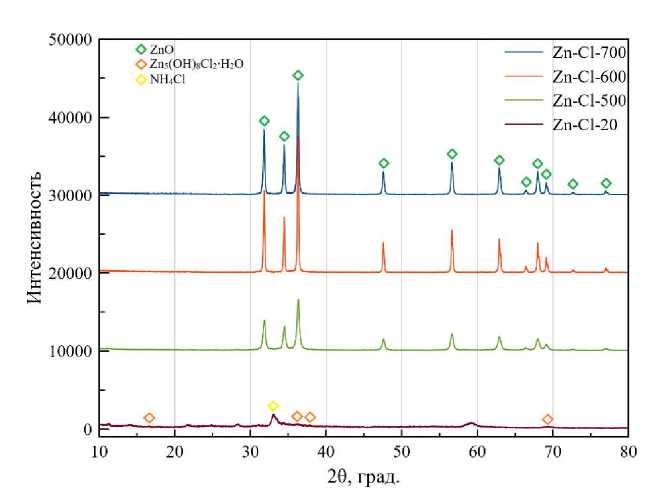
Рис. 1. Резуль т ат ы РФ А по ро шков, по л у ченны х при взаимодействии глу бо кого э в т е ктичес ко го р ас т в о р ит еля системы х ло р ид цинка — мочевина с дистиллированной водой
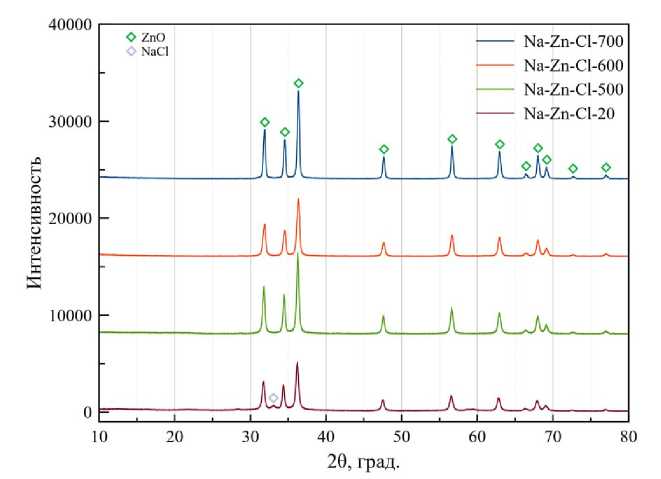
Рис. 2. Результаты РФА порошков, полученных при взаимодействии глубокого эвтектического растворителя системы хлорид цинка — мочевина с натриевой щёлочью
В случае осаждения гидроксидом натрия наблюдается вторая фаза — хлорид натрия с пиками слабой интенсивности.
Оценку химического состава полученных порошков проводили с помощью метода ЭДС. Соответствующие результаты представлены в таблицах 3 и 4.
Таблица 3
Результаты ЭДС порошков, полученных при взаимодействии глубокого эвтектического растворителя системы хлорид цинка — мочевина с дистиллированной водой
|
Температура синтеза, ℃ |
Zn-Cl |
||
|
Zn, атомн. % |
O, атомн. % |
Zn/O |
|
|
500 |
40,620 |
59,380 |
0,684 |
|
600 |
41,270 |
58,730 |
0,702 |
|
700 |
44,240 |
55,760 |
0,793 |
При увеличении температуры синтеза наблюдается стремление порошка к стехиометрическому составу, причём цинк находится в недостатке. Таким образом, с ростом температуры синтеза снижается количество вакансий по цинку, из-за чего соотношение становится более стехиометрическим. При этом не было обнаружено примесных элементов.
Таблица 4
Результаты ЭДС порошков, полученных при взаимодействии глубокого эвтектического растворителя системы хлорид цинка — мочевина с натриевой щёлочью
|
Температура синтеза, ℃ |
Na-Zn-Cl |
||
|
Zn, атомн. % |
Na, атомн. % |
Примеси, атомн. % |
|
|
500 |
58,429 |
38,426 |
3,145 |
|
600 |
64,608 |
28,034 |
7,358 |
|
700 |
64,433 |
30,674 |
4,893 |
По данным ЭДС, проведённого для порошков, полученных при осаждении NaOH, можно увидеть наличие натрия в образцах, а также наличие других элементов, например, хлора (статья «примеси»). Наличие натрия в любой форме крайне нежалательно и контроль его наличия на стадии синтеза затруднён. При повышении температуры синтеза также наблюдается увеличение содержания цинка.
Для оценки морфологии кристаллов, а также их размеров проведена сканирующая электронная микроскопия.
Результаты СЭМ представлены на рисунках 3–5.

Рис. 3. Микроструктуры порошков Zn-Cl-500 (а) и Na-Zn-Cl-500 (б)

Рис. 4. Микроструктуры порошков Zn-Cl-600 (а) и Na-Zn-Cl-600 (б)

Рис. 5. Микроструктуры порошков Zn-Cl-600 (а) и Na-Zn-Cl-600 (б)
В случае гидролиза водой частицы ZnO имеют преимущественно цилиндрическую форму со средней длиной 2,1 мкм и средним диаметром 0,6 мкм. При этом размер частиц с увеличением температуры синтеза уменьшается.
Аналогичной морфологией обладают порошки, полученные осаждением гидроксидом натрия. Размер частиц для Na-Zn-Cl — 0.8 мкм.
Температура прокаливания влияет на морфологию и размер частиц. Так, при 500 °C частицы ZnO в основном аморфные и агрегированные, при 600 °C в образце Zn-Cl-600 появляются стержнеобразные кристаллы, а при 700 °C формируются четко выраженные кристаллические структуры.
Для Zn-Cl-700 характерны цилиндрические частицы (длина 2,1 мкм, диаметр 0,6 мкм).
Тип осадителя влияет на размер частиц. Так, осаждение гидроксидом натрия приводит к уменьшению размера частиц (Na-Zn-Cl-700 — 0,8 мкм) по сравнению с аналогичным Zn-Cl-700, осаждённым водой — 2,1 мкм.
Для оценки удельной поверхности в таблице 5 представлены результаты БЭТ.
Таблица 5
Сравнение результатов БЭТ
|
Образец |
S уд , м2/г |
|
Na-Zn-Cl-500 |
18,5286 ± 0,03 |
|
Na-Zn-Cl-600 |
15,7685 ± 0,03 |
|
Na-Zn-Cl-700 |
8,8092 ± 0,03 |
|
Zn-Cl-500 |
17,52 ± 0,10 |
|
Zn-Cl-600 |
7,02 ± 0,05 |
|
Zn-Cl-700 |
2,00 ± 0,01 |
С ростом температуры синтеза закономерно снижается удельная поверхность частиц. При осаждении NaOH удельная поверхность частицы выше, а скорость седиментации ниже.
На основе РФА определены параметры решётки и ренгеновская плотность порошков. Эталонное значение рентгеновской плотности оксида цинка — 5,673 г/см3, а — 3,24992 Å, с — 5,20658 Å [16]. Результаты расчёта параметров решётки представлены в таблице 6.
Таблица 6
Рез у льт а ты рас чё та пара м е т ров решёт к и и ренгеновской плотности
|
Температура синтеза, °C |
Zn-Cl |
Na-Zn-Cl |
||||
|
a, Å |
c, Å |
Истинная плотность, г/см3 |
a, Å |
c, Å |
Истинная плотность, г/см3 |
|
|
500 |
3,2455 |
5,1981 |
5,689 |
3,2483 |
5,2017 |
5,689 |
|
600 |
3,2461 |
5,1999 |
5,683 |
3,2452 |
5,1959 |
5,684 |
|
700 |
3,2456 |
5,2005 |
5,680 |
3,2441 |
5,1936 |
5,693 |
Ренг е н ов ская плотност ь, к а к и па ра ме тры а и с , ве д ет себя нелинейно. Это с вя з ан о с и зм е н е н ием концентрации и вида дефектов кристаллическо й ре ше тки.
Для образцов Zn-Cl наблюдается тенденция к увеличению параметра с, что может быть связа но с изменением дефектов кристаллической решет к и , р о ст ом кри ст ал ли т ов или рел а кс ац ией нап ряж ен ий .
Ис ход я из с овок уп н ости всех приведённых результатов наибол е е оп ти ма л ь ны м образц ом д ля с ин тез а к е рамик и я вляе т ся Zn-Cl-500 за счёт чистоты, низкой температуры си нт еза и высок ой ак т и вн ос т и .
Одной из возможных переменных в процессе синтеза является время варки системы.
Таблица 7
Наименования образцов
|
Время синтеза, час |
Наименование |
|
0,5 |
Zii-Cl-0,5 |
|
1,0 |
Z11-C1-1 |
|
1,5 |
Zn-Cl-1,5 |
|
2,0 |
Zn-Cl-2 |
Дальнейши е и с с л едов а ни я направле ны н а оп ред еле н ие оп т им а л ьн ог о вре м ени варки сис те мы д о её ос а жд ени я.
В таб лиц е 7 предс т ав л е н ы н аим ен ования образ ц ов, с ин тезирова нн ы х в т ечение различ н ог о вре ме ни.
На рисунке 5 приведены результаты РФА для порошков, полученных из хло- рида цинка и осаждённых водой в зависимости от времени синтеза.
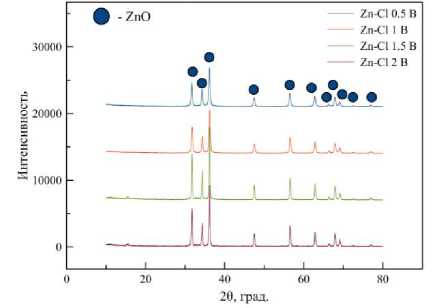
Рис. 6. Р ез у льт а ты рентгенофазового анализа для порошков, полу ч е нн ы х и з хлори д а цин к а после прокаливании при различном времени с и нт е з а
Как следует из результатов РФА, во всех случаях образуется целевая фаза ZnO. Энергодисперсионный анализ проведён в целях подтверждения химического состава полученных порошков. Результаты представлены в таблице 8.
Таблица 8
Результаты EDX для порошков, полученных из хлорида цинка при осаждении водой в зависимости от времени варки
|
Наименование образца |
Содержание элементов, атомн. % |
|||
|
Zn |
O |
Cl |
Примеси |
|
|
Zn-Cl-0.5 |
43,294 |
54,780 |
1,926 |
0,000 |
|
Zn-Cl-1 |
42.732 |
55,141 |
2,127 |
0,000 |
|
Zn-Cl-1.5 |
40,869 |
52,786 |
5,375 |
0,970 |
|
Zn-Cl-2 |
41,963 |
51,702 |
5,351 |
0,985 |
С увеличением времени варки наблюдается рост концентрации адсорбированного хлора, что может негативно сказаться на свойствах получаемого материала, особенно применяемого в биомедицинских целях. Наличие примесей в образцах Zn-Cl-1.5 и Zn-Cl-2 не связано с увеличением времени синтеза.
Для оценки наличия возможного содержания углерода в образцах, а также подтверждения количества примесей был проведён рентгенофлуоресцентный анализ (РфлА). Результаты представлены в таблице 9.
Таблица 9
Результаты РфлА для порошков, полученных из хлорида цинка после прокаливании при различном времени синтеза
|
Наименование образца |
Содержание элементов, мас. % |
||||
|
Zn |
C |
O |
Cl |
Zn/O |
|
|
Zn-Cl-0.5 |
55,90 |
20,75 |
22,43 |
0,92 |
71,36 |
|
Zn-Cl-1 |
55,80 |
21,27 |
21,92 |
1,01 |
71,80 |
|
Zn-Cl-1.5 |
53,15 |
22,74 |
22,11 |
1,99 |
70,62 |
|
Zn-Cl-2 |
59,00 |
16,31 |
22,20 |
2,49 |
72,66 |
С увеличением времени варки наблюдается снижение содержания углерода и увеличение количества хлора. Оптимальным образцом при этом является Zn-Cl-2 за счёт наименьшего количества примесей. Также при более длительной варке оксид цинка более стехиометричен (соотношение Zn/O — 72,66) и, следовательно, образец Zn-Cl-2 также предпочтителен.
На рисунках 7 и 8 представлены результаты исследования микроструктуры порошков.

Рис. 7. Результаты СЭМ для образцов Zn-Cl-0.5 (а) и Zn-Cl-1 (б)
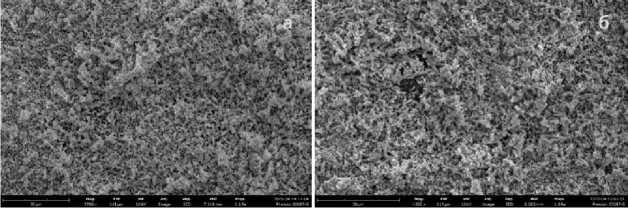
Рис. 8. Результаты СЭМ для образцов Zn-Cl-1.5 (а) и Zn-Cl-2 (б)
С увеличением времени варки системы наблюдается анизотропный рост кристаллов стержнеобразной формы, что характерно для оксида цинка. Средний размер частиц при этом остается на одном уровне. Анизотропия роста обсулов-лена гексагональной структурой вюрцита. Рост вдоль направления c происходит быстрее, чем в направлении а. Благодаря этому оксид цинка имеет игольчатые или стержневидные структуры. Соответственно, чем дольше длится процесс роста кристаллов, тем более выражены отличия в скоростях роста в различных направлениях.
Игольчатые структуры менее склонны к образованию крупных агрегатов. Однако несмотря на меньшую степень агрегации применение в синтезе керамики игольчатых структур не столь эффективно.
Имея более высокое сотношение длины к диаметру, игольчатые частицы сложно уплотняются, образуя большие поры. Также ввиду их анизотропии усадка в процессе спекания также становится анизотропной.
Рассчитаны параметры решётки ZnO в зависимости от времени варки на основе данных, полученных в ходе рентгенофазового анализа.
Результаты представлены в таблице 10.
Таблица 10
Результаты расчёта параметров решётки и ренгеновской плотности в зависимости от времени синтеза
|
Время синтеза, час. |
Zn-Cl-500 |
||
|
Параметр а, Å |
Параметр с, Å |
Плотность, г/см3 |
|
|
0,5 |
3,2554 |
5,2140 |
5,646 |
|
1,0 |
3,2512 |
5,2088 |
5,666 |
|
1,5 |
3,2515 |
5,2115 |
5,662 |
|
2,0 |
3,2517 |
5,2114 |
5,662 |
Наблюдается резкое падение обоих параметров при времени синтеза 1 час. При этом плотность образца Zn-Cl-1 ближе к рентгеновской, однако все образцы менее плотные по сравнению с эталоном — 5,673. Отличия вызваны дефектной структурой оксида цинка.
Для оценки структуры жидкого ГЭР была проведена ИК-спектроскопия методом НПВО. Результаты представлены на рисунке 9. Исследование проводилось на оборудовании ЦКП РХТУ им. Д. И. Менделеева.
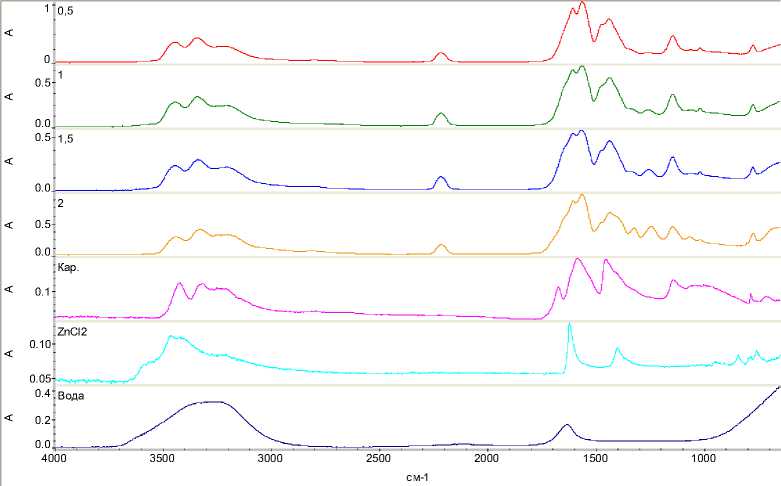
Рис. 9. Результаты ИК-спектроскопии для полученного ГЭР в зависимости от времени варки системы. Также проведены спектры воды, хлорида цинка и карбамида (Кар.)
Жидкая система хлорид цинка — мочевина образует тетраэдрические комплексы [Zn(urea)₄]²⁺, а также смешанные хлорид-карбамидные комплексы [Zn(urea)ₙClₘ](2-μ), где μ — заряд лигандов Cl-. При недостатке мочевины (возникающем в том числе в ходе варки системы) возможно появление полимерных структур типа [Zn(μ-Cl) 2 (urea) 2 ] n .
В ИК-спектре системы ZnCl₂ — мочевина наблюдаются характерные полосы поглощения, которые позволяют сделать выводы о взаимодействиях между компонентами. В области валентных колебаний N–H (3100–3500 см⁻¹) для свободной мочевины обычно видны две чёткие полосы: асимметричное колебание при ~3440 см⁻¹ и симметричное при ~3340 см⁻¹. В случае образования координационного комплекса эти полосы смещаются в низкочастотную область на 20–50 см⁻¹ и становятся более размытыми, что свидетельствует об участии групп N–H в образовании водородных связей с хлорид-ионами и соответственно об участии их в создании координационных соединений.
Важнейшим диагностическим признаком является поведение полосы карбонильной группы C=O мочевины. У свободной мочевины она проявляется как интенсивный пик около 1 680–1 700 см⁻¹. При координации мочевины к иону цинка через атом кислорода эта полоса смещается на 40 см⁻¹ в область 1 630–1 660 см⁻¹, что указывает на ослабление связи C=O вследствие донорно-акцепторного взаимодействия. Величина этого сдвига (~50 см⁻¹) подтверждает образование координационных связей Zn–O.
В низкочастотной области спектра (400–600 см⁻¹) также могли бы наблюдаться полосы, соответствующие колебаниям связей Zn–Cl и Zn–O. Для мостиковых хлоридных структур (μ-Cl) характерны полосы в районе 300–400 см⁻¹. Их наличие свидетельствует о возможном образовании полимерных цепочек [Zn(μ-Cl)₂(urea)₂] n в системе. Интенсивность этих полос зависит от соотношения компонентов: при избытке мочевины они менее выражены, так как доминируют тет-ракоординированные комплексы [Zn(urea)₄]²⁺. Однако оценка низкочастотного спектра затруднительная ввиду особенностей метода — возможна оценка спектра от 500 см⁻¹.
Образование полимерных структур подтверждает ускоренное затвердевание ГЭР при прекращении нагревания. При этом увеличение времени варки до 2,5 часа и более провоцирует ещё более активное затвердевание системы, а также её полимеризацию за счёт выкипания части мочевины.
Следовательно, оценка структуры посредством ИК-спектроскопии методом НПВО представляет трудности, поскольку ГЭР более не является жидкой фазой.
На основании приведённых анализов для различного времени варки были выбраны образцы Zn-Cl-2 за счёт наименьшего содержания углерода в порошке, а также стремления к стехиометрии (Zn/O — 72,66%).
Заключение
Проведённые исследования позволили установить ключевые закономерности синтеза оксида цинка из глубокого эвтектического растворителя системы ZnCl₂ — мочевина. Гидролиз дистиллированной водой приводит к образованию прекурсора на основе симонколлеита и хлорида аммония, который при прокаливании при 500–700 °C трансформируется в чистую фазу ZnO без примесей. В случае использования натриевой щёлочи в продукте сохраняется остаточный NaCl, что ограничивает его применение в высоко чистых процессах.
Установлено, что повышение температуры синтеза способствует приближению состава ZnO к стехиометрии за счёт уменьшения концентрации вакансий по цинку, при этом образцы, полученные гидролизом водой, демонстрируют более предсказуемый и воспроизводимый состав по сравнению с системами, содержащими натрий.
Морфология полученного ZnO характеризуется стержнеобразными частицами с выраженной анизотропией, обусловленной гексагональной структурой вюрци-та. Установлено, что увеличение времени варки системы усиливает анизотропию кристаллов, однако это негативно сказывается на их спекаемости из-за затруднённой упаковки и неоднородной усадки.
Наибольшую удельную поверхность демонстрируют образцы, синтезированные при 500 °C, что делает их перспективными для каталитических и сенсорных применений. При этом оптимальным с точки зрения чистоты и стехиометрии яв- 46
ляется образец Zn-Cl-2, полученный при двухчасовой варке системы, так как он содержит минимальное количество углеродных примесей и имеет наиболее сбалансированное соотношение Zn/O.
Инфракрасная спектроскопия подтвердила образование координационных комплексов [Zn(urea)₄]²⁺ и полимерных структур [Zn(μ-Cl)₂(urea)₂]n в ГЭР, что объясняет в том числе изменение реологических свойств системы при длительной варке. Таким образом, результаты работы позволяют заключить, что синтез ZnO посредством гидролиза ГЭР водой с последующим прокаливанием при 500 °C является оптимальным методом получения оксида цинка с контролируемой морфологией.
Керамические материалы на основе полученного порошка применимы, в первую очередь, для катализа и производства сорбентов. Для синтеза плотной керамики электротехнического назначения необходимо введение добавок, таких как висмут, сурьма, кобальт, марганец, ванадий.
Для дальнейших исследований целесообразно оптимизировать условия синтеза для минимизации содержания хлора и углерода в конечном продукте, а также возможный поиск другой эвтектической системы.


