Получение водорастворимых (1-гидроксиэтилиден)дифосфонатов марганца(II)
Автор: Семенов В.В., Петров Б.И., Лазарев Н.М.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.17, 2025 года.
Бесплатный доступ
Предложены два способа получения водорастворимых координационных соединений марганца(II) из MnSO4, (1-гидроксиэтилиден)дифосфоновой кислоты H4L и моноэтаноламина. Первый заключается в осаждении из водного раствора MnSO4 карбоната марганца и превращении его в трудно растворимый (1-гидроксиэтилиден)дифосфонат H2MnL·3Н2О добавлением H4L. Последующая реакция с моноэтаноламином приводит к получению хорошо растворимого бис(моноэтаноламиний) (1-гидроксиэтилиден)дифосфоната марганца(II) дигидрата (H3NCH2CH2OH)2MnL·2Н2О. Во втором способе к раствору сульфата марганца и ОЭДФ прибавляется моноэтаноламин. Образующаяся при этом смесь (1-гидроксиэтилиден)дифосфоната марганца(II) (H3NCH2CH2OH)2MnL с бис(моноэтаноламиний)сульфатом (H3NCH2CH2OH)2SO4 образует устойчивый при хранении крепкий раствор. Углекислый газ, выделяющийся в реакции карбоната марганца с ОЭДФ, понижает реакционную способность моноэтаноламина в результате образования комплекса с углекислотой HOCH2CH2NHCOO-+NH3CH2CH2OH, что приводит к ингибированию взаимодействия (1-гидроксиэтилиден)дифосфоната H2MnL·3Н2О с моноэтаноламином. Нагревание и перемешивание реакционной смеси, полученной при взаимодействии карбоната марганца с ОЭДФ, в течение 1 ч вызывает удаление углекислого газа, вследствие чего последующее прибавление водного раствора моноэтаноламина приводит к образованию прозрачного раствора бис(моноэтаноламиний) (1-гидроксиэтилиден)дифосфоната марганца(II) дигидрата (H3NCH2CH2OH)2MnL·2Н2О. Ингибирование реакции моноэтаноламином таким образом исключается. Сделанная попытка использовать вместо моноэтаноламина водный раствор аммиака не привела к успеху. В реакции сульфата марганца(II) с тетрааммониевой солью ОЭДФ был получен труднорастворимый продукт состава 2(NH4)HMnL·H2MnL. Исследовано термическое поведение полученных соединений в температурном диапазоне 25-640 °С.
Марганец(ii), (1-гидроксиэтилиден)дифосфоновая кислота, моноэтаноламин, комплексонаты, растворимость
Короткий адрес: https://sciup.org/147248062
IDR: 147248062 | УДК: 546.185, | DOI: 10.14529/chem250103
Текст научной статьи Получение водорастворимых (1-гидроксиэтилиден)дифосфонатов марганца(II)
Ацетаты и формиаты 3d-металлов образуют с моноэтаноламином [1] нерастворимые комплексы сложного состава. Так, при добавлении амина к раствору формиата марганца быстро выпадает осадок коричневого цвета сложного состава Mn4(OH)6(HCOO)2·H2NCH2CH2OH·2H2O. В то же время известно, что амины [H2NCH2CH2OH и H2NC(CH2OH)3] способны переводить в водную среду труднорастворимые соединения марганца(II) с (1-гидроксиэтилиден)дифосфоновой (ОЭДФ) [2, 3] и нитрилотриуксусной кислотами (НТА) [4], полученные из основного карбоната марганца(II) и сернокислого марганца(II). Координационные соединения марганца(II) с промышленными комплексонами (НТА, ЭДТА, ОЭДФ) обладают малой растворимостью [5] в водной среде, что затрудняет их использование в качестве фармацевтических препаратов, ингибиторов солеотложения в нефтяной промышленности, стабилизаторов пищевых продуктов, препаратов для химической очистки теплоэнергетического оборудования и микрокомпонентных добавок в минеральные удобрения. Цель настоящего исследования заключалась в разработке способов получения водорастворимого комплексоната, в котором в качестве источника использовалась одна из самых дешевых и доступных солей марганца(II) – пятиводный сульфат MnSO4·5H2O, в качестве промышленного комплексона – (1-гидроксиэтилиден)дифосфоновая кислота и в качестве промотора растворимости – моноэтаноламин. Ранее последний использовался [6] в процессе получения метилата марганца(II) из его карбоната. Продукты реакции ацетата марганца с алифатическими кислотами С7–С20 и моноэтаноламином, растворимые в органических средах, предложено [7] использовать в качестве сиккативов для масляных красок. Получены кристаллы соединений маганца(II) [8] и кобальта(II) [9–12] с ОЭДФ, в том числе в условиях гидротермального синтеза. Аморфные комплексы обладают большей растворимостью в водной среде и имеют преимущество для приложений в фармации и сельском хозяйстве.
Четырехосновная 1-гидроксиэтилидендифосфоновая кислота обладает хорошими хелатирующими свойствами, переводит в водную фазу оксиды и гидроксиды железа [13] и других металлов, в связи с чем может использоваться в процессах очистки трубопроводов теплосетей:
но сн3
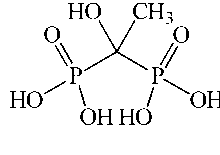
(1-Гидроксиэтилиден)дифосфоновая кислота H 4 L (ОЭДФ)
Предложены [14, 15] ингибиторы солеотложения для котловых систем, в состав которых входят также аммиак, триэтаноламин и морфолин. Реакции комплексобразования H4L в водных растворах изучены [16–19] для многих металлов. 1-Гидроксиэтилидендифосфоновая кислота использовалась [20] в синтезах комплексов изотопов технеция-99 и рения-188, предназначенных для визуализации отложений соединений кальция в кровеносных сосудах.
Экспериментальная часть
В работе использовали (1-гидроксиэтилиден)дифосфоновую кислоту H 4 L·H 2 O квалификации «ч» производства ПАО «Химпром», г. Новочебоксарск, ТУ 2439-363-05783441-2002, моно-этаноламин квалификации «ч» производства ООО «Синтез ОКА», г. Дзержинск, ТУ 2423-00278722668-2010, сульфат марганца(II) MnSO 4 ·5H 2 O, «ч», АО «Химреактив», Н. Новгород, ГОСТ 435-77. Карбонат марганца MnCO 3 ·2H 2 O (по данным РФА родохрозит), получали из сульфата марганца(II) и кислого углекислого калия.
(1-Гидроксиэтилиден)дифосфонат марганца(II) тригидрат H 2 MnL·3Н 2 О. К раствору 20 г MnSO 4 ·5H 2 O (8,30·10–2 моль) в 100 мл Н 2 О прибавляли при перемешивании 16,61 г КНСО 3 (1,66·10–1 моль) в 30 мл Н 2 О. Через 2 ч к полученной суспензии карбоната марганца прибавляли 18,60 г ОЭДФ (8,30·10–2 моль) в 30 мл Н 2 О. Прозрачный светло-розовый раствор нагревали 0,5 ч при перемешивании. Через 12 ч к полученной вязкой творожистой массе добавляли 100 мл Н2О, размешивали, фильтровали, осадок промывали водой, сушили на воздухе при 110 °С. Получили 22,30 г (7,56·10–2 моль, 91 %) (1-гидроксиэтилиден)дифосфоната марганца(II) тригидрата H2MnL·3Н2О в виде хрупкой светло-розовой массы, легко дробящейся до порошка. Растворимость 0,94 г в 100 мл Н 2 О. ИК-спектр, ν, см–1: 3620–2700 ш., 2406, 1638, 1590 пл, 1295 пл, 1194 пл, 1164, 1140, 1093, 1072, 1045, 991, 929, 917, 815, 661, 646, 586, 550, 488, 450. Найдено (%): C 7,95; H 3,83. С 2 H 12 O 10 P 2 Mn. Вычислено (%): C 7,68; H 3,86.
Бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфонат марганца(II) дигидрат (H 3 NCH 2 CH 2 OH) 2 MnL · 2Н 2 О. К суспензии 5,00 г H 2 MnL·3Н 2 О (1,60·10–2 моль) в 20 мл Н 2 О прибавляли при перемешивании 1,95 г (3,20·10–2 моль) H 2 NCH 2 CH 2 OH в 10 мл Н 2 О. Через 10 мин суспензия растворилась. Смесь фильтровали, фильтрат упаривали, остаток сушили при 110 °С.
Получили 6,42 г (1,53·10–2 моль, 96 %) (H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О в виде прочной массы кремового цвета, размалывающейся до желтого порошка. ИК-спектр, ν, см–1: 3620–2250 ш, 2129, 2073, 1629, 1605, 1566, 1542, 1343, 1271, 1137, 1093, 1057, 1000, 958, 881, 812, 661, 589, 553, 476. Найдено (%): C 17,93; H 5,73; N 6,77. С 6 H 24 N 2 O 11 P 2 Mn. Вычислено (%): C 17,28; H 5,80; N 6,72.
Растворимость 20 г в 100 мл Н 2 О.
Реакция сернокислого марганца(II) с тетракис (моноэтаноламиниевой) солью ОЭДФ. К раствору 5,00 г MnSO 4 ·5H 2 O (2,07·10–2 моль) в 20 мл Н 2 О прибавляли по каплям раствор (H 3 NCH 2 CH 2 OH) 4 L, полученный из 4,65 г (2,07·10–2 моль) ОЭДФ и 5.07 г (8,30·10–2 моль) моно-этаноламина. Выпадающий осадок по мере прибавления раствора (H 3 NCH 2 CH 2 OH) 4 L постепенно растворился. Смесь перемешивали 2 ч, фильтровали, упаривали, остаток сушили при 110 °С. Получили 10,8 г желто-розовой гигроскопичной твердой массы, которую нагревали в вакууме до 250 °С. Получили 9,35 г (H 3 NCH 2 CH 2 OH) 2 H 2 MnLSO 4 (1,95·10–2 моль, 94 %) в виде твердого слабо гигроскопичного аморфного продукта, подвергающегося размолу до желтого порошка. ИК-спектр, ν, см–1: 3600–2200 ш., 1620, 1516, 1501, 1462, 1379, 1349, 1260, 1140 пл., 1066, 1006 пл., 932 пл., 821, 762, 723, 661, 610, 553. РФА: аморфное гало в интервале углов отражения 2Ɵ 15–34о. Найдено (%): C 15,71, H 4,99, N 6,01, S 7,06. С 6 H 22 N 2 O 13 P 2 SMn. Вычислено (%): C 15,04; H 4,63; N 5,85; S 6,69.
Реакция сернокислого марганца(II) с ОЭДФ и моноэтаноламином. К раствору 5,00 г MnSO 4 ·5H 2 O (2,07·10–2 моль) в 20 мл Н 2 О прибавляли раствор 4,65 г (2,07·10–2 моль) ОЭДФ в 20 мл Н2О. Через 1 ч к прозрачному раствору прибавляли по каплям при перемешивании 5,07 г (8,30·10–2 моль) моноэтаноламина в 10 мл Н2О. После приливания 10 мл раствора наблюдали выпадение осадка, который быстро растворился в результате добавления всего объема (14,5 мл) раствора моноэтаноламина. Прозрачный раствор упарили, остаток нагревали в вакууме до 150 °С. Получили 9,20 г (1,92·10–2 моль, 93 %) (H 3 NCH 2 CH 2 OH) 2 H 2 MnLSO 4 в виде белых крупных трудно измельчающихся кусков. Найдено (%): C 15,04, H 5,09, N 6,06, S 7,04. С 6 H 22 N 2 O 13 P 2 SMn. Вычислено (%): C 15,04; H 4,63; N 5,85; S 6,69. Через 12 ч масса порошкообразного соединения увеличилась на 10 % за счет поглощения влаги воздуха. Смешивание с водой привело к образованию белого нефильтрующегося золя и осадка, что свидетельствовало о потере растворимости полученного продукта.
Бис (моноэтаноламиний)сульфат (H 3 NCH 2 CH 2 OH) 2 SO 4 . К раствору 5,11 г (8.36·10–2 моль) моноэтаноламина в 30 мл Н2О прибавляли по каплям 5,10 мл раствора 8,20 моль·л–1 H2SO4 (4,18·10–2 моль). Реакционная смесь самопроизвольно нагревалась, оставалась прозрачной. После упаривания при 110 °С получили 9,35 г прозрачной вязкой жидкости, которую нагревали в вакууме до 120 °С. Получили 7,50 г (3,40·10–2 моль, 82 %) бис (моноэтаноламиний)сульфата (H 3 NCH 2 CH 2 OH) 2 SO 4 в виде прочной стекловидной массы, внутри которой через 2 ч появились пучки белых нитей. Раздробленное до порошка соединение покрывалось жидкой пленкой, промывание ацетоном и удаление растворителя в вакууме приводило к получению «сухого» пересыпающегося порошка. ИК-спектр, ν, см–1: 3600 – 2200 ш, 2076, 1629, 1525, 1459, 1376, 1337, 1271, 1218, 1143, 1110, 1069, 1015, 976, 866, 836, 792, 711, 619, 580, 518, 473. Найдено (%): C 21,41; H 7,83; N 12,41; S 13,95. С 4 H 16 N 2 O 6 S. Вычислено (%): C 21,81, H 7,32, N 12,72, S 14,56.
Реакция сернокислого марганца(II) с тетрааммониевой солью ОЭДФ. К раствору 5,00 г MnSO 4 ·5H 2 O (2,07·10–2 моль) в 20 мл Н 2 О прибавляли по каплям раствор (NH 4 ) 4 L, полученный из 4,65 г (2,07·10–2 моль) ОЭДФ и 8,00 мл раствора аммиака 10,37 моль·л–1 (8,30·10–2 моль). Через 48 ч выпавший мелкодисперсный осадок не отстоялся. Мутную смесь фильтровали, осадок промывали водой, сушили при 110 °С. Получили 5,35 г (6,56∙10–3 моль, 95 %) продукта состава 2(NH 4 )НMnL· H 2 MnL в виде белого порошка. ИК-спектр, ν, см–1: 3229, 2046, 1644, 1459, 1429, 1376, 1104, 1069, 1000 пл., 956, 926 пл., 818, 723, 661, 562, 482. Найдено (%): C 8,20; H 3,46; N 3,73. С 6 H 28 N 2 O 21 P 6 Mn 3 . Вычислено (%): C 8,84, H 3,46; N 3,44.
ИК-спектры соединений в виде суспензии в вазелиновом (область 1400–400 см–1) и фторированном (4000–1400 см–1) маслах между пластинами KBr регистрировали на ИК Фурье-спектрометре ФСМ 1201.
Рентгенографические исследования выполнены на рентгеновском дифрактометре Shimadzu XRD-7000. Анализ проводился с использованием программы DIFFRACplus Evaluation package Release 2009, Bruker (Германия).
Элементный анализ выполнен на автоматическом элементном анализаторе Vario EL cube (Elementar Analysensysteme GmbH) в конфигурации CHNS, газ-носитель – гелий марки 6.0.
Термический анализ выполнен на приборе синхронного термического анализа TGA/DSC 3+ METTLER TOLEDO, скорость нагрева составляла 5 град/мин, скорость подачи аргона – 20 мл/мин.
Обсуждение результатов
Из выпускаемых в промышленных масштабах неорганических солей марганца для целей сельского хозяйства [21] наилучшим образом подходят сульфат и нитрат. Товарная форма микроудобрений, поставляемых на рынок, представляет собой близкие к насыщенным растворы солей биометаллов. Альтернативная форма – быстрорастворимые порошки или гранулы. В связи с этим испытания на растворимость сухих продуктов синтеза комплексонатов представляется актуальной проблемой. Обезвоживание может приводить к получению координационных полимеров и потери растворимости. Самым доступным и дешевым промотором растворимости является моно-этаноламин (МЭА), выпускаемый химической промышленностью РФ в больших количествах.
Испытание карбоната марганца, полученного осаждением кислым углекислым калием из раствора MnSO 4 , в целом подтвердило его высокую реакционную способность. Взаимодействие с ОЭДФ протекало без нагревания, приводило к быстрому растворению суспензии карбоната марганца и последующему выпадению (через 30–40 мин) обильного осадка (1-гидроксиэтилиден)дифосфоната марганца H2MnL. Приливание вслед затем к вязкой суспензии водного раствора моноэтаноламина вызывало ее растворение, однако оно было не полным.
MnCO 3 + H 4 L = H 2 MnL + CO 2 + H 2 O (1)
H 2 MnL + 2 H 2 NCH 2 CH 2 OH = (H 3 NCH 2 CH 2 OH) 2 MnL (2)
Реакционная смесь оставалась мутной, хотя количество осадка было минимальным. Причина наблюдаемого несоответствия ожидаемым результатам заключалась в понижении реакционной способности моноэтаноламина вследствие поглощения им углекислого газа, выделившегося в реакции карбоната марганца с ОЭДФ. Проверка методом кислотно-основного титрования водного раствора, полученного в результате фильтрования осадка H 2 MnL, показала, что в фильтрате остается растворенной более 4 % угольной кислоты относительно количества взятого в реакцию КНСО3. Известно [22], что моноэтаноламин является наилучшим реагентом для абсорбции углекислоты из топочных газов.
HOCH 2 CH 2 NH 2 + CO 2 = HOCH 2 CH 2 NHCOOH (3)
HOCH 2 CH 2 NHCOOH + H 2 NCH 2 CH 2 OH = HOCH 2 CH 2 NHCOO‒+NH 3 CH 2 CH 2 OH (4)
Понижение его реакционной способности в результате образования комплекса с углекислотой подтвердилось проведением реакции чистого (не свежевыделенного) H 2 MnL с МЭА и с его комплексом с СО 2 . Суспензия H 2 MnL растворялась под действием водного раствора чистого МЭА через 10 мин, а под действием раствора МЭА, насыщенного углекислым газом, только через 60 мин. Нагревание и перемешивание реакционной смеси, полученной при взаимодействии карбоната марганца с ОЭДФ, в течение 1 ч вызывало удаление углекислого газа, вследствие чего последующее прибавление водного раствора МЭА приводило к образованию прозрачного раствора бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфоната марганца(II) (H 3 NCH 2 CH 2 OH) 2 MnL. Ингибирование реакции моноэтаноламином таким образом было исключено. Упаривание раствора и сушка остатка привели к получению целевого соединения с выходом 96 %. Оно содержало 2 молекулы воды и представляло собой массу кремового цвета, размалывающуюся до желтого порошка с растворимостью 20 г в 100 мл Н 2 О, что допускает возможность использования хелатированного соединения в качестве микроудобрения в порошкообразном виде. Устойчивые при длительном хранении водные растворы высоких концентраций обычно образуют аморфные производные биометаллов. На рис. 1 показаны рентгенограммы исходного карбоната марганца (родохрозита, кривая 1 ), продукта его реакции с ОЭДФ (H 2 MnL·3Н 2 О, кривая 2 ) и (H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О (кривая 3 ). Конечный продукт представляет собой глубоко аморфизованное соединение, чем и объясняется его хорошая растворимость в водной среде.
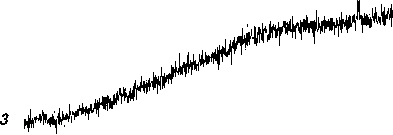
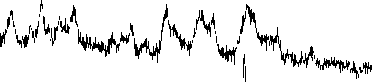
o
15 20 25 30 35 40 2 ® ,
Рис. 1. Рентгенограммы MnCO 3 ( 1 ), H 2 MnL · 3Н 2 О ( 2 ) и (H 3 NCH 2 CH 2 OH) 2 MnL · 2Н 2 О ( 3 )
Реакция сульфата марганца(II) с тетракис(моноэтаноламиниевой) солью ОЭДФ (реакция (5)) привела к образованию бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфоната марганца(II) и бис (моноэтаноламиний) сульфата. Прибавление раствора моноэтаноламиниевой соли ОЭДФ к раствору сульфата марганца вызывало выпадение белого хлопьевидного осадка, который постепенно растворялся.
MnSO 4 + (H 3 NCH 2 CH 2 OH) 4 L = (H 3 NCH 2 CH 2 OH) 2 MnL + (H 3 NCH 2 CH 2 OH) 2 SO 4 (5)
Разделение этой смеси не являлось необходимым в случае использования ее в сельскохозяйственных мероприятиях. Получающийся прозрачный розовый раствор при хранении осадка не выделял. Упаривание приводило к застудневанию смеси. После сушки при 110 °С получалась светлая желто-розовая твердая масса, по консистенции подобная гудрону и не подвергающаяся размолу до порошка. Нагревание ее в вакууме до 250 °С привело к окончательному отверждению, убыли 7 % массы и потере растворимости. Согласно элементному анализу формула получившегося продукта может быть представлена как (H 3 NCH 2 CH 2 OH) 2 H 2 MnLSO 4 . Она отличалась от ожидаемой (H3NCH2CH2OH)4MnLSO4 на два фрагмента моноэтаноламина предположительно потерянного в результате термообработки. Однако в другом аналогичном эксперименте сухой остаток не подвергался столь интенсивной обработке, но имел такую же брутто формулу. Из этого следовало, что во время упаривания в концентрированном растворе происходило накопление кислых моноэтаноламиниевых солей (H 3 NCH 2 CH 2 OH)HMnL и (H 3 NCH 2 CH 2 OH)HSO 4 . «Лишний» моноэтаноламин удалялся во время упаривания и сушки. Такой состав явился причиной потери растворимости сухого остатка в водной среде.
Изменение порядка смешивания реагентов, т. е. прибавление раствора сульфата марганца к раствору тетрааминиевой соли ОЭДФ, привело к аналогичному результату. Выпадение белого осадка замедляло процесс синтеза. Быстрое приливание второго компонента вызывало образование вязкой суспензии, затрудняющей эффективное перемешивание. Осадок представлял собой труднорастворимый (1-гидроксиэтилиден)дифосфонат марганца(II) H 2 MnL. Растворимость сухого H 2 MnL·2Н 2 О составляла только 0,94 г в 100 мл Н 2 О.
Наилучшие условия получения смеси (H 3 NCH 2 CH 2 OH) 2 MnL/(H 3 NCH 2 CH 2 OH) 2 SO 4 создавались, когда к сульфату марганца и ОЭДФ прибавляли МЭА. Раствор, содержащий эквимолярные количества MnSO 4 и H 4 L, не генерировал выпадения осадка H 2 MnL в кислой среде. Моноэтано-ламин вызывал появление осадка только после прибавления двух третей от исходного количества. Смесь легко перемешивалась на всем протяжении реакции, осадок быстро растворялся.
Бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфонат марганца(II) (H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О представляет собой негигроскопичное соединение, легко размалывающееся до светло-розового порошка. Визуально наблюдаемое его отличие от полученного в реакции (5) продукта обусловлено присутствием бис (моноэтаноламиний)сульфата
(H 3 NCH 2 CH 2 OH) 2 SO 4 . Синтезированный из моноэтаноламина и серной кислоты, он представлял собой бесцветную стекловидную чрезвычайно гигроскопичную массу, покрывающуюся влажной пленкой вследствие поглощения атмосферной влаги.
2 H 2 NCH 2 CH 2 OH + H 2 SO 4 = (H 3 NCH 2 CH 2 OH) 2 SO 4 (6)
Соединение подвергали размолу до крупнозернистого порошка, влажную пленку смывали ацетоном, полученный сухой порошок хранили в запаянной трубке или под плотной пробкой.
Существенную разницу в протекании вышеописанных реакций можно объяснить следующим образом. В водном растворе имеет место равновесие тетракис(моноэтаноламиниевой) соли
ОЭДФ согласно уравнениям (7)–(10).
(H3NCH2CH2OH)H3L = (H3NCH2CH2OH)+ + H3L–(7)
(H3NCH2CH2OH)2H2L = 2 (H3NCH2CH2OH)+ + H2L2–(8)
(H3NCH2CH2OH)3HL = 3 (H3NCH2CH2OH)+ + HL3–(9)
(H3NCH2CH2OH)4L = 4 (H3NCH2CH2OH)+ + L4–(10)
Прибавление к этому раствору сульфата марганца вызывало быстрое выпадение труднорастворимого H2MnL из-за высокой концентрации H2L2–. Иная ситуация складывалась, когда к раствору MnSO 4 + H 4 L прибавляли моноэтаноламин. Равновесие реакции
MnSO 4 + H 4 L = H 2 MnL + H 2 SO 4
сдвинуто влево, вследствие чего осадок H2MnL не выпадал. В растворе присутствовали Mn2+, SO 4 2‒, H+, H 3 L‒, H 2 L2‒. Добавленный H 2 NCH 2 CH 2 OH быстро взаимодействовал с катионами H+, давая моноэтаноламиниевую соль (H 3 NCH 2 CH 2 OH)+. Последняя реагировала прежде всего с анионами SO 4 2‒, H 3 L‒, H 2 L2‒.
2 (H 3 NCH 2 CH 2 OH)+ + SO 4 2‒ = (H 3 NCH 2 CH 2 OH) 2 SO 4
(H 3 NCH 2 CH 2 OH)+ + H 3 L‒ = (H 3 NCH 2 CH 2 OH)H 3 L
2 (H 3 NCH 2 CH 2 OH)+ + H 2 L2‒ = (H 3 NCH 2 CH 2 OH) 2 H 2 L
Осадок труднорастворимого H 2 MnL получался в результате конкурирующей реакции
Mn2+ + H2L2‒ = H2MnL в условиях небольшой концентрации дианиона H2L2‒ и превращался в растворимый (H3NCH2CH2OH)2MnL по реакции 2.
Сделанная попытка использовать вместо моноэтаноламина водный раствор аммиака не привела к успеху. В реакции сульфата марганца(II) с тетрааммониевой солью ОЭДФ был получен труднорастворимый продукт состава 2(NH 4 )HMnL·H 2 MnL.
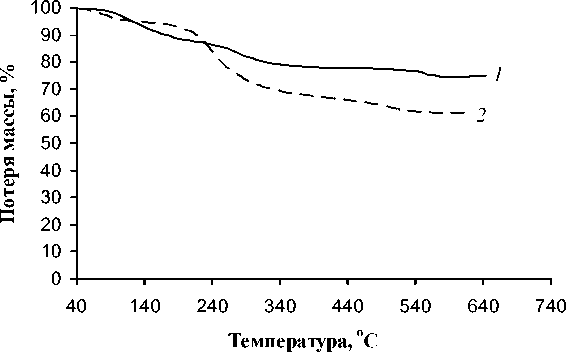
Устойчивость на воздухе порошкообразных препаратов, предназначенных для использования в качестве микрокомпонентных добавок в минеральные удобрения, представляется необходимым качеством, обеспечивающим долговременное хранение без потери растворимости. Дигидрат бис (моноэтаноламиний)(1-гидроксиэтилиден)дифосфоната марганца (H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О при хранении в течение 1 года сохранил способность растворяться в воде. Данные термогравиметрического анализа (рис. 2) свидетельствуют о несколько меньшей его термической устойчивости по сравнению с исходным тригидратом (1-гидроксиэтилиден)дифосфоната марганца(II) H2MnL·3Н2О, что обусловлено существенно большей органической составляющей в структуре молекулы. При нагревании до 640 °С соединения теряют соответственно 25 и 37 % от первоначальной массы. У первого из них наиболее интенсивные потери протекают при 118, 178, 276 и 553 °С, у второго при 82, 241 и 499 °С. Низкотемпературные пики на кривых дифференциальной термогравиметрии (ДТГ) (118 и 82 °С) следует отнести на потери молекул воды. В кристаллическом соединении H 2 MnL·3Н 2 О кристаллогидратная вода удерживается более прочно, чем в аморфном (H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О.
а)
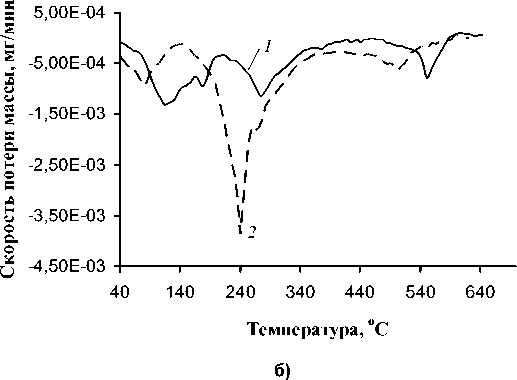
Рис. 2. Термический анализ (1-гидроксиэтилиден)дифосфоната марганца(II) тригидрата H 2 MnL · 3Н 2 О ( 1 ) и бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфоната марганца(II) дигидрата (H 3 NCH 2 CH 2 OH) 2 MnL · 2Н 2 О ( 2 ): а – ТГА, б – ДТГ
Выводы
Бис (моноэтаноламиний) (1-гидроксиэтилиден)дифосфонат марганца(II)
(H 3 NCH 2 CH 2 OH) 2 MnL·2Н 2 О, полученный в сухом виде из карбоната марганца, (1-гидроксиэтилиден)дифосфоновой кислоты и моноэтаноламина, показал высокую растворимость в водной среде (20 г в 100 мл Н 2 О), что позволяет использовать его в качестве микроком-понентной добавки в удобрения.
Смесь (1-гидроксиэтилиден)дифосфоната марганца(II) (H3NCH2CH2OH)2MnL с бис(моноэтаноламиний)сульфатом (H3NCH2CH2OH)2SO4, синтезированная из тет- ра(моноэтаноламиниевой) соли (1-гидроксиэтилиден)дифосфоновой кислоты (H3NCH2CH2OH)4L и сернокислого марганца(II), образует устойчивый водный раствор, однако после выделения в сухом виде теряет растворимость.


