Поражение заразихой (Orobanche сumana Wallr.) образцов подсолнечника коллекции ВИР и молекулярное дифференцирование контрастных по устойчивости растений
Автор: Челюстникова Т.А., Гучетль С.З., Арасланова Н.М., Антонова Т.С.
Рубрика: Защита растений и иммунология
Статья в выпуске: 2 (148-149), 2011 года.
Бесплатный доступ
Выполнена оценка устойчивости 500 образцов культурного подсолнечника из мировой коллекции ВИР к высоковирулентной популяции заразихи из Тацинского района Ростовской области. Полностью устойчивых образцов не обнаружено, однако они дифференцированы на группы с разной степенью пораже-ния. Выделены образцы с распределением тестированных растений на восприимчивые и полностью устой-чивые. ПЦР анализ ДНК показал генетическую неоднородность устойчивых и восприимчивых растений. Определены локусы, полиморфные для этих групп растений.
Подсолнечник, заразиха, устойчивость, полиморфизм
Короткий адрес: https://sciup.org/142151005
IDR: 142151005 | УДК: 633.854.78:631.52
Текст научной статьи Поражение заразихой (Orobanche сumana Wallr.) образцов подсолнечника коллекции ВИР и молекулярное дифференцирование контрастных по устойчивости растений
Подсолнечник – один из значимых источников растительного масла в мире и основной – в Российской Федерации. В настоящее время мощным ограничивающим фактором в производстве подсолнечника в Ростовской и Волгоградской областях, а также в ряде районов Ставропольского и Краснодарского краев является заразиха ( Orobanche сumana Wallr.). Заразиха – паразитическое цветковое растение, не содержащее хлорофилла, использует воду, а также органические и минеральные вещества растения-хозяина, обладает высоким потенциалом воспроизводства. Поражение подсолнечника заразихой значительно снижает урожай, а многочисленные осыпающиеся семена засоряют почву, сохраняя всхожесть до 20 лет, ухудшая тем самым состояние посевов в последующие годы.
Основным способом борьбы с этим злостным сорняком является поиск источников генетической устойчивости к новым вирулентным расам паразита и вовлечение их в селекционные программы. Более высока вероятность обнаружения генов устойчивости в коллекциях дикорастущих видов, однако существует некоторая устойчивость к заразихе и у культурного подсолнечника [1; 2].
Использование молекулярных технологий позволяет избежать фенотипических ошибок при отборах, дает возможность сократить сроки для создания материала с генами устойчивости к новым расам заразихи и таким образом ускорить селекционный процесс. Молекулярные маркеры, сцепленные с генами устойчивости к заразихе, могут стать полезным инструментом для контроля переноса генов и быстрой идентификации индивидов с интересующим селекционеров признаком [1; 3; 4].
Tang и соавторы (2003) идентифицировали молекулярные маркеры, сцепленные с геном Or5 , определили положение этого локуса на молекулярной генетической карте подсолнечника [3]. Авторы предполагают, что эта область ответственна у подсолнечника за генетическую устойчивость к заразихе расы Е. Lu и соавторы (2000) идентифицировали пять SCAR (sequence characterized amplified region) маркеров в одной группе сцепления с геном Or5 . Предложенная группа маркеров может быть использована для проведения массового сегрегационного анализа, для насыщения зоны, приближенной к гену Or5, новыми молекулярными маркерами [4]. Солоденко с соавторами, (2003) выявили полиморфные фрагменты амплификации ДНК, дифференцирующие устойчивые и восприимчивые к заразихе растения, определили сцепление молекулярного маркера и локуса Or3 [5]. Используя опыт и результаты исследований, проведенных в мире, мы начали молекулярное дифференцирование устойчивых и восприимчивых растений подсолнечника к заразихе, собранной в регионах РФ.
Целью нашей работы являлась оценка устойчивости образцов подсолнечника коллекции ВИР к заразихе и поиск молекулярных различий между устойчивыми и восприимчивыми растениями.
Материалы и методы. Для выявления устойчивых к заразихе генотипов использованы 500 образцов мировой коллекции культурного подсолнечника ВИР и испанская линия Р 96, устойчивая к расам заразихи от А до F.
Семена подсолнечника сеяли в короба, заполненные смесью просеянной почвы с речным песком в соотношении 3:1. В почвенную смесь вносили семена заразихи, собранные в Тацинском районе Ростовской области, из расчета 200 мг семян на 1 кг почвы. По ранее опубликованным данным, в этой популяции заразихи высока концентрация высоковирулентных рас E, F,G [6].
Растения подсолнечника выращивали в теплице в течение 30 дней при температуре 22-25°С при 16 часовом фотопериоде. Через 30 дней после появления всходов проводили их оценку на устойчивость к заразихе. Восприимчивыми считались растения, на корнях которых были обнаружены клубеньки заразихи или сформировавшиеся побеги; устойчивыми – растения, на корнях которых не было обнаружено здоровых клубеньков и побегов, но были видны многочисленные некрозы клеток в области проникновения проростков заразихи и погибшие клубеньки. Учитывали процент пораженных растений и степень поражения. Степень поражения учитывали как среднее количество клубеньков и цветоносов паразита на одно поражённое растение. В качестве контроля был использован сорт ВНИИМК 8883, не обладающий устойчивостью к современным расам O. сumana .
Для молекулярного анализа отбирали по два настоящих листа с растения. Выделение ДНК проводили по модифицированному методу Saghai-Maroof et аl. [7]. Ткани листьев гомогенизировали с 0,9 мл СТАВ буфера, в течение часа инкубировали при температуре 65 оС. Затем добавляли половину объема смеси хлороформа и изоамилового спирта (24 : 1) и тщательно перемешивали с последующим центрифугированием. Очистку хлороформом проводили дважды. Осаждение ДНК проводили охлажденным до -20 оС изопропаноловым спиртом. Подсушенную ДНК растворяли в течение 12 часов в стерильной воде. Концентрацию ДНК в полученном препарате определяли по интенсивности свечения пробы объемом 10 мкл в ультрафиолетовом свете в 1 % -ном агарозном геле с содержанием бромистого этидия.
Для проведения полимеразной цепной реакции использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 2,5 мM MgCl2; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозид фосфатов; по 10 пМ прайме- ров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Москва, ГосНИИгенетика). Амплификацию проводили в приборе Терцик (ДНК-технология, Россия). Для амплификации ДНК применяли нуклеотидные последовательности пяти пар SCAR-праймеров, сконструированных [4] (см. табл. 2). Термальный режим реакций подбирали для каждой пары праймеров с учетом их нуклеотидного состава. Для большинства проведенных реакций оптимальным оказался режим амплификации с начальной денатурацией при 96 оС в течение 2 мин, затем 30 циклов при соблюдении тем-пературно-времен-ного режима: отжиг при 60-65 оС в течение 40 сек, элонгация – 1 мин при 70 оС, денатурация при 94 оС – 30 сек, финальная элонгация – 2 мин.
Электрофоретическое разделение продуктов амплификации проводили в агарозном геле (2 % агароза, 1×ТАЕ-буфер) с использованием камеры для горизонтального электрофореза (SE.1, ДНК-технология, Россия) в течение 1-1,5 часов при силе тока 50 mA, напряжении 90-100 V. Документирование результатов электрофореза обеспечивалось при помощи гель-документирующей видеосистемы BIO-PRINT (Vilber Lourmat, Франция).
Результаты и обсуждение. Расовый состав популяций заразихи динамичен, находится в зависимости от преобладающего сортимента подсолнечника в регионе. Задачей селекционеров является поиск источников устойчивости к новым вирулентным расам и создание сортов и гибридов с привнесением в них генов устойчивости. В связи с этим и проведена оценка устойчивости образцов культурного подсолнечника мировой коллекции ВИР, различающихся по происхождению. Результаты приведены в таблице 1. Большая часть тестированного материала в разной степени, но стопроцентно поражалась заразихой. По степени поражения образцы коллекции ВИР условно можно разделить на три группы. Первая группа включает образцы со степенью поражения на уровне контроля. В нее вошли образцы: 2982 (из Испании), 2925 (из Франции), 2995 (из Португалии), 3020 (из Венгрии), 3074 и 3080 (из Мексики). Среднее количество клубеньков и побегов заразихи на одно поражённое растение у этих образцов было в пределах от 96 до 121. Вторая группа со средней степенью поражения от 58 до73 включает образцы: 2930 (из
Франции), 2975 (из Австралии), 2978 (из Испании), 2988 (из Болгарии), 3004 (из Югославии), 3015 (из Венгрии).
Таблица 1
Поражение некоторых образцов подсолнечника коллекции ВИР заразихой (O. сumana) при искусственном заражении в теплице
|
№ п/п |
№ каталога |
Происхождение |
Учетных расте-ний, шт. |
Пораженных растений, % |
Степень поражения |
|
|
1 |
2925 |
Франция |
30 |
100 |
110 |
|
|
2 |
2930 |
Франция |
30 |
100 |
61 |
|
|
3 |
2931 |
Франция |
31 |
100 |
20 |
|
|
4 |
2938 |
Аргентина |
34 |
100 |
12 |
|
|
5 |
2953 |
Аргентина |
30 |
89 |
11 |
|
|
6 |
2954 |
Аргентина |
30 |
82 |
12 |
|
|
7 |
2973 |
Австралия |
30 |
90 |
28 |
|
|
8 |
2975 |
Австралия |
30 |
100 |
73 |
|
|
9 |
2978 |
Испания |
30 |
100 |
62 |
|
|
10 |
2982 |
Испания |
31 |
100 |
121 |
|
|
11 |
2988 |
Болгария |
30 |
100 |
58 |
|
|
12 |
2995 |
Португалия |
30 |
100 |
96 |
|
|
13 |
2996 |
Португалия |
31 |
100 |
89 |
|
|
14 |
3004 |
Югославия |
30 |
100 |
68 |
|
|
15 |
3015 |
Венгрия |
29 |
100 |
65 |
|
|
16 |
3020 |
Венгрия |
30 |
100 |
98 |
|
|
17 |
3074 |
Мексика |
30 |
100 |
97 |
|
|
18 |
3080 |
Мексика |
30 |
100 |
115 |
|
|
19 |
Р 96 |
Испания |
30 |
78 |
12 |
|
|
19 |
ВНИИМК 8883, контроль |
30 |
100 |
115 |
||
Особенно интересна третья группа образцов, степень поражения которых была в пределах от 12 до 28 экземпляров заразихи на растение. Она включает образцы: 2931 (из Франции), 2973 (из Австралии), 2938, 2953 и 2954 (из Аргентины) и линию Р 96, созданную в Испании, не входящую в коллекцию ВИР и обладающую устойчивостью к расам от А до F. Среди тестированных образцов подсолнечника 2973, 2953, 2954 и Р 96 наблюдалось расщепление на непораженные и поражённые в слабой степени экземпляры.
Для выяснения причины различий по устойчивости к заразихе среди учетных растений внутри образцов, выполнено сравнение ДНК, выделенной отдельно из пяти пораженных и пяти непораженных растений образцов 2953, 2954 и линии Р 96. В нашей работе с популяцией заразихи, состоящей из смеси рас, учитывалось известное предположение [5], что гены устойчивости к ней расположены кластерно, подобно генам устойчивости к ложной мучнистой росе – Pl 1, Pl 2 и Pl 6, формирующим кластер и сцепленным с одними и теми же ДНК маркерами. Поэтому были использованы 5 локусов ДНК (табл. 2), предложенные Lu et al. (2000) [4], как характеризующие устойчивость к расе Е заразихи.
Таблица 2
Характеристика SCAR маркеров, использованных для дифференциации контрастных по устойчивости к заразихе растений подсолнечника
ВНИИМК 2011 г.
|
Назва ние локусов |
Последовательность фланкирующих праймеров 5’-3’ |
Полиморфизм в образцах |
||
|
Р 96 |
2953 |
2954 |
||
|
RTS 05 |
TGGTCGCAGATGGACGTGTGGGTG GTCGCAGAGAGTGAGAGAGAGTGT |
+ |
+ |
+ |
|
RTS28 |
AGTAGACGGGCAAAGCGAAAGGAT AGTAGACGGGTTGAATATGTTGAA |
- |
+ |
+ |
|
RTS29 |
GCTTCCCCTTAATGATCCGGAAGA GCTTCCCCTTGGCTAGAAGATGAA |
- |
- |
- |
|
RTS40 |
TCCACCGAGCTACCAGTTCCGGAG TCCACCGAGCGAGCATATTCCGAG |
- |
- |
- |
|
RTS43 |
CGGAGAGCGAGCATAGGGTCAGGT CGGAGAGCGACGACATCATTCCAA |
- |
- |
- |
|
( + ) - есть полиморфизм между пораженными и непораженными растениями; (- ) – нет полиморфизма между пораженными и непораженными растениями |
||||
При проведении амплификации ДНК по приведенным в таблице 2 пяти локусам получены следующие результаты. По локусам RTS29, RTS40 и RTS43 продукты амплификации ДНК у пораженных и непораженных растений не отличались. Отличия в ампликонах получены по локусам RTS05 и RTS28. По локусу RTS28 у пораженных и непораженных растений линии Р 96 амплифицированы одинаковые фрагменты ДНК. У непораженных растений образцов 2953 и 2954 обнаружены более интенсивные фракции и, возможно, при использовании других методов разделения продуктов реакции будут визуализированы различия по количеству фрагментов. Продукты амплификации ДНК по локусу RTS05 различали пораженные и непораженные растения у образцов 2953, 2954 и линии Р 96 (рисунок). У восприимчивых растений присутствовала фракция ДНК 650 п.н. Это указывает на генетическую неоднородность внутри указанных образцов, различающихся и по устойчивости к вирулентным расам заразихи. Поэтому локус RTS 05 можно в дальнейшем использовать как маркерный при анализе растений, устойчивых и восприимчивых к высоковирулентным расам заразихи.
Выводы . Среди 500 образцов культурного подсолнечника коллекции ВИР не выявлено полностью устойчивых к высоковирулентной популяции заразихи из Тацинского-района Ростовской области. Однако образцы различались по степени поражения. Обнару-
ISSN 0202-5493. МАСЛИЧНЫЕ КУЛЬТУРЫ. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур. Вып.2 (148-149), 2011
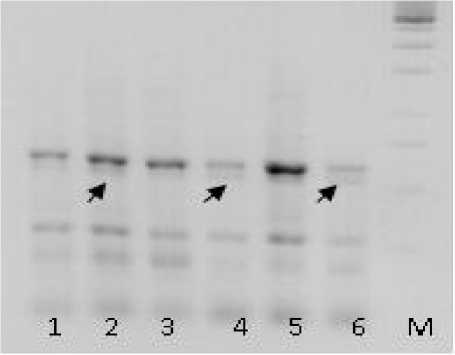
Рисунок – Электрофоретические спектры продуктов амплификации ДНК у устойчивых и восприимчивых растений подсолнечника по локусу RTS 05.
Дорожки: 1, 3, 5 – устойчивые растения; 2, 4, 6 – восприимчивые растения; образцы: 1, 2 – Р 96; 3, 4 – 2953; 5, 6 – 2954; М – маркер молекулярного веса 1 кb; стрелкой указана полиморфная зона 650 п.н.
-
3. Tang, S. Genetic mapping of the Or5 gene for resistance to Orobanche race E in sunflower / S. Tang, A. Heesacker, V.K. Kishore, A. Fernandez, E. Sadik, G. Cole, St. Knapp. // Crop. Sci. – 2003. –V.43. – P. 1021-1028.
-
4. Lu, Y.H. Development of SCAR markers linked to the gene Or5 conferring resistance to broomrape ( Orobanche cumana Wallr.) in sunflower / Y.H. Lu, J.M. Melero-Vara, J.A. Blanchard // TAG. – 2000. – 100. – P. 626-632.
-
5. Солоденко, А.Е. Маркирование гена устойчивости к заразихе Or3 у подсолнечника / А.Е. Солоденко, А. В. Саналатий, В.В. Толмачев, К.В. Ведмедева, Ю.М. Сиволап // Цитология и генетика. – 2005. – С. 9-12.
-
6. Антонова, Т.С. Вирулентность заразихи, поражающей подсолнечник в Волгоградской и Ростовской областях / Т.С. Антонова, Н.М. Арасланова, С.А. Рамазанова, С.З. Гучетль, Т.А. Челюстникова // Масличные культуры: Науч.-тех. бюл. ВНИИМК. – 2009. – Вып.1 (140). – С. 31-37.
-
7. Saghai-Maroof, M.A. Ribosomal DNA spacer-length polymorphisms in barley: Mende-lian inheritance, chromosomal location, and population dynamics / M.A. Saghai-Maroof, K.M. Soliman, R.A. Jorgensen, R.W. Allard // PNAS USA. – 1984. – 81. – P. 8014-8018.
жено четыре образца с разделением на устойчивые и восприимчивые растения. Методом ПЦР ДНК по двум SCAR локусам найдены генетические отличия у пораженных и непораженных растений внутри образцов. Локус RTS 05 пригоден для использования в качестве маркерного при анализе растений, устойчивых и восприимчивых к высоковирулентным расам.
Исследования выполнены при финансовой поддержке РФФИ, грант № 11-04-96502.
В.А. Гавриловой и к. с-х. н. В.Т. Рожковой за любезно предоставленный семенной материал подсолнечника из коллекции ВИР.


