Последовательная бронхопластическая верхняя лобэктомия - хирургический компонент мультимодального лечения синхронного двухстороннего первично-множественного немелкоклеточного рака легкого
Автор: Кит О.И., Туркин И.Н., Харагезов Д.А., Лазутин Ю.Н., Лейман И.А., Чубарян А.В., Мирзоян Э.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Актуальность. Рак легкого (РЛ) является основной причиной смерти от рака у мужчин как в России, так и в зарубежных странах. Хирургическое вмешательство является основным методом лечения ранних стадий немелкоклеточного рака легкого (НМРЛ). Однако с увеличением распространенности процесса возрастает риск метастазирования, а эффективность хирургического метода снижается. Тактика лечения пациентов с одним НМРЛ отработана, но при наличии 2 и более опухолей, особенно в обоих легких, правильный выбор обусловлен множеством дополнительных факторов. Взгляд на хирургическое лечение синхронного первично-множественного НМРЛ кардинально изменился, вместе с тем больные с местнораспространенным синхронным НМРЛ часто лечатся консервативно, а для тех, кто подвергается оперативному вмешательству, прогностические факторы неясны. В настоящее время доказано, что прогноз заболевания после хирургического лечения по поводу двухстороннего синхронного первично-множественного НМРЛ является благоприятным. Считается, что пневмонэктомия не оказывает отрицательного влияния на выживаемость, но в сериях хирургического лечения синхронного НМРЛ с большим удельным весом данного вмешательства послеоперационная летальность, по данным некоторых авторов, увеличивается до 4,3-6,9 %, т. е. в 1,5-2 раза. Описание. Наше сообщение содержит описание редкого применения расширенной бронхопластической верхней лобэктомии в качестве хирургического компонента комплексного лечения больного двухсторонним синхронным НМРЛ. Наш опыт показывает, что последовательное применение современных медицинских технологий позволяет добиться удовлетворительных отдаленных результатов лечения. Заключение. Представленное клиническое наблюдение в силу своей уникальности будет полезно для выработки тактики и планирования лечения синхронного местнораспространенного НМРЛ.
Рак легкого, множественный, синхронный, хирургическое лечение, мультимодальная терапия, прогноз
Короткий адрес: https://sciup.org/140295072
IDR: 140295072 | УДК: 616.24-006.6-089 | DOI: 10.21294/1814-4861-2022-21-3-143-150
Текст научной статьи Последовательная бронхопластическая верхняя лобэктомия - хирургический компонент мультимодального лечения синхронного двухстороннего первично-множественного немелкоклеточного рака легкого
Актуальность
Рак легкого (РЛ) остается актуальной проблемой современной онкологии из-за роста показателей заболеваемости и смертности [1]. Хирургическое вмешательство является основным методом лечения ранних стадий НМРЛ. По мере прогрессирования заболевания возрастает риск метастазирования, а эффективность хирургического метода снижается. Тактика лечения пациентов с одним НМРЛ отработана, в то время как при наличии двух и более опухолей, особенно в обоих легких, правильный выбор обусловлен множеством дополнительных факторов. В отсутствие экстраторакальных метастазов двухсторонняя патология может представлять собой как независимые первичные опухоли, так и внутриле-гочные метастатические очаги [2]. Очевидно, что в первом случае хирургическое вмешательство принесет больному пользу, тогда как во втором не повлияет на исход ставшего системным заболевания, возможно, ухудшив качество жизни. Представленные данные свидетельствуют о сложности рассматриваемой проблемы. В нескольких ранних исследованиях сообщалось об отсутствии длительной выживаемости больных, перенесших операцию, отсюда, независимо от, вероятно, различного биологического поведения, сложилось мнение о плохом прогнозе мультифокальных опухолей [3]. Вместе с тем медиана общей выживаемости пациентов с ранними стадиями синхронного первично множественного рака легкого при противопоказаниях к хирургическому лечению в результате мультимодальной консервативной терапии достигает 31 мес [4].
Возможности дифференцировать первичномножественные раки легкого для определения показаний к радикальному хирургическому лечению постоянно совершенствуются на базе молекулярногенетических исследований [2]. Разработанные ранее общие критерии независимой первичности, к сожалению, не помогают больным синхронным раком, т. к., например, около 50,8–57,9 % опухолей имеют сходное морфологическое строение, а правильная оценка вовлеченности медиастинальных лимфатических узлов (N2) до операции сложна [5]. Несмотря на неопределенность в отношении тактики ведения, в исследованиях последних лет сообщается о длительной выживаемости больных двухсторонним синхронным НМРЛ после хирургического лечения [6, 7].
Поскольку сегодня есть возможности для улучшения результатов лечения синхронного рака легкого, нами представлено клиническое наблюдение больного двухсторонним центральным первично-множественным НМРЛ, перенесшего комплексную терапию с хорошим отдаленным результатом. Несмотря на изначальную распространенность опухолевого процесса, основой успеха мультимодальной терапии, несомненно, стало радикальное органосохраняющее хирургическое лечение. В литературе не встретилось сообщений о последовательном выполнении расширенной бронхопластической верхней лобэктомии с обеих сторон как оптимальной опции хирургического компонента комплексного лечения.
Описание клинического случая
Больной К., 61 г., курит более 35 лет, обратился в Ростовский НИИ онкологии с жалобами на сухой кашель, одышку при физической активности. Считает себя больным с марта 2018 г., когда изменился характер кашля. При КТ органов грудной клетки заподозрен центральный рак верхней доли левого легкого, в связи с чем пациент самостоятельно обратился в институт.
При обследовании, по данным КТ грудной клетки (19.04.18): центральный перибронхиально-узловой рак левого легкого 5,0×5,5 см с поражением верхнедолевого и дистальных отделов левого главного бронхов (рис. 1). А также центральный перибронхиально-узловой рак правого легкого с поражением верхнедолевого бронха. Гиповентиляция и пульмонит верхних долей обоих легких. Определялись лимфатические узлы кпереди от дуги аорты, диаметром 2,2 см, рерокавальные – 1,3 см (рис. 2). По данным фибробронхоскопии (28.04.2018): справа просвет В3 щелевидно сужен за счет давления извне с признаками подслизистой инфильтрации; слева просвет верхнего долевого бронха на 4/5 перекрыт экзофитной опухолью (рис. 3). Гистологическое исследование: 1) из В3 справа №40978–82/18 – очаги плоскоклеточной карциномы; 2) из верхнего долевого бронха слева № 40983–88/18 – очаги плоскоклеточной карциномы.
На основании результатов обследования установлен диагноз первично-множественный синхронный рак с поражением обоих легких: Рак левого легкого: центральная периброхиально-узловая форма с поражением верхнего долевого
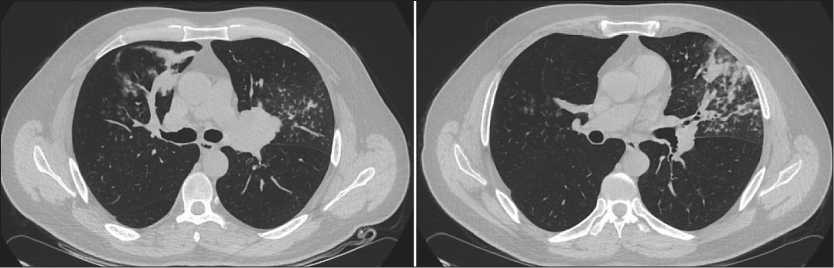
Рис. 1. КТ органов грудной клетки до лечения: центральная перибронхиально-узловая опухоль левого легкого 5,0×5,5 см с поражением верхнедолевого бронха и дистальных отделов левого главного бронха
Fig. 1. Сhest СT before treatment: central peribronchial nodular tumor of the left lung measuring 5.0×5.5 cm with invasion of the upper lobe bronchus and distal portion of the left main bronchus
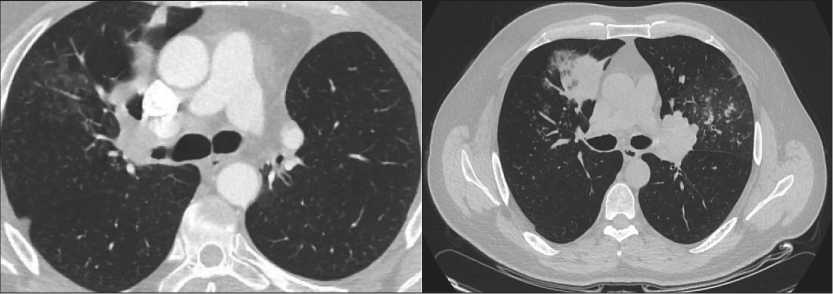
Рис. 2. КТ органов грудной клетки до лечения: центральная перибронхиально-узловая опухоль правого легкого с поражением верхнедолевого бронха
Fig. 2. Сhest СT before treatment: central peribronchial nodular tumor of the right lung with invasion of the upper lobe bronchus
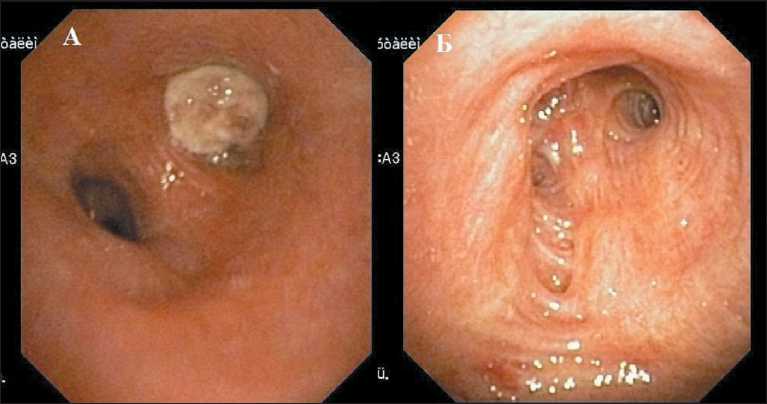
Рис. 3. Фибробронхоскопия до лечения: А) вид из левого главного бронха, Б) вид из правого главного бронха Fig. 3 Fibrotracheobronchoscopy before treatment: А) view from the left main bronchus, B) view from the right main bronchus
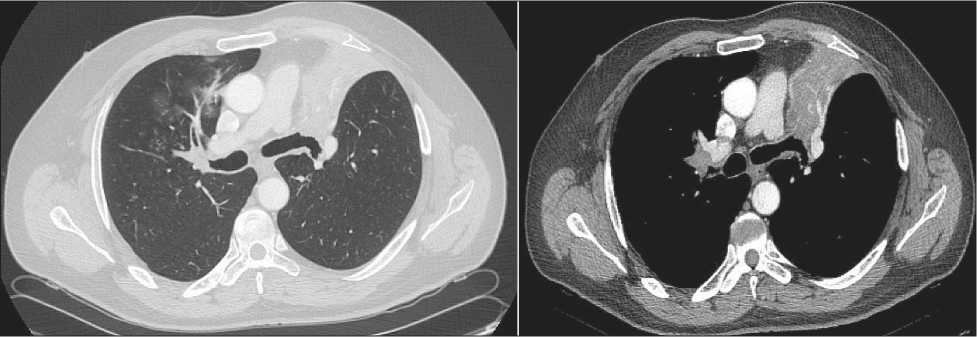
Рис. 4. КТ органов грудной клетки до лечения после завершения индукционной химиоиммунотерапии Fig. 4. Сhest СT after completion of induction chemoimmunotherapy
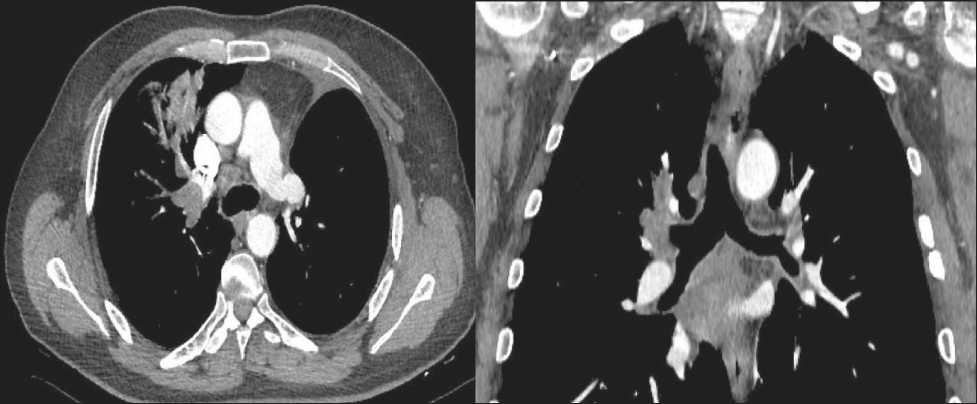
Рис. 5. КТ органов грудной клетки до лечения перед второй операцией с правой стороны Fig. 5. Сhest СT prior to the second surgery on the right side
и дистального отдела левого главного бронха сТ2N2M0, IIIА стадия; Рак правого легкого: центральная перибронхиально-узловая форма с поражением верхнего долевого бронха сТ1N2M0, IIIА стадия.
Решением консилиума с учетом локо-регионар-ной распространенности опухоли первым этапом лечения решено провести 3 курса индукционной химиоиммунотерапии по схеме цисплатин – 80 мг/м2 + гемцитабин – 1600 мг/м2 с рекомбинантным фактором некроза опухоли-тимозин альфа-1 – 150.000 МЕ/м2 [8]. Лечение проведено в период с 18.05. по 26.07.18.
После завершения курсов индукционной химиоиммунотерапии проведена контрольная КТ (10.08.18), на которой визуализирована центральная опухоль левого легкого с поражением верхнего долевого и дистального отдела левого главного бронха, без определяемых четких размеров, сливающаяся с ателектазированной легочной тканью. Ателектаз верхней доли левого легкого. Перибронхиально верхнему долевому бронху спра- ва плотная ткань, деформирующая его просвет. Участки гиповентиляции верхней доли справа. Лимфатические узлы аортального окна – 1,3 см, предаортальные – 1,3 см с жировыми включениями, ретрокавальные – 1,6 см с жировыми включениями, бифуркационные – 1,3 см (рис. 4).
При оценке эффективности индукционной терапии с использование критериев REСIST 1.0 динамика расценена как частичный ответ, в связи с чем принято решение о хирургическом лечении. 3.09.18 выполнена расширенная верхняя бронхопластическая лобэктомия слева с резекцией 3 хрящевых полуколец левого главного бронха и нижнего долевого бронха на уровне устья В6 с формированием прямого межбронхиального анастомоза между главным и нижним долевым бронхами «конец в конец».
Послеоперационный период протекал без особенностей. Послеоперационное гистологическое исследование: высокодифференцированная плоскоклеточная карцинома с ороговением и очагами некроза, по линии резекции бронхов без признаков опухолевого роста; в 5 из 6 исследованных бронхопульмональных лимфатических узлах – метастазы плоскоклеточной карциномы, в лимфатических узлах корня легкого, «аортального окна» и зоны бифуркации трахеи метастазов нет.
Через 3 нед проведено контрольное обследование, при КТ органов грудной клетки (13.10.18): состояние после расширенной верхней лобэктомии слева. Перибронхиально вдоль верхнего долевого бронха плотная ткань, деформирующая просвет бронха. Участки гиповентиляции верхней доли справа. Ретрокавальные лимфатические узлы, диаметром до 2 см (рис. 5). Фибробронхоскопия (19.10.18): состояние после бронхопластической верхней лобэктомии слева. Межбронхиальный анастомоз состоятельный, слизистая оболочка без признаков воспаления. Справа В3 щелевидно сужен за счет давления извне с признаками подслизистой инфильтрации верхнего долевого бронха (рис. 6).
Через 2 мес после первой операции 30.10.18 выполнена расширенная бронхопластическая верхняя лобэктомия справа с циркулярной резекцией 2 хрящевых полуколец правого главного и одного полукольца промежуточного бронхов и наложением межбронхиального анастомоза «конец в конец». Послеоперационный период протекал без осложнений. Послеоперационное гистологическое исследование: умереннодифференцированная плоскоклеточная карцинома с ороговением; линии резекции бронхов без признаков опухолевого роста; в лимфатических узлах корня правого легкого, паратрахеальных справа – метастазы плоскоклеточной карциномы.
На основании результатов морфологического исследования установлен постхирургический патологический диагноз: первично-множественный
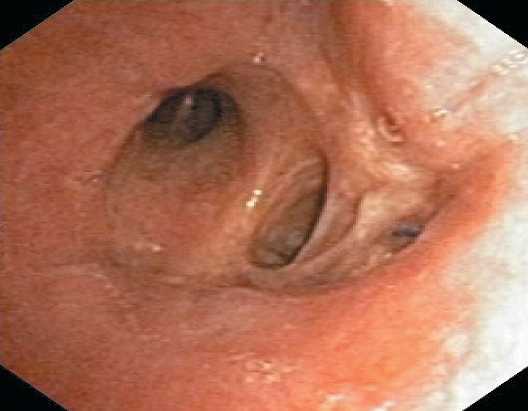
Рис. 6. Фибробронхоскопия: межбронхиальный анастомоз состоятельный без признаков воспаления и деформации.
Бронхи нижней доли проходимы
Fig. 6. Fibro-tracheo-bronchoscopy: consistent interbronchial anastomosis without signs of inflammation and deformation. The bronchi of the lower lobe are permeable синхронный рак с поражением обоих легких: Рак левого легкого: центральная перибронхиально-узловая форма с поражением верхнего долевого и дистального отдела левого главного бронха руТ2N1M0 G1R0, IIB стадия; Рак правого легкого: центральная перибронхиально-узловая форма с поражением верхнего долевого бронха pyТ1N2M0G2R0, IIIА стадия. Для определения дальнейшей тактики лечения проведен консилиум в составе: торакального хирурга-онколога, радиолога и химиотерапевта. С учетом достаточной эффективности индукционной химиотерапии рекомендовано проведение 4 курсов адъювантной химиотерапии комбинацией карбоплатины AUC 5–6 и гемцитабина 1000 мг/м2 с интервалом 28 дней.
С 24.11.18 по 31.01.19 проведено 2 курса адъювантной химиотерапии, которые сопровождались тромбоцитопенией IV степени, потребовавшей повторных трансфузий тромбоконцентрата. С 1.03.19 по 15.04.19 проведено еще 2 курса адъювантной химиотерапии, с редукцией дозы гемцитабина на 50 %. После завершения лекарственного лечения с 20.05.19 по 14.06.19 на линейном ускорителе Novalis TX, Varian, посредством 7 статических конформных полей с использованием режима IMRT, проведена консолидирующая лучевая терапия на область корней легких и средостение РОД 2 Гр до СОД 46 Гр. С 25.07.19 по 08.08.19 проведена 3D-конформная IMRT лучевая терапия на область шейно-надключичных лимфатических узлов с обеих сторон, РОД 3 Гр, 5 фракций в неделю до СОД 39 изоГр. Лучевых реакций не отмечено, лечение перенес удовлетворительно.
При контрольном обследовании в ноябре 2020 г. по данным фибробронхоскопии: состояние после бронхопластической верхней лобэктомии слева и справа. Анастомозы состоятельны, без признаков
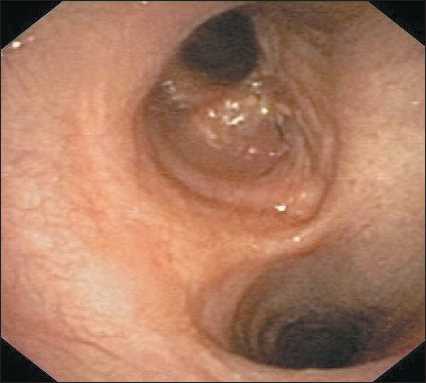
Рис. 7. Фибробронхоскопия: межбронхиальные анастомозы состоятельные, без признаков воспаления и деформации.
Нижнедолевые бронхи с обеих сторон проходимы
Fig. 7. Fibro-tracheo-bronchoscopy: consistent interbronchial anastomoses without signs of inflammation and deformation. The lower lobe bronchi on both sides are permeable воспаления и деформации. Долевые и сегментарные бронхи с обеих сторон свободно проходимы (рис. 7).
При КТ органов грудной клетки (25.01.21): пневматизация легочной ткани не изменена, без признаков эмфиземы. Состояние после бронхопластической верхней лобэктомии справа и бронхопластической верхней лобэктомии слева бронхи проходимы, Внутригрудные, аксиллярные, над- и подключичные лимфатические узлы не увеличены.
В настоящее время пациент находится под наблюдением без признаков прогрессирования, что позволяет утверждать, что мультимодальное лечение двухстороннего синхронного первично-множественного НМРЛ IIIA стадии с использованием последовательной бронхопластической верхней лобэктомии позволило добиться длительной ремиссии с сохранением хорошего качества жизни.
Обсуждение
В настоящее время показано, что прогноз заболевания у пациентов после хирургического лечения по поводу двухстороннего синхронного первичномножественного НМРЛ является благоприятным. Медиана общей выживаемости при операциях любого объема достигла 52 мес [3], 5-летняя выживаемость – 38 % [6], что значимо выше по сравнению с выживаемостью при предположительной IV стадии НМРЛ. Среди всех резекций легкого, как правило, выполняемых последовательно, двухсторонние лобэктомии производятся примерно одной трети больных. Послеоперационная летальность не превышает 2,9 % [6, 10]. Считается, что пневмонэктомия, ранее рассматриваемая как плохой прогностический фактор, не оказывает отрицательного влияния на выживаемость. Однако в сериях хирургического лечения синхронного НМРЛ с большим удельным весом данного вмешательства послеоперационная летальность увеличивается в 1,5–2 раза, до 4,3–6,9 % [9, 10]. После билатеральных лобэктомий или лобэктомий с контралатеральными сублобарными резекциями 3- и 5-летняя общая выживаемость достигает 84,5 и 75,0 % соответственно [7]. Считается, что контралатеральные сублобарные резекции при I стадии синхронного НМРЛ отрицательно не влияют на показатели 5-летней выживаемости в отличие от таких статистически значимых предикторов плохого прогноза, как мужской пол и преклонный возраст [3]. Кроме того, установлено, что самыми сильными предикторами плохого прогноза являются: степень вовлеченности внутригрудных лимфатических узлов N2 HR 1,94 по сравнению с N0 и N1 HR 1,68 по сравнению с N0, и односторонняя локализация опухолей HR 1,45 по сравнению с двухсторонней. Лучшие показатели выживаемости при двухстороннем НМРЛ обусловлены большей вероятностью истинного первично-множественного поражения с учетом расстояния между «опухолевыми полями» без очевидных признаков гематогенного метастазирования. Морфологическое сходство опухолей в качестве прогностического фактора не связано с худшей выживаемостью, наоборот, выявлена тенденция к улучшению показателей выживаемости больных опухолями одинакового гистологического строения [3].
Для иллюстрации влияния перечисленных прогностических факторов Т.Tanvetyanon et al. провели оценку выживаемости методом Каплана–Мейера в 2 группах пациентов, разделенных в зависимости от наличия таких факторов риска, как пол, возраст, распространенная стадия заболевания и локализация опухоли. Обнаружено, что больные без факторов риска имели значительно лучшую выживаемость, чем пациенты с более чем одним неблагоприятным фактором риска. Предполагаемая 5-летняя выживаемость для больных с отсутствующими факторами риска составила 82 % по сравнению с 43 % для лиц с присутствующими факторами риска [3]. Поскольку одинаково благоприятный исход не коснется всех пациентов, установленные прогностические факторы необходимы для принятия клинических решений.
Послеоперационный патологический диагноз, классифицированный по ТNМ отдельно для обеих синхронных опухолей, имеет хорошую корреляцию с прогнозом и важен для планирования адъювантной терапии первично-множественного НМРЛ. Следует отметить, что адъювантная и/ или неоадъювантная химиотерапия проводится в 25–36 % наблюдений [9–11], лучевая терапия – каждому 10-му больному синхронным раком легкого [9, 10] и нет еще данных о том, улучшают ли таргетная и иммунотерапия результаты лечения. В качестве факторов прогноза необходимо изучение генетического профиля синхронного рака легкого, влияния адъювантной терапии, состояния функции дыхательной системы и сопутствующей патологии.
Интерес нашего сообщения заключается в том, что оно содержит описание редкого применения расширенной бронхопластической верхней лобэктомии в качестве хирургического компонента комплексного лечения больного двухсторонним синхронным НМРЛ. Последовательное применение современных технологий лечения позволяет добиться удовлетворительных отдаленных результатов.
Заключение
Несмотря на редкость представленного наблюдения, можно сделать ряд практических выводов. Во-первых, органосохраняющее хирургическое вмешательство является оправданным вариантом лечения больных синхронными опухолями обоих легких даже тогда, когда двухсторонний процесс имеет сходное морфологическое строение и доподлинно неизвестно, является ли заболевание первично-множественным раком легкого. Следовательно, если пациент представляется хорошим
Список литературы Последовательная бронхопластическая верхняя лобэктомия - хирургический компонент мультимодального лечения синхронного двухстороннего первично-множественного немелкоклеточного рака легкого
- Владимирова Л.Ю., Кит О.И., ШолоховаЕ.А. Роль гистологического и молекулярного анализа в выборе метода лечения немелкокле-точного рака легкого поздних стадий. Фарматека. 2012; 8(241): 9-22. [VladimirovaL.Yu., Kit O.I., SholokhovaE.A. The role of histological and molecular analysis in the choice of treatment for advanced non-small cell lung cancer. Pharmateka. 2012; 8(241): 9-22. (in Russian)].
- Romaszko A.M., Dobo.szyn.skaA. Multiple primary lung cancer: A literature review. Adv Clin Exp Med. 2018; 27(5): 725-30. doi: 10.17219/ acem/68631.
- Tanvetyanon T., Finley D.J., Fabian T., Riquet M., Voltolini L., Kocaturk C., Fulp W.J., Cerfolio R.J., ParkB.J., Robinson L.A. Prognostic factors for survival after complete resections of synchronous lung cancers in multiple lobes: pooled analysis based on individual patient data. Ann Oncol. 2013; 24(4): 889-94. doi: 10.1093/annonc/mds495.
- Griffioen G.H., Lagerwaard F.J., Haasbeek C.J., Smit E.F., Slot-man B.J., Senan S. Treatment of multiple primary lung cancers using stereotactic radiotherapy, either with or without surgery. Radiother Oncol. 2013; 107(3): 403-8. doi: 10.1016/j.radonc.2013.04.026.
- RiquetM., CazesA., PfeutyK., Ngabou U.D., Foucault C., DujonA., Banu E. Multiple lung cancers prognosis: what about histology? Ann Tho-rac Surg. 2008; 86(3): 921-6. doi: 10.1016/j.athoracsur.2008.05.041.
- Leyn P. De, Moons J., Van.steenki.ste J., Verbeken E, Raemdonck D.V., NafteuxP., Decaluwe H., Lerut T. Survival after resection of synchronous bilateral lung cancer. Eur J Cardiothorac Surg. 2008; 34(6): 1215-22. doi:10.1016/j.ejcts.2008.07.069.
- Yang H., Sun Y., Yao F., Yu K., Gu H., Han B., Zhao H. Surgical Therapy for Bilateral Multiple Primary Lung Cancer. Ann Thorac Surg. 2016; 101(3): 1145-52. doi: 10.1016/j.athoracsur.2015.09.028.
- Лазутин Ю.Н., Сергостьянц Г.З., Пыльцин С.П., Харитонова А.П., Лейман И.А. Способ лечения рака легкого. Патент РФ № 2554750. Заявл. 13.02.2014; Опубл. 27.06.2015. [Lazutin Yu.N., Sergostyants G.Z., Pyltsin S.P., Kharitonova A.P., Leyman I.A. Method of treating lung cancer. The patent of the Russian Federation No 2554750. 27.06.2015. (in Russian)].
- Tanvetyanon T., Robinson L., Sommers K.E., Haura E., Kim J., Altiok S., Bepler G. Relationship between tumor size and survival among patients with resection of multiple synchronous lung cancers. J Thorac Oncol. 2010; 5(7): 1018-24. doi: 10.1097/JT0.0b013e3181dd0fb0.
- Voltolini L., Rapicetta C., Luzzi L., Ghiribelli C., Paladini P., Granato F., Gallazzi M., Gotti G. Surgical treatment of synchronous multiple lung cancer located in a different lobe or lung: high survival in node-negative subgroup. Eur J Cardiothorac Surg. 2010; 37(5): 1198-204. doi: 10.1016/j.ejcts.2009.11.025.
- Fabian T., Bryant A.S., Mouhlas A.L., Federico J.A., Cerfolio R.J. Survival after resection of synchronous non-small cell lung cancer. J Thorac Cardiovasc Surg. 2011; 142(3): 547-53. doi: 10.1016/j. jtcvs.2011.03.035.


