Послеоперационные осложнения при репротезировании клапанов сердца
Автор: Барбараш Леонид Семенович, Кокорин Станислав Геннадьевич, Плотников Георгий Павлович, Шукевич Дмитрий Леонидович, Григорьев Евгений Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.28, 2013 года.
Бесплатный доступ
Цель: анализ причин и структуры полиорганной недостаточности в послоперационном периоде при репротезировании клапанов сердца. Был проведен ретроспективный анализ 153 историй болезни пациентов, последовательно поступавших в клинику в 2003-2012 гг. для оперативного лечения по поводу дисфункции протезов клапанов сердца: 133 пациента (86,9%) - с IV ФК по NYHA и НК ПБ, 11 (7,2%) - с III ФК и 9 (5,9%) - II ФК. Проводилась стандартизированная базовая терапия в послеоперационном периоде. Были выделены две группы: исследуемая группа (n=51) - с развитием в послеоперационном периоде полиорганной недостаточности (ПОН), и группа сравнения (n=102) - без ПОН. Проведены межгрупповой и внутригрупповой анализы по клиническим параметрам (частота и структура органных дисфункций, длительность интенсивной терапии, летальность). ПОН выявлена у 51 пациента (33,3%), неосложненное течение или наличие дисфункции одного органа/системы - у 102 (66,7%). Исходная патология и гендерно-возрастные различия не влияли на частоту развития ПОН. Развитие ПОН отмечено только при сочетании двух и более факторов риска, преимущественно при длительном ИК (min 118 мин, max 194 мин) и трансфузии более 4 доз донорских компонентов крови (в 39 случаях, 76,5% - умеренная положительная связь, r=0,355; р=0,01). Частота ПОН не зависит от хирургической активности (r=-0,205; p=0,029), но определяет общую летальность (r=0,31; p=0,013) и длительность пребывания выживших пациентов в реанимационном отделении (5,6 дней по сравнению с 11,2 днями при ПОН; p=0,011). Не выявлено взаимосвязи между ПОН и хирургической активностью (r=-0,295; p=0,0333), общая летальность определяется развитием ПОН в послеоперационном периоде (r=0,715; p=0,0155), риск летального исхода значимо повышается при поражении трех и более органов/систем.
Репротезирование клапанов сердца, полиорганная недостаточность
Короткий адрес: https://sciup.org/14919894
IDR: 14919894 | УДК: 616.126-089.168-06
Текст научной статьи Послеоперационные осложнения при репротезировании клапанов сердца
Известно, что исходные расстройства внутрисердечной гемодинамики и/или прогрессирование инфекции на фоне протезного эндокардита являются основными причинами осложненного послеоперационного периода при репротезировании клапанов сердца [6, 9]. Вследствие воздействия различных факторов риска (исходной тяжести клинического состояния, длительности нарушений функции протезов клапанов сердца, декомпенсации недостаточности кровообращения, технической сложности оперативного вмешательства) развитие прогрессирующего системного воспалительного ответа (СВО) приводит к последующему формированию полиорганной недостаточности (ПОН) [11]. Частота развития ПОН при операциях по поводу дисфункции протезов клапанов сердца, по данным различных авторов, варьирует от 8,5 до 43,6%. При этом тяжесть поражения отдельных органов/ систем различна и во многом зависит от исходного состояния пациента [10]. Совокупность этих факторов обуславливает длительность и интенсивность терапии в реанимационном отделении [3, 7].
Цель исследования: анализ причин и структуры по-лиорганной недостаточности в послеоперационном периоде при репротезировании клапанов сердца.
Материал и методы
Проведен ретроспективный анализ 153 историй болезни пациентов, последовательно поступавших в клинику в 2003–2012 гг. для оперативного лечения по поводу дисфункции протезов клапанов сердца. Среди обследованных было 73 мужчины (47,7%), средний возраст – 46,8±12,1 лет (min 23, max 71); 80 женщин 80 (52,3%), средний возраст – 51,1±9,9 лет (min 30, max 64). Большинство (133 – 86,9%) пациентов имели IV ФК по NYHA и НК IIБ, 11 (7,2%) – III ФК и 9 (5,9%) – II ФК. В структуре
Таблица 1
Частота репротезирований клапанов сердца, полиорганной недостаточности и летальности
|
Всего |
Летальность |
ПОН |
Летальность при ПОН |
|
|
МК |
109 (71,2) |
11 (10,1) |
38 (34,9) |
8 (21,1) |
|
АК |
18 (11,8) |
1 (5,6) |
5 (27,8) |
0 |
|
ТК |
19 (12,4) |
1 (5,3) |
5 (26,3) |
0 |
|
МК+ТК |
6 (3,9) |
1 (16,7) |
2 (33,3) |
1 (50) |
|
МК+АК |
1 (0,7) |
0 |
1 (100) |
0 |
Примечание: все значения – n (%). МК – репротезирование митрального клапана, АК – аортального, ТК – трикуспидального, МК+ТК – митрального и трикуспидального, МК+АК – митрального и аортального, ПОН – полиор-ганная недостаточность, % в группе.
Таблица 2
Прогнозирование риска развития полиорганной недостаточности у кардиохирургических больных*
|
События |
Частот |
а встречаемо |
сти, % |
|
при ПОН |
без ПОН |
p |
|
|
Длительность ИК>150 мин (или повторное ИК в ближайшие 12 ч) |
76,1 |
18,3 |
0,017 |
|
Непланируемое расширение предполагаемого объема операции |
64,4 |
12,1 |
0,029 |
|
Мультифокальное атеросклеротическое сосудистое поражение |
62,9 |
30,1 |
0,049 |
|
Исходная дисфункция органа/системы |
58 |
22,5 |
0,031 |
|
Тяжесть состояния АРАСНЕ II>18 |
57,5 |
15,7 |
0,015 |
|
Выраженность системного воспаления (по уровню TREM-1, hsСRP и PCT-теста) |
78,0 |
21,9 |
0,014 |
|
Факторы |
|||
|
Концентрация нейронспецифических белков (совокупность белка S100 и НСЕ) |
49,1 |
29,1 |
0,004 |
|
Шок (ишемия/реперфузия) |
38,1 |
9,8 |
0,019 |
|
Выраженность системного воспаления (по клиническим признакам и данным стандартных биохимических тестов – CRP) |
36,5 |
21,3 |
0,035 |
|
Трансфузия более 2 доз компонентов крови |
33,9 |
28,7 |
0,0425 |
|
Повторные тканевые повреждения (рестернотомия, длительность операции и ИК) |
32,5 |
25,5 |
0,0447 |
|
Исходная тяжесть состояния EuroSCORE >2,5 |
31,1 |
19,3 |
0,027 |
Примечание: *патент РФ №2422092 27.06.2011, приоритет от 11.01.2010.
патологии, определявшей необходимость первоначального протезирования, преобладали: ревматическая болезнь сердца (РБС) – 102 (66,7%) и первичный инфекционный эндокардит (ИЭ) – 33 (21,6%); 18 пациентов (11,7%) были с синдромом соединительно-тканной дисплазии (ССТД). В 127 случаях (83%) использовались биопротезы, в 26 (17%) – механические. Характер оперативных вмешательств при репротезировании отражен в таблице 1, из которой следует, что преобладали репротезирования митрального клапана (в 76 случаях – 69,7% в сочетании с пластикой трикуспидального клапана), превалировало репротезирование механическими протезами – 108 (71%). Проводилась стандартизированная базовая терапия в послеоперационном периоде, включавшая разработанные оригинальные органопротективные мероприятия (патент РФ №2444379 10.03.2012, приоритет от 17.03.2012).
Летальность составила 9,15% (14 пациентов), среднее пребывание в реанимационном отделении для выживших – 6,1±1,1 койко-дня. Все пациенты разделены на две группы – исследуемая (ГИ; n=51; с развитием в послеоперационном периоде ПОН) и сравнения (ГС; n=102; без ПОН); проведены межгрупповой и внутригрупповой анализы по клиническим параметрам (частота и структура органных дисфункций, длительность интенсивной терапии, летальность). Диагностика СВО и ПОН осуществлялась в соответствии с критериями ACCP/SCCM, 1992. Факторы риска развития ПОН оценивались оригинальным способом (патент РФ №242209227 27.06.2011, приоритет от 11.01.2010), таблица 2.
Статистическая обработка результатов исследований проводилась с использованием программы STATISTICA 6.0. Все данные представлены как средняя арифметическая ±стандартное отклонение (M± σ ), значимыми различия считали при уровне р<0,05. Для сравнительной оценки использовали непараметрические методы (Манна–Уитни, Вилкоксона, коэффициент ранговой корреляции Спирмена).
Результаты и обсуждение
Послеоперационный период осложнился ПОН у 51 пациента (33,3%), неосложненное течение или наличие дисфункции одного органа/системы было отмечено у 102 (66,7%) пациентов, что в целом сопоставимо с показателями других авторов [4]. Общая летальность составила 9,15% (14 пациентов). При межгрупповом сравнении гендерно-возрастные различия не влияли на развитие ПОН. Исходная патология, по поводу которой было проведено первичное протезирование, не оказывала влияния на частоту развития ПОН (табл. 3).
И хотя при сравнении относительных значений в обеих группах преобладала РБС, при корреляционном
Таблица 3
Структура первичной патологии, потребовавшей протезирования клапанов
|
n (%) |
ПОН, n (%) |
без ПОН, n (%) |
|
|
Всего |
153 (100) |
51 (100) |
102 (100) |
|
РБС |
102 (66,7) |
28 (54,9) |
74 (72,5) |
|
ССТД |
18 (11,7) |
2 (3,9) |
16 (15,7) |
|
ИЭ |
33 (21,6) |
21 (41,2) |
12 (11,8) |
Примечание: ПОН – полиорганная недостаточность. РБС – ревматическая болезнь сердца. ССТД – синдром соединительнотканной дисплазии. ИЭ – инфекционный эндокардит.
Таблица 4
Причины репротезирования
|
Причины репротезирования |
n (%) |
ПОН, n (%) |
без ПОН, n (%) |
|
Всего |
153 (100) |
51 (100) |
102 (100) |
|
Первичные дисфункции |
75 (49,0) |
9 (17,6) |
66 (64,7) |
|
ПЭ |
51 (33,3) |
18 (35,3) |
33 (32,4) |
|
Тромбоз без ИЭ |
27 (17,7) |
24 (47,1) |
3 (2,9) |
Примечание: ПОН – полиорганная недостаточность. ПЭ – протезный эндокардит. Первичные дисфункции – первичные дисфункции биопротезов. Тромбоз без ИЭ – тромбозы без инфекции.
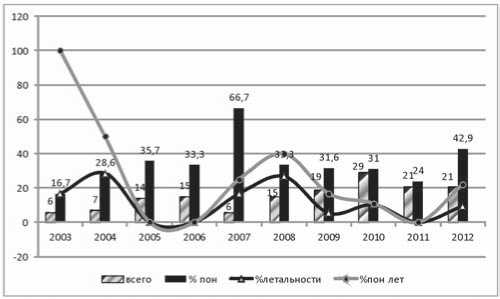
Рис. 1. Частота репротезирований, полиорганной недостаточности (ПОН), общая летальность при репротезировании и летальность при ПОН в течение 10 лет анализе выявлена сильная положительная связь (r=0,63; p=0,0155) с ИЭ. При анализе причин, приведших к необходимости репротезирования, в группе без ПОН преобладала первичная дисфункция биопротезов (табл. 4) – умеренно положительная связь (r=0,22; p=0,031), а в ГИ – тромбоз механического протеза, при слабой корреляции (r=0,08; p=0,033).
Тяжесть состояния при поступлении в реанимационную палату по АРАСНЕ II сопоставима – 16,3±4,4 балла в ГС и 18,1±2,7 балла в ГИ (p=0,072). Изолированно ни один из факторов риска не являлся предиктором развития ПОН, хотя в ГС частота проявления исходной дисфункции органов выше (71% vs. 58% в ГИ, p=0,0215), преимущественно за счет сердечной недостаточности, а длительность искусственного кровообращения (ИК) дольше (152,4 мин vs. 138,9 мин в ГС, p=0,0188). В то же время в ГИ развитие ПОН отмечено только при сочетании двух и более факторов риска, преимущественно – при длительном ИК (min 118 мин, max 194 мин) и трансфузии более 4 доз донорских компонентов крови (в 39 случаях, 76,5% – умеренная положительная связь, r=0,355; р=0,01). Это обусловлено в первую очередь экстренностью вмешательства при тромбозах протезов (по жизненным показаниям), без предварительной длительной предоперационной подготовки, на фоне приема антикоагулянтов. В целом, частота проявлений ПОН (рис. 1) не уменьшается с уве-
Таблица 5
Частота системных поражений при ПОН, n=51
|
ПОН, n (%) |
|
|
Сердечная недостаточность* |
39 (76,5) |
|
Системный воспалительный ответ** |
32 (62,7) |
|
Острая почечная недостаточность |
31 (60,9) |
|
Острое повреждение легких |
22 (43,1) |
|
Церебральная недостаточность*** |
16 (31,4) |
|
Абдоминальный компартмент |
10 (19,6) |
|
Острая печеночная недостаточность |
6 (11,8) |
Примечание: * – СИ менее 2,5 л/мин/м2 и/или потребность в инотропной поддержке. ** – осложненный СВО (критерии ACCP/SCCM + признаки по-лиорганной дисфункции). *** – неврологические нарушения I типа.
личением количества вмешательств и совершенствованием хирургической техники (слабая отрицательная связь; r=–0,205; p=0,029), но логично определяет общую летальность (умеренная положительная связь, r=0,31; p=0,013) и длительность пребывания выживших пациентов в реанимационном отделении (5,6 дней в ГС и 11,2 дней в ГИ; p=0,011 при сравнении относительных значений).
Следует отметить, что если причиной летальности в 2003–2007 гг. преимущественно были СН и неврологические осложнения при краткосрочном пребывании умерших на реанимационной койке, то c 2008 г. по мере совершенствования медицинских технологий и внедрения принципов органопротективной терапии преобладают гнойно-септические осложнения, преимущественно обусловленные внутрибольничной микрофлорой при длительном госпитальном периоде. Эти данные совпадают с мнением многих авторов [1, 5]. В то же время относительное увеличение частоты ПОН и летальности в 2012 г. обусловлено в первую очередь наличием пациентов с острыми тромбозами и эмболическими осложнениями, поступавших в критическом состоянии и потребовавших органозамещающей терапии (в частности, экстракорпоральной мембранной оксигенации) как в до-, так и в послеоперационном периоде. Летальность преимущественно в группе с ПОН – 9 пациентов (17,6%) против 5 (4,9%) в группе сравнения, где она обусловлена гнойно-септическими осложнениями (ГСО) и исходным инфекционным процессом.
При внутригрупповом сравнении в ГС только 57,9% (59) имели моноорганную дисфункцию. Несмотря на то, что более трети (33,9%, n=20) требовали в послеоперационном периоде высоких доз инотропной поддержки, СН не являлась предиктором летальности и достаточно легко разрешалась в процессе посткоррекционного ремоделирования камер сердца. СВО проявлялся достаточно часто (18,6%, n=11), но не носил осложненного характера и разрешался на фоне стандартной терапии в первые сутки послеоперационного периода. Считается, что неврологические осложнения преимущественно эмболического характера возникают у 10–12% с тромбозами протезов [8, 12]. В нашем наблюдении неврологические осложнения I типа диагностированы у 16,9% (n=10), в двух случаях у пациентов с ИЭ и последующих ГСО длительная (31,5±5,5 дней) интенсивная терапии привела к летальному исходу. Также фатальными были два случая резистентной к интенсивной терапии печеночной недостаточности (всего у 4 пациентов, 6,7%) и у одного из двух пациентов (3,4%) с мезентереальным тромбозом. При достаточно частом (по 10,6%) проявлении в послеоперационном периоде изолированного острого повреждения легких или поченочной недостаточности они благополучно разрешались при консервативной интенсивной терапии, не вызывая развития ПОН.
При внутригрупповом сравнении у пациентов с ПОН развитие осложнений не зависело от характера оперативного вмешательства (p>0,05 при сравнении относительных значений), таблица 1. Преобладали (табл. 5) сочетания СН, резистентной к инотропной терапии, с ОПН в стадии олигоанурии, требовавшей почечно-заместительной терапии.
В большинстве случаев (62,7%) это сопровождалось осложненным течением СВО и острым повреждением легких. Наиболее неблагоприятным следует считать как вовлечение в развитие ПОН более трех систем, так и сочетание любой дисфункции с острой печеночной недостаточностью и абдоминальным компартментом (44,4% – 4 летальных исхода из 9). Ряд авторов отмечают значимо большую частоту печеночной недостаточности [2], что, видимо, связано с большей частотой исходного кардиального фиброза печени (анализ эффективности различных методов органопротективной терапии в периопера-ционном периоде предполагается в отдельном сообщении).
Заключение
В целом при анализе за десятилетие не выявлено прямой взаимосвязи между проявлением ПОН и хирургической техникой (r=–0,295; p=0,0333), а общая летальность определяется развитием ПОН в послеоперационном периоде (r=0,715; p=0,0155) после длительного ИК и массивной кровопотери, в основном у пациентов с тромбозами механических протезов. При совершенствовании медицинских технологий протективной и органозамещающей интенсивной терапии, приводящих к увеличению реанимационного койко-дня, в структуре ПОН начинают преобладать внутригоспитальные гнойно-септические осложнения, которые в подавляющем числе случаев и являются причиной летального исхода. Помимо этого, риск летального исхода значимо повышается при поражении трех и более органов/систем.
Список литературы Послеоперационные осложнения при репротезировании клапанов сердца
- Белобородова Н.В., Попов Д.А., Бачинская Е.Н. Послеоперационные инфекции в кардиохиургии: современное состояние проблемы и перспективы//Грудная и сердечно-сосудистая хирургия. -2004. -№ 4. -С. 54-59.
- Караськов А.М., Железнев С.И., Назаров В.М. и др. Клиникоморфологические изменения при дисфункциях биологических протезов сердца//Патология кровообращения и кардиохирургия. -2006. -№ 2. -С. 21-26.
- Лейдерман И.Н. Синдром полиорганной недостаточности (ПОН). Метаболические основы//Вестник интенсивной терапии. -1999. -№ 2-3. -С. 8-13.
- Муратов Р.М. и др. Причины повторных вмешательств на трикупидальном клапане после ранее выполненной реконструкции//Сб. науч. трудов VIII Всерос. съезда сердечнососудистых хирургов. -М., 2002. -С. 44.
- Тюрин В.П. Инфекционные эндокардиты. -М.: ГЭОТАР-Медиа, 2002. -222 с.
- Schaff H.V. et al. Artificial Valve Endocarditis Reduction Trial. Paravalvular leak and other events in silzone-coated mechanical heart valves: A report from AVERT//Ann. Thorac. Surg. -2002. -Vol. 73. -P. 785-792.
- Cohn L.H. et al. Decrease in operative risk of reoperative valve surgery//Ann. Thorac. Surg. -1993. -Vol. 56. -P. 15-21.
- Edmunds L.H. Jr. Thrombotic and bleeding complications of prosthetic heart valves//Ann. Thorac. Surg. -1987. -Vol. 44. -P. 430-445.
- Pansini S. et al. Reoperations on heart valve prostheses: An analysis of operative risks and late results//Ann. Thorac. Surg. -1990. -Vol. 50. -P. 590-596.
- Jones J.M. et al. Repeat heart valve surgery: Risk factors for operative mortality//J. Thorac. Cardiovasc. Surg. -2001. -Vol. 122. -P. 913-918.
- Kirsch M. et al. The risk of reoperative heart valve procedures in octogenarian patients//J. Heart Valve Dis. -2004. -Vol. 13. -P. 991-996.
- Bloomfield P. et al. Twelve-year comparison of a Bjork-Shiley mechanical heart valve with porcine bioprostheses//N. Engl. J. Med. -1991. -Vol. 324. -P. 573-579.


