Послеоперационные осложнения: современный взгляд на профилактику и лечение
Автор: Хачатрян Н.Н., Чупалов М.О., Исаев А.И., Фесенко Т.А., Волков М.А.
Журнал: Хирургическая практика @spractice
Рубрика: Современное состояние проблемы: обзоры, лекции
Статья в выпуске: 4, 2013 года.
Бесплатный доступ
Послеоперационные осложнения замедляют выздоровление больных, увеличивают продолжительность пребывания в стационаре, являются в ряде случаев причиной летального исхода. Развитие послеоперационного осложнения увеличивает вероятность летального исхода с 2 до 6%. Однако 40-60% инфекций области хирургического вмешательства предотвратимы при условии признания проблемы и необходимости ее решения. Основными возбудителями инфекций в области хирургического вмешательства (ИОХВ) являются грамположительные микроорганизмы - S.aureus и S.pyogenes. Проблемы лечения грамположительных инфекций обусловлены глобальным ростом устойчивости этих микроорганизмов к традиционным антибактериальным средствам. Особые сложности возникают при лечении инфекций, вызванных метициллин резистентными стафилококками. Инфекции, вызванные метициллинрезистентными стафилококками, имеют большое медицинское и социальное значение, так как сопровождаются более высокой летальностью и требуют больших материальных затрат на лечение. Лечение инфекций области хирургического вмешательства обеспечивается комплексом мероприятий, в котором, безусловно, ведущее место занимает адекватная санация и дренирование очага воспаления. Существенное место занимает адекватная антибактериальная терапия с учетом предполагаемого возбудителя и клинических данных. Последние годы характеризовались синтезом ряда препаратов, высоко активных в отношении метициллирезистентных стафилококков, в том числе и препаратов бактерицидного действия и с активностью в биопленках. С учетом широкого спектра действия на грамположительную флору, в том числе, и на MSSA и MRSA штаммы и на грамотрицательную флору, можно рекомендовать цефалоспорины V поколения в режиме монотерапии у больных с инфекцией области хирургического вмешательства.
Грамположительные инфекции, метициллинрезистентные стафилококки, антибактериальная терапия
Короткий адрес: https://sciup.org/142211538
IDR: 142211538 | УДК: 616-089;
Текст научной статьи Послеоперационные осложнения: современный взгляд на профилактику и лечение
Профилактика послеоперационных осложнений остается одной из актуальных проблем современной хирургии [1, 3, 6, 18, 22].
Согласно сводной статистике, в стационарах США количество больных с осложненными формами инфекции мягких тканей, среди которых значительное место занимают послеоперационные раневые осложнения, возросло с 1997 по 2009 год на 176% [9].
Послеоперационные осложнения замедляют выздоровление больных, увеличивают продолжительность пребывания в стационаре, являются в ряде случаев причиной летального исхода [1, 3, 13, 22]. Развитие послеоперационного осложнения увеличивает вероятность летального исхода с 2 до 6%. [18].
По данным отечественных и зарубежных исследований, развитие послеоперационного осложнения удлиняет стационарное лечение, в зависимости от типа операции, от 6,9 до 16,7, в среднем на 10 суток [3, 9, 18].
Кроме того, в связи с ранней выпиской больных из стационара, часть осложнений развивается или диагностируется уже на амбулаторном этапе. Учет этих осложнений практически отсутствует. По данным зарубежных исследований, от 12 до 84% послеоперационных осложнений диагностируется на амбулаторном этапе, после выписки больного из стационара.[18, 22].
Исследователи стран Европы и США отмечают, что проблема инфекций в области хирургического вмешательства в настоящее время недооценена [7, 9, 13, 22]. Значительный разброс показателей (от 1 до 20% – в Европе и от 2 до 8% – в США) указывает на отсутствие правдивой картины. В то время как инфекция области хирургического вмешательства являются актуальной и значимой проблемой как для больных, так и для общества в целом.
Особенно это актуально для России в связи с отсутствием механизмов, стимулирующих достоверную статистику послеоперационных осложнений.
Значительный вклад в недостоверность статистики внесли финансовые карательные меры страховых компаний.
Однако 40–60% инфекций области хирургического вмешательства предотвратимы при условии признания проблемы и необходимости ее решения.
На лечение послеоперационного осложнения в странах Европы тратится в среднем 2000 евро на 1 больного, находящегося в стационаре. При этом не учитываются дальнейшие затраты на амбулаторном этапе лечения и другие параметры, связанные с отсутствием работника на работе (табл. 1).
Растущая во всем мире резистентность к антибактериальным препаратам диктует необходимость поиска новых подходов к профилактике и лечению послеоперационных осложнений.
Возбудители инфекций в области хирургического вмешательства
Основными возбудителями инфекций в области хирургического вмешательства (ИОХВ) являются грамположительные микроорганизмы – S. aureus и S. pyogenes .
По данным мониторинга в нашей клинике, ведущее место в этиологической структуре послеоперационных осложнений
Таблица 1
Стоимость лечения послеоперационных осложнений в разных странах
|
Авторы |
Страна |
Вмешательство |
Колебания |
В среднем |
|
Riose et al. |
Испания |
аппенлэкто- мия |
€1881– 2057 |
|
|
Riosе et al. |
Испания |
колэктомия |
€6406– 8141 |
|
|
Plowman et al. |
Великобритания |
различные операции |
€2370 |
|
|
Reilly et al. |
Великобритания |
различные операции |
€600 |
|
|
Geubbels et al. |
Netherlands |
различные операции |
€900–2700 |
|
|
Garsia and Salto |
Испания |
различные операции |
€2400 |
|
|
Coello et al. |
Великобритания |
различные операции |
€1900 |
|
|
Kappstein et al. |
Германия |
кардиохирургия |
€3010 |
-
■ Staphylococcus aureus
-
■ Escherichia coli
-
■ Staphylococcus epidermidis
1 Others
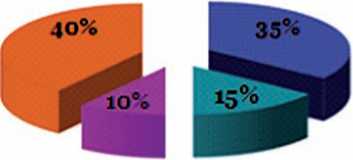
Рис. 1. Структура возбудителей послеоперационных осложнений занимают золотистый стафилококк – 35% и кишечная палочка – 15% (рис. 1).
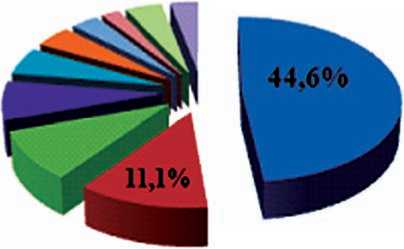
Это согласуется с данными европейских исследований [20] (рис. 2).
По данным SAEI (2012), доля золотистого стафилококка в структуре осложненных инфекций мягких тканей составила 26%, грамотрицательных энтеробактерий – 13% [23] (рис. 3).
По данным исследования REACH, грамположительные микроорганизмы составляют 70%, уровень метициллинрези-
Moet G.J., Jones R.N., Biedenbach D.J. et. al., 2007
Рис. 2.
-
■ Staphylococcus aureus
-
■ Pseudomonas aeruginosa
-
■ Enterococcus
-
■ Escherichia coli
-
■ Enterobacter
-
■ Klebsiella spp
-
■ CN
Staphylococcus
-
■ Serratia
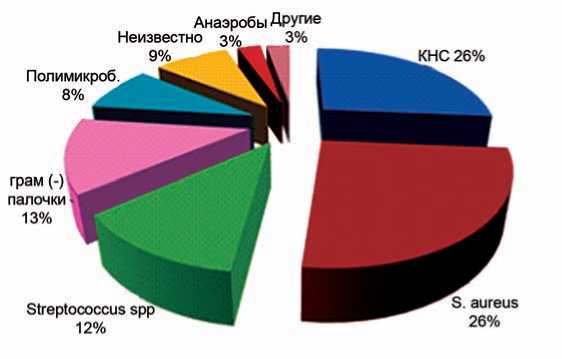
Рис. 3. Наиболее частые возбудители послеоперационных осложнений, по данным SAEI, 2012 г.
стентных стафилококков варьирует от 22,8% в Европе до 59% в США [10, 11].
Проблемы лечения грамположительных инфекций обусловлены глобальным ростом устойчивости этих микроорганизмов к традиционным антибактериальным средствам [2, 8, 22]. Особые сложности возникают при лечении инфекций, вызванных метициллинрезистентными стафилококками [2, 4, 16, 21, 24, 25].
По данным международного многоцентрового исследования RELIEF, в котором принимала участие и наша клиника, уровень метициллинрезистентных стафилоккоков в структуре возбудителей ИОХВ достигает 14% [17] (рис. 4).
Метициллинрезистентные стафилококки помимо бета-лактамов часто проявляют устойчивость и к другим классам антибактериальных препаратов, в частности к аминогликозидам, макролидам, линкозамидам, фторхинолонам.
Инфекции, вызванные метициллинрезистентными стафилококками, имеют большое медицинское и социальное значение, так как сопровождаются более высокой летальностью и требуют больших материальных затрат на лечение.
Лечение послеоперационных осложнений
Лечение инфекций области хирургического вмешательства обеспечивается комплексом мероприятий, в котором, безусловно, ведущее место занимает адекватная санация и дренирование очага воспаления.
Существенное место занимает адекватная антибактериальная терапия с учетом предполагаемого возбудителя и клинических данных.
Российская Ассоциация Специалистов по Хирургическим Инфекциям в 2009 году предложила схемы выбора режима антибактериальной терапии с учетом уровня поражения, системной воспалительной реакции и предполагаемых возбудителей инфекции [4] (табл. 2).
У больных с глубокой инфекцией области хирургического вмешательства рекомендуется добавление антиMRSA-препаратов при высоком риске или выделении метициллинре-зистентных штаммов стафилококков (табл. 3).
У больных с глубокой инфекцией области хирургического вмешательства на фоне сепсиса рекомендуется назначение карбапенемов II поколения и препаратов с антиMRSA-активностью (табл. 4).
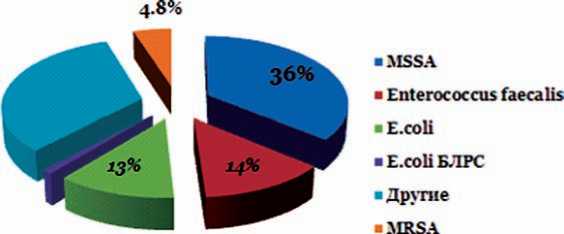
Рис. 4. Наиболее частые возбудители осложненных инфекций кожи и мягких тканей, по данным RELIEF
Таблица 2
Лечение больных с поверхностной инфекцией области хирургического вмешательства
|
Поверхностные ИОХВ |
S. auerus S. pyogenes Реже: Enterobacteri aceae |
Снятие швов, дренирование раны. Местное лечение Средства 1-го ряда: Цефазолин (в/в, 1–2 г 3 раза в сут.) Цефуроксим (в/в, 1,5 г 3 раза в сут.) Амоксициллин/клавуланат (в/в, 1–2 г 3 раза в сут.) Альтернативные средства: Клиндамицин (по 0,6 г – 3 р в сут., в/в) ± амикацин (в/в 0,5 г 2 раза в сут.) У пациентов, получавших ранее антибактериальную терапию: Левофлоксацин (в/в или внутрь 0,5– 0,75 г 1 раз в сут.) Моксифлоксацин (в/в или внутрь 0,4 г 1 раз в сут.) Линезолид (в/в или внутрь 0,6 г 2 раза в сут.) ± пиперациллин/тазо-бактам (в/в 2,5 г 3 раза в сут.) |
Таблица 3
Антибактериальная терапия больных с глубокой инфекцией области хирургического вмешательства
|
Глубокие ИОХВ А. Пациенты без сепсиса |
S.auerus S.pyogenes Enterobacteri aceae Peptostrepto-coccus spp. Реже: P.aeruginosa |
Радикальная хирургическая обработка. Местное лечение Средства 1-го ряда: Пиперациллин/талобактам (в/в, 4,5 г 3 раза в сут) Клиндамицин (в/в, 0,6 г 3 раза в сут.) или Амоксициллин/клавула-нат (в/в, 1,2 г 3–4 раза в сут.) + не-тилмицин (в/в, 0,2 г 2 раза в сут.) или амикацин (в/в, 1 г 1 раз в сут.) Цефоперазон/сульбактам (в/в, 4 г/ сут. 2 раза в сут.) Альтернативные средства: Левофлоксацин (в/в, 0,5–0,75 г 1 раз в сут.) + метронидазол (в/в, 0,5 г 3 раза в сут.) Цефепим (в/в, 2 г 2–3 раза в сут.) + метронидазол (в/в, 0,5 г 3 раза в сут.) Эртапенем (в/в, 1 г 1 раз в сут.) Имипенем (в/в, 0,5–1 г 3–4 раза в сут.) Меропенем (в/в, 0,5–1 г 3 раза в сут.) Тигециклин (в/в, однократно 100 мг, затем 50 мг 2 раза в сут.) При риске или выделении МRSA к любому режиму терапии добавить: Линезолид1 (в/в или внутрь, 0,6 г 2 раза в сут.) или Ванкомицин (в/в, 15 мг/кг 2 раза в сут.) |
Таблица 4
Антибактериальная терапия больных с глубокой инфекцией области хирургического вмешательства на фоне сепсиса
|
Глубокие ИОХВ Б. Пациенты с тяжелым сепсисом (ПОН) или шоком |
S. auerus S. pyogenes Enterobacteri aceae Bacteroides spp. Peptostrepto-coccus spp. Реже: P. aeruginosa |
Средства 1-го ряда: Имипенем (в/в 1 г 3–4 раза в сут.) + линезолид (в/в 0,6 г в сут.) или ванкомицин (в/в 15 мг/кг 2 раза в сут.) Меропенем (в/в 1 г 3–4 раза в сут.) + линезолид (в/в 0,6 г 2 раза в сут.) или ванкомицин (в/в 15 мг/кг 2 раза в сут.) Альтернативные средства: Цефоперазон/сульбактам (в/в, 4 г 2 раза в сут.) или пиперациллин/та-зобактам (в/в 4,5 г 3–4 раза в сут.) + линезолид (в/в 0,6 г 2 раза в сут.) или ванкомицин (в/в 15 мг/кг 2 раза в сут.) Левофлоксацин (в/в 1 г 1 раз в сут.) + линезолид (в/в 0,6 г 2 раза в сут.) или ванкомицин (в/в 15 мг/кг 2 раза в сут.) |
Цефалоспорины V поколения
Цефалоспорины занимают в настоящее время ведущее место по частоте использования среди всех антибактериальных препаратов, благодаря широкому спектру бактерицидной активности, благоприятной фармакокинетике, хорошей переносимости и небольшим количеством побочных эффектов.
В настоящее время создано 5 поколений цефалоспориновых антибиотиков (табл. 5).
На протяжении последних 50 лет появление новых поколений цефалоспоринов сопровождалось снижением их активности на грамположительную флору и повышением активности на грамотрицательную флору. Лишь у цефалоспоринов IV по-
Таблица 5
Цефалоспориновые антибактериальные препараты
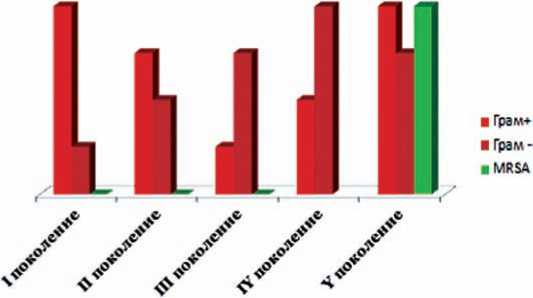
Рис. 5. Эволюция цефалоспоринов
Новый цефалоспорин V поколения
В 2010 году FDA одобрило использование нового цефалоспорина V поколения – цефтаролина фосамила, активным метаболитом которого является цефтаролин, для лечения осложненных инфекций кожи и мягких тканей в связи с широким бактерицидным действием на грамположительную и грамо-трицательную флору. В 2012 году препарат был одобрен Европейским комитетом (Committee for Medical Products for Human Use), а также зарегистрирован и в России в конце 2012 года (РУ № ЛП-001912 от 20.11.2012).
На сегодняшний день это единственный цефалоспорин, одобренный FDA, для лечения инфекций, вызванных метицил-линрезистентными стафилококками.
Цефтаролин обладает широким спектром действия на энтеробактерии, за исключением штаммов, продуцирующих бета-лактамазы расширенного спектра и карбапенемазы, высокой антианаэробной активностью в отношении грамполо-жительных анаэробов. Однако препарат не обладает активностью в отношении Bacteroides fragilis , неферментирующих бактерий – Pseudomonas aeruginosa и Acinetobacter, атипичных микроорганизмов[10, 11].
Международная программа AWARE (Assessing Worldwide Antimicrobial Resistance Evalution Surveillance Prоgram) провела анализ активности цефтаролина в отношении возбудителей осложненных инфекций кожи и мягких тканей, в том числе, послеоперационных раневых осложнений, в период с 2008 по 2010 годы. Среди 8469 штаммов Staphylococcus aureus , изолированных из 72 медицинских центров США, метициллинрези-стентные штаммы составили 52,6%. [10].
96,1% метициллинрезистентных и 100% метициллинчувствительных штаммов золотистого стафилококка были чув- ствительны к цефтаролину. Активность цефтаролина оказалась сопоставимой с активностью линезолида, ванкомицина, тигециклина и триметроприм-сульфаметоксазола.
При анализе 2438 изолятов из очагов инфекции у больных с инфекцией мягких тканей в 52 медицинских центрах 19 стран Европы в 2010 году по Международной программе AWARE получены аналогичные данные.
При анализе минимальной концентрации, необходимой для подавления 50% и 90% изолятов, цефтаролин показал высокую активность в отношении и метициллинчувствительных, и метициллинрезистентных штаммов стафилоккокков in vitro (рис. 6–8).
Наибольшая активность к метициллинрезистентным стафилококкам отмечена у тигециклина, даптомицина, линезоли-да, ванкомицина и цефтаролина. Тогда как только 18,7–21,5% метициллинрезистентных штаммов были чувствительны к фторхинолонам, эритромицину и клиндамицину.
Согласно данным EUCAST, цефтаролин проявляет активность в отношении энтеробактерий, сопоставимую с цефтриаксоном и цефтазидимом.
К примеру, среди штаммов E.coli , не продуцирующих БЛРС, 90,3% и 96,5% штаммов ингибируются цефтаролином при ми-
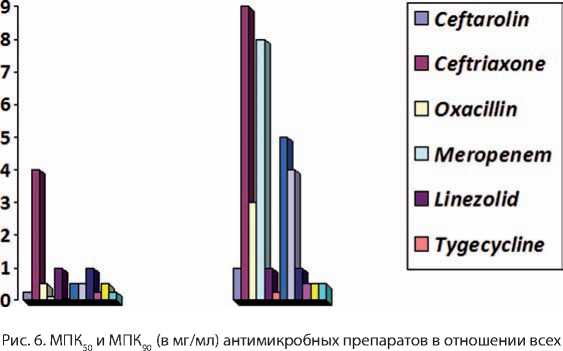
штаммов Staphylococcus aureus у больных с осложненной инфекцией мягких тканей
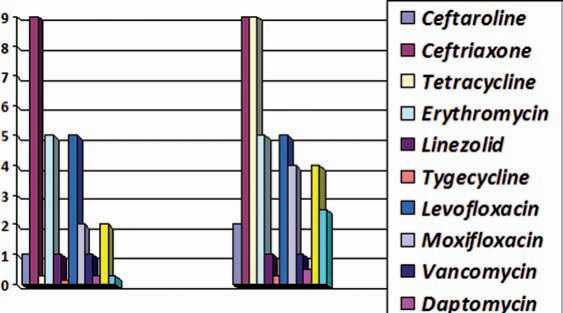
Рис. 7. МПК50 и МПК90 антимикробных препаратов в отношении MRSA у больных с осложненной инфекцией мягких тканей
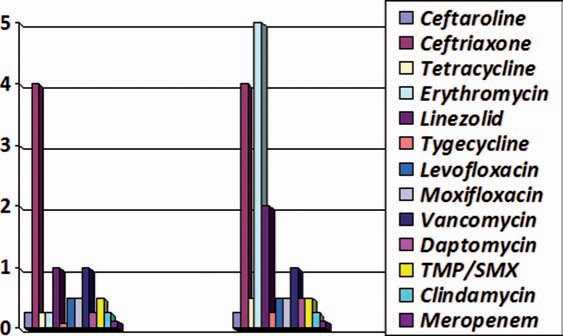
Рис. 8. МПК50 и МПК90 антимикробных препаратов в отношении MSSA у больных с осложненной инфекцией мягких тканей нимальной подавляющей концентрации <0,5 мг/л и <1 мг/л. При анализе всех штаммов (продуцируюших и не продуцирующих БЛРС) 63,5% их были чувствительны к цефтаролину. Препарат также высоко активен в отношении штаммов Klebsiella pneumoniae, не продуцирующих бета-лактамазы расширенного спектра [10, 11, 14].
Таким образом, цефтаролин характеризуется высокой активностью в отношении метициллинрезистентных стафилококков, сопоставимой с препаратами, широко используемыми в настоящее время для лечения грамположительных резистентных инфекций. В то же время препарат обладает высокой активностью и в отношении метициллинчувствительных стафилококков, а также энтеробактерий, не продуцирующих БЛРС, сопоставимой с цефалоспоринами III поколения.
Клиническая эффективность цефтаролина при лечении осложненных инфекцией кожи и мягких тканей показана в двух международных рандомизированных, двойных слепых исследованиях 3 фазы в монотерапии при внутривенном введении по 600 мг каждые 12 часов, по сравнению с комбинированной антибактериальной терапией сочетанием ванкомицина и азтреонама по 1 г каждые 12 часов в течение 5–14 дней [12, 14, 15]. В исследования CANVAS 1 и CANVAS 2 были включены 1378 больных с осложненной инфекцией кожи и мягких тканей из 111 центров, расположенных в Европе, США, Латинской Америке и России. Клиническая и микробиологическая эффективность оказалась высокой при сравнении двух режимов терапии в обоих исследованиях. При этом при анализе раннего клинического ответа к 3 дню терапии эффективность монотерапии цефтаролином оказалась статистически достоверно выше (у 74% больных) по сравнению с комбинированным режимом – ванкомицином + азтреонамом (у 66,2%) [14]. Кроме того, эффективность цефтаролина в режиме монотерапии оказалась высокой даже в группе больных, у которых перед началом лечения выделяли грамотрицатель-ные бактерии – энтеробактерии.
Таким образом, высокая эффективность препарата в отношении грамположительной флоры, в том числе метициллин- резистентных, метициллинчувствительных стафилококков, грамотрицательной флоры, возможность монотерапии, бактерицидный механизм действия, хороший профиль переносимости, свойственный классу бета-лактамов, открывают широкие перспективы для использования препарата в различных областях хирургии.
Широкое использование ванкомицина в хирургической практике, в том числе и с профилактической целью, привело к росту резистентности грамположительной микрофлоры. С 90-х годов стали поступать сообщения о выделении штаммов с промежуточной чувствительностью к ванкомицину и устойчивых к тейкоплакину, а также штаммов с высокой устойчивостью к ванкомицину [2, 5, 16, 19].
Последние годы характеризовались синтезом ряда препаратов, высоко активных в отношении метициллинрезистентных стафилококков, в том числе и препаратов бактерицидного действия и с активностью в биопленках (рис. 9).
С учетом данных о возбудителях инфекций области хирургического вмешательства, нарастающей резистентности, сопутствующих заболеваний и уровня поражения тканей, можно предложить схему выбора препарата с активностью против MRSA штаммов (рис. 10).
Заключение
В связи с быстрым распространением во всех странах мети-циллинрезистентных штаммов стафилококков целесообразно
Цефта рол ин
Ванкоми цин
Линезо лид
Даптоми цин
Тигецик
Невысокая активность против MSSA Невысокая пенетрация в ткани Снижение чувствительности Нефротоксичность
Высокая активность Бактериостатический эффект
Быстрый бактерицидный эффект Высокая активность против MSSA и MPSA Активность в биопленках
Бактериостатический эффект Тетрациклиновый
РЯД
Активность против БЛ РС-штаммов
Цефалоспорин V поколения Бактерицидный эффект Бактерицидная активность против Enterobactenacae Низкий потенциал резистентности
Рис. 9. Анти-MRSA препараты для лечения хирургических инфекций
Неосложненная инфекция
- Нет сопутствующих заболеваний
-
- Локализация в
поверхностных слоях кожи
-
- Нет в анамнезе хронических инфекций и/или
антибактериальной терапии
-
- Сопутствующие заболевания
-
- Наличие MRSA инфекции в анамнезе
-
- Вовлечение в процесс глубоких слоев
-
- Антибактериальная
терапия в анамнезе
Цефтаролин
Даптомицин
Тигециклин
Линезолид
Ванкомицин
Рис. 10. Выбор препарата с антиMRSA-активностью при лечении инфекций области хирургического вмешательства
Эмпирическая терапия
включение в протоколы лечения больных с послеоперационными раневыми осложнениями препаратов с выраженной активностью против MRSA-штаммов с учетом данных локального микробиологического мониторинга.
С учетом широкого спектра действия на грамположитель-ную флору, в том числе и на MSSA и MRSA-штаммы и на гра-мотрицательную флору, можно рекомендовать цефалоспорины V поколения в режиме монотерапии у больных с инфекцией области хирургического вмешательства.
Список литературы Послеоперационные осложнения: современный взгляд на профилактику и лечение
- Беденков А.В. Фармакоэпидемиологическая и фармакоэкономическая оценка периоперационной антибиотикопрофилактики в абдоминальной хирургии: Автореф. дис. …к.м.н./Смоленская Государственная Медицинская Академия. -2003. -20 с.
- Козлов Р.С., Голуб А.В. Цефтаролин -sui generis. Клиническая микробиология и антимикробная химиотерапия. 2013. Том 15, № 2 стр.1-7.
- Плешков В.Г., Голуб А.В., Москалев А.П. и др. Влияние инфекций области хирургического вмешательства на длительность госпитализации пациентов хирургических отделений многопрофильных стационаров. 2008.
- Савельев В.С. и другие. Хирургические инфекции кожи и мягких тканей. Национальные рекомендации 2009 г.
- Никулин А.А., Дехнич А.В. Обзор рекомендаций Британского общества по антимикробной химиотерапии по диагностике и лечению инфекций, вызванных метициллинрезистентными штаммами Staphylococcus aureus (MRSA) во внебольничных условиях. Клиническая микробиология и антимикробная химиотерапия 2010, Том 12, №1 стр.4-21.
- Хачатрян Н.Н., Смирнов Г.Г., Дизенгоф И.М. Хирургическая помощь ВИЧ-инфицированным и больным СПИД. Журнал Хирургия им. Н.И.Пирогова. №7, 2000. С.46-50
- Amara Shipa, Adamson R.T., Lew Indu. Clinical response at Day 3 of therapy and economic outcomes in hospitalized patients with acute bacterial skin and skin structure infection. Current Medical Research and Opinion Vol. 29 N7, 2013, 869-877.
- Drusano G.L. Pharmacodynamics of ceftaroline fosamil for complicated skin and skin structure infection: rationale for improved anti-methicillin-resistant Staphylococcus aureus activity. J. Antimicrob Chemother 2010; Suppl 4; p. 33-39.
- Fact and Figures 2009, Healthcare Cost and Utilization Project. Agency for Healthcare Research and Quality, USA. 2012].
- Farrel David, Castanheira Mariana et al. In vitro Activity of Ceftaroline Against Multidrug-Resistant Staphylococcus aureus and Streptococcus Pneumoniae: A Review of Published Studies and the AWARE Surveillance Program (2008-2010). Clinical Infectious Diseases 2012, 55(S3), P. 206-214.
- Farrel D.J., Flamm R.K., Sader H.S., Jones R.N. Spectrum and potency of ceftaroline tested against leading pathogens causing skin and soft-tissue infections in Europe (2010). International Journal of Antimicrobial Agents. 2013, 41, 337-342.
- Friedland H.D., O’Neal Tanya, Biek D. et al. CANVAS 1 and 2: Analysis of Clinical Response at Day 3 in Two Phase 3 Trials of Ceftaroline Fosamil versus Vancomycin plus Aztreonam in Treatment of Acute Bacterial Skin and Skin Structure Infections Antimicrobial Agents and Chemotherapy, May 2012 Volume 56 Number 5 p. 2231-2236.
- Garau J., Osterman H., Medina J. et al. Current management of patients hospitalized with complicated skin and soft tissue infections across Europe (2010-2011): assessment of clinical practice patterns and real-life effectiveness of antibiotics from the REACH study. Clinical Microbiology and Infection. 2013. March.
- Giuliano Ch, Kale-Pradhan P.B., Johnson L.B. Early response of ceftaroline fosamil in the treatment of soft-tissue infections. Expert Rev. Clin. Pharmacol. 5(5), 509-512. 2012.
- Corey GR, Wilcox M, Talbot GH, Friedland HD, Baculik T, Witherell GW, Critchley I, Das AF, Thye D. Integrated analysis of CANVAS 1 and 2: phase 3, multicenter, randomized, double-blind studies to evaluate the safety and efficacy of ceftaroline versus vancomycin plus aztreonam in complicated skin and skin-structure infection. Clin Infect Dis. 2010 Sep 15;51(6):641-50.
- Hansen S., Schwab F., Asensio A. et al. Methicillin-resistant Staphylococcus aureus (MRSA) in Europe: which infection control measures are taken? Infection. 2010. Vol. 38 Issue 3 p. 159-164.
- Gyssens Inge C, Matthew Dryden, and Pierre Arvis. A randomized trial of the efficacy and safety of sequential intravenous/oral moxifloxacin monotherapy versus intravenous piperacillin/tazobactam followed by oral amoxicillin/clavulanate for complicated skin and skin structure infections. J Antimicrob Chemother 2011; 66: 2632 -2642.
- Leaper David J, Harry van Goor et al. Surgical site infection -a European perspectives of incidence and economic burden. Int Wound J, 2004, 1, 247-273.
- Moellering R. The problem of complicated skin and skin structure infections: the need for new agents. J. Antimicr Chemother 2010; 65; 3-8.
- Moet GJ, Jones RN, Biedenbach DJ et al. Contemporary causes of skin and soft tissue infections in North America, Latin America and Europe: report from the SENTRY Antimicrobial Surveillance Program. Clin Infect Dis 2011, 53, 144-149.
- Mohr J., Murray E. Point: Vancomycin is not obsolete for the treatment if infection caused by Methicillin-Resistant Staphyloccus aureus. Clinical Infectious Diseases. Vol. 44, 2007. P.1536-1548.
- Pulgar S, Mehra M., Quintana A. et al. The epidemiology of hospitalized cases of skin and soft tissue infection in Europe. 18th European Congress of Clinical Microbiology and Infectious Diseases. 2008, Barcelona, Spain, Abstract P821.
- del Toro, Niet I, Nuno E. et al. Outcome of a multicenter cohort of patients with prosthesis joint infections according to current recommendations. SAEI group. ECCMID. 2012. O 502.
- Wang Z.X., Jiang C.P., Cao Y., Ding Y.T. Systematic review and meta-analysis of triclosan-coated sutures for the prevention of surgical-site infection. British Journal of Surgery. 2013. Published online in Wiley Online Library DOI: 10.1002.
- Weigelt J., Haytham M.A., Itany K.M.F. and others. Linezolid eradicates MRSA better then vancomycin from surgical-site infections//Аm. J. Surg. -2004. -V. 188. -№ 6. -P. 760-766.


