Поствакцинальный иммунитет к дифтерии, кори, столбняку, коклюшу у детей в условиях воздействия химических факторов риска среды обитания
Автор: Устинова О.Ю., Макарова В.Г., Долгих О.В.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Актуальные аспекты анализа риска здоровью
Статья в выпуске: 2 (2), 2013 года.
Бесплатный доступ
Проведена оценка состояния поствакцинального иммунитета к дифтерии, кори, столбняку, коклюшу у детей с повышенным содержанием химических токсикантов, обусловленным внешнесредовым воздействием. Установлено, что содержание поствакцинальных антител у данной категории детей достоверно ниже показателей детского населения, проживающего в условиях санитарно-гигиенического благополучия среды обитания, а нарушения формирования поствакцинального иммунитета встречаются в 1,5–2,4 раза чаще. Установлена достоверная связь снижения содержания специфических поствакцинальных антител с увеличением в крови концентрации свинца, хрома, марганца и О-крезола.
Дети, поствакцинальный иммунитет, дифтерия, коклюш, корь, столбняк, внешнесредовое воздействие, химические факторы
Короткий адрес: https://sciup.org/14237820
IDR: 14237820 | УДК: 61.616.9
Текст научной статьи Поствакцинальный иммунитет к дифтерии, кори, столбняку, коклюшу у детей в условиях воздействия химических факторов риска среды обитания
Введение плановой вакцинопрофилак-тики позволило существенно снизить во многих странах мира заболеваемость целым рядом инфекций. Благодаря вакцино-профилактике в мире ежегодно предотвращается около 3 млн смертей от коклюша, кори, столбняка, дифтерии [3, 13]. В то же время техногенное загрязнение среды обитания снижает иммунологическую эффективность вакцинопрофилактики у детского населения и может способствовать развитию эпидемического неблагополучия [1, 4, 5, 6, 7, 8, 17].
Ретроспективный анализ эпидемии дифтерии (1993–1996 гг.) показал, что среди заболевших значительный удельный вес составляли привитые лица (74– 81 %), что свидетельствует о недостаточном уровне поствакцинального иммунитета у отдельных категорий населения [1, 12]. Среди взрослых, заболевших диф- терией, процент привитых достигает 65– 70 %, а среди детей – более 80 % [11]. Аналогичная картина прослеживается и в отношении коклюша [9]. Продолжают регистрироваться случаи заболевания корью у привитых, в том числе у ревакцинированных [13]. Среди всех заболевших, привитые живой коревой вакциной составляют до 20,5 %, в том числе получившие две дозы вакцины – 13,2 %. В мировой практике описаны случаи заболевания столбняком у привитых [13].
Исследованиями ряда авторов установлено, что техногенное загрязнения среды обитания является одним из ведущих факторов риска формирования у 35–51,9 % детей низкого уровня поствакцинальных антител [8, 14, 15]. На территориях санитарно-гигиенического неблагополучия число детей с максимальным содержанием противодифтерийных антител в 7–8 раз ниже
аналогичного показателя у лиц, проживающих в относительно благоприятных условиях [9, 14, 16]. По данным литературы у детей 10–14 лет, проживающих на территориях техногенного загрязнения, установлено отсутствие защитных уровней антител к дифтерии в 20–25 % случаев, кори – в 28– 37 %, коклюша – у 90 % обследованных [10, 18, 20].
Согласно результатам проведенных исследований загрязнение объектов среды обитания химическими токсикантами техногенного происхождения (свинец, марганец, хром, фенол, ароматические углеводороды) на уровне 1,01–5,0 ПДК с.с формирует повышенное их содержание в крови, в 1,5– 5,3 раза превышающее референтный уровень [4, 5, 6, 7]. Повышенное содержание в биологических средах этих токсичных соединений, обусловленное различными путями их поступления в организм (водный, аэрогенный, пищевой и др.), формирует состояние вторичного иммунодефицита [4, 6, 11]. У детей с контаминацией биосред перечисленными токсикантами выше рефе-ренсных/фоновых уровней установлено снижение относительно физиологической нормы содержания иммунокомпетентных клеток, активно участвующих в формировании поствакцинального иммунитета: абсолютного и относительного содержания зрелых Т-лимфоцитов и их субпопуляций (СД4+, СД8+), количества киллерных (CD16+CD56+), антителопродуцирующих (CD19+) клеток и угнетение медиаторов Т х 1 типа, на фоне одновременного повышения CD25+, CD95+, общей и специфической сенсибилизации (IgE), а также продукции цитокинов Т х 2 типа (IL-4, IL-6) [2,14,16]. Снижение иммунологической реактивности сопровождается угнетением неспецифической резистентности организма (снижение абсолютного содержания и функциональной активности фагоцитов на фоне дефицита IgG и IgA), что препятствуют формированию полноценного поствакцинального иммунитета [2, 8, 17].
Используемые в настоящее время отечественные диагностические системы для качественной и количественной оценки поствакцинального иммунитета, основанные на реакции агглютинации или пассивной гемагглютинации, не дают адекватного представления о направленности специфических антител к различным компонентам возбудителя и о реальной протективной активности этих антител [19]. Наиболее полно этим требованиям отвечает метод ИФА, основными преимуществами которого являются: высокая чувствительность и специфичность, возможность одновременного исследования большого количества проб с определением специфических антител различных классов – JgА, JgМ, JgG, JgЕ, объективная оценка результатов, простота постановки и возможность использования внутреннего контроля.
Целью исследования являлось изучение связи нарушений поствакцинального иммунитета к дифтерии, кори, столбняку, коклюшу у детей с повышенным содержанием в крови химических токсикантов, обусловленным внешнесредовым воздействием.
Объектом исследования являлись 276 детей в возрасте 4–6 лет, у которых в соответствии с «Национальным календарем прививок» была выполнена плановая профилактика дифтерии, коклюша и столбняка вакциной «АКДС» (базовая вакцинация в возрасте 3, 4, 5 и 6 месяцев жизни и первая ревакцинация в 18 месяцев) и против кори вакциной «ЖКВ», (вакцинация в 12 месяцев, ревакцинация – в возрасте 6 лет) и не имевших поствакцинальных реакций. 219 детей (группа наблюдения) проживали на территории крупного промышленного центра с многопрофильным характером промышленного производства, 57 детей (группа сравнения) – на территории относительного санитарно-гигиенического благополучия. Группы были сопоставимы по гендерному составу и социально-экономическому статусу семей. Из исследования были исключены дети с патологией, сопровождающейся развитием иммунных нарушений.
Гигиеническая оценка воздействия на атмосферный воздух в зонах проживания детей проводилась на основании анализа количественного состава выбросов промышленных предприятий по данным 2-ТП-воздух. Для оценки качества атмосферного воздуха были использованы официальные данные мониторинговых исследований Росгидромета и результаты собственных натурных исследований качества атмосферного воздуха в зонах экспозиции.
Оценка риска развития у детей нарушений со стороны иммунной системы осуществлялась по стандартизованной методике в соответствии с «Руководством по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду» (Р 2.1.10.1920-04).
Химико-аналитические исследования содержания металлов (марганец, свинец, хром) в биосубстратах (кровь) и атмосферном воздухе проводилась методом атомноабсорбционной спектрофотометрии на спектрофотометре PERKIN-ELMER-3110 (США) (регистрационный номер в Государственном реестре 14427-95) с атомизацией в пламени и масс-спектрометре с индуктивно-связанной плазмой ICP-MS фирмы «Agilent 7500сх» (США) (регистрационный номер в Государственном реестре 24863-08 ). Исследование содержания фенола и О-крезола в биосубстратах (кровь) и атмосферном воздухе проводилось методом капиллярной газовой хроматографии и па-рафазного анализа в соответствии с методическими указаниями (МУК 4.1.7634.1.779-99; МУК 4.1.2102-4.1.2116-06) с использованием газового хроматографа (модель 7890A, регистрационный номер в Государственном реестре 15118-07) (США) и аппаратно-программного комплекса «Хро-матэк-Кристалл-5000» (№ ФСР 2009/04091, ТУ 9443-004-12908609-99).
Оценка содержания поствакцинальных антител осуществлялась методом иммуно-ферментного анализа на полуавтоматическом иммуноанализаторе «ELx808» с использованием:
-
а) тест-системы «Anti-Diphtheria Toxoid ELISA», предназначенной для количественного определения in vitro антител класса IgG (а также классов IgМ и IgА) к дифтерийному анатоксину (Diphtheria тoxoid) в сыворотке крови, откалиброванной в международных единицах (МЕд) с использованием международной референсной сыворотки NIBSC 91|534 (National Institute for Biological Standards Control, Hertfordshire, England);
-
б) тест-системы «RIDASCREEN Borde-tella IgG ELISA», предназначенной для количественного in vitro определения антител класса IgG к коклюшному анатоксину (Bor-detella тoxoid) в сыворотке крови;
-
в) тест-системы «Anti-Measles Viruses ELISA (IgG)», предназначенной для количественного in vitro определения антител класса IgG (а также классов IgМ и IgА) к вирусу кори в сыворотке крови;
-
г) тест-системы «Anti-Tetanus Toxoid ELISA», предназначенной для количественного in vitro определения антител класса IgG к cтолбнячному анатоксину (Tetanus тoxoid) в сыворотке крови, откалиброванной в международных единицах (МЕд) с использованием международной референсной сыворотки (I Международный стандарт антител к столбняку, Human NIBSC Code TE-3).
Оценка состояния поствакцинального иммунитета к дифтерии, коклюшу и столбняку проведена через три, четыре и пять лет после первой ревакцинации АКДС; к возбудителю кори – через три и четыре года после вакцинации и один год – после ревакцинации ЖКВ на основании исследования содержания циркулирующих специфических поствакцинальных антител.
Оценка межгрупповых различий исследуемых показателей проводилась с использованием стандартных методов параметрической статистики. На основе логистических моделей проведена оценка зависимости нарушений формирования поствакцинального иммунитета (содержание поствакцинальных антител ниже протек-тивного уровня) от повышенного (относи- тельно референсных/фоновых концентраций) содержания в крови химических токсикантов, обусловленного внешнесредовым воздействием. В рамках моделирования по критерию отношения шансов была выполнена оценка недействующих уровней марганца, свинца, хрома и о-крезола на формирование поствакцинального иммунитета к дифтерии, столбняку, коклюшу и кори.
Получены следующие результаты. На территории проживания детей группы наблюдения (крупный промышленный центр с многопрофильным производством) ежегодно в атмосферный воздух от стационарных источников поступает более 900 т загрязняющих веществ (в том числе соединений хрома, марганца, свинца, фенола и крезолов), среди которых вещества 1-3-х классов опасности составляют более 77 % (759,6 т/год).
Натурные исследования атмосферного воздуха в зонах экспозиции позволили идентифицировать в отобранных пробах хром, свинец, марганец - в концентрациях до 1,5 ПДКс . с, крезолы и фенол - до 2,34,0 ПДК с.с .
На территории проживания детей группы сравнения (поселок городского типа) качество атмосферного воздуха соответствовало гигиеническим нормативам как по данным мониторинговых наблюдений, так и по результатам натурных исследований.
В ходе исследований, проведенных на территории проживания детей группы наблюдения, установлен неприемлемый риск развития иммунных нарушений ( HI >1,0) при ингаляционном поступлении исследуемых соединений (хром, марганец, свинец). Результаты эпидемиологических исследований выявили причинноследственную связь между изучаемыми химическими факторами риска и возникновением иммунных нарушений (ОШ = = 2,56; ДИ = 1,05-6,26).
При оценке риска развития иммунных нарушений, связанных с воздействием химических факторов среды обитания, проведенной на территории проживания детей группы сравнения, установлен приемлемый уровень риска ( HI <1,0).
В результате химико-аналитических исследований крови детей группы наблюдения установлено, что содержание марганца (0,021±0,003 мг/дм3), свинца (0,131±0,013 мг/дм3), хрома (0,0191± 0,0035 мг/дм3), фенола (0,0494±0,0071 мг/дм3) и о-крезола (0,0143±0,0046 мг/дм3) достоверно (р = = 0,01-0,0001) в 1,4-4,0 раза превышало референтные/фоновые уровни. Кроме того, содержание данных химических веществ было в 1,2-4,9 раза выше аналогичных показателей группы сравнения (марганец -0,013±0,0024 мг/дм3, свинец - 0,109±0,009 мг/дм3, хром - 0,0107±0,0020 мг/дм3, фенол - 0,0087±0,0004 мг/дм3, о-крезол -0,003 3±0,0012 мг/дм3; р = 0,03-0,0001) (табл. 1).
Таблица 1
Содержание химических веществ в крови детей, проживающих в различных условиях санитарно-гигиенического благополучия среды обитания, мг/дм3
|
Вещество |
Группа наблюдения |
Группа сравнения |
р |
|
Марганец |
0,021±0,003 |
0,013±0,0024 |
0,0001 |
|
Свинец |
0,131±0,013 |
0,109±0,009 |
0,006 |
|
Хром |
0,0191±0,0035 |
0,0107±0,0020 |
0,03 |
|
Фенол |
0,0494±0,0071 |
0,0087±0,0004 |
0,0001 |
|
О-крезол |
0,0143±0,0046 |
0,0033±0,0012 |
0,0001 |
Примечание: р - достоверность различий группы наблюдения и группы сравнения
Анализ среднегрупповых показателей содержания поствакцинальных антител к дифтерии, столбняку, коклюшу и кори показал, что их уровень в обеих исследуемых группах в анализируемые сроки после вакцинации/первой ревакцинации соответствовал протективному. В группе наблюдения уровень поствакцинальных антител к токсину дифтерии составлял: min – 0,089 Мед/мл (протективный уровень – 0,1–2,0 Мед/мл, р = 0,82), max – 0,365 Мед/мл ( р ≤0,001), к анатоксину столбняка – min – 0,11 Мед/мл (протек-тивный уровень – 0,01–5,0 Мед/мл, р ≤0,001), max – 0,73 Мед/мл ( р ≤0,001), к возбудителю коклюша – min – 19,13 Ед/мл (протективный уровень – 14,0–18,0 Ед/мл, р = 0,02), max – 39,19 ( р ≤0,001), к возбудителю кори – min – 933,78 Мед/мл (протек-тивный уровень – 200,0–275,0 Мед/мл, р ≤0,001), max – 1126,43 Мед/мл ( р ≤0,001) (табл. 2). В то же время у детей группы наблюдения через 3 года после первой ревакцинации АКДС уровень антител к токсину дифтерии (0,089±0,096 Мед/мл) и анатоксину столбняка (0,11±0,09 Мед/мл) был в 4,8–10,4 раза ниже показателей группы сравнения (0,429±0,131 Мед/мл и 1,14±0,66 Мед/мл соответственно; р = 0,002...0,0001); через четыре года – в 1,4 раза ниже к возбудителю коклюша (30,07±7,69 Ед/мл против 43,31±2,0 Ед/мл, р = 0,001) и во все исследуемые периоды содержание антител к возбудителю кори после вакцинации/ревакцинации ЖКВ было (1126,43±166,12 Мед/мл, 933,78±132,25 Мед/мл, 1043,39±169,8 Мед/мл) в 1,3– 1,6 раза ниже группы сравнения (1457,87± ±142,11 Мед/мл, 1493,13±180,94 Мед/мл, 1314,31±170,44 Мед/мл; р = 0,025...0,0001) (табл. 2).
Для углубленной оценки иммунологической эффективности вакцин АКДС и ЖКВ в изучаемых группах была проанализирована частота нарушений формирования поствакцинального иммунитета (табл. 3). Результаты исследования показали, что у 50–67 % детей группы наблюдения и 21– 46 % детей группы сравнения содержание поствакцинальных антител не обеспечивало протективного уровня иммунитета к дифтерии и коклюшу, при этом частота случаев формирования у привитых детей группы наблюдения низких титров поствакцинальных антител была в 1,8–2,0 раза выше группы сравнения (р = 0,03...0,0001), в то время как нарушения противокоревого поствакцинального иммунитета в обеих группах встречались в единичных случаях (3–6 %). У всех исследованных детей содержание поствакцинальных антител к анатоксину столбняка в анализируемые сроки соответствовало про-тективному уровню.
В группе наблюдения в исследуемые сроки поствакцинального периода про-тективный уровень противодифтерийных антител имели только 33–48 % привитых детей, что достоверно в 1,5–2,0 раза меньше группы сравнения (67–71 %, р = 0,003...0,0001). Содержание поствакцинальных противококлюшных антител на протективном уровне и выше в группе наблюдения имели только 46–50 % детей, в то время как в группе сравнения таких детей было в 1,5–1,6 раза больше (70–78 %, р = 0,003...0,0001). В целом в группе наблюдения количество детей, имеющих низкое содержание поствакцинальных противодифтерийных антител, в 1,8–2,0 раза ( р = 0,001...0,003) превышало показатель группы сравнения, а число детей с уровнем противококлюшных антител ниже протек-тивного – в 1,5–2,4 раза ( р = 0,03...0,0001) (см. табл. 3). Кроме того, в анализируемые сроки поствакцинального периода (с 3 лет до 5) число детей с содержанием противодифтерийных антител ниже протективного уровня в группе наблюдения увеличивается на 28,9 %, в то время как в группе сравнения только на 13,8 % ( р = 0,03).
Таблица 2
и
S Я св Й а
V
о
и
|
)Д Д м § к 8 s о и s § g |
о V o' |
о irT о o' |
ОО 4 |
1Г) о |
||||||||||
|
д Д д Д д д и |
3 g § й & S & « § м § 2 о Й д н й о О § д М" м ® Е< д |
3 Д Д О О н н 9 ° I о |
ОО о |
о о о V |
о о о V |
о о о V |
о о о V |
о о о V |
<4 о о |
о о о V |
о о о V |
о о о V |
о о о V |
о о о V |
|
о В |
^ о о о о |
о |
о |
сч о о о |
ОО о |
о о |
S о |
^ о о о |
о о |
СП о о о |
^ о о о о |
ID СЧ О О |
||
|
o' -н о |
S o' -н о о |
о o' о о |
о о o' |
o' -Н ОО о о |
о -н о 1Г) о |
о о ^ ОО |
о^ 3 |
S ОО о ОО |
^ ОО |
о o' ОО о |
о |
|||
|
д д д д д |
о о o' -н о ОО о^ o' |
5 о^ o' -н о о |
о ОО о^ o' -н о S о |
о о^ o' о |
о o' НН о |
o' о |
о m о |
о о НН О' о |
о o' ^ о |
о о |
-Н ОО о |
ОО о о ^ о |
||
|
Д Д Д д Д д д д д § О ti д д д д о д д о к |
д В |
о о |
о |
ОО о |
о о |
о |
ОО о |
о о |
о |
ОО о |
ОО о o' |
ОО о |
о |
|
|
д |
ОО о o' -н о |
о НН |
о o' -н о irT |
ОО о o' -н о |
о НН |
о o' -н о irT |
ОО о o' -н о |
о НН |
о o' -н о irT |
o' |
о o' -Н ОО о |
o' -н о |
||
|
д д |
ОО |
о o' -н о ^ |
ОО o' -н irT |
ОО |
о o' -н о ^ |
ОО o' -н irT |
ОО |
о o' -н о ^ |
ОО o' -н irT |
IT) o' о о |
o' -Н ОО ОО |
o' -н ОО |
||
|
д |
д н д |
5^ |
§-5 5 “ |
Я4 о д 5 |
||||||||||
Таблица 3
2 S и у к R
к к я о
О X о
Я о
с о я я о о я X m о н Я й И Я и X о
X я и я я 2 я X я m о
ю
2 CD я ю
Изучение показателей системного иммунитета позволило установить у детей, проживающих в условиях антропогенного загрязнения среды обитания, достоверно более низкое, относительно группы сравне- ния, абсолютное содержание лимфоцитов СД19+ и CD16+56+ (р = 0,01...0,001) и сывороточного иммуноглобулина А (р = 0,02) (табл. 4).
Таблица 4
Показатели системного иммунитета у детей у детей с различным уровнем содержания в крови химических токсикантов техногенного происхождения
|
Показатель |
Физиологический уровень |
Группа наблюдения |
Группа сравнения |
р |
|
Процент фагоцитоза (%) |
35–60 |
56,0±2,5 |
56,5±4,5 |
0,92 |
|
Фагоцитарное число (у.е.) |
0,8–1,2 |
1,05±0,08 |
1,0±0,09 |
0,40 |
|
Фагоцитарный индекс (у.е.) |
1,5–2,0 |
1,85±0,08 |
1,70±0,12 |
0,06 |
|
Абсолютный фагоцитоз (109/дм3) |
0,964–2,988 |
2,541±0,247 |
2,170±0,323 |
0,07 |
|
CD3+-лимфоциты отн. (%) |
55–84 |
67,5±2,0 |
66,5±6,5 |
0,89 |
|
CD3+-лимфоциты абс. (109/дм3) |
0,690–2,540 |
2,037±0,213 |
2,160±0,276 |
0,48 |
|
CD3+CD4+-лимфоциты отн. (%) |
31–60 |
34,5±2,5 |
38,0±4,0 |
0,64 |
|
CD3+CD4+-лимфоциты абс. (109/дм3) |
0,410–1,590 |
1,047±0,132 |
1,233±0,166 |
0,08 |
|
CD3+CD8+-лимфоциты отн. (%) |
13–41 |
25,5±2,0 |
23,0±3,0 |
0,71 |
|
CD3+CD8+-лимфоциты абс. (109/дм3) |
0,190–1,140 |
0,773±0,089 |
0,757±0,112 |
0,82 |
|
CD19+-лимфоциты отн. (%) |
6–25 |
13,5±1,5 |
17,0±2,5 |
0,52 |
|
CD19+-лимфоциты абс. (109/дм3) |
0,090–0,660 |
0,417±0,065 |
0,545±0,079 |
0,01 |
|
CD16+56+-лимфоциты отн. (%) |
5–27 |
15,5±2,5 |
8,0±1,5 |
0,16 |
|
CD16+56+-лимфоциты абс. (109/дм3) |
0,090–0,590 |
0,463±0,084 |
0,253±0,05 |
0,001 |
|
CD3+CD25+-лимфоциты отн. (%) |
5,5 |
4,5±0,5 |
4,5±0,5 |
1,0 |
|
CD3+CD25+-лимфоциты абс. (109/дм3) |
0,155 |
0,136±0,023 |
0,154±0,021 |
0,26 |
|
IgА (г/дм3) |
2,0–2,8 |
1,14±0,07 |
1,29±0,11 |
0,02 |
|
IgM (г/дм3) |
1,0–1,6 |
1,09±0,04 |
1,17±0,09 |
0,1 |
|
IgG (г/дм3) |
12,0–16,0 |
10,01±0,33 |
10,25±0,73 |
0,35 |
Примечание: р – достоверность различий показателей системного иммунитета у детей группы наблюдения и группы сравнения.
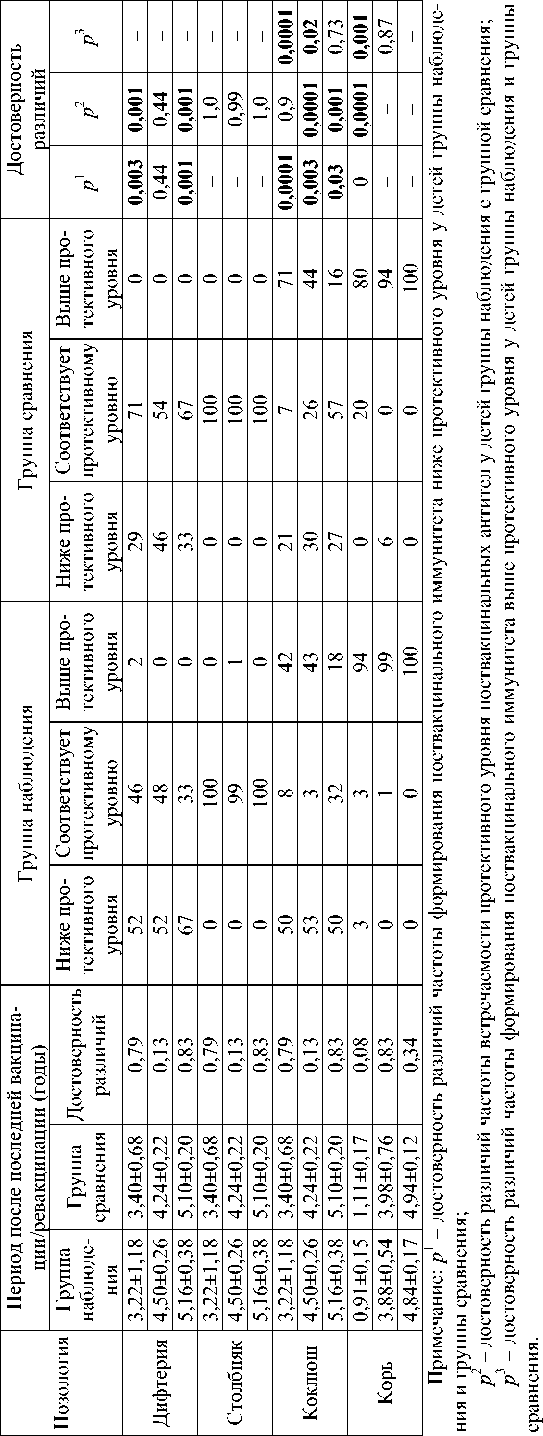
Анализ показателя отношения шансов изменения уровня поствакцинального специфического иммунитета при различном уровне токсикантной нагрузки позволил установить достоверную связь снижения содержания JgG к дифтерийному анатоксину при увеличении в крови концентрации свинца (недействующий уровень – 0,04 мг/дм3; R 2 = 0,09; р ≤0,0001) и
О-крезола (недействующий уровень – 0,0 мг/дм3; R 2 = 0,48; р ≤0,0001) (рис. 1, 2).
Кроме того, установлено достоверное снижение содержания JgG к возбудителю коклюша при увеличении в крови концентрации хрома (недействующий уровень – 0,004 мг/дм3; R 2 = 0,76; р ≤0,0001) (рис. 3), марганца (недействующий уровень – 0,011 мг/дм3; R 2 = 0,80; р ≤0,0001) (рис. 4).
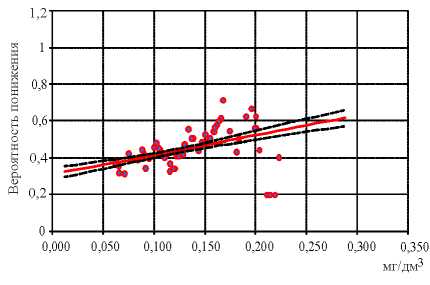
Рис. 1. Связь снижения содержания поствакцинального JgG к дифтерийному анатоксину при увеличении в крови концентрации свинца
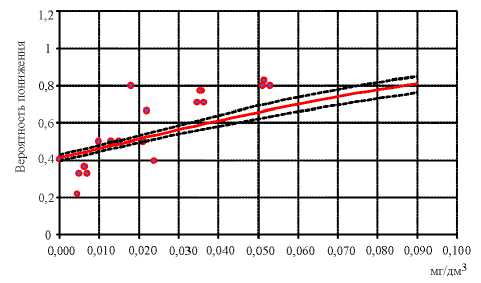
Рис. 2. Связь снижения содержания поствакцинального JgG к дифтерийному анатоксину при увеличении в крови концентрации О-крезола
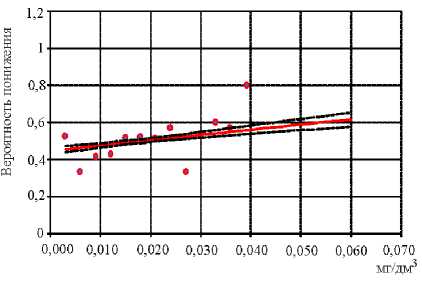
Рис. 3. Связь снижения содержания поствакцинального JgG к возбудителю коклюша при увеличении в крови концентрации хрома
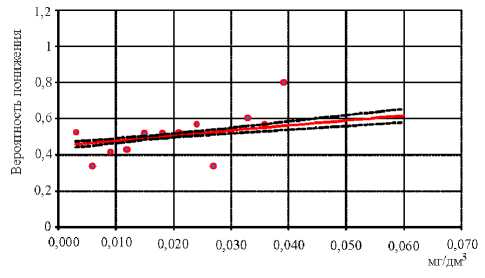
Рис. 4. Связь снижения содержания поствакцинального JgG к возбудителю коклюша при увеличении в крови концентрации марганца
Результаты проведенного исследования позволяют сделать следующие выводы:
-
1. У детей с повышенным содержанием в крови химических токсикантов (марганец, свинец, хром, фенол, О-крезол), обусловленным внешнесредовым воздействием, через 3– 5 лет после вакцинации/первой ревакцинации вакцинами АКДС и ЖКВ содержание поствакцинальных антител в 1,3–10,4 раза ниже относительно показателей детей, проживающих в условиях санитарно-гигиенического благополучия среды обитания.
-
2. Нарушения формирования поствакцинального иммунитета (уровень поствакцинальных антител ниже протективного) у детей с повышенным содержанием в крови марганца, свинца, хрома, фенола, О-крезола встречаются в 1,5–2,4 раза чаще относи-
- тельно детей с содержанием химических токсикантов на уровне референсных/фоно-вых значений.
-
3. Абсолютное содержание антителопродуцирующих (CD19+) клеток у детей с повышенным содержанием в крови химических токсикантов техногенного происхождения достоверно ниже показателя у детей, проживающих в условиях санитарно-гигиенического благополучия среды обитания.
-
4. Установлена достоверная связь снижения содержания специфических поствакцинальных антител при увеличении в крови концентрации свинца, хрома, марганца и О-крезола.
Список литературы Поствакцинальный иммунитет к дифтерии, кори, столбняку, коклюшу у детей в условиях воздействия химических факторов риска среды обитания
- Брико Н.И. Политика и механизмы принятия решений в области иммунопрофилактики в РФ: доклад на III ежегодном Всерос. конгрессе по инфекционным болезням [Электронный ресурс]. -М., 2011. -URL: http://www.congress-infection.ru/archiv.htm.
- Васнева Ж.П., Беляева Л.В., Шапошникова С.В. Напряженность поствакцинального гуморального иммунитета у детей//Организационные, диагностические и лечебные аспекты деятельности учреждений здравоохранения: сб. науч. тр. -Воронеж, 2005. -С. 187-190.
- Зверев В.В., Юминова Н.В. Эффективность вакцинации против кори и эпидемического паротита//Вакцинация. Новости вакцинопрофилактики. -2000. -№ 11 (5). -С. 10-11.
- Влияние полиметаллических загрязнений объектов окружающей среды на изменение микроэлементного состава биосред у детей/Н.В. Зайцева, Т.С. Уланова, Л.В. Плахова, Г.Н. Суетина//Гигиена и санитария. -2004. -№ 4. -С. 11.
- Зайцева Н.В., Землянова М.А., Кирьянов Д.А. Оценка адаптационно-приспособительных реакций у детей в условиях хронического воздействия химических факторов//Экология человека. -2005. -№ 9. -С. 29-31.
- боснование максимально недействующей концентрации формальдегида в крови детей, проживающих на территориях с различной антропогенной нагрузкой/Н.В. Зайцева, Т.С. Уланова, О.В. Долгих, Т.В. Карнажицкая//Пермский медицинский журнал. -2010. -Т. 27, № 1. -С. 101-104.
- Зайцева Н.В., Устинова О.Ю., Аминова А.И. Гигиенические аспекты нарушения здоровья детей при воздействии химических факторов среды обитания: руководство/под ред. Н.В. Зайцевой. -Пермь: Книжный формат, 2011. -489 с.
- Ильина С.В. Влияние техногенного загрязнения окружающей среды на эффективность вакцинопрофилактики у детского населения: автореф. дис. … докт. мед. наук. -Иркутск, 2008. -24 с.
- Коклюш на территориях с высоким уровнем техногенного загрязнения окружающей среды/С.В. Ильина, М.А. Дронова [и др.]//Эпидемиология и инфекционные болезни. -2007. -№ 1. -С. 18-21.
- Вакцинопрофилактика полиомиелита живой полиовакциной в условиях экологического неблагополучия/Ильина С.В., Степаненко Л.А. [и др.]//Сибирский медицинский журнал (Иркутск). -2005. -Т. 56, № 7. -С. 48-50.
- Инфекция и техногенное загрязнение: Подходы к управлению эпидемиологическим процессом/Е.Д. Савилов, С.И. Колесников, Г.Н. Красовский; Рос. акад. мед. наук, Сиб. отд., Вост.-Сиб. науч. центр, Ин-т эпидемиологии и микробиологии. -Новосибирск: Наука, 1996. -188 с.
- Каральник Б.В., Маркова С.Г. Экологические аспекты АКДС-вакцинации//Журнал микробиологии, эпидемиологии и иммунобиологии. -1991. -№ 12. -С. 34-38.
- О реализации мероприятий третьего этапа Программы ликвидации кори в Российской Федерации/Г.Г. Онищенко, Е.Б. Ежлова [и др.]//Эпидемиология и инфекционные болезни. -2011. -№ 3. -С. 4-10.
- Оскирко А.А. Неспецифическая медико-экологическая реабилитация как путь повышения специфического иммунитета против дифтерии в периоды между плановыми ревакцинациями//Педиатрия. -1997. -№ 2. -С. 110-111.
- Попова А.Ю. Влияние загрязнения окружающей среды хлорированными бифенилами на неспецифическую резистентность и поствакцинальный иммунитет: автореф. дис. … канд. мед. наук. -М., 1997. -23 с.
- Рахманин Ю.А., Ревазова Ю.А. Донозологическая диагностика в проблеме «окружающая среда -здоровье населения»//Гигиена и санитария. -2004. -№ 6. -С. 3-5.
- Семенов Б.Ф., Зверев В.В., Хаитов Р.М. Ожидаемые события в развитии вакцинопрофилактики до 2020-2030 гг.//Журнал микробиологии, эпидемиологии и иммунобиологии. -2010. -№ 2. -С. 105-111.
- Скачков М.В., Верещагин Н.Н. Особенности эпидемического процесса на территориях с различным уровнем антропогенной нагрузки//Эпидемиология и вакцинопрофилактика. -2004. -№ 3. -С. 14-18.
- Селезнева Т.С. Влияние вакцинопрофилактики на эпидемический процесс управляемых инфекций в Российской Федерации//Эпидемиология и инфекционные болезни. -2002. -№ 2. -С. 6-11.
- Фельдблюм И.В. Вакцинопрофилактика как жизнесберегающая технология и инструмент демографической политики//Эпидемиология и инфекционные болезни. Актуальные вопросы. -2011. -№ 2. -С. 14-16.


