Повреждения периферических нервов, история развития лечения, консервативное, интервенционное и хирургическое лечение
Автор: Яриков А.В., Байтингер А.В., Тутуров А.О., Евграфов Д.П., Байтингер В.Ф., Селянинов К.В., Фраерман А.П., Перльмуттер О.А., Волков И.В., Паркаев М.В., Цыбусов С.Н., Гарсия А., Туткин А.В., Соснин А.Г., Ежов И.Ю.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 1 т.11, 2025 года.
Бесплатный доступ
Представлены история хирургического лечения травм периферической нервной системы. Представлен весь спектр оперативных вмешательств, использующихся при лечении повреждений периферической нервной системы: невролиз, эпиневральный шов, невротизация, аутонейропластика, сухожильно-мышечные транспозиции, артродез, резекция кости, нейромодуляция. Освещены основы регенерации нервов. Проанализирована научная литература по вопросам использования кондуитов, стромально-васкулярной фракции, антиадгезивных композиций. Важная роль в успешном лечении травм периферической нервной системы отводится различным видам адъювантной терапии: ортезированию, лекарственной терапии, электростимуляции поврежденного нерва, физиолечению, лечебной физкультуре. Еще в лечение повреждений периферических нервов отводится различным интервенционным вмешательствам: радиочастотная нейроабляция, крионевролиз.
Нейрорафия, невротизация, невролиз, аутонейропластика, кондуит, крионевролиз
Короткий адрес: https://sciup.org/14132045
IDR: 14132045 | УДК: 616.8-089 | DOI: 10.33619/2414-2948/110/18
Текст обзорной статьи Повреждения периферических нервов, история развития лечения, консервативное, интервенционное и хирургическое лечение
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.8-089
Повреждение периферической нервной системы (ПНС) является важной клинической проблемой с тяжелыми последствиями для пациентов [1, 2]. Около 150 000 000 000 $ в США тратится ежегодно на лечение пациентов с травмами ПНС, в том числе затраты на лечение травм срединного и локтевого нервов оцениваются примерно в 70 000 $ и 45 000 $ соответственно, 87% этих затрат обусловлены результатом временной нетрудоспособности [3]. При этом повреждения ПНС в 2004 г. в США вызывали трудопотери (8 500 000 дней нетрудоспособности) и ежегодное выполнение более 200 000 операций [4].
Среди общего травматизма повреждения ПНС составляют 1,5-12%, при этом частота травм нервов верхней конечности, в частности, локтевого, срединного и лучевого, достигает 60–70%. [5-7]. Ятрогенные повреждения ПНС составляют 7-20% от всех поражений ПНС [8]. В виду особенностей анатомо-топографических взаимоотношений ПНС с окружающими тканями в 20-22% травмы ПНС сочетаются с повреждением сухожилий, в 12-15% — крупных сосудов, в 14-25% с переломами трубчатых костей, а также могут сопровождаться одномоментным повреждением всех анатомических структур [9, 10].
Хотя такие травмы и не представляют угрозы для жизни больного в изолированной форме, но в 60-65% случаев могут приводить к длительной или полной утрате трудоспособности [11].
Даже после лечения в узкоспециализированных учреждениях около 30% больных становятся инвалидами или вынуждены сменить профессию [4, 12]. В РФ ежегодно регистрируется от 150 000 до 700 000 случаев повреждений ПНС [13].
Ежегодно в РФ в хирургическом лечении нуждается 4-7 тыс. лиц с травматическими повреждениями ПНС [5, 14]. Наиболее частыми причинами являются транспортный, производственный и бытовой травматизм, а также огнестрельные ранения. Стоит отметить, что около 45% повреждений ПНС приходится на молодой возраст (21-30 лет), что, в свою очередь, обусловливает высокую социальную значимость данной проблемы. К закрытым повреждениям относят - растяжение (тракция), сдавление, к открытым - колотые и резанные (стеклом, ножом и т.д.) [15]. Резаные и колотые ранения традиционно считаются наиболее прогностически благоприятными вследствие несложности диагностики уровня и характера повреждения [16]. Рубленые, рваные повреждения являются более тяжелыми и характеризуются обширностью поражения ПНС [17].
Наибольшей сложностью отличаются огнестрельные ранения, имеющие широкую зону контузии нервных структур на значительном отдалении от раневого канала. Ошибки в лечении травм ПНС можно разделить на [18]:
-диагностические — несвоевременное, неполное и неправильное распознавание повреждений нервных стволов конечностей. Также к данным типам ошибок относится ошибки уровня повреждения ПНС, типа повреждения (нейропраксия, аксонотмезис и др.), игнорирование повреждения других органов (сухожилий, сосудов, мышц и др.). Они допускаются не только в ходе обследования больного, но и во время проведения операций на ПНС
-
- тактические — связаны с неправильными действиями врача при точно установленном диагнозе. Сюда включаются ошибки выбора тактики лечения (консервативный, интервенционный или хирургический), ошибки консервативного лечения (подборе лекарственной терапии и физиотерапии), определения сроков, показаний, способа и объема хирургического вмешательства на ПНС и скелетно-мышечной системе;
-
- технические – недочеты общего технического характера, связанные с погрешностями в подготовке и проведении операций, неправильном применении технических приемов (дефекты шва нерва, невротизации, аутонейропластики);
-
- организационные — недостатки в организации специализированной нейрохирургической помощи: инструмент, шовный материал, инструментальная диагностика, реабилитационные мероприятия, физиотерапия;
-
- экспертные – обусловлены неправильными решениями врачей о трудоспособности при освидетельствовании пострадавших с травмами ПНС;
-
- деонтологические – связаны с недооценкой взаимоотношений врача с пострадавшими и их родственниками, недостаточная мотивация пациента к занятиям, а также неверным информированием пациентов о современных возможностях реконструктивной хирургии ПНС и прогнозе;
История хирургического лечения и диагностики травм ПНС [19].
625–690 гг. греческий врач Paul of Aegina первым описал сближения концов нерва посредством сближения краев раны при ушивании.
-
XIII век итальянец Salicetti первым выполнил шов повреждённого нерва.
1596 г Gabriele Ferrare (1543–1627) первым ясно и лаконично описал технику шва пересеченного нерва, которая похожа на современную.
1752 г. швейцарский врач и естествоиспытатель Albrecht von Haller доказал, что сухожилия отличаются от нервов, и его работа по сшиванию сухожилий получила одобрение во Французской академии наук.
1795 г. шотландский хирург Сruikshank впервые продемонстрировал регенерацию после шва нерва.
1806 г. Я.В. Виллие написана важная для русских военных врачей работа «Краткое наставление о важнейших хирургических операциях», в которой приводился перечень операций с описанием техники их выполнения и необходимые инструменты.
1819 г. английский ученый и врач Josef Swan опубликовал эссе с убедительными данными результатов экспериментов на животных, доказывающих регенераторные возможности ПНС.
1827 г. Achille-Cleophas Flaubert во Франции первым описал аутопсийные находки повреждения плечевого сплетения (ПС).
1836 г. французский военный хирург L.J.B. Baudens впервые восстановил целостность срединного и локтевого нервов у человека.
1847 г. Sir James Paget впервые в Англии выполнил первичный шов n.medianus у 11летнего пациента с хорошим отдаленным функциональным результатом.
1863 г. французские хирурги A. Nelaton и S. Laugier впервые выполнили первичный эпиневральный шов с помощью очень тонкой проволоки.
1864 г. французский хирург A. Nelaton описал вторичный шов нерва.
1870 г. J.M. Philipeaux, A. Vulpia выполнили в эксперименте аутонейропластику с помощью графта.
1872 г. W. Mitchell – невролог и хирург, анализировавший повреждения нервов в течение гражданской войны в США первым охарактеризовал мучительную боль, связанную с повреждением ПС. Именно он предложил термин «каузальгия».
1873 гг. C. Hueter ввел концепцию первичного эпиневрального шва.
1873 г. французский хирург Jean-Joseph Emile Letievant впервые выполнил шов нерва конец-в-бок.
1876 г. Eugene-Armand Despres впервые применил технику шва нерва конец-в-бок, соединив дистальную культю n.medianus с неповрежденным n.ulnaris.
1876 г. чешский хирург и публицист Eduard Albert произвел первую неудачную аутотрансплантацию в клинике. Вначале хирурги использовали для пластики цельные нервные стволы, которые плохо реваскуляризировались.
1881 г. первый успешный случай хирургического восстановления поврежденного n.medianus в России был описан Н.В. Склифосовским.
1880 г. T. Gluck в качестве первого кондуита использовал декальцинированную кость. Однако его первый эксперимент оказался неудачным из-за выраженного рубцового процесса на месте операции.
1882 г. С. Vanlair при лечении дефекта n.ischiadicus в 3 см у собаки с помощью проводника из декальцинированной кости.
1882 г. польско-австрийский хирург J. Mikulicz опробовал специальный шовный материал для уменьшения натяжения на уровне шва нерва.
1884 г. Loebke предложил укорачивать кости сегмента конечности для сближения краев нерва.
1885 г. A. Klumpke объяснила наличие синдрома Горнера при травмах ПС, связав его с отрывом нижнего ствола.
1891 г. Bungner О. использовал сегмент a.brachialis для восполнения дефекта ПНС.
1891 г. Bungner предложил использовать сегмент артерии для восполнения дефекта ПНС.
1895 г. G.C. Huber первое экспериментальное исследование шва нерва конец-в-бок.
1899 г. R. Kennedy выполнил пересечением n.facialis и включением его периферического (дистального) конца конец-в-бок в спинальную порцию n.acessoris у пациента со спазмом лицевой мускулатуры.
1903 г. Ch. Ballance сообщил о серии наблюдений по лечению паралича n.facialis путем выполнения анастомоза между дистальным сегментом поврежденного n.facialis и другим, здоровым, нервом: 6 случаев с анастомозом n.facialis конец-в-бок со спинальной ветвью n.accessorius и 1 — с анастомозом n.facialis конец-в-бок с n.hypoglossus.
1906 г. J. Sherren предложил классификацию соединений сохранившейся дистальной части пересеченного нерва-реципиента с боковой поверхностью нерва-донора. Было предложено классифицировать все термино-латеральные соединения нервов по принципу подготовки донорской зоны: только продольный разрез эпиневрия, к краям которого затем подшивался нерв-реципиент; рассечение нерва-донора в косом направлении с пересечением всех оболочек и части нервных волокон; отделение части пучков для соединения с поврежденным нервом.
1908 г. Hacker восстановил двигательную функцию m.trapezius 12-летнего пациента. Он имплантировал в структуру m.trapezius проксимальный сегмент n.accessorius вместе с двигательной ветвью от шейного сплетения.
1909 г. Wrede впервые использовал аутовену в качестве кондуита для восполнения дефекта ПНС.
1914-1918 гг. в Первую Мировую войну хирургами были предложены и иные «вставки» – аутовена и синтетические проводники. Из-за плохих результатов, по сравнению с аутонейропластикой, длительное время эти операции пребывали в забвении.
1917 г. Trendelenbеrg продемонстрировал серьезные повреждения ПНС с потерей функции при замораживании тканей, при этом он отметил, что восстановление происходит без образования невромы.
1917 г. Л.М. Пуссеп опубликовал монография, в которой рассматривались вопросы диагностики и хирургического лечения повреждений ПНС.
1922 г. Джозеф Эрлангер и Герберт Гассер для анализа электромиограммы использовали осциллограф, что позволило им предложить классификацию нервных волокон по скорости проведения возбуждения.
1923 г. H. Platt and W.R. Bristow сообщили о 7 клинических случаях, когда дистальный конец поврежденного n.ulnaris имплантировали в сохранный n.medianus, не получив положительного результата. Все это послужило прекращению на многие десятилетия клинических испытаний шва нерва конец-в-бок.
1927 г. S. Bunnel опубликовал успешные результаты аутопластики пальцевых нервов.
1938 г. австрийский травматолог-ортопед Hans Spitz впервые выполнивший шов нерва конец-в-бок на нижней конечности (дистальный конец малоберцового в бок большеберцового).
1938 г. итальянский хирург R. Gatta в эксперименте на кроликах (дистальный конец пересеченного n. fibularis [peroneus] communis в бок целого n. tibialis (конец-в-бок или бок-в- бок) были получены нейрогистологические доказательства регенерации нервных волокон из n. tibialis в n. fibularis [peroneus] communis.
1939 г. успешные результаты аутопластики крупных нервов конечностей, что дало существенный толчок в развитии данного направления.
1942 г. Н.Н.Бурденко впервые применяет метод тракционного удлинения в замещении дефектов ПНС.
1943 г. Seddon предложил классификацию травм ПНС — три степени повреждения: нейропраксию, аксонотмезис и нейротмезис.
1947 г. Seddon впервые выполнил кабельную пластику тонкими трансплантатами.
1954 г. G. Bonney были внедрены электромиография и миелография.
1955 г. Schottstaed et. al. применил перемещение m. latissimus dorsi у пациента с повреждением ПС для восстановления сгибания предплечья.
1964 г. I. Smith впервые использовал микроскоп для реконструкции поврежденных нервных стволов и доказал, что оптическое увеличение позволяет более точно выполнить эпиневральный шов. С этого момента микрохирургическая техника становится непременным условием выполнения операций на ПНС.
1967 г. F.M. Bora впервые в эксперименте на кошках продемонстрировал технологию микрохирургического периневрального шва фасцикулярных групп.
1967 г. К.А. Григорович первым в России предложил объективную схему оценки восстановления движений и чувствительности после выполнения шва ПНС.
1972-1974 гг. H. Millesi et. al при выполнении кабельной пластики первым стал использовать микрохирургическую технику и показали, что результаты этой операции лучше, чем результаты эпиневрального шва, наложенного с натяжением.
1976 г. G.I. Taylor, F.J. Ham впервые представили микрохирургическую технологию пересадки кровоснабжаемой аутонервной вставки.
1978 г. Sunderland представил новую классификацию травм ПНС – пять степеней повреждения
1980-е гг. D.T.W. Chiu провел убедительные эксперименты на животных и доказал эффективность аутовенозной пластики в клинике
1981 г. Terzis J.K. начала применять для пластики ПС кровоснабжаемый трансплантат n. ulnaris.
1987 г. Merle M. на аутонейропластике начал применять “Biocol” и “Tissucol”, которые повышают точность сопоставления пучков, уменьшает степень их повреждения и убыстряет время проведения самой операции.
1988 г. B.D. Fornage впервые упоминает о применении ультразвукового исследования (УЗИ) для верификации периферических нервов.
1988 г. Sedel L. установил, что восстановление нервов трансплантатами длиной более 20 см приводит к плохим результатам.
1988 г. G. Brunelli сообщал о высокой продуктивности прямой мионевротизации, которая производилась путем вшивания донорского нерва в денервированную мышцу.
1989 г. S.MacKinnon и A.Dellon дополнили классификацию Sunderland.
1990 г. S.Mackinnon и A.Dellon для пластики коротких дефектов пальцевых нервов использовали трубки из рассасывающихся синтетических материалов (Dexon или Vicryl).
1990-х гг. после публикаций Fausto Viterbo о положительных результатах шва конец-в-бок в эксперименте на крысах и хирурги вновь заинтересовались данным методом.
1992 г. после публикаций Fausto Viterbo о положительных результатах шва конец-в-бок в эксперименте на крысах и хирурги вновь заинтересовались данным методом.
1994 г. G. Lundborg et. al. обосновали возможность боковой регенерации аксонов.
1998 г. U. Mennen анонсировал о серии из 22 лиц, которым выполнялась невротизация посредством шва конец-в-бок.
1999 г. китайский травматолог-ортопед Shao Cheng Zhang из Шанхая впервые выполнил шов нерва бок-в-бок у пациентов со спастическим церебральным параличом с целью ликвидации локального спазма мышц нижних конечностей при высокоуровневых повреждениях ПНС конечностей, а также для восстановления чувствительности у «парализованных пациентов».
2004 г. K. G. Krishnan проводил ревизию ПС как диагностическую операцию на трупах, направленную на выявление степени повреждения ПС и планирования дальнейшей тактики лечения, помимо этого, обозначив основные анатомические ориентиры при его выполнении через над- и подключичный доступы.
2004 г. А.А. Каюмходжаев разработал способ реконструкции поврежденного нерва в условиях наличия обширного дефекта и рубцовой трансформации мягких тканей верхней конечности.
2006 г. Braga-Silva J. провел эндоскопическую ревизию ПС на живом человеке с положительным эффектом.
2007 г. А.А. Давлятов внедряет способ аутоневральной пластики за счёт тыльной ветви n.ulnaris при травмировании ПНC на уровне н/3 предплечья, который позволяет взять трансплантат в пределах основной раны.
2007 г. Yamamoto Y et al. выполнили анастомоз n.facialis с n.hypoglosus по типу «конец-в-бок».
В России изучением травм ПНС занимаются: НМИЦН им. Н.Н. Бурденко, Научный центр неврологии, ГКБ им. С.П. Боткина г. Москва, РНХИ им. А.Л. Поленова – филиал НМИЦ им. В.А. Алмазова, Военно-медицинская академия им. С.М. Кирова, НИИ СП им. И.И. Джанелидзе, НМИЦ им. Р.Р. Вредена г. Санкт-Петербург, ПИМУ, ПОМЦ г. Н. Новгород, КБ СМП им. Н.В. Соловьева г. Ярославль, НИИТОН СГМУ им. В.И. Разумовского г. Саратов, НМИЦ им. Г.А. Илизарова г. Курган, Федеральный центр нейрохирургии (ФЦН) г. Тюмень, Федеральный центр нейрохирургии (ФЦН) г. Новосибирск, НИИ Микрохирургии г. Томск, Иркутский научный центр хирургии и травматологии (ИНЦХТ) г. Иркутск, ДВФУ г. Владивосток.
Большой вклад реконструктивной хирургии внесли: Григорович К. А., Берснев В. П., Орлов А. Ю., Ништ А. Ф., Свистов Д. В., Парфенов В. Е., Древаль О. Н., Родоманова Л. А., Говенько Ф. С., Мещерягина И. А., Гайворонский А. И., Байтингер В. Ф., Байтингер А. В., Богов А. А., Пак О. И., Золотов А. С., Бажанов С.П., Евзиков Г. Ю., Голубев И. О., Ключевский В. В., Пшениснов К. П., Назаров А. С., Суфианов А. А., Шнякин П. Г., Шток А. В.
Лечение. При контузии мягких тканей и повреждении кости первичное лечение нерва не показано, так как можно ожидать появления рубцовой ткани и вовлечения в рубец культи нерва. В большинстве случаев закрытые травматические повреждения происходят в результате действия сил растяжения или сжатия, и не всегда возможно определить степень повреждения (нейропраксия, аксонотмезис) [20, 21].
При закрытых повреждениях ПНС самостоятельное восстановление функций верхней конечности отмечается у 40–43% пациентов и наблюдается в первые 2–4 недели – 2–3 месяца после травмы [22].
В связи с этим операции на структурах ПНС при их закрытых повреждениях рекомендуют выполнять не ранее, чем через 3 месяца после травмы и проведения консервативного лечения. В случаях тяжелого неполного повреждения со стабильными неврологическими нарушениями или если ранее имело место минимальное неврологическое улучшение, клиническое и электромиографическое наблюдение следует продолжать, как минимум, 3–5 недель. Если спонтанная регенерация не происходит, то следует произвести хирургическое исследование с записью отведений от нерва для определения того, насколько к этому времени необходимо его восстановление. Лечение резаных ран, нанесенных острыми предметами (стеклом или ножом), лучше начинать немедленно или как можно скорее для соединения концов нерва, что возможно только при очень «чистой» перерезке последних без повреждения концов [22, 23]. Основной причиной отказа от хирургического лечения травмы нерва в раннем периоде являются возможные осложнения: формирование невромы в области шва нерва, несостоятельность шва, вовлечение в рубец соединительной ткани, нагноение в области шва нерва, неточное сопоставление концов нерва [24].
Регенерация периферического нерва [25]. После двух наиболее тяжелых повреждений периферических нервов из шести типов - раздавливания (аксонотмезис) и перерезания (нейротмезис) нервные волокна, расположенные дистальнее места повреждения, теряют контакт с телом нейрональной клетки. Они фактически лишены своего источника синтеза белков, гликопротеидов, липидов и углеводов. В результате нервные волокна подвергаются валлеровской дегенерации, оставляя соединительнотканные оболочки и трубки базальной пластинки, содержащие шванновские клетки неповрежденными. По мере того, как денервированные швановские клетки дедифференцируются, пролиферируют, удлиняются и выстилают эндоневральные трубки в пучках денервированных дистальных нервных окончаний, они снижают регуляцию генов, связанных с миелином, и повышают регуляцию генов, связанных с ростом. Однако процесс отрастания аксонов и проникновения их в эндоневральные трубки является сложным и запоздалым, особенно после хирургического лечения перерезанных нервных окончаний.
В течение нескольких дней после перерезки нерва:
-
1. периферический конец аксона дегенерирует, продукты распада удаляют моноциты, которые перемещаются из кровотока в эндоневрий и превращаются в макрофаги. Помимо осуществления фагоцитоза, макрофаги стимулируют митотическую активность шванновских клеток
-
2. центральный конец перерезанного аксона начинает прорастать и образовывать конусы роста, на концах конусов роста формируются напоминающие антенны филоподии, где располагаются поверхностные рецепторы, временно связывающиеся с соответствующими поверхностными молекулами адгезии базальных мембран шванновских клеток. Начинается процесс разрастания, ветвления новых ветвей аксонов (спраутинг).
-
3. При нарушении формирования связи между конусом роста и швановской клеткой образуется псевдоневрома, представляющая собой извитые регенерирующие аксоны, погруженные в рубцовую ткань
-
4. тело нервной клетки подвергается процессу, называемому хроматолизом
-
5. некоторые шванновские клетки становятся фагоцитарными и поглощают дегенерирующие аксоны и миелин.
-
6. центральный конец аксона прорастает, а отростки прорастают в эндоневриальные оболочки, оставшиеся после дегенерировавшей терминальной части исходного аксона.
-
7. шванновские клетки размножаются по мере того, как аксон растет по направлению к мышце.
-
8. аксон восстанавливает контакт с мышечным волокном. На этой стадии аксон довольно тонок и еще не полностью миелинизирован
-
9. диаметр терминального аксона увеличивается за счет образования новых нейрофиламентов, которые увеличивают диаметр аксона; терминальный аксон становится миелинизированным.
-
10. может случиться так, что дистальная часть регенерированного аксона никогда не достигнет диаметра или степени миелинизации исходного аксона, поскольку скорость проведения не обязательно вернется к прежнему уровню.
-
11. если регенерация аксонов не происходит, мышечное волокно атрофируется, а тело нейрональной клетки дегенерирует и подвергается апоптозу.
-
12. после перерезки нерва тело нейрональной клетки подвергается процессу хроматолиза, при котором ядро клетки смещается в сторону от центра перикариона, а вещество Ниссля (РНК) распадается и значительно редуцируется.
-
13. в этот момент синтез белка в клетке изменяется таким образом, что белки, необходимые для роста аксона, производятся, упаковываются и переносятся в растущий терминатор посредством антероградного аксонального транспорта.
Регенерация нерва после шва представляет сложный и длительный процесс, поскольку средняя скорость роста аксонов у человека составляет 1–2 мм/сут. [12].
Зона шва нерва составляет определенное препятствие на пути роста аксонов, поэтому на ее прохождение требуется около 1 месяца. Это означает, что при травме ПНС на уровне верхней трети плеча реиннервацию кисти теоретически стоит ожидать через 1,5-2 года. [26].
Несмотря на научные достижения в изучении ПНС человека и непрерывное совершенствование хирургической техники, значительного улучшения исходов травм ПНС не наблюдается [27, 28].
Внедрение микрохирургической техники, использование операционного микроскопа существенно облегчили решение технических аспектов проблемы, однако полное восстановление функции после травмы ПНС реальностью пока не стало [29-31].
Современная микрохирургия ПНС подразумевает наличие у специалиста не только мануальных навыков, но и знаний как топографической анатомии, так и особенностей архитектоники и внутриствольного строения пораженного нерва. Основными оперативными приемами, направленными на соединение разобщенных концов нервного ствола, являются шов «конец в конец» и пластика нерва трансплантатами различной природы (Рисунок) [32].
Невролиз выполняется в случаях сдавления структур ПНС при условии сохранения их анатомической целостности [22, 34].
Если в ранние сроки после травмы невролиз производится для удаления гематом, костных фрагментов, других инородных тел, то при последствиях травматического повреждения ПНС с целью устранения экстра- и интраневральной фиброзной ткани, рубцов, оказывающих компремирующее воздействие на нервные и сосудистые структуры [35].
С целью уменьшения образования рубцовых тканей вокруг ПНС, применяются отграничивающие материалы не вызывающие реакцию со стороны окружающих тканей: алломатериалы (противоспаечные мембраны, противоспаечный гель и др.), аутожир, аутовена [20, 36].
В то же время с учетом риска травмирования сохранных нервных структур и питающих их сосудов подход к выбору операции невролиза противоречив: от отрицания целесообразности до применения в 20 % случаев оперативного лечения [37].
Эпиневральный шов. В настоящее время основным оперативным приемом, как и 50-60 лет назад, остается эпиневральный шов [38]. Задача этой операции состоит в точном совопоставлении и удержании в соприкосновении поперечных срезов центрального и периферического концов пересеченного нервного ствола с помощью швов, накладываемых на эпиневрий [39]. Преимущества этой техники: короткое время выполнения, техническая непринужденность и отсутствие интраневральных повреждений, так как швы накладываются во внешней оболочке. Данный метод применяется как при первичной, так и при отсроченной вторичной реконструкции ПНС. Перед швом необходима резекция измененного участка ПНС до получения на поперечных срезах пучкового строения нерва во всех его секторах. При зернистом виде пучков нерва с характерным блеском, хорошей кровоточивостью сосудов и заметным сокращением эпиневрия освежение считалось «удовлетворительным» [40, 41].
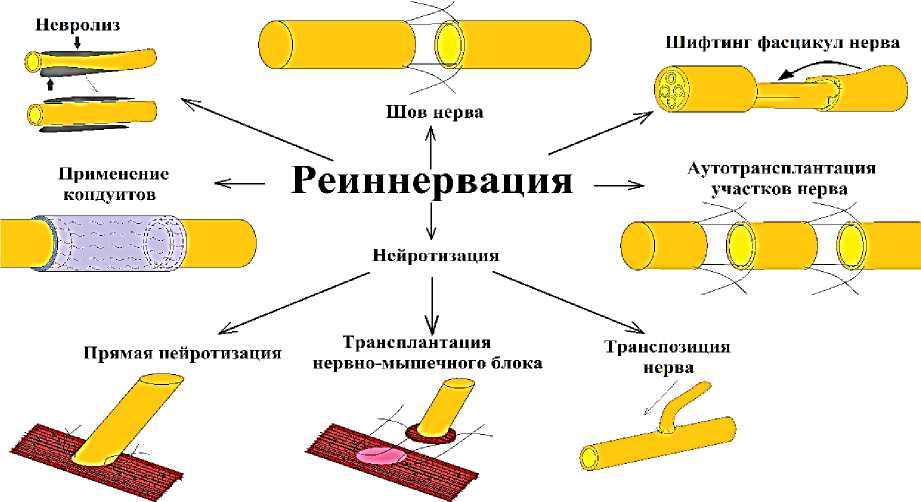
Рисунок. Схема – варианты реиннервации при повреждении ПНС по Tuturov A.O. et al. [33]
Натяжение концов нерва от естественного сокращения, несмотря на отсутствие потери ткани нерва, ставит под угрозу точное выравнивание фасцикулов, что в свою очередь мешает достигнуть эндоневральной структурной целостности нерва, оценивается как самый существенный недостаток данного метода. Перед швом нерва нужно оценить влияние натяжения сшиваемых концов (без предварительной их мобилизации) на внутриствольный кровоток [42]. Речь идет о влиянии удлинения нерва (за счет его эластичности), необходимого для ликвидации дефекта, на внутриствольный кровоток в сшиваемых концах. Процент удлинения для ликвидации диастаза можно вычислить по формуле G. Lundborg: % nerve elongation = A / (B1 + B2) × 100, где A — протяженность дефекта, B1 + B2 — длина концов сшиваемого нерва без дополнительной их хирургической мобилизации.
При минимальном удлинении (менее 5%), когда диастаз был минимальным, концы легко сближаются, внутриствольный кровоток в сшиваемых концах не снижается; в этих условиях формируется нежный глиальный рубец. При удлинении на 5-10% появляются первые при-знаки повреждения тканей в связи со снижением внутриствольного кровотока уже на 50%. Развивается неврома. При удлинении более чем на 11% внутриствольный кровоток в сшиваемых концах нерва прекращается полностью.
Мобилизация концов пересеченного нерва на протяжении 10 см в проксимальном и дистальном направлениях незначительно способствует уменьшению диастаза – в среднем всего на 1,5 см (по сравнению с мобилизацией в 4 см) [32]. При этом происходит увеличение размера операционной раны, что существенно повышает операционные риски и восстановительный период [43, 44] Для сближения концов поврежденного нерва применяются следующие способы и приемы: придание конечности определенного положения; соединение разноименных нервов; этапный шов, перемещение нерва в новое ложе по более короткому пути; резекция кости для укорочения конечности. В этой связи при одномоментном реконструкции ПНС и сухожилий необходимо соблюсти условия восстановления нерва без натяжения [44].
Наиболее перспективным методом хирургического лечения является тубулизация ушитого нерва при соблюдении определенной методики имплантации и правильном подборе материала имплантата. Техника тубулизации с неабсорбируемыми или абсорбируемыми трубками показала многообещающие результаты экспериментально и клинически, когда использовалась для устранения диастаза или эпиневральном шве. Трубка нерва — трубчатая структура, разработанная для устранения диастаза ПНС, защиты ее от окружающей ткани (например, от формирования невромы) и направления аксональной регенерации в дистальную культю нерва. Кондуиты нерва включают алифатические полиэфиры и основанные на сополиэфире, такие как эпсилон-поликапролактон, полигликолевая и полимолочная кислоты. Общей проблемой любых кондуитов является отсутствие в них шванновских клеток, которые являются фактором роста и регулятором направления роста аксонов. По этой причине применение кондуитов показано пока только при небольших (до 30 мм) дефектах ПНС. Увеличение регенеративного потенциала внутренней среды кондуитов достигается использованием клеточных (стволовые клетки, шванновские клетки) и/или гуморальных факторов (факторы роста), которые оказывают в разной степени стимулирующее влияние на рост аксонов [45, 46]
Регенерация периферических нервов представляет собой сложный физиологический процесс, в котором участвуют шванновские клетки, макрофаги, фибробласты, PDGF(Тромбоцитарный фактор роста), FGF(фактор роста фибробластов), TGF-β(Трансформирующий фактор роста бета) и другие клетки, а также взаимный синтез биологически активных факторов. При использовании пористых кондуитов основную роль в улучшении регенерации ПНС играют определенные размеры, проницаемость, морфология и взаимосвязь структуры пор, соответствующие патофизиологическим потребностям восстановления периферических нервов, гарантирующие синергетическое действие этих факторов. В кондуитах для восстановления ПНС поры, как правило, предназначены для обеспечения миграции клеток, поддержания достаточного притока питательных веществ и кислорода и устранения метаболических отходов. Таким образом, проницаемость структуры пор напрямую связана с их положительной ролью в стимулировании регенерации периферических нервов. Размер и морфология пор также влияет на ранние стадии клеточного поведения, такие как адгезия, распространение и миграция [47, 48]. Классификация пористых кондуитов в соответствии с их проходимостью и соответствующими характеристиками представлена в Таблице 1.
Антиадгезивные гели и композиции. В лечении травматических повреждений ПНС существует проблема образования фиброзной ткани и спаек, оказывающих отрицательное воздействие на нервные образования. Нарушается трофика нервной ткани, проводимость по нерву. Одним из способов профилактики спаечного процесса, образования периневрального фиброза является использование антиадгезивных гелев. В их основе лежит способность образовывать барьер между ПНС и окружающими тканями, препятствуя при этом образованию спаечного процесса. В эксперименте исследовалась способность геля из карбоксиметилцеллюлозы и полиэтиленоксида препятствовать образованию периневральных рубцов. После термического повреждения седалищного нерва крысы, на поврежденный
Бюллетень науки и практики / Bulletin of Science and Practice Т. 11. №1 2025 участок нерва наносился антиадгезивный гель. При сравнении контрольных групп, в группе с использованием противоспаечной композиции выраженность явления периневрального фиброза была намного ниже [49].
Т аблица 1
КЛАССИФИКАЦИЯ ПОРИСТЫХ КОНДУИТОВ [47]
|
Классификация |
Размер пор |
Проницаемость |
Преимущество для регенерации периферического нерва |
Недостатки |
|
Полупроницаемые |
<10 µm |
Проницаем для питательных веществ, молекулярных сигналов, метаболических отходов |
Защита от фиброзных рубцов |
Невозможность прямой передачи сигналов между клетками |
|
Полностью проницаемые |
>50 µm |
Проницаем для клеток, питательных веществ, молекулярных сигналов, метаболических отходов |
Способствуют прямой передаче сигналов между клетками |
Риск инвазии фиброзных рубцов |
|
Ассиметричные |
Размер пор на внешней поверхности > размер пор на поверхности просвета |
Высокая пропускная способность |
Высокая эффективность удаления метаболических отходов |
Не удается обеспечить прямую передачу сигналов между клетками |
Исследовалась способность противоспаечного геля на основе карбоксиметилцеллюлозы профилактировать рубцово-спаечные осложнения после декомпрессии срединного нерва при синдроме карпального канала. По итогам исследования, использование противоспаечного геля привела к лучшим функциональным результатам и меньшему числу рецидивов синдрома карпального канала [50].
Стромально-васкулярная фракция. Особую роль при лечении травматических повреждений ПНС отводится различным клеточным фракциям и гуморальным факторам. Стромально-васкулярную фракцию (СВФ) можно определить как гетерогенную популяцию свежевыделенных клеток из жировой ткани после ферментативной диссоциации с последующим центрифугированием. Эта популяция клеток включает множество различных типов клеток, таких как стволовые клетки жировой ткани (СКЖТ), эндотелиальные и гладкомышечные клетки кровеносных сосудов и их предшественники, перициты, фибробласты, макрофаги, Т-лимфоциты и т. д., но не включает зрелые адипоциты. Основным компонентом СВФ являются СКЖТ, которые способны к самообновлению и мультипотентной дифференцировке [51].
Для обоснования применения клеток СВФ для лечения травм ПНС было проведено экспериментальные исследования на беспородых крысах, с целью изучения влияния клеток СВФ на регенерацию ПНС. Животным в седалищном нерве формировался дефект, на месте которого сразу же производилась аутонейропластика. В группе 1 в проксимальный и дистальный концы, в аутонервную вставку вводились СКЖТ. В группе 2 вводился физиологический раствор, группа 3 - интактная. Во всех группах седалищный нерв после аутонейропластики покрывали слоем фибринового клея. После операции у подопытных животных производили регистрацию электрических М-ответов мышц, микроскопически исследовался спинальный ганглий L5, микроскопический анализ срезов седалищного нерва. Таким образом, в эксперименте показано, что применение клеток СВФ: приближает порог М-ответа к показателям интактных животных, повышает выживаемость клеток в спинальных ганглиях, уменьшает количество внутриствольных невром, что в сумме способствует регенерации [52].
Исследовалось применение клеток СВФ при хирургическом лечении повреждений ПС. Исследование было проведено у 62 пациентов с использованием клеток СВФ-ЖТ и классических методов лечения при травме ПС. Эффективность регенерации оценивали с помощью электромиографического исследования и положительного восстановления двигательной и чувствительной функции. Оценка результатов хирургического лечения с применением клеток СВФ-ЖТ после невролиза ПС показала восстановление ранней функции M3-M5 и S3–S4 у 90% пациентов, а в группе сравнения — 68%. Количество пациентов с функциями M4–M5 в группе с применением СВФ-ЖТ при невротизации ПС составило 85%, в то время как в группе контроля — 64%. Данные ЭНМГ-исследования также свидетельствовали об увеличении среднего числа двигательных единиц на 30% после использования клеток СВФ-ЖТ, в отличии от группы сравнения [53].
Многочисленные типы клеток СФВ, включая стволовые клетки жирового происхождения, макрофаги и эндотелиальные клетки-предшественники, вносят значительный вклад в регенеративные способности СВФ. Предполагается, что гетерогенная природа СВФ обеспечивает свойства иммуномодуляции, контролируемого воспаления, ангиогенеза, дифференцировки и производства внеклеточного матрикса, способствующие регенерации. Хотя эти свойства явно присутствуют в регенерации, вызванной СВФ, точные механизмы и вклад отдельных клеточных популяций еще предстоит выяснить [54].
Интраоперационные методы диагностики. Применение интраоперационной ангиографии с индоцианином зеленым после реконструктивных операций на ПНС является доступной и легко выполнимой методикой, позволяющей определить сохранность и, что не менее важно, адекватность и эффективность кровотока в нервном стволе [55]. Она позволяет проводить контроль сохранности кровотока в ПНС, изучить механизмы компенсации кровоснабжения нерва после микрохирургического эпиневрального шва, оценить качество сопоставления культей нерва по оси, исключая вероятность их «перекрута».
Предоперационное УЗИ позволяет локализовать проксимальные и дистальные концы поврежденного нерва [56]. При использовании интраоперационного УЗИ отмечено снижение средней продолжительности операций на 15–60 мин по сравнению с традиционными вмешательствами на тех же нервах и при том же уровне повреждения [57]. В первую очередь сокращение длительности операции достигается за счет сокращения этапа поиска нерва в условиях измененной анатомии. Такая же положительная тенденция отмечается и в уменьшении длины разреза, необходимого для доступа к поврежденному нервному стволу. У пациентов, прооперированных с использованием интраоперационного УЗИ, длина разреза кожи была на 2–6 см меньше, чем при традиционных операциях на одноименных нервах [5, 58]. С точки зрения предоперационного планирования УЗИ позволяет определить не только точное местонахождение концов нерва и диастаз между ними, но и измерить истинный диастаз – с учётом резекции посттравматических невром.
Аутонейропластика. Особую группу составляют больные с травматическими дефектами ПНС. Обширным дефектом периферических нервов признается такой вид травмы, при котором сближения центрального и периферического участков поврежденного нерва не удается достичь всеми известными способами [59]. В течение начала 1970-х Millesi рекомендовал аутонейропластику трансплантатами для любого диастаза концов нерва, больше чем 2 см, и достиг больших результатов при восстановлении локтевого, срединного и лучевого нервов. В качестве замещающего материала могут применяться как аутотрансплантаты нервных стволов, так и искусственно созданные для этих целей материалы [43]. Показанием к выбору того или иного приема служит величина диастаза между проксимальной и дистальной культями поврежденного нерва, а также субъективное представление хирурга о степени выраженности натяжения структур нерва при их сопоставлении. Одни хирурги предлагают отказаться от шва «конец в конец» в пользу аутопластики необходимо уже при наличии дефекта нервного ствола >1,5 см. и выявлении «незначительного» натяжения, тогда как другие отмечают целесообразность выбора данной методики лишь при диастазе более 5 см и «умеренном» натяжении в проекции шва [43]. Некоторые из его основных правил при аутонейропластики трансплантатами включают [60, 61]:
-
1) трансплантаты должны быть немного больше по длине, чем участок повреждения;
-
2) использовать соединительную ткань между группами фасцикулов, а не каждый индивидуальный фасцикул;
-
3) стремиться сохранять только здоровую ткань и, если в сомнении, пересекать место повреждения;
-
4) разбор фасцикулов должен быть как в дистальном, так и в центральном участке нерва в пределах нормальной ткани;
-
5) сопоставлять концы нерва и трансплантатов в соответствии с рисунком фасцикулов;
-
6) пять – шесть аутотрансплантатов необходимы для срединного нерва и четыре - пять для локтевых и радиальных нервов.
-
7) окутывание центрального и периферического концов поврежденной структуры ПНС и уровня анастомоза с аутотрансплантатом жировой тканью на сосудистой ножке для предупреждения образования фиброзной ткани
Наиболее часто для использования в качестве аутотрансплантатов применяют вставки из n. suralis, глубокой ветви n. fibularis [peroneus] communi, а также сегменты других поврежденных ПНС, восстановление которых по различным причинам не целесообразно при сочетанном повреждении нескольких крупных нервных стволов [62]. Резекция интактного периферического нерва для использования его участка в качестве аутонервной вставки всегда сопровождается расстройствами иннервации в зоне распространения ветвей донорского нерва. Степень утраты иннервации в донорской зоне при таких вмешательствах является прогнозируемой. В то же время объем восстановления иннервации реципиентной зоны после таких вмешательств представляется непредсказуемым.
Межфасцикулярная групповая аутопластика рекомендуется при повреждении нерва, где пересеченные фасцикулы в нерве хорошо сформированы и идентифицируются в основном нервном стволе [63, 64].
Шифтинг фасцикул нерва. Функциональный результат аутонейропластики как было указано ранее, часто непредсказуем. Неудовлетворительные результаты могут быть следствием значительного несоответствия количеств аксонов: один n. suralis обеспечивает всего около 5600 аксонов преимущественно малого диаметра [65].
Кроме того, недостаточная регенерация считается следствием качественного несоответствия, которое выражается в том, что «чувствительный» трансплантат используется для реконструкции смешанного «чувствительный/двигательный» нерв. Было высказано предположение, что регенерация моторных аксонов, особенно на больших расстояниях, требует наличия моторных путей с адекватными эпитопами и гуморальной поддержкой [66, 33].
Активно обсуждаемой в настоящее время является методика «шифтинга фасцикул нерва». От дистального от повреждения/невромы участка нервного ствола выделяется чувствительная фасцикула/группа фасцикул и перемещается в область основного дефекта нерва с наложением швов конец-в-конец. В экспериментальной модели на крысах этот метод способствовал успешной регенерации нервов и превосходил традиционные аутотрансплантаты сенсорных нервов не только за счет формирования качественно адекватных аутотрансплантатов, но и лучшую реиннервацию, о чем свидетельствует гистоморфометрические данные [67].
Также было проведено исследование на ПС на кадаверах. Было показано шифтинг фасцикул n. ulnaris и n. medianus обеспечивает достаточное количество донорского материала. Несмотря на то, что потенциальная длина донора в n. radialis ограничена, он все равно может помочь расширить хирургический арсенал в отдельных клинических ситуациях. Эта потенциально перспективная методика реконструкции дефектов нервных стволов представляет огромный интерес и требует дальнейших исследований [68].
Невротизация (nerve transfer). В связи с преобладанием тракционного механизма травмы с обширным, многоуровневым повреждением структур ПНС, основным методом хирургического лечения последствий травматического повреждения ПНС является невротизация его структур [69, 70]. При невротизации применяется шва нерва конец-в-бок [71]. Приоритетное направление при этом — восстановление наиболее функционально значимого движения – сгибания предплечья [72].
Операция невротизации состоит из 3 этапов [73, 74].
-
1 этап. Выделение стволов и/или невротизируемых ПНС.
-
2 этап. Выделение нервов-невротизаторов.
-
3 этап. Наложение анастомоза между нервом-невротизатором и структурами (стволами и/или нервами) поврежденного
Особенности невротизации [61, 75]:
-
- выбор невротизируемой структуры определялся характером и уровнем повреждения ПНС; при неполном повреждении ПНС проводится невротизизацию проксимальных отделов длинных нервов ПНС, иннервирующих парализованные мышцы верхней конечности; при повреждении ПС с тотальным параличом мышц верхней конечности в первую очередь невротизировали стволы, в случаях их повреждения - проксимальные отделы длинных нервов ПС;
-
- выбор нервов-невротизаторов определяетя содержанием в них миелинизированных волокон и локализацией невротизируемых структур ПНС для исключения применения аутотрансплантата; невротизация первичных стволов проводится двигательными ветвями шейного сплетения, а также диафрагмальным, добавочным и спинальным С4 нервами, вторичных стволов ветвями шейного сплетения с аутонейропластикой или межреберными нервами; для невротизации проксимальных отделов длинных нервов ПНС используются межреберные нервы;
-
- невротизация стволов ПС проводится с учетом внутриствольного строения (реиннервировали фасцикулы, относящиеся к определенным нервам), функциональной значимости фасцикул в стволах ПС, что предупреждает рассеивание фасцикул невротизаторов на функционально менее значимые мышцы; фасцикулами одного невротизатора или невротизаторов-синергистов реиннервировали фасцикулы поврежденных синергистов ПС, что позволяло избежать патологической коактивации;
При выполнении невротизации учитывается также приоритет восстановления проксимальной группы мышц, в первую очередь m. biceps brachii.
В случаях, когда проксимальный участок является недостижимым по различным причинам, может быть применен метод невротизации дистального участка пересеченного нерва за счет его соединения «конец в конец» с отсеченным проксимальным участком менее значимого в функциональном плане нервного ствола.
Прямая невротизация, является наименее изученным, но перспективным способом реиннервации. Применение методики оправдано в тех случаях, когда нейрорафия невозможна из-за отсутствия или серьезного повреждения дистального конца нерва. В этом случае аутотрансплантация и использование кондуитов невозможны. Для реиннервации в таких случаях проксимальный конец нерва имплантируют непосредственно в мышечную ткань. Первые упоминания об успешной невротизации относятся к 1908 г. [76]. Однако, несмотря на успех, невротизация долгое время не использовалась и нашла применение лишь в экспериментальных исследованиях на животных. Наибольший интерес в этом направлении нейрорегенерации вызывает проблема формирования новых терминальных пластинок или нервно-мышечных соединений (НМС). НМС — зона, в которой нервная система через ПНС взаимодействует с волокнами скелетных мышц и заставляет их сокращаться. Повреждение этого механизма НМС вызывает многие генетические заболевания [77].
Для реализации электрофизиологических процессов необходимо формирование НМС на морфологическом уровне. Каждая ветвь дистального конца нерва имеет постсинаптические складки, увеличивающие площадь поверхности постсинаптической мембраны. Имеются везикулы, содержащие нейротрансмиттеры, которые организуют интенсивность передачи нервов по ионным каналам к миоцитам [78]. Таким образом, ключевой задачей прямой нейротизации является формирование новых НМС или расширение/активация старой зоны НМС после имплантации нерва.
Спорные результаты многих экспериментальных работ были разрешены в технологии Sobotka и Mu [79]. Авторы исследования выполнили рассечение и коагуляцию нервных окончаний, иннервирующих левую m. sternocleidomastoideus. На противоположной мышце для сохранения концевых пластинок резецировали дистальную часть нервного ствола с участком иннервируемой мышечной ткани размером 6 мм х 6 мм х 3 мм. Этот нервномышечный блок (НМБ) имплантировали с помощью шва нерва нейлоном 10/0. 3 месяца спустя исследователи окрасили нервные волокна импрегнацией нитрата серебра и в результате отметили, что регенерирующие аксоны имплантированного НМБ проросли в мышцу реципиента. При этом мышечная масса составила 87% от контрольной группы, а степень функционального восстановления иннервации - 66% при измерении максимальной силы сокращения.
В 2013 г. Dy et al. сообщили об использовании прямой невротизации у 3-х пациентов с нереконструируемыми травматическими повреждениями ПС [80]. В частности, прямая невротизация была выполнена для восстановления функции m. biceps у одного пациента и функции m. deltoideus у 2-х пациентов, из которых у всех 3-х наблюдалось улучшение послеоперационных электродиагностических исследований. Авторы предположили, что, учитывая их обнадеживающие результаты, эту технику потенциально следует рассматривать как вспомогательное лечение, а не как стандартное, особенно в случаях отрыва нерва от мышцы.
В 2020 г. Padovano et al. [81] описали использование прямой невротизации как метода «спасения» мышц тенара при размозжении мягких тканей кисти. Через 8 месяцев у пациента восстановилась функция I пальца с сокращением мышц тенара. Хотя последующая электромиография не проводилась, что затрудняет определение того, была ли эта функция обусловлена прямой невротизацией, тяжестью травмы. Предположительно, эта техника играет роль в механизме восстановления.
Методы восстановления локальной целостности структур ПНС (невролиз, шов, аутонейропластика, невротизация) целесообразно применять в сроки до 6 месяцев с момента травмы ПНС [22].
Сухожильно-мышечная транспозиция показана при повреждениях ПНС в более длительные сроки (не менее 6 мес.), сопровождающихся полным или глубоким нарушением проводимости и развития в них необратимых дегенеративных изменений в мышцах [82]. Общие принципы переноса сухожилий описаны: донорские сухожильно-мышечные единицы должны иметь нормальную или близкую к нормальной силу (не менее 4/5), иметь одинаковую экскурсию и желательно действовать в фазе с сухожилием реципиента [83].
Для выполнения сухожильно-мышечной транспозиции имеется множество опций. При осмотре хирург обязательно выясняет у пациента о том, какая функция первостепенно ему необходима. При высоких поражениях нервов, как правило, первично сгибание в локтевом суставе. В качестве трансплантатов используются m.latissimus dorsi, m.pectoralis major, m.triceps brachii, m.trapezius. В алгоритме оперативных вмешательств преимущество отдается транспозиции m.triceps brachii и операции Стендлера, которые по техническому исполнению являются наиболее доступными, однако наименее эффективны, приводят к осложнениям в виде отсутствия разгибания в локтевом суставе и развития сгибательной контрактуры предплечья, кисти, пальцев [19]. Лишь при невозможности проведения данных оперативных вмешательств рассматривается выполнение транспозиции m.latissimus dorsi или m.pectoralis major. Биполярная транспозиция m.latissimus dorsi с формированием тубулизированного лоскута на нервно-сосудистой ножке в ложе удаленной парализованной m.biceps brachii без рассечения фасции плеча с фиксацией дистально – к сухожилию удаленной m.biceps brachii, проксимально – к клювовидному отростку лопатки. Для обеспечения фиксации мышечного трансплантата предложен усовершенствованный метод биполярной транспозиции наружного и среднего отделов m.latissimus dorsi с формированием тубулизированного лоскута на нервно-сосудистой ножке в ложе удаленной парализованной m.biceps brachii без рассечения фасции плеча с фиксацией мышечного трансплантата дистально – к сохраненной части мышечного брюшка, проксимально – к сухожилию короткой головки m.biceps brachii [84].
Так же применяется метод монополярной транспозиции лоскута верхнего треугольника m. trapezius на нервно-сосудистой ножке на переднюю поверхность верхней трети плеча с фиксацией к проксимальному отделу парализованной m.biceps brachii.
Для оценки показаний к транспозициям сухожилий при поражении кисти и предплечья необходимо выполнять пассивный тенодез запястья. При нормальном тесте пальцы переходят из вытянутого положения при сгибании запястья в согнутое положение при разгибании запястья, при этом пальцы сохраняют «каскад». Отклонения от нормы при осмотре могут указывать на изолированные повреждения сухожилий. Тестирование диапазона движений запястья, кисти и пальцев важно, поскольку перед транспозицией сухожилий должен быть достигнут полный пассивный диапазон движений.
При травме n. radialis первостепенным является восстановление разгибания. Разгибание запястья достигается за счет передачи m. pronator teres к m. extensor carpi radialis brevis. Разгибание пястно-фалангового сустава трехфалангового пальца достигается за счет переноса m. flexor carpi radialis к m. extensor digitorum или m. flexor digitorum superficialis к m. extensor digitorum communis. Разгибание большого пальца достигается за счет переноса m.
palmaris longus к m. extensor pollicis longus или m. flexor digitorum superficialis к m. extensor pollicis longus [85].
При низкой травме n. medianus страдает оппозиция большого пальца, которая достигается путем перемещения m. abductor digiti minimi (Huber), или m. extensor indicis (Burkhalter), или m. flexor digitorum superficialis (Bunnell or Royle-Thompson) к m. abductor brevis pollicis.
При высокой травме n. medianus предпочтение отдают:
Межфаланговое сгибание большого пальца достигается за счет переноса m. brachioradialis, m. extensor carpi radialis longus или m. flexor carpi ulnaris к m. flexor pollicis longus.
Сгибание в дистальном и проксимальном межфаланговых суставах указательного пальца может быть достигнуто путем переноса длинного m. extensor carpi radialis brevis на сухожилие m. flexor digitorum profundus или путем бокового тенодезирования m. flexor digitorum profundus [86].
В случаях утраты разгибания кисти и пальцев вследствие нарушения функции n. radialis при последствиях травматического повреждения ПНС и сохранности m. flexor carpi ulnaris и m. flexor carpi radialis показано выполнение их транспозиции на разгибательную поверхность предплечья [22].
Последствия травм n. ulnaris – это трудности с захватом предмета пальцами и «удержание ключа» хват большим пальцем, а также деформация по типу когтистой лапы. Известная precedure (Zancolli) lasso позволяет путем трансфера расщепленного поверхностного сгибателя пальца и фиксации его через А1 связки 2-3-4-5 пальцев добиться коррекции. Для коррекции слабости «удержания ключа» выполняется транспозиция m. extensor carpi radialis brevis с сухожильной аугментацией (Smith) или m. brachioradialis (Boyes) [87].
Ортопедические вмешательства направлены на устранение контрактур, восстановление стабильности суставов, заместительное восстановление отдельных движений. К числу таких операций относятся артродез, резекция кости и др. [88, 89]. Ортопедические операции на сухожильно-мышечном аппарате, костях и суставах выполняются, как правило, в поздние сроки после повреждения (спустя год и позже) и направлены на коррекцию вторичных изменений и улучшение функции поврежденной конечности [88, 90].
Интервенционные вмешательства. Хроническая боль при травме ПНС составляет 1015% [91, 92]. Депрессивные расстройства различной степени тяжести диагностируются у 20–50% пациентов с хронической болью. В случае неэффективности консервативного лечения хронического болевого синдрома при посттравматических нейропатиях пациентам показаны интервенционные вмешательства [93]. При наличии болевого синдрома лечение начинают с блокад нерва под УЗ- и ЭНМГ-навигацией. При эффективности возможно выполнение радиочастотной абляции (РЧА) или крионевролиза нерва. Под УЗ-контролем игла устанавливался к нерву [94]. Далее проводится нейрофизиологическое тестирование: на электрод подается импульс, вызывающий болевые ощущения. При положительном результате тестирования проводится нейродеструкция путем РЧА (температуре 90° и экспозиции 90 сек.). Крионевролиз с целью разрушения пораженного нервного ствола проводится через криозонд с использованием закиси азота или углекислого газа, нагнетаемых под высоким давлением, обеспечивает деструкцию нерва при температуре от – 20 до –100° C , что по степени тяжести повреждения соответствует аксонотмезису [95]. Обезболивающий эффект после однократной процедуры сохраняется до нескольких месяцев. При положительном ответе от нейродеструктивных вмешательств выполняется повторно.
Имеются отдельные описания успешной РЧА при поражении ПНС с нейропатическим и фантомным болевыми синдромами [96].
Нейромодуляция. Еще одним методом лечения хронического болевого синдрома является нейромодуляция (хроническая нейростимуляция с помощью имплантированных электродов в заднее эпидуральное пространство спинного мозга, либо к периферическому нерву). Хроническая стимуляция ПНС делится на:
-
1) стимуляция стволов периферических нервов (PNS – Periferal Nerve Stimulation), при которой электрод имплантируют непосредственно над стволом нерва,
-
2) стимуляция в области подкожных разветвлений нервов, так называемая, «стимуляция поля периферического нерва» – Periferic Nerve Field Stimulation (PNFS), когда электроды располагаются подкожно в надапоневротическом слое, непосредственно в зоне боли. Из-за расположения основных контактов электрода прямо в зоне боли, такую стимуляцию еще называют таргетированной – “Target Stimulation”. По эффективности периферической нейростимуляции, ни блокада нерва, ни чрескожная электронейростимуляция не являются достоверными предикторами эффективности стимуляции ПНС. Лекарственная терапия заключается в назначении метаболических средств, антигипоксантов, лекарственных веществ, улучшающих синаптическую передачу и обладающих нейропротекторным действием, витаминов группы В, L-карнитина, а также препаратов, содержащих полиненасыщенные жирные кислоты (Таблица 2) [97-99].
СПИСОК ОСНОВНЫХ КЛАССОВ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ИСПОЛЬЗУЕМЫХ ПРИ ЛЕЧЕНИИ ТРАВМ ПНС
Таблица 2
|
Группы лекарственных препаратов |
Название активного вещества |
|
НПВП(Нестероидные противовоспалительные препараты) |
Целекоксиб, эторикоксиб, нимесулид, мелоксикам, кетопрофен, диклофенак, индометацин и т.д.. Используются для уменьшения боли при остром, подостром и обострении хронического болевого синдрома. |
|
Антидепрессанты |
Трициклические антидепрессанты: амитриптилин. Ингибиторы обратного захвата серотонина и норадреналина:дулоксетин и венлафаксин. Используются для лечения невропатической боли. |
|
Антиконвульсанты |
Габапентин и прегабалин. Используются для лечения невропатической боли. |
|
Препараты для местного применения |
Используются для лечения периферической нейропатической боли |
|
Слабые опиоиды |
Трамадол, Тапентадол. Используются при лечении болевого синдрома средней и высокой интенсивности при недостаточной эффективности более слабых анальгетиков. |
|
Сильные опиоиды |
Оксикодон, морфин. Используются при рефрактерном болевом синдроме, когда комбинации препаратов и слабые опиоиды не эффективны, чаще при остром болевом синдроме. |
|
Антигипоксанты, вазоактивные препараты, антиагреганты, ангиопротекторы и т.д. |
Пентоксифиллин, Аминофиллин, Никотиновая кислота, дипиридамол, L-карнитин. Используются для улучшения микроциркуляции, реологических свойств крови. |
|
Ингибитор холинэстеразы |
Ипидакрин. Используется в восстановительном периоде для улучшения нервно-мышечной проводимости. |
|
Витамины группы B |
Тиамин, Пиридоксин, Цианкоболамин. Нейротропные витамины, усиливают действие анальгетиков, улучшают регенерацию нервов. |
|
Глюкокортикостероиды |
Гидрокортизон, дексаметазон, бетаметазон, триамциналон для локальных инъекций под УЗИ-, ЭНМГ-контролем. |
Считается разумным, что после восстановления нерва (шов нерва конец-в-конец, аутонервная вставка) необходима защита операционной раны иммобилизацией [100]. Клетки CВФ, выделенные из жировой ткани, представляются перспективными стимуляторами для восстановления при травме ПНС [101].
Ортезирование. Важным элементом консервативных мероприятий является раннее ортезирование верхней конечности, что способствует профилактике чрезмерного отвисания руки с необратимым растяжением мышц, сосудов и стволов ПНС [97]. Ее продолжительность может быть от 10-14 дней до 6 недель в зависимости от локализации повреждения ПНС и риска натяжения реконструированного нерва. После периода иммобилизации начинается реабилитационный период выполнением полных пассивных, а затем активных движений в функционирующих соседних суставах [102]. Ортезы, рекомендуемые к назначению при параличах/парезах верхних конечностей: бандажи (фиксатор (манжета), фиксирующе-разгружающие, разгружающие (поддерживающие, косыночные), отводящая шина-бандаж, на лучезапястный сустав и I палец, на лучезапястный сустав и кисть, на плечо с манжетой на предплечье), тургоры (лучезапястный, локтевой сустав), ортопедические аппараты (на суставы пальцев, кистедержатель, на предплечье с захватом лучезапястного сустава, на локтевой сустав с захватом плеча и предплечья). Общепризнанным и бесспорно правильным принципом ортезирования является строго индивидуальный подход к выбору ортопедического изделия, назначаемого больному. Использование ортезов при поражении верхних конечностей позволяет предотвращать возникновение деформаций в суставах, устранять патологические условия функционирования мышц, приводит, не только, к восстановлению или замещению функций схвата и удержания предметов, но и, в какой-то мере, к восстановлению способности инвалида к самообслуживанию, созданию благоприятных условий для психологической реабилитации [103].
Лечебная гимнастика включает лечение положением, специальные упражнения для мышц верхней конечности и пассивные движения во всех суставах конечности, при появлении самопроизвольных движений – активные упражнения со строго индивидуальным дозированием постепенно увеличиваемых физических нагрузок [104].
Физиотерапевтическое лечение выбираются с учётом срока заболевания, возраста пациента и сопутствующей патологии. В последние годы, наряду с совершенствованием хирургического лечения больных с поражением периферических нервов, все шире применяются стимуляционные методы: прямая стимуляция нервного ствола, чрескожная стимуляция, стимуляция в области периферического нерва, стимуляция корешков и задних столбов спинного мозга [59, 105]. Электростимуляция воздействует на весь комплекс обменно-трофических процессов, направленных на энергетическое обеспечение нервов и мышц, повышает активность регулирующих систем, оказывает анальгезирующее действие [106, 107]. При прохождении стимулирующего электрического тока по нерву возрастает проводимость нервного импульса, ускоряется регенерация поврежденных нервов. Как известно, денервированные мышцы через 3–4 месяца подвергаются атрофии, а через 1–1,5 года необратимо дегенерируют. К этому, особенно, чувствительна собственная мускулатура кисти. Считается, что темпы перерождения мышечных волокон могут быть замедлены посредством электрической стимуляции. Электростимуляция парализованных мышц на всех этапах лечения является важнейшим моментом восстановительного лечения [7, 108, 109]. Она восполняет функциональный дефицит внутрисегментной импульсации, улучшая трофику и микроциркуляцию в мышечной ткани и нервных стволах, сохраняя синаптический аппарат денервированной мышцы и предотвращая её атрофию. Электростимуляция мышц должна быть направлена на все парализованные мышцы и проводиться ежедневно [110, 111].
Обсуждение. Возраст пациента. В реконструкции ПНС, ожидаемые функциональные результаты обратно пропорциональны возрасту пациентов [63]. При реконструкции ПНС с лучшим успехом восстановление дискриминации наблюдается у пациентов возрастной группы 20-31 гг., и результат хуже > 31 год. Для пациентов до 20 летнего возраста восстановленная дискриминация была такой же самой, какая характерна с возрастом у здоровых лиц. Моторная деятельность ПНС, с другой стороны, показала хорошее функциональное восстановление до возраста 50 лет. Авторы Lundborg G. и Rosin B. нашли, что пациенты до 10 лет показали лучшие результаты в сроке восстановления чувствительности после повреждения срединных или локтевых нервов на уровне запястья. Кроме того, они наблюдали снижение показателей в возвращении чувствительности до возраста 18 лет [112]. Mondelli М. et. al. также сообщают, что пожилые пациенты показали меньшие показатели восстановления, чем группа 20-54 летних пациентов [113]. Faivre S. et. al. утверждают, что дети - превосходные кандидаты на невротизацию отдалённых от центра повреждений нерва, даже без шва нерва [114].
Время реконструкции нерва. Venkatramani H. et. al. и предполагают, хорошие результаты ожидаются, если процедура произведена в течение 6 месяцев после травмы. Есть некоторые разногласия у большинства авторов относительно оптимального выбора времени для того, чтобы зашить пересеченные нервы [115].
Использование клеточной технологии. В последние годы многочисленными экспериментальными и клиническими исследованиями установлено, что применение аутологичных клеток стромальной васкулярной фракции (СВФ) благоприятно влияет на регенерацию ПНС путём активации естественных возможностей организма [64]. При этом было выявлено, что сроки реиннервации при использовании клеточных технологий в чувствительной сфере сокращаются в несколько раз, а в двигательной сфере – на 30-40%.
Выполнение оперативных вмешательств в условиях специализированных центров. В настоящее время хирургия ПНС является сложной хирургией, а нейрохирург занимающейся этим направлением должен иметь глубокие знания в анатомии, физиологии и топической диагностике ПНС; инструментальной диагностике и владеть целым спектром оперативных вмешательств (от интервенционных до сложных реконструктивных) [116, 117, 118]. Выполнение вмешательств в условиях специализированных центров позволит улучшить результаты лечения [119, 120].
Выводы
В целях решения основных проблем организации оказания помощи пострадавшим с травмой ПНС необходимо создать центры лечения данной патологии на базе ведущей медицинской организации, оказывающий в том числе неотложную нейрохирургическую помощи. В данные центры должен направляться этот контингент пациентов. Хирург, занимающийся вопросами лечения травм ПНС, должен владеть всем спектром операций от реконструктивных до интервенционных.
У многих пациентов даже после проведенных на высоком уровне восстановительных операций (шов или пластика нерва) остаются параличи, грубые нарушения чувствительности, хроническая боль. В подавляющем большинстве случаев нейрохирург не может предсказать результат восстановительной операции на ПНС. При выполнении интраплексальной невротизации следует планировать выбор нервов-невротизаторов с учетом необходимости сохранения грудо-спинного или передних грудных нервов предполагая возможность второго этапа хирургического лечения – мышечной транспозиции. Мышечную и сухожильно-мышечную транспозицию следует выполнять как второй этап хирургического лечения при неэффективности операций на структурах ПНС или в сроки более 12 мес. после травмы.
Лечение травм ПНС должно быть комплексным и после операции пациент должен постоянно наблюдаться у оперирующего хирурга и в лечение должны включаться смежные специалисты: физиотерапевт, врач физической медицинский реабилитации, невролог.
Список литературы Повреждения периферических нервов, история развития лечения, консервативное, интервенционное и хирургическое лечение
- Золотов А. С., Пак О. И. К вопросу об истории хирургических операций при ранениях периферических нервов // Травматология и ортопедия России. 2013. №3 (69). С. 162-166.
- Яриков А. В., Туткин А. В., Леонов В. А., Фраерман А. П., Перльмуттер О. А., Тихомиров С. Е., Цыганков Д. А., Цыганков А. М. Травматическое повреждение плечевого сплетения // Сибирский медицинский журнал (Иркутск). 2019. Т. 159. № 4. С. 14-18.
- Литвиненко И. В., Одинак М. М., Живолупов С. А., Булатов А. Р., Рашидов Н. А., Бардаков С. Н. Клинико-инструментальные характеристики травматических поражений периферических нервов конечностей // Вестник Российской Военно-медицинской академии. 2018. № 3 (63). С. 50-56.
- Гайворонский А. И., Журбин Е. А., Декан В. С., Железняк И. С., Алексеев Е. Д., Мартынов Б. В., Свистов Д. В. Интраоперационное ультразвуковое исследование в хирургии периферических нервов верхней конечности // Вестник Российской Военно-медицинской академии. 2015. № 2 (50). С. 56-59.
- Журбин Е. А., Гайворонский А. И., Железняк И. С., Декан В. С., Чуриков Л. И., Алексеев Е. Д., Алексеев Д. Е., Свистов Д. В. Диагностическая точность ультразвукового исследования при повреждениях периферических нервов конечностей // Вестник Российской Военно-медицинской академии. 2017. № 3 (59). С. 63-68.
- Мартель И. И., Мещерягина И. А., Митина Ю. Л., Россик О. С., Михайлова Е. А. МРТ-диагностика повреждений периферических нервов // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2011. № 4-1 (80). С. 119-123.
- Бажанов С. П., Шувалов С. Д., Коршунова Г. А., Айтемиров Ш. М., Островский В. В. Результаты применения различных методов хирургического лечения у пациентов с закрытыми тракционными повреждениями плечевого сплетения // Гений ортопедии. 2023. Т. 29. № 4. С. 351-356.
- Дюсембеков Е. К., Халимов А. Р., Курмаев И. Т., Николаева А. В., Жайлаубаева А. С., Гаитова К. К., Досым Н. Ятрогенные повреждения периферических нервов в нейрохирургической клинике // Вестник Казахского национального медицинского университета. 2021. № 3. С. 131-135.
- Журбин Е. А., Гайворонский А. И., Декан В. С., Железняк И. С., Чуриков Л. И., Исаев Д. М., Алексеев Е. Д., Свистов Д. В. Диагностическая эффективность ультразвукового исследования при повреждениях периферических нервов // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2019. Т. 11. № 1. С. 23-29.
- Говенько Ф. С. Хирургия повреждений периферических нервов. СПб.: Феникс, 2010. 384 с
- Золотов А. С., Зеленин В. Н., Сороковиков В. А. Хирургическое лечение повреждений сухожилий сгибателей пальцев кисти. Иркутск, 2006. 110 с.
- Худяев А. Т., Мартель И. И., Самылов В. В., Мещерягина О. С., Россик О. С. Малоинвазивные методы лечения повреждений периферических нервов // Гений ортопедии. 2012. № 1. С. 85-88.
- Литвиненко И. В., Живолупов С. А., Булатов А. Р., Кузина Е. Э., Рашидов Н. А., Иванов В. С., Труфанов А. Г. Анализ диагностических и тактических ошибок при ведении пациентов с травматическими невропатиями конечностей // Вестник Российской Военно-медицинской академии. 2019. № 2 (66). С. 204-208.
- Халимов А. Р., Дюсембеков Е. К., Юнусов Р. Ю., Курмаев И. Т., Николаева А. В., Жайлаубаева А. С., Гаитова К. К., Надыр А. Т., Оразбаков Б. Н., Оразбеков А. А., Алдияров Е. Т. Актуальные аспекты хирургического лечения повреждений периферических нервов // Нейрохирургия и неврология Казахстана. 2020. № 3 (60). С. 3-10.
- Усатова И. С., Старикова А. С., Шнякин П. Г., Чумаков В. П., Пестряков Ю. Я., Старикова О. С., Краснощеков В. А., Спугис Е. И. Анализ структуры пациентов с травмой периферической нервной системы, пролеченных в КГБУЗ ККБ г. Красноярска в 2015-2017 гг. // Современные технологии лечения пациентов с травмой опорно-двигательного аппарата и центральной нервной системы: Сборник статей. 2019. С. 114-118.
- Золотов А. С., Пак О. И. Случай высокой бифуркации срединного нерва // Вопросы нейрохирургии им. Н.Н. Бурденко. 2015. Т. 79. № 5. С. 68-71.
- Смеянович А. Ф., Сидорович Р. Р. Методы хирургического лечения открытых повреждений плечевого сплетения // Белорусский медицинский журнал. 2004. № 2 (8). С. 9294.
- Воеводкина А. Ю., Олейник Е. А., Александров М. В., Потемкина Е. Г., Орлов А. Ю. Клинико-инструментальные методы обследования больных с заболеваниями и повреждениями плечевого сплетения: исторические аспекты (к 100 летию РНХИ им. проф. А.Л. Поленова) // Российский нейрохирургический журнал им. проф. А.Л. Поленова. 2023. №15(4). С. 122-128.
- Сидорович Р. Р., Юдина О. А. Анатомо-топографические особенности трехглавой мышцы плеча в аспекте использования ее в качестве трансплантата при травматическом повреждении плечевого сплетения // Вестник Витебского государственного медицинского университета. 2004. Т. 3. № 3. С. 90-95.
- Зоркова А. В., Григорьева В. Н. Применение невролиза, эндоневральнои стимуляции и противоспаечнои мембраны в хирургическом лечении внутриствольных травм лучевого нерва // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2019. Т. 11. № 2. С. 42-47.
- Бажанов С. П., Толкачев В. С., Коршунова Г. А., Джумагишиев Д. К., Шувалов С. Д. Результаты хирургического лечения пациентов с закрытыми повреждениями нервов верхних и нижних конечностей // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2021. Т. 13. № S1. С. 30.
- Сидорович Р. Р., Смеянович А. Ф. Алгоритм хирургического лечения последствий травматического повреждения плечевого сплетения с учетом результатов оперативных вмешательств на его структурах и реконструктивных операций мышечной и сухожильно-мышечной транспозиций // Доклады Национальной академии наук Беларуси. 2012. Т. 56. № 4. С. 83-93.
- Шимон Р. Почему надо оперировать травматические повреждения периферических нервов? // Нейрохирургия и неврология детского возраста. 2012. № 2-3 (32-33). С. 130-134.
- Сафронов В. А., Шевелев И. Н. Предоперационное исследование сохранности нервов-невротизаторов // Вопросы нейрохирургии им. Н.Н. Бурденко. 2005. № 3. С. 17-20.
- Gordon T. Peripheral Nerve Régénération and Muscle Reinnervation // Int J Mol Sci. 2020. 17. 21(22). P. 8652. https://doi.org/10.3390/ijms21228652
- Novak C. B. Peripheral nerve injuries. 2011.
- Гайворонский А. И., Губочкин Н. Г., Чуриков Л. И., Исаев Д. М., Алексеев Д. Е., Легздайн М. А., Аверьянов Д. А., Свистов Д. В. Вклад сотрудников Военно-Медицинской Академии в развитие хирургии периферических нервов // Вестник Российской Военно-медицинской академии. 2020. № 1 (69). С. 238-241.
- Байтингер В. Ф., Селянинов К. В., Белозерцева А. А. Становление микрохирургической службы в Томской области // Анналы пластической, реконструктивной и эстетической хирургии. 2016. № 1. С. 63-64.
- Козлов А. В. Новые хирургические технологии лечения больных с повреждениями периферических нервов // Дальневосточный медицинский журнал. 2002. № 3. С. 139.
- Селянинов К. В., Курочкина О. С., Байтингер В. Ф. Технологии обучения микрохирургическим навыкам в институте Микрохирургии // Вопросы реконструктивной и пластической хирургии. 2021. Т. 24. № 1 (76). С. 19-28.
- Чичилимов А. В. Особенности современных микрохирургических операций в центре микрохирургии в Благовещенске // Молодежь XXI века: шаг в будущее. Материалы XX региональной научно-практической конференции. 2019. С. 143-144.
- Говенько Ф. С. Некоторые вехи и достижения в хирургии повреждений нервов // Неврологический вестник. 2008. Т. 40. № 1. С. 88-92.
- Tuturov A. O. The role of peripheral nerve surgery in a tissue reinnervation // Chin Neurosurg J. 2019. V. 18. №5. P. 5. https://doi.org/10.1186/s41016-019-0151-1
- Сидорович Р. Р., Смеянович А. Ф. Особенности хирургического лечения последствий травматического повреждения плечевого сплетения методом невролиза // Неврология и нейрохирургия в Беларуси. 2010. № 4 (8). С. 126-137.
- Сидорович Р. Р. Применение невролиза в хирургическом лечении последствий травматического повреждения плечевого сплетения // Вестник Витебского государственного медицинского университета. 2005. Т. 4. № 2. С. 63-69.
- Никитин А. С., Алейникова И. Б. Опыт применения противоспаечного геля в хирургическом лечении компрессионной невропатии срединного нерва на уровне запястного канала // Нейрохирургия. 2021. Т. 23. № 3. С. 39-47.
- Филяева А. С., Яриков А. В., Фраерман А. П., Перльмуттер О. А., Цыбусов С. Н., Хохлов М. Ю., Камнев И. Ю., Прокопьев В. В., Коваленко Н. Н., Клементьев Е. Н., Алидин С. А., Корочкин Д. А., Костогриз Е. В., Гарсия А., Байтингер А. В. Аспекты хирургического лечения повреждений периферических нервов-современное состояние проблемы // Здравоохранение Югры: опыт и инновации. 2024. №1. С. 15-29
- Горбунов Н. С., Ростовцев С. И., Самотесов П. А., Кобер К. В., Русских А. Н. К вопросу о строении плечевого сплетения: современные взгляды в хирургии // Сибирское медицинское обозрение. 2020. № 2 (122). С. 13-19.
- Байтингер В. Ф., Байтингер А. В. Шов нерва конец-в-конец: прошлое и настоящее // Вопросы реконструктивной и пластической хирургии. 2013. Т. 16. № 1 (44). С. 20-27.
- Берснев В. П., Хамзаев Р. И., Борода Ю. И. Результаты эпиневрального шва седалищного нерва // Вестник хирургии им. И.И. Грекова. 2009. Т. 168. № 1. С. 61-63.
- Хамзаев Р. И., Берснев В. П., Борода Ю. И., Жарова Е. Н. Диагностика повреждений седалищного нерва и его ветвей // Бюллетень сибирской медицины. 2008. Т. 7. № 5-2. С. 457460.
- Байтингер В. Ф., Байтингер А. В. Шов нерва конец-в-бок: стратегия "получения" аксонов из интактного нерва (Часть II) // Вопросы реконструктивной и пластической хирургии. 2013. Т. 16. № 2 (45). С. 13-19.
- Чуриков Л. И., Гайворонский А. И., Гайворонский И. В., Булыщенко Г. Г., Кветной И. М., Траль Т. Г. Влияние дозированного растяжения и мобилизации на структуры лучевого нерва в области плеча // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2017. Т. 9. № 3. С. 33-40.
- Унжаков В. В., Берснев В. П., Кокин Г. С., Орлов А. Ю., Извекова Т. О. Повторные операции у больных с последствиями сочетанных повреждений нервов и сухожилий // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2006. № 6 (52). С. 98-100.
- Пятин В. Ф., Тутуров А. О. Значение состава внутренней среды кондуитов для активации роста аксонов при протяженных дефектах периферических нервов // Журнал неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119. № 4. С. 100-105.
- Тутуров А. О. Современные тенденции в восстановлении протяжённых дефектов нервов. развитие технологий использования регенераторного потенциала нервных волокон, их сущность, недостатки и преимущества // Международный студенческий научный вестник. 2017. № 1. С. 10.
- Qian Y., Lin H.; Yan Z. W., Shi J. L., Fan C. Y. Functional nanomaterials in peripheral nerve regeneration: Scaffold design, chemical principles and microenvironmental remodeling // Mater. 2021. V. 51. P. 165-187.
- Wan T., Wang Y.-L., Zhang F.-S., Zhang X.-M., Zhang Y.-C., Jiang H.-R., Zhang M., Zhang P.-X. The Porous Structure of Peripheral Nerve Guidance Conduits: Features, Fabrication, and Implications for Peripheral Nerve Regeneration // Int. J. Mol. Sci. 2023. V. 24. P. 14132.
- Tos P, Crosio A, Pellegatta I, Valdatta L, Pascal D, Geuna S, Cherubino M. Efficacy of anti-adhesion gel of carboxymethylcellulose with polyethylene oxide on peripheral nerve: Experimental results on a mouse model // Muscle Nerve. 2016. V. 53(2). P. 304-9. https://doi.org/10.1002/mus.24739
- Никитин А. С., Алейникова И. Б. Опыт применения противоспаечного геля в хирургическом лечении компрессионной невропатии срединного нерва на уровне запястного канала // Нейрохирургия. 2021. V. 23(3). P. 39-47. https://doi.org/10.17650/1683-3295-2021-23-3-39-47.
- Павлов В. Н., Казихинуров А. А., Казихинуров Р. А., Агавердиев М. А., Гареев И. Ф., Бейлерли О. А., Мазоров Б. З. Стромально-васкулярная фракция: биология и потенциальное применение // Креативная хирургия и онкология. 2021. V. 11(1). P. 92-99.
- Богов А. А., Галлямов А. Р, Ханнанова И. Г., Масгутова Г. А., Ахтямов И. Ф., Киясов А. П. Клинико-экспериментальное обоснование применения клеток стромально-васкулярной фракции при травме периферических нервов // Практическая медицина. 2016. V. 4(96).
- Богов А. А., Ханнанова И. Г., Ахтямов И. Ф., Данилов В. И. Применение клеток стромально-васкулярной фракции аутожировой ткани в хирургии повреждений плечевого сплетения // Практическая медицина. 2022. Т. 20. № 6. С. 28-34.
- Guo J., Nguyen A, Banyard D. A., Fadavi D., Toranto J. D., Wirth G. A., Paydar K. Z., Evans G. R., Widgerow A. D. Stromal vascular fraction: A regenerative reality? Part 2: Mechanisms of regenerative action // J Plast Reconstr Aesthet Surg. 2016. V. 69(2). P. 180-8. https://doi.org/10.1016/j.bjps.2015.10.014
- Свистов Д. В., Исаев Д. М., Гайворонский А. И., Чуриков Л. И., Беляков К. В. Интраоперационная инфракрасная флуоресцентная ангиография в хирургии повреждений периферических нервов // Вестник Российской Военно-медицинской академии. 2021. Т. 23. № 1. С. 59-66.
- Журбин Е. А., Гайворонский А. И., Железняк И. С., Чуриков Л. И., Труфанов Г. Е., Декан В. С. Возможности ультразвукового исследования при травматических повреждениях периферических нервов конечностей // Российский электронный журнал лучевой диагностики. 2017. Т. 7. № 3. С. 127-134.
- Чуриков Л. И., Гайворонский А. И., Журбин Е. А., Декан В. С., Свистов Д. В., Алексеев Д. Е. Современные аспекты хирургии повреждений лучевого нерва // Вестник Российской Военно-медицинской академии. 2016. № 4 (56). С. 14-18.
- Журбин Е. А., Декан В. С., Дищенков А. С., Железняк И. С., Чуриков Л. И., Гайворонский А. И. Возможности интраоперационного ультразвукового исследования при травматических повреждениях периферических нервов конечностей // Лучевая диагностика и терапия. 2017. № 3 (8). С. 100-101.
- Мещерягина И. А., Скрипников А. А. Электростимуляция при повреждениях периферических нервов верхних и нижних конечностей // Евразийский союз ученых. 2014. № 5-5 (5). С. 80-82
- Сидорович Р. Р., Смеянович А. Ф. Метод аутонейропластики в лечении посттравматических дефектов структур плечевого сплетения // Новости хирургии. 2011. Т. 19. № 4. С. 83-88.
- Сидорович Р. Р., Смеянович А. Ф. Применение сочетаний методов оперативных вмешательств на структурах плечевого сплетения при его обширном повреждении // Вестник Витебского государственного медицинского университета. 2011. Т. 10. № 3. С. 86-92.
- Ништ А. Ю., Фомин Н. Ф. Нерешенные проблемы реконструктивной хирургии периферических нервов // Вестник экспериментальной и клинической хирургии. 2019. Т. 12. № 2. С. 127-133.
- Кариев Г. М., Заремба А. Е., Асланова М. Современный взгляд на реконструктивные методы лечения повреждения периферических нервов (обзор) // Журнал теоретической и клинической медицины. 2016. № 1. С. 59-64.
- Chen L., Coleman R., Leang R., Tran H., Kopf A., Walsh C. M., Sears-Kraxberger I., Steward O., Bcklin W., Loring J. F., Lane T. E. Human Neural Precursor Cells Promote Neurologic Recovery in a Viral Model of Multiple Sclerosis // Stem Cell Research & Therapy. 2014. V. 15. https://doi.org/10.1016Zj.stemcr.2014.04.005
- Chentanez V., Cha-oumphol P., Kaewsema A., Agthong S., Huanmanop T. Accuracy of the three-window sampling method in morphometric analysis of human sural nerve // J Neurosci Methods. 2006. V. 157. P. 154-157. https://doi.org/10.1016/jjneumeth.2006.04.001
- Brushart T. M. Preferential motor reinnervation: a sequential double-labeling study // Restor Neurol Neurosci. 1990. V. 1. P. 281-287.
- Hader M., Sporer M. E., Roche A. D., Unger E., Bergmeister K. D., Wakolbinger R., Aszmann O. C. Fascicular Shifting: A Novel Technique to Overcome Large Nerve Defects // Journal of Neurosurgery. Spine. 2017. V. 27(6). P. 723-31. https://doi.org/10.3171/2017.3.spine16276
- Sporer M. E., Brugger P. C., Aman M., Fuchssteiner C. F., Festin C., Gstoettner C., Aszmann O. C. Fascicular shifting in the reconstruction of brachial plexus injuries: an anatomical and clinical evaluation // J Neurosurg. 2022. V. 16. P. 1-10 https://doi.org/10.3171/2022.11.JNS221312
- Коротченко Е. Н., Семенова Ж. Б. Селективная невротизация срединного нерва у молодых пациентов с осложненной позвоночно-спинномозговой травмой на уровне CV-CVII // Вопросы нейрохирургии им. Н.Н. Бурденко. 2020. Т. 84. № 6. С. 59-66.
- Горбунов Н. С., Кобер К. В., Протасюк Е. Н., Ростовцев С. И., Самотесов П. А. Анатомическое обоснование транспозиции грудоспинного нерва при невротизации поврежденных нервов плечевого сплетения // Бюллетень сибирской медицины. 2021. Т. 20. № 1. С. 31-38.
- Байтингер В. Ф., Байтингер А. В. Шов нерва конец-в-бок: стратегия "получения" аксонов из интактного нерва (Часть I) // Вопросы реконструктивной и пластической хирургии. 2013. Т. 16. № 2 (45). С. 6-12.
- Неведров А. В., Келбан Д. И., Алейникова И. Б., Иванов П. А., Гринь А. А., Светлов К. В. Транспозиция функционирующих мышц в комплексном лечении взрослых пациентов с повреждениями плечевого сплетения (обзор литературы) // Нейрохирургия. 2023. Т. 25. № 1. С. 95-102.
- Сидорович Р. Р. Особенности хирургического лечения последствий травматического повреждения плечевого сплетения методом экстраплексальной невротизации // Медицинский журнал. 2006. № 3 (17). С. 83-87.
- Коротченко Е. Н., Шток А. В. Модификация интеркостобрахиальной невротизации мышечно-кожного и подмышечного нервов при тотальной брахиоплексопатии: описание методики и обзор литературы // Вопросы нейрохирургии им. Н.Н. Бурденко. 2022. Т. 86. № 4. С. 75-82.
- Говенько Ф. С., Монашенко Д. Н., Лукин Д. С., Команцев В. Н. Невротизация трех крупных нервов при тракционном повреждении плечевого сплетения // Вестник Российской Военно-медицинской академии. 2012. № 4 (40). С. 12-19.
- Hacker V. Erfolgreich operativ behandelte cucullarislahmung // Wien Klin Wehnschr. 1908. V. 21(2). P. 1314.
- Abicht A., Evangelista T., Spendiff S. The increasing genetic and phenotypical diversity of congenital myasthenic syndromes // Neuropediatrics. 2017. V. 48. P. 294-308 https://doi.org/10.1055/s-0037-1602832
- Slater C. R. The structure of human neuromuscular junctions: some unanswered molecular questions // Int J Mol Sci. 2017. V. 18(10). P. 2183 https://doi.org/10.3390/ijms18102183
- Mu L., Sobotka S., Su H. Nerve-muscle-endplate band grafting: a new technique for muscle reinnervation. Operative // Neurosurgery. 2011. V. 69. P. 208-24 https://doi.org/10.1227/neu.0b013e31822ed596
- Dy C. J., Kitay A., Garg R. Neurotization to innervate the deltoid and biceps: 3 cases // J Hand Surg. 2013. V. 38. P. 237-240. https://doi.org/10.1016/jjhsa.2012.10.039
- Padovano W. M., Hill E. J. R, Felder J. M. Reconstruction of severe palm injury with sensate medial plantar artery flap and nerve grafting // Plast Reconstr Surg Glob Open. 2020. V. 8. P. e2944 https://doi.org/10.1097/G0X.0000000000002944
- Сидорович Р. Р., Юдина О. А., Гузов С. А. Анатомо-топографические особенности широчайшей мышцы спины с позиций использования ее в качестве трансплантата при хирургическом лечении последствий травматического повреждения плечевого сплетения // Вестник Витебского государственного медицинского университета. 2004. Т. 3. № 1. С. 78-85.
- Makarewich C. A., Hutchinson D. T.. Tendon Transfers for Combined Peripheral Nerve Injuries // Hand Clinics. 2016. V. 32(3). P. 377-87. http://dx.doi.org/10.1016/j.hcl.2016.03.008
- Сидорович Р. Р. Реконструктивные операции мышечной и сухожильно-мышечной транспозиции в реабилитации пациентов с последствиями травматического повреждения плечевого сплетения // Доклады Национальной академии наук Беларуси. 2011. Т. 55. № 4. С. 79-88.
- Исенгалиев И. Н., Беседин В. Д., Храпов Ю. В. Сухожильно-мышечная транспозиция при тяжелом необратимом повреждении лучевого нерва: хирургическая техника и клиническая практика // Медицинский вестник ГВКГ им. Н.Н. Бурденко. 2021. № 4 (6). С. 23-28.
- Sridhar K. Tendon transfer for median nerve palsy // Indian J Plast Surg. 2011. V. 44(2). P. 357-61. https://doi.org/10.4103/0970-0358.85357
- Sammer D. M., Chung K. C.. Tendon transfers: Part II. Transfers for ulnar nerve palsy and median nerve palsy // Plast Reconstr Surg. 2009. V. 124(3). P. 212e-221e. https://doi.org/10.1097/PRS.0b013e3181b037c7
- Сидорович P. P. Транспозиция широчайшей мышцы спины в хирургическом лечении последствий повреждений плечевого сплетения // Вестник травматологии и ортопедии им. Н.Н. Приорова. 2005. № 4. С. 55-61.
- Смеянович А. Ф., Сидорович Р. Р., Барановский А. Е., Семак И. А., Юдина О. А. Метод транспозиции трапециевидной мышцы в реабилитации пациентов с последствием травматического повреждения плечевого сплетения // Новости хирургии. 2011. Т. 19. № 5. С. 90-95.
- Яриков А. В., Лобанов И. А., Казакова Л. В., Корнакова О. С., Фраерман А. П., Перльмуттер О. А., Цыбусов С. Н., Павлова Е. А., Комкова Е. Ф., Зайцева Н. Е. Современные инструментальные методы диагностики травматических поражений периферических нервов // Бюллетень науки и практики. 2024. Т. 10. №2. С. 273-296. https://doi.org/10.33619/2414-2948/99/28
- Мудрякова М. В. Формальные основы хирургической помощи пациентам с хроническим болевым синдромом при травматическом поражении периферической нервной системы (обзор) // Известия Российской военно-медицинской академии. 2022. Т. 41. № S4. С. 88-92.
- Мудрякова М. В. Сравнительные результаты лечения пациентов с хроническим болевым синдромом при травматическом поражении периферической нервной системы // Вестник Санкт-Петербургского университета. Медицина. 2022. Т. 17. № 3. С. 166-174.
- Сидорович Р. Р., Боярчик В. П., Алексеевец В. В., Терехов В. С. Нейрохирургическое лечение пациентов с постоянной некупирующейся болью при посттравматических моно- и полиневропатиях с применением радиочастотной абляции // Успехи современной клинической неврологии и нейрохирургии: Сборник материалов XVIII Республиканской научно-практической конференции. 2019. С. 80-82.
- Яриков А. В., Игнатьева О. И., Волков И. В., Романов С. В. Современные подходы к решению проблемы комплексного регионарного болевого синдрома // Дальневосточный медицинский журнал. 2023. № 4. С. 115-125.
- Никитин А. С., Кудрявцева Е. В., Камчатнов П. Р. Посттравматические болевые мононейропатии // Журнал неврологии и психиатрии им. С.С. Корсакова. 2023. Т. 123. №4. С. 14-23. https://doi.org/10.17116/j nevro202312304114
- Яриков А. В., Макеева О. А., Фраерман А. П., Перльмуттер О. А., Хиновкер В. В., Байтингер А. В., Байтингер В. Ф., Селянинов К. В., Цыбусов С. Н., Павлова Е. А., Симонов А. Е., Истрелов А. К., Коготкова Е. А. Комплексный региональный болевой синдром: клиника, диагностика, лечение // Бюллетень науки и практики. 2023. Т. 9. №5. С. 257-272. https://doi.org/10.33619/2414-2948/90/33
- Бажанов С. П., Шувалов С. Д., Островский В. В., Ульянов В. Ю., Капралов С. В., Толкачев В. С., Коршунова Г. А., Чехонацкий А. А. Современные представления об особенностях клиники, диагностики и комплексного лечения пациентов с закрытыми тракционными повреждениями плечевого сплетения (обзор литературы) // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2022. Т. 14. № 1-1. С. 137-145.
- Мещерягина И. А., Россик О. С. Способ применения анти-холинестеразных препаратов в сочетании с методом прямой электростимуляции при нейропатиях периферических нервов. Описание трех случаев // Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2014. № 3 (97). С. 4145.
- Литвиненко И. В., Булатов А. Р. Роль препарата L-карнитина в комплексной терапии повреждений периферических нервов конечностей // Вестник неврологии, психиатрии и нейрохирургии. 2020. № 4. С. 12-26.
- Бояршинов М. А., Воловик В. Е., Шпачинский Я. Б., Аксюк Е. Ф., Владимирцев И. О. Клиника, диагностика и хирургическое лечение повреждений лучевого нерва // Здравоохранение Дальнего Востока. 2004. № 5 (13). С. 37-39.
- Богов А. А., Ахтямов И. Ф., Данилов В. И., Старостина И. Г., Ханнанова И. Г., Богов А. А. Восстановление повреждённого плечевого сплетения при помощи клеток стромально-васкулярной фракции аутожировой ткани // Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье. 2023. Т. 13. № 1. С. 56-63.
- Григорович К.А. Хирургическое лечение повреждений нервов. М.: Медицина, 1981. 304 с.
- Николаев В. Ф., Щербина К. К., Андриевская А. О., Черникова М. В., Фогт Е. В., Иванова Н. В. Проблемы ортезирования пациентов с синдромом вялого пареза/паралича верхних конечностей // Физическая и реабилитационная медицина. 2023. Т. 5. № 4. С. 81-94.
- Алексеев Е. Д., Парфенов В. Е., Говенько Ф. С. Открытые и закрытые повреждения плечевого сплетения // Сборник лекций по актуальным вопросам нейрохирургии. СПб, 2008. С. 437-452.
- Зоркова А. В., Григорьева В. Н., Гликин С. Е. Хирургическое лечение закрытых внутриствольных травматических повреждений периферических нервов // Медицинский альманах. 2018. № 5 (56). С. 134-137.
- Бажанов С. П., Толкачев В. С., Коршунова Г. А., Нинель В. Г., Джумагишиев Д. К., Бахарев Р. М., Шувалов С. Д. Ближайшие результаты двухуровневой электронейромодуляции при закрытых тракционных повреждениях седалищного нерва // Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2019. Т. 11. № 4. С. 5-9.
- Лола Н. И., Филонов И. В., Шибанова В. В., Клочкова Г. Ф., Кудрань С. П., Колесников Г. В. Электростимуляция при травматических повреждениях костно-мышечной системы, сухожилий и периферических нервов // Медицинский вестник МВД. 2018. № 5 (96). С. 40-45.
- Шпагин М. В., Яриков А. В., Павлов С. С., Соколов А. А. Применение лазеротерапии в комплексном лечении больных с компрессионно-ишемической невропатией // Лазерная медицина. 2021. Т. 25. № 1. С. 36-44.
- Бажанов С. П., Шувалов С. Д., Бахарев Р. М., Капралов С. В., Коршунова Г. А., Ульянов В. Ю., Островский В. В. Сравнительный анализ ближайших результатов хирургического лечения пациентов с закрытыми тракционными повреждениями плечевого сплетения // Гений ортопедии. 2022. Т. 28. № 5. С. 631-635.
- Зеелигер А. Стимуляция периферических нервов при комплексных регионарных болевых синдромах и фантомных болях // Вестник российской военно-медицинской академии. 2007. № 3 (19). C. 53-57.
- Мещерягина И. А., Скрипников А. А. Применение комбинированной электростимуляции при изолированных и сочетанных повреждениях периферических нервов верхних и нижних конечносте //. Российский медицинский журнал. 2015. № 21 (3). C. 14-19.
- Lundborg G, Rosen B. Sensory relearning after nerve repair // Lancet. 2001. V. 358. №9284. P. 809-10.
- Mondelli M, Padua L, Reale F. Carpal tunnel syndrome in elderly patients: results of surgical decompression // J Peripher Nerv Syst. 2004. V. 9. №3. P.168-76.
- Faivre S, Lim A, Dautel G, Duteille F, Merle M. Adjacent and spontaneous neurotization after distal digital replantation in children // Plast Reconstr Surg. 2003. V. 111. №1. P. 59-65.
- Venkatramani H, Bhardwaj P, Faruquee S. R., Sabapathy S. R. Functional outcome of nerve transfer for restoration of shoulder and elbow function in upper brachial plexus injury // J Brachial Plex Peripher Nerve Inj. 2008. V. 3. P. 15-20.
- Яриков А. В., Лобанов И. А., Казакова Л. В., Корнакова О. С., Фраерман А. П., Перльмуттер О. А., Байтингер А. В., Байтингер В. Ф., Селянинов К. В., Макеева О. А. Травма периферической нервной системы. Часть 1. Клиническая картина, инструментальная диагностика // Врач. 2024. Т. 35. №9. С. 22-26.
- Яриков А. В., Байтингер А. В., Байтингер В. Ф., Селянинов К. В., Фраерман А. П., Перльмуттер О. А., Бутримова С. В. Травма периферической нервной системы. Часть 2. Консервативное, интервенционное и хирургическое лечение // Врач. 2024. Т. 35, №10. С. 2629.
- Румянцева Е. В., Яриков А. В., Байтингер А. В., Байтингер В. Ф., Селянинов К. В., Тутуров А. О., Корнакова О. С., Бутримова С. В., Ким Е. Р., Перльмуттер О. А., Фраерман А. П., Цыбусов С. Н., Гарсия А., Коготкова Е. А. Современные возможности реконструкции нервов головы и шеи // Бюллетень науки и практики. 2024. Т. 10. №10. С. 98-125. https://doi.org/10.33619/2414-2948/107/12
- Яриков А. В., Бутримова С. В., Байтингер А. В., Байтингер В. Ф., Селянинов К. В., Фраерман А.П., Перльмуттер О.А., Цыбусов С.Н., Мухин А.С. Результаты работы АНО НИИ Микрохирургии (г. Томск) // Научный медицинский вестник Югры. 2024. №3(41). С. 37-44.
- Филяева А. С., Яриков А. В., Байтингер А. В., Байтингер В. Ф., Селянинов К. В. Опыт обучения навыкам реконструктивной микрохирургии в институте микрохирургии (г. Томск) // Виртуальные технологии в медицине. 2023. №3(37). С. 199-200.


